TNFα、IL-6、IL-4、IL-2对IFNγ抗弓形虫感染作用的影响
作者:方艳秋 许淑芬 谭岩u.*w|0, 百拇医药
单位:方艳秋(白求恩医科大学一院中心研究室,吉林 长春 130021);许淑芬(白求恩医科大学一院中心研究室,吉林 长春 130021);谭岩(白求恩医科大学一院生物治疗中心,吉林 长春 130021)u.*w|0, 百拇医药
关键词:弓形虫;TNFα;IL-6;IL-4;IL-2;小鼠腹腔巨噬细胞u.*w|0, 百拇医药
免疫学杂志000310 [摘 要]目的 探讨TNFα、IL-6、IL-4、IL-2对IFNγ诱导的小鼠腹腔巨噬细胞(mouse peritoneal maerophage,MPM)抗弓形虫(toxoplasma gondii,TG)效应的机制。方法 应用3H-U标记的TG在MPM内的增殖实验及125I-UdR标记的细胞毒实验,结果和结论 ①高浓度TNFα只能诱导MPM轻微的抗TG效应,而与亚剌激量IFNγ结合几乎可以完全抑制TG增殖;抗TNFα在IFNγ诱导MPM的最初阶段,可消除IFNγ诱导的ΜΡΜ的抗ΤG效应,与ΙFNγ诱导ΜΡΜ产生内源性ΤΝFα的作用相同。②IL-6可促进TG在MPM内的增殖,并能逆转IFNγ诱导的MPM抗TG效应。③IL-4在体外可部分抑制TG在MPM内的增殖,其作用机制与TNFα无关,但与IFNγ有相加作用。④体外应用IL-2对MPM抗TG作用无影响;体内应用IL-2明显延长急性TG感染小鼠的生存时间(P<0.05),治疗组小鼠脾细胞杀伤肿瘤细胞及TG感染自身细胞的能力,均明显高于对照组(P<0.001);而正常小鼠NK细胞及LAK细胞杀伤自身感染TG靶细胞能力,显著低于杀伤肿瘤细胞的能力(P<0.001);经IL-2诱导的LAK细胞杀伤自身感染TG靶细胞的能力,明显高于NK细胞(P<0.001) ,并与LAK细胞杀伤肿瘤靶细胞的能力无明显差别(P>0.05)。u.*w|0, 百拇医药
[中图分类号]R531.8 [文献标识码]Au.*w|0, 百拇医药
[文章编号]1000-8861(2000)03-0196-04u.*w|0, 百拇医药
Effects of TNFα,IL-6,IL-4 and IL-2 on IFNγ-induced toxoplasmastatic activityu.*w|0, 百拇医药
FANG Yan-qiuu.*w|0, 百拇医药
(Central Laboratory,First Teaching Hospital,Bethune University of Medical Sciences,Changchun 130021,China)9^6, http://www.100md.com
XU Shu-fen, TAN Yan9^6, http://www.100md.com
(Center of Biotherapy First Teaching Hospital,Bethune University of Medical Sciences,Changchun 130021,China)9^6, http://www.100md.com
[Abstract]Objectire To observe the effects of IL-6,IL-4,TNFα,IL-2 and IFNγ οr a combination of these cytokines and ability to restrict growth of toxoplasma gondii(TG).Methods Murine peritoneal macrophage(MPM)were incubated with 3H-uracil-labelled TG in vitro. Results and Conclusions TNFα alone inhibited the intracellular proliferation of TG slightly.The IFNγ-induced toxoplasmastatic adctivity was inhibited by neutralizing antibodies against mouse TNFα in a dose- and time-dependent way.Prdetreatment of unelicited MPM with IL-6 enhanced TG replication in a dose-dependent manner.Pretreastment with IFNγ resulted in active killing of parasites whereas the addition of IL-6 and IFNγ pretreatment resulted in reversal of IFNγ-mediated toxoplasmacidal activity.IL-4 alone inhibited the growth of TG in MPM only partially.No synergistic activity of IL-4 and IFNγ on tne inhibtion of TG proliferation was found in vitro,IL-2 did not induce the toxoplasmastatic activity of in MPM.However in vivo treatment of mice with IL-2 had prolonged time of survival compared with control mice after infecftion of TG.Studies on the protective mechanism demonstrated that IL-2 could significantly enhance the NK and LAK activity to kill tumor target cells and LAK activity to kill autologous sppleen cells infected with TG but not NK activity.
[Key words]toxoplasma gondii;TNFα;IL-6;IL-4;IL-2;murine peritoneal macrophage!k, 百拇医药
多数研究证实,IFNγ是激活巨噬细胞(Μφ)抗TG的主要细胞因子[1]。SUZUKI等人[2]成功地应用抗IFNγ单抗注入TG慢性感染的小鼠体内,使之转变为致死性TG病,更进一步证明IFNγ在机体抗TG感染中的重要作用,但同时也涉及其它细胞因子,如TNFα、IL-6、IL-1、IL-4、GM-CSF、IL-2等,它们在激活Mφ及IFNγ产生方面均起着重要的调节作用。近年来国外关于上述细胞因子单独对Mφ抗TG作用的影响及对IFNγ诱导的Mφ抗TG效应的影响的报导较多(国内尚无这方面报导),但结果不尽相同。本文应用C57BL/6 MPM系统地观察了TNFα、IL-6、IL-4、IL-2等相关细胞因子对IFNγ诱导MPM抗TG效应的影响,并且对其机制进行了探讨。!k, 百拇医药
1 材料与方法!k, 百拇医药
1.1 材料!k, 百拇医药
1.1.1 实验动物及虫株:C57BL/6雌性小鼠6~8WK龄,经PCR检测为TG阴性;RH株TG为常用标准强毒株;Yac-1细胞为NK敏感细胞株。!k, 百拇医药
1.1.2 试剂:HurIL-2、IL-6、mrIFNγ、TNFα、IL-4、兔抗小鼠TNFα,由德国MPG免疫研究所赠送;3H-U购于中国科学院上海核技术开发公司;125I-UdR购于北京中国原子能研究所。!k, 百拇医药
1.2 方法!k, 百拇医药
1.2.1 TG增殖实验[3]!k, 百拇医药
1.2.2 小鼠NK细胞杀伤活性测定[4]!k, 百拇医药
1.2.3 小鼠LAK细胞活性测定[5]!k, 百拇医药
2 结果!k, 百拇医药
2.1 TNFα在IFNγ诱导的对MPM抗TG效应中的作用 IFNγ诱导的MPM对TG增长有明显的抑制作用,并呈剂量依赖关系,TNFα诱导的MPM只有在高浓度时才表现出轻微的抑制效应(见图1A);在1000U/ml IFNγ诱导MPM抗TG作用的同时加入兔抗鼠TNFα中和抗体及兔抗鼠IL-1β(见图1B),结果表明:抗TNFα抗体对IFNγ诱导MPM抗TG效应有抑制作用,且呈剂量依赖关系,而IL-1β抗体无此作用;观察不同时间加入抗TNFα抗体(2×104U/ml)对IFNγ(1000U/ml)诱导的MPM抗TG效应的影响(见图1C),IFNγ诱导MPM 6h后加入抗TNFα抗体,其抑制作用明显降低,12h后几乎不作用;在TG感染MPM前24h以不同剂量的TNFα与亚剂量IFNγ(0.1U/ml)协同诱导MPM抗TG效应时发现(见图1D),亚剂量IFNγ及高剂量TNFα对MPM抗TG效应均无明显作用,但二者结合则明显抑制TG在MPM中的增长,随TNFα剂量增高,其协同作用明显增强。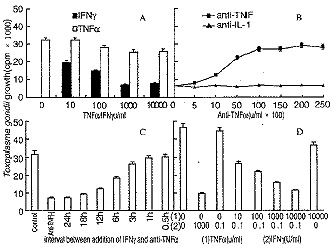
图1 TNFα对IFNγ抗弓形虫作用的影响#v;|f, 百拇医药
Fig1 The effects of TNFα on IFNγ-induced toxoplasmastatic activity in MPM#v;|f, 百拇医药
2.2 IL-6促进TG在MPM内增殖及与IFNγ和TNFα的相互作用 IL-6促进TG在MPM的内增殖作用与IL-6剂量呈依赖关系(见图2A);IL-6能够部分逆转IFNγ诱导MPM的抗TG效应,其逆转作用随IL-6剂量增加而增强,但高剂量(400U/ml)的IL-6不能完全逆转IFNγ诱导的MPM的抗TG效应(见图2B),IFNγ处理MPM后12h,IL-6对IFNγ诱导的MPM的抗TG效应无明显影响(见图2C);TNFα对IL-6促进TG在MPM内的增殖作用无明显影响(见图2D),但TNFα可部分恢复IL-6对IFNγ诱导MPM抗TG效应的逆转作用(见图2E);在IL-6及IL-6和IFNγ处理的MPM中,加入抗TNFα抗体,再感染TG(见图2F),抗TNFα对IL-6引起的TG增殖作用无影响,但可增加IL-6对IFNγ诱导MPM抗TG效应的逆转作用。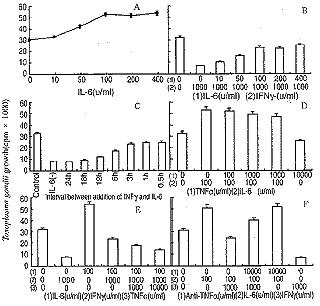 #v;|f, 百拇医药
#v;|f, 百拇医药
图2 IL-6促进弓形虫在小鼠腹腔巨噬细胞内的增殖及其对IFNγ抗弓形虫作用的影响#v;|f, 百拇医药
Fig2 The effects of IL-6 on toxoplasma gondii growth and IFNγ-induced toxoplasmastatic activity in MPM#v;|f, 百拇医药
2.3 IL-4对MPM抗TG效应的影响 在TG感染前24h及感染后应用100U/ml IL-4(见图3A),IL-4 100U/ml时能够诱导MPM抗TG效应,但作用不如IFNγ,随IL-4剂量增加,IL-4诱导MPM抗TG效应增强,200U/ml即达高峰,(见图3B);IL-4和IFNγ共同处理MPM表明(见图3C)两者具有相加作用;在IL-4、IFNγ处理MPM同时加入抗TNFα抗体(见图3D),抗TNFα对IL-4诱导的MPM抗TG活性无明显影响。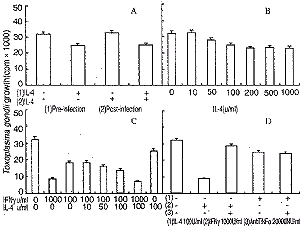 #v;|f, 百拇医药
#v;|f, 百拇医药
图3 IL-4对小鼠腹腔巨噬细胞抗弓形虫作用的影响
Fig3 The effects of IL-4 on IFNγ-induced toxoplasmastatic activity in MPMao, 百拇医药
2.4 IL-2在小鼠抗TG感染中的作用 实验组自1×102个TG感染前2d至感染后第4d(-2,-1,0,+1,+2,+3,+4),每天腹腔注射100U/ml IL-2(0.1ml),共700U,对照组小鼠注射等量PBS(见图4A,B),结果显示,对照组平均生存时间为9.2±1.2,而实验组为14.1±1.2,两组相比差异显著;在观察IL-2对急性TG感染小鼠脾细胞杀伤活性的影响的实验中,在TG感染小鼠第-2,-1,0,+1,+2d,实验组小鼠每只每次注射100U IL-2 0.1ml,对照组注射等量的PBS,感染后第3d测小鼠脾细胞杀伤肿瘤细胞及TG感染的自身脾脏淋巴母细胞的能力(见图4C),IL-2治疗组的杀伤肿瘤细胞及TG感染自身细胞的能力均明显高于对照组(P<0.001),同时也发现对照组小鼠脾细胞几乎不能杀伤TG感染的自体靶细胞;在IL-2体外诱导小鼠脾细胞杀伤能力的实验中,取正常小鼠脾细胞悬液,直接杀伤肿瘤细胞及TG感染的自身靶细胞(NK)或经IL-2 100U/ml体外诱导72h后杀伤靶细胞(LAK)(见图4D),小鼠NK细胞杀伤自身感染TG靶细胞的能力显著低于杀伤肿瘤细胞的能力(P<0.01),而IL-2诱导的LAK细胞杀伤自身感染TG靶细胞明显高于NK细胞(P<0.01),且与LAK杀伤肿瘤靶细胞的能力无明显差别(P>0.05)。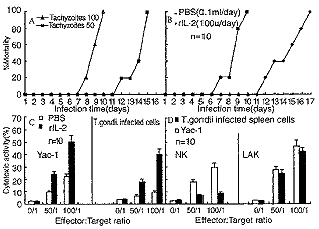 ao, 百拇医药
ao, 百拇医药
图4 IL-2在小鼠抗弓形虫感染中的作用ao, 百拇医药
Fig4 The effects of IL-2 against toxolasma gondii infection in miceao, 百拇医药
3 讨论ao, 百拇医药
单独应用TNFα可部分激活MPM抑制TG的增殖早有报导[6],其作用机制到目前尚不清楚,但已有研究表明,不论体内外,在特定的条件下剌激MPM,确实可以产生超过1×104U/ml的TNFα[7]。TNFα与IFNγ协同作用的机制可能是,当其发挥作用时TNFα需要同膜表面TNFα受体结合,低剂量的IFNγ可以诱导多种细胞株表达TNFα受体;另一种可能是TNFα单独与膜受体结合,不足以激活涉及抗TG效应的转导途径,另一个所需的信号则可能是低剂量的IFNγ或IL-1,因为IL-1已被证实涉及参与机体抗多种病原体的效应,其中包括TG[8]。
IL-6促进TG在MPM内增殖的机制到目前还不清楚,但可能与以下两个方面有关:(1)IL-6可能是TG特异性生长因子,直接促进TG增殖。1992年DENIS等[9]报导IL-6可在体外直接促进鸟型结核分支杆菌增殖,结核分支杆菌细胞壁上存在IL-6特异性受体;(2)IL-6可能通过抑制MPM的有氧或无氧杀伤途径而促进TG在MPM内增殖。MURRAY等[10]报导IL-6通过此途径促进衣原体及利什曼原虫的增殖。本实验结果支持后一种设想,因为IL-6可以部分逆转IFNγ诱导的MPM抗TG效应,并呈剂量依赖性关系。但使人感兴趣的是,在上述实验中加入TNFα可以降低IL-6对IFNγ诱导抗TG效应的逆转作用,而加入抗TNFα抗体则可增加这种逆转作用,均提示在IL-6逆转的IFNγ诱导的MPM抗TG效应过程中与内源性TNFα有关。cm, 百拇医药
一般认为当体内IL-4含量增高时,应该对Th1和Tc1分泌的IFNγ和TNFα起拮抗作用,二者均在抗TG效应中起着重要作用。到目前已有关于TG抗原可以诱导特异性Th2、Tc2克隆的报导[11]。而Roberts等人[12]认为IL-4在TG感染过程中起着双向调节的作用。本实验表明,IL-4可以部分抑制TG在MPM内的增殖,增加剂量至1000U/ml,抑制作用未见明显增加;IL-4可以增加IFNγ诱导的MPM抗TG效应,但无协同作用,提示IL-4对MPM内TG增殖的抑制作用与IFNγ不同。cm, 百拇医药
至今人们已对IL-2抗TG效应的机制进行了广泛的研究,但结果仍不能令人满意。一般认为,Mφ表面亦存在IL-2受体,IL-2除了以往认为的通过诱生IFNγ而间接活化Mφ外,其本身也可直接增强Μφ的吞噬杀伤能力,同时,IL-2具有促进Pre-NK细胞的成熟、调整CD3-.CD56+/CD3+.CD56-细胞比例的功能,因此,增强NK细胞对TG的杀伤能力,也是目前为人们所瞩目的[13,14]。本实验提示(图4),IL-2体内应用提高TG感染小鼠生存能力的机制可能与提高体内LAK细胞杀伤自身感染TG细胞的能力有关;NK细胞的抗TG机制可能在于激活NK细胞产生IFNγ和TNFα等细胞因子,间接地作用于Μφ而发挥作用。cm, 百拇医药
[作者简介]方艳秋(1968-),女,吉林长春市人,助研,博士,主要从事抗感染免疫、自身免疫病及肿瘤生物治疗的研究。
[参考文献]k, 百拇医药
[1]SUBAUSTE CS,REMINGTON JS. Role of gamma interferon in toxoplasma gondii infection[J].Eur J Clin Microbiol Infect Dis,1991,10:58~72.k, 百拇医药
[2]SUZUKI Y,ORLLANA MA,SCHREIBER RD,et al.Interferon-γ:the major mediator of resistance against toxoplasma gondii[J].Science,1988,240:516~518.k, 百拇医药
[3]方艳秋,谭岩,张永生.IL-6对弓形虫增殖的影响[J].中国寄生虫学与寄生虫病杂志,1999,17(2):106~108.k, 百拇医药
[4]方艳秋,谭 岩.IL-2在小鼠抗弓形虫作用的研究[J].中国人兽共患病杂志,1998,14(4):11~14.k, 百拇医药
[5]谭岩,王江滨.胃癌患者外周血淋巴因子活化杀伤细胞活性测定及影响因素[J].中华内科杂志,1990,29(9):550~552.k, 百拇医药
[6]CHANG HR,GE GRAU. Role of TNF and IL-1 in infections with Toxoplasma gondii[J].Imunology,1990,69:33~39.k, 百拇医药
[7]JAN A,LANGERMANS M.IFN-γinduced dependent toxoplasmastatic activity in murine peritoneal macrophages is mediated by endogenous tumor necrosis factor-α[J].J Immunol,1992,148:568~579.k, 百拇医药
[8]KULLBERG BJ,VAN WOUT JW,VAN FURTH,et al.Role of granulo-cytes in increased host resistance to Candida albicans induced by rIL-1[J].Infect Immun,1990,58:3319~3330.
[9]DENIS M.IL-6 is used as a growth factor by virulent Mycoba-cterium avium:presence of speific receptors.Cell Immunl,1992,141:182~190.k7(', 百拇医药
[10]MURRAY HW,GRANGER AM,TEITELBAUM RF et al.Gamma interferon-activated humamacrophages and Toxoplasma gondii,Chlamydia psittaci,and Leishmania donovani;antimicrobial role of limiting intracellular iron[J].Infect Immun.1991,59:4684~6492.k7(', 百拇医药
[11]DAUBENER W,MACKENZIE C,HADDING U,et al.Establishment of T helper type 1-and T-helper type 2-like human toxoplasma antigen-spicific T-cell clones[J].Immunology,1995,86:79~87.k7(', 百拇医药
[12]ROBERTS CW,FERGUSON DJP,JEBBARI H,et al.Different roles for IL-4 during the course of toxoplasma gondii infection[J].Infect Immun,1996,64:897~906.k7(', 百拇医药
[13]GOYAL M,GANGULY NK,MAHAJAN RC.Natural killer cell cyto-toxicity against toxoplasma gondii in acute and chronic murine toxoplasnosis[J].Med Sci Res,1988,16:375~387.k7(', 百拇医药
[14]DANNEMANN BR,MORRIS VA,ARAUJO FG,et al.Assessment of human natural killer and lymphokkine activated killer cells cytoto-xicity against toxoplasma gondii trphozoites and brain cysts[J].J Immunol,1989,143:2684~2691.k7(', 百拇医药
[收稿日期]1999-06-17;[修回日期]2000-02-21(方艳秋 许淑芬 谭岩)
单位:方艳秋(白求恩医科大学一院中心研究室,吉林 长春 130021);许淑芬(白求恩医科大学一院中心研究室,吉林 长春 130021);谭岩(白求恩医科大学一院生物治疗中心,吉林 长春 130021)u.*w|0, 百拇医药
关键词:弓形虫;TNFα;IL-6;IL-4;IL-2;小鼠腹腔巨噬细胞u.*w|0, 百拇医药
免疫学杂志000310 [摘 要]目的 探讨TNFα、IL-6、IL-4、IL-2对IFNγ诱导的小鼠腹腔巨噬细胞(mouse peritoneal maerophage,MPM)抗弓形虫(toxoplasma gondii,TG)效应的机制。方法 应用3H-U标记的TG在MPM内的增殖实验及125I-UdR标记的细胞毒实验,结果和结论 ①高浓度TNFα只能诱导MPM轻微的抗TG效应,而与亚剌激量IFNγ结合几乎可以完全抑制TG增殖;抗TNFα在IFNγ诱导MPM的最初阶段,可消除IFNγ诱导的ΜΡΜ的抗ΤG效应,与ΙFNγ诱导ΜΡΜ产生内源性ΤΝFα的作用相同。②IL-6可促进TG在MPM内的增殖,并能逆转IFNγ诱导的MPM抗TG效应。③IL-4在体外可部分抑制TG在MPM内的增殖,其作用机制与TNFα无关,但与IFNγ有相加作用。④体外应用IL-2对MPM抗TG作用无影响;体内应用IL-2明显延长急性TG感染小鼠的生存时间(P<0.05),治疗组小鼠脾细胞杀伤肿瘤细胞及TG感染自身细胞的能力,均明显高于对照组(P<0.001);而正常小鼠NK细胞及LAK细胞杀伤自身感染TG靶细胞能力,显著低于杀伤肿瘤细胞的能力(P<0.001);经IL-2诱导的LAK细胞杀伤自身感染TG靶细胞的能力,明显高于NK细胞(P<0.001) ,并与LAK细胞杀伤肿瘤靶细胞的能力无明显差别(P>0.05)。u.*w|0, 百拇医药
[中图分类号]R531.8 [文献标识码]Au.*w|0, 百拇医药
[文章编号]1000-8861(2000)03-0196-04u.*w|0, 百拇医药
Effects of TNFα,IL-6,IL-4 and IL-2 on IFNγ-induced toxoplasmastatic activityu.*w|0, 百拇医药
FANG Yan-qiuu.*w|0, 百拇医药
(Central Laboratory,First Teaching Hospital,Bethune University of Medical Sciences,Changchun 130021,China)9^6, http://www.100md.com
XU Shu-fen, TAN Yan9^6, http://www.100md.com
(Center of Biotherapy First Teaching Hospital,Bethune University of Medical Sciences,Changchun 130021,China)9^6, http://www.100md.com
[Abstract]Objectire To observe the effects of IL-6,IL-4,TNFα,IL-2 and IFNγ οr a combination of these cytokines and ability to restrict growth of toxoplasma gondii(TG).Methods Murine peritoneal macrophage(MPM)were incubated with 3H-uracil-labelled TG in vitro. Results and Conclusions TNFα alone inhibited the intracellular proliferation of TG slightly.The IFNγ-induced toxoplasmastatic adctivity was inhibited by neutralizing antibodies against mouse TNFα in a dose- and time-dependent way.Prdetreatment of unelicited MPM with IL-6 enhanced TG replication in a dose-dependent manner.Pretreastment with IFNγ resulted in active killing of parasites whereas the addition of IL-6 and IFNγ pretreatment resulted in reversal of IFNγ-mediated toxoplasmacidal activity.IL-4 alone inhibited the growth of TG in MPM only partially.No synergistic activity of IL-4 and IFNγ on tne inhibtion of TG proliferation was found in vitro,IL-2 did not induce the toxoplasmastatic activity of in MPM.However in vivo treatment of mice with IL-2 had prolonged time of survival compared with control mice after infecftion of TG.Studies on the protective mechanism demonstrated that IL-2 could significantly enhance the NK and LAK activity to kill tumor target cells and LAK activity to kill autologous sppleen cells infected with TG but not NK activity.
[Key words]toxoplasma gondii;TNFα;IL-6;IL-4;IL-2;murine peritoneal macrophage!k, 百拇医药
多数研究证实,IFNγ是激活巨噬细胞(Μφ)抗TG的主要细胞因子[1]。SUZUKI等人[2]成功地应用抗IFNγ单抗注入TG慢性感染的小鼠体内,使之转变为致死性TG病,更进一步证明IFNγ在机体抗TG感染中的重要作用,但同时也涉及其它细胞因子,如TNFα、IL-6、IL-1、IL-4、GM-CSF、IL-2等,它们在激活Mφ及IFNγ产生方面均起着重要的调节作用。近年来国外关于上述细胞因子单独对Mφ抗TG作用的影响及对IFNγ诱导的Mφ抗TG效应的影响的报导较多(国内尚无这方面报导),但结果不尽相同。本文应用C57BL/6 MPM系统地观察了TNFα、IL-6、IL-4、IL-2等相关细胞因子对IFNγ诱导MPM抗TG效应的影响,并且对其机制进行了探讨。!k, 百拇医药
1 材料与方法!k, 百拇医药
1.1 材料!k, 百拇医药
1.1.1 实验动物及虫株:C57BL/6雌性小鼠6~8WK龄,经PCR检测为TG阴性;RH株TG为常用标准强毒株;Yac-1细胞为NK敏感细胞株。!k, 百拇医药
1.1.2 试剂:HurIL-2、IL-6、mrIFNγ、TNFα、IL-4、兔抗小鼠TNFα,由德国MPG免疫研究所赠送;3H-U购于中国科学院上海核技术开发公司;125I-UdR购于北京中国原子能研究所。!k, 百拇医药
1.2 方法!k, 百拇医药
1.2.1 TG增殖实验[3]!k, 百拇医药
1.2.2 小鼠NK细胞杀伤活性测定[4]!k, 百拇医药
1.2.3 小鼠LAK细胞活性测定[5]!k, 百拇医药
2 结果!k, 百拇医药
2.1 TNFα在IFNγ诱导的对MPM抗TG效应中的作用 IFNγ诱导的MPM对TG增长有明显的抑制作用,并呈剂量依赖关系,TNFα诱导的MPM只有在高浓度时才表现出轻微的抑制效应(见图1A);在1000U/ml IFNγ诱导MPM抗TG作用的同时加入兔抗鼠TNFα中和抗体及兔抗鼠IL-1β(见图1B),结果表明:抗TNFα抗体对IFNγ诱导MPM抗TG效应有抑制作用,且呈剂量依赖关系,而IL-1β抗体无此作用;观察不同时间加入抗TNFα抗体(2×104U/ml)对IFNγ(1000U/ml)诱导的MPM抗TG效应的影响(见图1C),IFNγ诱导MPM 6h后加入抗TNFα抗体,其抑制作用明显降低,12h后几乎不作用;在TG感染MPM前24h以不同剂量的TNFα与亚剂量IFNγ(0.1U/ml)协同诱导MPM抗TG效应时发现(见图1D),亚剂量IFNγ及高剂量TNFα对MPM抗TG效应均无明显作用,但二者结合则明显抑制TG在MPM中的增长,随TNFα剂量增高,其协同作用明显增强。

图1 TNFα对IFNγ抗弓形虫作用的影响#v;|f, 百拇医药
Fig1 The effects of TNFα on IFNγ-induced toxoplasmastatic activity in MPM#v;|f, 百拇医药
2.2 IL-6促进TG在MPM内增殖及与IFNγ和TNFα的相互作用 IL-6促进TG在MPM的内增殖作用与IL-6剂量呈依赖关系(见图2A);IL-6能够部分逆转IFNγ诱导MPM的抗TG效应,其逆转作用随IL-6剂量增加而增强,但高剂量(400U/ml)的IL-6不能完全逆转IFNγ诱导的MPM的抗TG效应(见图2B),IFNγ处理MPM后12h,IL-6对IFNγ诱导的MPM的抗TG效应无明显影响(见图2C);TNFα对IL-6促进TG在MPM内的增殖作用无明显影响(见图2D),但TNFα可部分恢复IL-6对IFNγ诱导MPM抗TG效应的逆转作用(见图2E);在IL-6及IL-6和IFNγ处理的MPM中,加入抗TNFα抗体,再感染TG(见图2F),抗TNFα对IL-6引起的TG增殖作用无影响,但可增加IL-6对IFNγ诱导MPM抗TG效应的逆转作用。
 #v;|f, 百拇医药
#v;|f, 百拇医药图2 IL-6促进弓形虫在小鼠腹腔巨噬细胞内的增殖及其对IFNγ抗弓形虫作用的影响#v;|f, 百拇医药
Fig2 The effects of IL-6 on toxoplasma gondii growth and IFNγ-induced toxoplasmastatic activity in MPM#v;|f, 百拇医药
2.3 IL-4对MPM抗TG效应的影响 在TG感染前24h及感染后应用100U/ml IL-4(见图3A),IL-4 100U/ml时能够诱导MPM抗TG效应,但作用不如IFNγ,随IL-4剂量增加,IL-4诱导MPM抗TG效应增强,200U/ml即达高峰,(见图3B);IL-4和IFNγ共同处理MPM表明(见图3C)两者具有相加作用;在IL-4、IFNγ处理MPM同时加入抗TNFα抗体(见图3D),抗TNFα对IL-4诱导的MPM抗TG活性无明显影响。
 #v;|f, 百拇医药
#v;|f, 百拇医药图3 IL-4对小鼠腹腔巨噬细胞抗弓形虫作用的影响
Fig3 The effects of IL-4 on IFNγ-induced toxoplasmastatic activity in MPMao, 百拇医药
2.4 IL-2在小鼠抗TG感染中的作用 实验组自1×102个TG感染前2d至感染后第4d(-2,-1,0,+1,+2,+3,+4),每天腹腔注射100U/ml IL-2(0.1ml),共700U,对照组小鼠注射等量PBS(见图4A,B),结果显示,对照组平均生存时间为9.2±1.2,而实验组为14.1±1.2,两组相比差异显著;在观察IL-2对急性TG感染小鼠脾细胞杀伤活性的影响的实验中,在TG感染小鼠第-2,-1,0,+1,+2d,实验组小鼠每只每次注射100U IL-2 0.1ml,对照组注射等量的PBS,感染后第3d测小鼠脾细胞杀伤肿瘤细胞及TG感染的自身脾脏淋巴母细胞的能力(见图4C),IL-2治疗组的杀伤肿瘤细胞及TG感染自身细胞的能力均明显高于对照组(P<0.001),同时也发现对照组小鼠脾细胞几乎不能杀伤TG感染的自体靶细胞;在IL-2体外诱导小鼠脾细胞杀伤能力的实验中,取正常小鼠脾细胞悬液,直接杀伤肿瘤细胞及TG感染的自身靶细胞(NK)或经IL-2 100U/ml体外诱导72h后杀伤靶细胞(LAK)(见图4D),小鼠NK细胞杀伤自身感染TG靶细胞的能力显著低于杀伤肿瘤细胞的能力(P<0.01),而IL-2诱导的LAK细胞杀伤自身感染TG靶细胞明显高于NK细胞(P<0.01),且与LAK杀伤肿瘤靶细胞的能力无明显差别(P>0.05)。
 ao, 百拇医药
ao, 百拇医药图4 IL-2在小鼠抗弓形虫感染中的作用ao, 百拇医药
Fig4 The effects of IL-2 against toxolasma gondii infection in miceao, 百拇医药
3 讨论ao, 百拇医药
单独应用TNFα可部分激活MPM抑制TG的增殖早有报导[6],其作用机制到目前尚不清楚,但已有研究表明,不论体内外,在特定的条件下剌激MPM,确实可以产生超过1×104U/ml的TNFα[7]。TNFα与IFNγ协同作用的机制可能是,当其发挥作用时TNFα需要同膜表面TNFα受体结合,低剂量的IFNγ可以诱导多种细胞株表达TNFα受体;另一种可能是TNFα单独与膜受体结合,不足以激活涉及抗TG效应的转导途径,另一个所需的信号则可能是低剂量的IFNγ或IL-1,因为IL-1已被证实涉及参与机体抗多种病原体的效应,其中包括TG[8]。
IL-6促进TG在MPM内增殖的机制到目前还不清楚,但可能与以下两个方面有关:(1)IL-6可能是TG特异性生长因子,直接促进TG增殖。1992年DENIS等[9]报导IL-6可在体外直接促进鸟型结核分支杆菌增殖,结核分支杆菌细胞壁上存在IL-6特异性受体;(2)IL-6可能通过抑制MPM的有氧或无氧杀伤途径而促进TG在MPM内增殖。MURRAY等[10]报导IL-6通过此途径促进衣原体及利什曼原虫的增殖。本实验结果支持后一种设想,因为IL-6可以部分逆转IFNγ诱导的MPM抗TG效应,并呈剂量依赖性关系。但使人感兴趣的是,在上述实验中加入TNFα可以降低IL-6对IFNγ诱导抗TG效应的逆转作用,而加入抗TNFα抗体则可增加这种逆转作用,均提示在IL-6逆转的IFNγ诱导的MPM抗TG效应过程中与内源性TNFα有关。cm, 百拇医药
一般认为当体内IL-4含量增高时,应该对Th1和Tc1分泌的IFNγ和TNFα起拮抗作用,二者均在抗TG效应中起着重要作用。到目前已有关于TG抗原可以诱导特异性Th2、Tc2克隆的报导[11]。而Roberts等人[12]认为IL-4在TG感染过程中起着双向调节的作用。本实验表明,IL-4可以部分抑制TG在MPM内的增殖,增加剂量至1000U/ml,抑制作用未见明显增加;IL-4可以增加IFNγ诱导的MPM抗TG效应,但无协同作用,提示IL-4对MPM内TG增殖的抑制作用与IFNγ不同。cm, 百拇医药
至今人们已对IL-2抗TG效应的机制进行了广泛的研究,但结果仍不能令人满意。一般认为,Mφ表面亦存在IL-2受体,IL-2除了以往认为的通过诱生IFNγ而间接活化Mφ外,其本身也可直接增强Μφ的吞噬杀伤能力,同时,IL-2具有促进Pre-NK细胞的成熟、调整CD3-.CD56+/CD3+.CD56-细胞比例的功能,因此,增强NK细胞对TG的杀伤能力,也是目前为人们所瞩目的[13,14]。本实验提示(图4),IL-2体内应用提高TG感染小鼠生存能力的机制可能与提高体内LAK细胞杀伤自身感染TG细胞的能力有关;NK细胞的抗TG机制可能在于激活NK细胞产生IFNγ和TNFα等细胞因子,间接地作用于Μφ而发挥作用。cm, 百拇医药
[作者简介]方艳秋(1968-),女,吉林长春市人,助研,博士,主要从事抗感染免疫、自身免疫病及肿瘤生物治疗的研究。
[参考文献]k, 百拇医药
[1]SUBAUSTE CS,REMINGTON JS. Role of gamma interferon in toxoplasma gondii infection[J].Eur J Clin Microbiol Infect Dis,1991,10:58~72.k, 百拇医药
[2]SUZUKI Y,ORLLANA MA,SCHREIBER RD,et al.Interferon-γ:the major mediator of resistance against toxoplasma gondii[J].Science,1988,240:516~518.k, 百拇医药
[3]方艳秋,谭岩,张永生.IL-6对弓形虫增殖的影响[J].中国寄生虫学与寄生虫病杂志,1999,17(2):106~108.k, 百拇医药
[4]方艳秋,谭 岩.IL-2在小鼠抗弓形虫作用的研究[J].中国人兽共患病杂志,1998,14(4):11~14.k, 百拇医药
[5]谭岩,王江滨.胃癌患者外周血淋巴因子活化杀伤细胞活性测定及影响因素[J].中华内科杂志,1990,29(9):550~552.k, 百拇医药
[6]CHANG HR,GE GRAU. Role of TNF and IL-1 in infections with Toxoplasma gondii[J].Imunology,1990,69:33~39.k, 百拇医药
[7]JAN A,LANGERMANS M.IFN-γinduced dependent toxoplasmastatic activity in murine peritoneal macrophages is mediated by endogenous tumor necrosis factor-α[J].J Immunol,1992,148:568~579.k, 百拇医药
[8]KULLBERG BJ,VAN WOUT JW,VAN FURTH,et al.Role of granulo-cytes in increased host resistance to Candida albicans induced by rIL-1[J].Infect Immun,1990,58:3319~3330.
[9]DENIS M.IL-6 is used as a growth factor by virulent Mycoba-cterium avium:presence of speific receptors.Cell Immunl,1992,141:182~190.k7(', 百拇医药
[10]MURRAY HW,GRANGER AM,TEITELBAUM RF et al.Gamma interferon-activated humamacrophages and Toxoplasma gondii,Chlamydia psittaci,and Leishmania donovani;antimicrobial role of limiting intracellular iron[J].Infect Immun.1991,59:4684~6492.k7(', 百拇医药
[11]DAUBENER W,MACKENZIE C,HADDING U,et al.Establishment of T helper type 1-and T-helper type 2-like human toxoplasma antigen-spicific T-cell clones[J].Immunology,1995,86:79~87.k7(', 百拇医药
[12]ROBERTS CW,FERGUSON DJP,JEBBARI H,et al.Different roles for IL-4 during the course of toxoplasma gondii infection[J].Infect Immun,1996,64:897~906.k7(', 百拇医药
[13]GOYAL M,GANGULY NK,MAHAJAN RC.Natural killer cell cyto-toxicity against toxoplasma gondii in acute and chronic murine toxoplasnosis[J].Med Sci Res,1988,16:375~387.k7(', 百拇医药
[14]DANNEMANN BR,MORRIS VA,ARAUJO FG,et al.Assessment of human natural killer and lymphokkine activated killer cells cytoto-xicity against toxoplasma gondii trphozoites and brain cysts[J].J Immunol,1989,143:2684~2691.k7(', 百拇医药
[收稿日期]1999-06-17;[修回日期]2000-02-21(方艳秋 许淑芬 谭岩)