突变和修饰IFN-α 2b基因的5’和3’端对其在E.Coli表达的调控作用
作者:胡守旺 梁希若 吴淑华k*wm, 百拇医药
单位:胡守旺(广东省卫生防疫站,广东 广州 510300);梁希若(广州医学院,广东 广州 510182);吴淑华(中国预防医学科学院病毒学研究所,北京 100052)k*wm, 百拇医药
关键词:IFN-α2b基因;PCR;3’端非编码区;5’端翻译起始区;表达调控k*wm, 百拇医药
免疫学杂志000311k*wm, 百拇医药
[摘 要] 目的 对人IFN-α2b基因进行突变和修饰,从翻译水平上调控IFN-α2b基因在大肠杆菌中的表达。方法 采用PCR技术,人工合成寡核苷酸引物,对人IFN-α2b基因进行了改造:在不改变氨基酸的前提下,将5’端编码区的四个G、C位点突变为A、T;去除3’端非编码区。将突变和修饰后的基因片段分别克隆入原核表达载体pBV321,在大肠杆菌中进行表达。对表达产物进行活性效价测定。结果 3’端删除非编码区,表达水平比删除前提高4倍;5’端四个位点突变,表达水平比突变前降低2倍。结论 IFN-α2b基因的3’端非编码区抑制其在原核系统的表达,删除该区可提高表达水平。k*wm, 百拇医药
[中图分类号] R392.1 [文献标识码] Ak*wm, 百拇医药
[文章编号]1000-8861(2000)05-0355-04k*wm, 百拇医药
Mutagenesis and modifications of IFN-α 2b gene affect the expression level in E.colik*wm, 百拇医药
Hu Shou-wangk*wm, 百拇医药
(Health and Epidemic Prevention Station of Guangdong Province,Guangzhou 510300,China)k*wm, 百拇医药
Liang xi-ruok*wm, 百拇医药
(Guangzhou Medical College,Guangzhou 510182,China)k*wm, 百拇医药
Wu shu-hua
(Institute of Virology,Chinese Academy of Preventive Medicine,Beijing 100052,China)tf[u, 百拇医药
[Abstract] Objective To investigate the effects of mutation and modification of human IFN-α2b gene and translational control of the expression of IFN-α2b gene in E.coli.Methods PCR was pertormed as follows:four G and C bases in 5’ terminal were substituted with A or T,without altering the amino acid sequence;the downstream of stop codon TAG in the 3’terminal non-coding region was removed.The mutated and modified genes were then cloned into expressing vector pBV321 and expressed in E.coli respectively. The activity and potency of expressed proteins were determined.Results The highest level of expression was obtained by removal of 3’ terminal non-coding region(four times as much as the original value);by mutation of 4 sites the 5’ terminal,the expression level was 0.5 times as compared to that of the original level.Conclusion IFN-α2b gene 3’terminal non-coding region hinders the expression in E.coli,and it is feasible to increase the expression level by removal of the region.tf[u, 百拇医药
[Key words] IFN-α2b gene;PCR;3’non-coding region;5’TIR;regulation of expression
干扰素(IFN)是一类具有复杂生物学活性的细胞因子。作为病毒性、免疫病理性和肿瘤等疾病的生物治疗手段,天然和重组IFN在临床上应用日益广泛。国内外重组IFN-α2b的开发研究是将人IFN-α2b基因的编码区连同其3’端非编码区克隆入表达载体,在原核系统获得较高表达水平。本研究的目的是对人IFN-α2b基因进行5’端突变和3’端修饰,从翻译水平上调控IFN-α2b基因在原核系统的表达,以求进一步提高表达水平。5q9e, 百拇医药
1 材料与方法5q9e, 百拇医药
1.1 DNA片段、质粒载体 pBV27:插入IFN-α2b基因全序列的pBV321质粒;pBV321:原核系统高效表达载体。以上载体由中国预防医科院病毒所病毒基因工程国家重点实验室提供。5q9e, 百拇医药
1.2 细胞、菌株、病毒 WISH细胞株(对VSV敏感,用于干扰素生物学活性的测定)、VSV(水泡性口腔炎病毒)、DH5α、JM103、JM109菌株,由病毒所基因室提供。5q9e, 百拇医药
1.3 酶类 T4DNA连接酶、TaqDNA聚合酶、以及EcoRⅠ、XbaⅠ、PstⅠ、PvuⅡ、HindⅢ、ClaⅠ等限制性内切酶,以及核糖核酸酶、溶菌酶、细胞消化胰酶等,分别购自美国Promega、New England Biolabs公司、德国Boehringer Mannheim公司,以及华美、天象人等公司。5q9e, 百拇医药
1.4 试剂 丙烯酰胺、N,N-亚甲基双丙烯酰胺、TEMED、SDS(电泳级)购自美国SERVA公司。X-gal、IPTG:美国Promega公司。其它试剂和材料分别购自相关国内外公司。5q9e, 百拇医药
1.5 PCR引物设计和合成5q9e, 百拇医药
5’端引物序列:5’-GC TCTAGA ATG TGT GAT TTA CCT CAA ACT CAT AGC CTG GGT AGC…3’5q9e, 百拇医药
5’端原序列:5’…AATTC ATG TGT GAT CTG CCT CAA ACC CAC AGC CTG GGT AGC…3’5q9e, 百拇医药
3’端原序列:5’…TA AGA AGT AAG GAA TGA AAA CTG GTT CAA …3’
3’端引物序列:3’…AT TCT TCA TTC CTT ACT ATT GAC GTC TT-5’k^#4, 百拇医药
5’端引物中有4个突变位点,并引入XbaⅠ酶切点;3’端引物中增加TAA终止子及PstⅠ酶切点。k^#4, 百拇医药
1.6 聚合酶链反应(PCR) PCR反应系统:DNA模板(pBV27/XbaⅠ、PstⅠ)103~107拷贝/反应,上下游引物各0.25μmol/l,dNTP 250 μmol/L,MgCl2 1.5~4.5 nmol/L。95 °C 1 min,50~64 °C退火1 min,72 °C延伸10 min,30个循环扩增后,再72 °C延伸10 min。取5 μ1样品于1.2%琼脂糖电泳鉴定。k^#4, 百拇医药
1.7 分子克隆和亚克隆技术 按照参考文献[1]进行。k^#4, 百拇医药
1.8 核苷酸序列测定 PCR产物片段插入pGEM-T载体中,在Mode1373A自动测序上完成测序。k^#4, 百拇医药
1.9 重组人IFN-α2b基因在大肠杆菌中的表达及样品制备 选择含IFN-α2b表达质粒的单菌落,LB培养基中37 °C活化过夜,1∶10二次活化8 h。收集OD650值1.0的菌液,5 000 r/min 5 min,将沉淀重新悬浮于缓冲液中,超声波裂解或加溶菌酶至1 mg/ml冰浴作用30 min,加0.2 mmol/L EDTA(或直接放-20 °C)终止反应。冻溶3次,15 000 r/min 15 min,上清即为粗制干扰素。k^#4, 百拇医药
1.10 重组人IFN-α2b抗病毒活性及效价测定 采用VSV-WISH细胞病变抑制法[2]。WISH细胞悬液加入96孔板培养,每孔100 μ1。5% CO2孵箱37 °C过夜,去除培养液,加4倍比稀释的干扰素溶液,37 °C、5%CO2孵育过夜后,弃干扰素溶液,用50~100TCID50的VSV攻击,37 °C、5% CO2培养1~2 d,待对照孔的细胞75%以上发生明显病变时记录结果。用能抑制50%细胞病变的最高稀释度作为1个干扰素单位。k^#4, 百拇医药
1.11 表达产物SDS-PAGE电泳 分离胶和浓缩胶的浓度为12%和5%,上样后恒压电泳,浓缩胶100 V,分离胶180 V。电泳完成后,考马斯亮蓝R250染色。
2 结果0, http://www.100md.com
2.1 IFN-α2b基因的定点诱变和修饰 人工合成寡核苷酸引物,在引物指导下,对IFN-α2b基因进行突变和修饰,PCR扩增出新的基因片段。所有的突变和修饰只改变DNA序列,而不改变其翻译所得的氨基酸序列。结果,在5’端将4个位点的G、C突变为T、A,3’端删除全部非编码区330 bp(包括其中的TA富集序列),并增加原核强终止子TAA,这样,使基因序列由850 bp缩短到520 bp。PCR产物经过1.2%琼脂糖电泳,结果显示明显的520 bp大小的亮带(见图1)。 0, http://www.100md.com
0, http://www.100md.com
图1PCR扩增突变和修饰后的IFN-α2b基因琼脂糖凝胶电泳图0, http://www.100md.com
Fig 1Electrophoretic pattern of IFN-α2b gene after PCR amplification0, http://www.100md.com
1:p27/EcoRⅠ;2:PCR product;3:λDNA/HindⅢ marker0, http://www.100md.com
2.2 PCR产物IFN-α2b基因的核苷酸序列测定 PCR产物用1.2%琼脂糖电泳回收、纯化,与pGEM-T载体连接,构建成测序载体pGEM-TIFNab。对插入测序载体的IFN-α2b基因序列进行DNA序列分析。结果表明:PCR扩增产物序列与实验设计序列完全相符(测序图略)。0, http://www.100md.com
2.3 重组IFN-α2b基因原核表达载体的构建 与原序列相比,PCR获得的IFN-α2b基因片段有5’端核苷酸突变和3’端非编码区删除修饰。为了分别研究这两个区域的变化对表达水平的影响,实验中利用PvuⅡ、XbaⅠ及PstⅠ位点,对基因片段进行重新酶切、连接组合,总共有4种组合的片段:①5’端突变、3’端删除非编码区(命名为IFNab);②5’端突变、3’端保留非编码区(命名为IFNad);③5’端不变、3’端删除非编码区(命名为IFNcb);④5’端不变、3’端保留非编码区(命名为IFNcd)。将以上基因片段分别插入同种载体pBV321,分别得到相应的4种表达载体pIFNab、pIFNcd、pIFNcb及pIFNad。构建程序见图2。 0, http://www.100md.com
0, http://www.100md.com
图2原核表达载体pIFNab、pIFNcd、pIFNad及pIFNcb的构建
Fig 2Construction of expression plasmids pIFNab、pIFNcd、pIFNad and pIFNcb]0cnh, 百拇医药
2.4 重组IFN-α2b在大肠杆菌中的表达]0cnh, 百拇医药
2.4.1 rIFN-α2b在大肠杆菌中的表达及SDS-PAGE:4种表达质粒分别转化大肠杆菌进行表达,盐酸胍裂解,硫酸铵沉淀,蒸溜水透析24 h。12%SDS-PAGE结果如图3所示,在19 kD处出现新增蛋白带,这条蛋白带的电泳行为与IFN-α2b的特性相符。 ]0cnh, 百拇医药
]0cnh, 百拇医药
图3表达产物的SDS-PAGE电泳分析]0cnh, 百拇医药
Fig 3SDS-PAGE analysis of expression product]0cnh, 百拇医药
1:molecular weight standard;2,3,4,7:pBV321;5:pIFNab;6:pIFNad;8:pIFNcb;9:pIFNcd]0cnh, 百拇医药
2.4.2 rIFN-α2b的抗病毒活性效价测定:溶菌酶裂解法获得粗制IFN-α2b,采用VSV-WISH细胞病变抑制法测定其活性效价。结果:未经突变和修饰的IFN-α2b基因原序列载体(pIFNcd),表达产物的效价为1.74×107 U/L菌液,设此值为1,5’端突变而3’端未删除者(pIFNad),效价降低为0.5;5’端突变同时3’端删除者(pIFNab),效价降低为0.67;3’端删除但5’端未突变者(pIFNcb),效价提高到4,见表1。]0cnh, 百拇医药
表1 rIFN-α2b的活性效价测定]0cnh, 百拇医药
Tab 1 rIFN-α2b activity expressed in E.coli plasmids]0cnh, 百拇医药
activity]0cnh, 百拇医药
(IU/L)]0cnh, 百拇医药
ratio to]0cnh, 百拇医药
original
pIFNcd(original sequence).g9}, 百拇医药
1.74×107.g9}, 百拇医药
1.g9}, 百拇医药
pIFNad(5’mutated).g9}, 百拇医药
8.80×106.g9}, 百拇医药
0.5.g9}, 百拇医药
pIFNab(5’mutated,3’removal).g9}, 百拇医药
1.16×107.g9}, 百拇医药
0.67.g9}, 百拇医药
pIFNcb(3’removal).g9}, 百拇医药
7.10×107.g9}, 百拇医药
4.g9}, 百拇医药
P<0.01,each activity is an average value of 3 experiments..g9}, 百拇医药
3 讨论.g9}, 百拇医药
在原核系统表达真核基因,其表达效率受转录和翻译两方面调控[3]。影响转录的因素包括启动子、增强子、SD序列、转录终止子等,这是构建表达载体时必须考虑的。而影响翻译的因素多与目的基因序列本身的结构有关,包括mRNA 5’端翻译起始区(TIR)的二级结构稳定性、3’端非编码区(包括其中可能存在的TA富集序列)、SD序列与起始密码子间距离等[4,5]。IFN-α2b基因是真核基因,目前国内外都已在原核系统表达成功,并在转录水平得到较好调控,但在翻译水平的调控还未见报道。本研究对IFN-α2b基因的5’和3’端作了一系列的突变和修饰,从翻译水平上调控其在原核系统的表达。在5’端,将4个位点的G、C突变为A、T,结果突变后对IFN-α2b基因的表达起负调控作用。我们借助计算机软件,选择ATG下游50个核苷酸,分析了IFN-α2b基因翻译起始区(TIR)突变前后的二级结构及自由能(ΔG),结果如图4。突变了4个核苷酸残基后,序列自身形成的二级结构稳定性较突变前增强,ΔG由-9.2 kcal/mol降至-13.0 kcal/mol,二级结构的稳定性增高。可能mRNA TIR结构稳定性增强不利于它与核糖体的接近和结合[6],从而阻碍翻译的起始。为了研究3’端非编码区对IFN-α2b基因在原核系统翻译水平的影响,我们用PCR方法完全去除了3’端侧翼区,结果表达水平明显提高。据报导:许多细胞因子的3’端非翻译区都有一段TA富集序列,能被特异性核酸酶识别,可能参与mRNA的降解[7,8]。另外,有文献报道,3’端TA富集区还可能通过改变mRNA的二级结构而影响mRNA的有效翻译[9]。我们发现,IFN-α2b基因序列的3’端非翻译区内也有一段TA富集序列,提示该区对表达水平有负面影响(见下图)。我们删除了包括该区在内的所有3’端侧翼,解除了抑制作用,表达水平提高。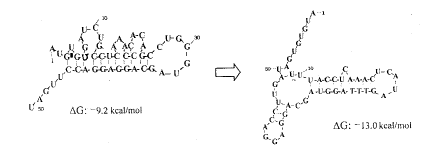
图4IFN-α2b基因序列TIR区的二级结构和ΔG*/wow6, 百拇医药
Fig 4Secondary structure and ΔG prediction of IFN-α2b gene sequence TIR */wow6, 百拇医药
*/wow6, 百拇医药
[作者简介] 胡守旺(1964-),男,安徽合肥市人,主治医师,硕士,主要从事细胞因子基因工程及病毒基因研究。*/wow6, 百拇医药
[参考文献]*/wow6, 百拇医药
[1] SAMBROOK J,FRITSCH EF,MANIATIS T.Molecular cloning, a laboratory manual [M].USA:Cold Spring Harbor Press,1989.*/wow6, 百拇医药
[2] 侯云德.病毒基因工程原理及方法[M].北京:人民卫生出版社,1985.166-175.*/wow6, 百拇医药
[3] GOLD L.Posttranscriptional regulatory mechanisms in Escherichia coli[J].Ann Rev Biophs Chem,1988,57(2):199-223.*/wow6, 百拇医药
[4] TESSIER LH,SONDERMEYER P,FAURE T,et al.The influence of mRNA primary and secondary structure on human IFN-gamma gene expression in E.coli[J].Nucl Acids Res,1984,12(20):7 663-7 675.*/wow6, 百拇医药
[5] DE SMIT MH,VAN DUIN J.Control of translation by mRNA secondary structure in Escherichia coli.A quantitative analysis of literature data[J].J Mol Biol,1994,244(2):144-150.*/wow6, 百拇医药
[6] 张智清,侯云德.应用PRPL串联启动子和clty857调控基因高效表达人γ干扰素调控[J].病毒学报,1988,4(2):97-101.*/wow6, 百拇医药
[7] KRUYS V,MARINX O,SHAW G,et al.Translation blockade imposed by cytokine-derived UA-rich sequence[J].Science,1989,245(4 920):852-855.*/wow6, 百拇医药
[8] KRUYS V,WATHELET M,POUPARTP,et al.The 3’untranslated region of the human interferon-beta mRNA has an inhibitory effect on translation[J].Proc Natl Acad Sci USA,1987,84(17):6 030-6 036.*/wow6, 百拇医药
[9] SHAW G,KAMAN R.A conserved AU sequence from the 3’ untranslated region of GM-CSF mRNA mediates selective mRNA degradation[J].Cell,1986,46(5):659-663.*/wow6, 百拇医药
[收稿日期] 2000-01-27; [修回日期] 2000-04-28(胡守旺 梁希若 吴淑华)
单位:胡守旺(广东省卫生防疫站,广东 广州 510300);梁希若(广州医学院,广东 广州 510182);吴淑华(中国预防医学科学院病毒学研究所,北京 100052)k*wm, 百拇医药
关键词:IFN-α2b基因;PCR;3’端非编码区;5’端翻译起始区;表达调控k*wm, 百拇医药
免疫学杂志000311k*wm, 百拇医药
[摘 要] 目的 对人IFN-α2b基因进行突变和修饰,从翻译水平上调控IFN-α2b基因在大肠杆菌中的表达。方法 采用PCR技术,人工合成寡核苷酸引物,对人IFN-α2b基因进行了改造:在不改变氨基酸的前提下,将5’端编码区的四个G、C位点突变为A、T;去除3’端非编码区。将突变和修饰后的基因片段分别克隆入原核表达载体pBV321,在大肠杆菌中进行表达。对表达产物进行活性效价测定。结果 3’端删除非编码区,表达水平比删除前提高4倍;5’端四个位点突变,表达水平比突变前降低2倍。结论 IFN-α2b基因的3’端非编码区抑制其在原核系统的表达,删除该区可提高表达水平。k*wm, 百拇医药
[中图分类号] R392.1 [文献标识码] Ak*wm, 百拇医药
[文章编号]1000-8861(2000)05-0355-04k*wm, 百拇医药
Mutagenesis and modifications of IFN-α 2b gene affect the expression level in E.colik*wm, 百拇医药
Hu Shou-wangk*wm, 百拇医药
(Health and Epidemic Prevention Station of Guangdong Province,Guangzhou 510300,China)k*wm, 百拇医药
Liang xi-ruok*wm, 百拇医药
(Guangzhou Medical College,Guangzhou 510182,China)k*wm, 百拇医药
Wu shu-hua
(Institute of Virology,Chinese Academy of Preventive Medicine,Beijing 100052,China)tf[u, 百拇医药
[Abstract] Objective To investigate the effects of mutation and modification of human IFN-α2b gene and translational control of the expression of IFN-α2b gene in E.coli.Methods PCR was pertormed as follows:four G and C bases in 5’ terminal were substituted with A or T,without altering the amino acid sequence;the downstream of stop codon TAG in the 3’terminal non-coding region was removed.The mutated and modified genes were then cloned into expressing vector pBV321 and expressed in E.coli respectively. The activity and potency of expressed proteins were determined.Results The highest level of expression was obtained by removal of 3’ terminal non-coding region(four times as much as the original value);by mutation of 4 sites the 5’ terminal,the expression level was 0.5 times as compared to that of the original level.Conclusion IFN-α2b gene 3’terminal non-coding region hinders the expression in E.coli,and it is feasible to increase the expression level by removal of the region.tf[u, 百拇医药
[Key words] IFN-α2b gene;PCR;3’non-coding region;5’TIR;regulation of expression
干扰素(IFN)是一类具有复杂生物学活性的细胞因子。作为病毒性、免疫病理性和肿瘤等疾病的生物治疗手段,天然和重组IFN在临床上应用日益广泛。国内外重组IFN-α2b的开发研究是将人IFN-α2b基因的编码区连同其3’端非编码区克隆入表达载体,在原核系统获得较高表达水平。本研究的目的是对人IFN-α2b基因进行5’端突变和3’端修饰,从翻译水平上调控IFN-α2b基因在原核系统的表达,以求进一步提高表达水平。5q9e, 百拇医药
1 材料与方法5q9e, 百拇医药
1.1 DNA片段、质粒载体 pBV27:插入IFN-α2b基因全序列的pBV321质粒;pBV321:原核系统高效表达载体。以上载体由中国预防医科院病毒所病毒基因工程国家重点实验室提供。5q9e, 百拇医药
1.2 细胞、菌株、病毒 WISH细胞株(对VSV敏感,用于干扰素生物学活性的测定)、VSV(水泡性口腔炎病毒)、DH5α、JM103、JM109菌株,由病毒所基因室提供。5q9e, 百拇医药
1.3 酶类 T4DNA连接酶、TaqDNA聚合酶、以及EcoRⅠ、XbaⅠ、PstⅠ、PvuⅡ、HindⅢ、ClaⅠ等限制性内切酶,以及核糖核酸酶、溶菌酶、细胞消化胰酶等,分别购自美国Promega、New England Biolabs公司、德国Boehringer Mannheim公司,以及华美、天象人等公司。5q9e, 百拇医药
1.4 试剂 丙烯酰胺、N,N-亚甲基双丙烯酰胺、TEMED、SDS(电泳级)购自美国SERVA公司。X-gal、IPTG:美国Promega公司。其它试剂和材料分别购自相关国内外公司。5q9e, 百拇医药
1.5 PCR引物设计和合成5q9e, 百拇医药
5’端引物序列:5’-GC TCTAGA ATG TGT GAT TTA CCT CAA ACT CAT AGC CTG GGT AGC…3’5q9e, 百拇医药
5’端原序列:5’…AATTC ATG TGT GAT CTG CCT CAA ACC CAC AGC CTG GGT AGC…3’5q9e, 百拇医药
3’端原序列:5’…TA AGA AGT AAG GAA TGA AAA CTG GTT CAA …3’
3’端引物序列:3’…AT TCT TCA TTC CTT ACT ATT GAC GTC TT-5’k^#4, 百拇医药
5’端引物中有4个突变位点,并引入XbaⅠ酶切点;3’端引物中增加TAA终止子及PstⅠ酶切点。k^#4, 百拇医药
1.6 聚合酶链反应(PCR) PCR反应系统:DNA模板(pBV27/XbaⅠ、PstⅠ)103~107拷贝/反应,上下游引物各0.25μmol/l,dNTP 250 μmol/L,MgCl2 1.5~4.5 nmol/L。95 °C 1 min,50~64 °C退火1 min,72 °C延伸10 min,30个循环扩增后,再72 °C延伸10 min。取5 μ1样品于1.2%琼脂糖电泳鉴定。k^#4, 百拇医药
1.7 分子克隆和亚克隆技术 按照参考文献[1]进行。k^#4, 百拇医药
1.8 核苷酸序列测定 PCR产物片段插入pGEM-T载体中,在Mode1373A自动测序上完成测序。k^#4, 百拇医药
1.9 重组人IFN-α2b基因在大肠杆菌中的表达及样品制备 选择含IFN-α2b表达质粒的单菌落,LB培养基中37 °C活化过夜,1∶10二次活化8 h。收集OD650值1.0的菌液,5 000 r/min 5 min,将沉淀重新悬浮于缓冲液中,超声波裂解或加溶菌酶至1 mg/ml冰浴作用30 min,加0.2 mmol/L EDTA(或直接放-20 °C)终止反应。冻溶3次,15 000 r/min 15 min,上清即为粗制干扰素。k^#4, 百拇医药
1.10 重组人IFN-α2b抗病毒活性及效价测定 采用VSV-WISH细胞病变抑制法[2]。WISH细胞悬液加入96孔板培养,每孔100 μ1。5% CO2孵箱37 °C过夜,去除培养液,加4倍比稀释的干扰素溶液,37 °C、5%CO2孵育过夜后,弃干扰素溶液,用50~100TCID50的VSV攻击,37 °C、5% CO2培养1~2 d,待对照孔的细胞75%以上发生明显病变时记录结果。用能抑制50%细胞病变的最高稀释度作为1个干扰素单位。k^#4, 百拇医药
1.11 表达产物SDS-PAGE电泳 分离胶和浓缩胶的浓度为12%和5%,上样后恒压电泳,浓缩胶100 V,分离胶180 V。电泳完成后,考马斯亮蓝R250染色。
2 结果0, http://www.100md.com
2.1 IFN-α2b基因的定点诱变和修饰 人工合成寡核苷酸引物,在引物指导下,对IFN-α2b基因进行突变和修饰,PCR扩增出新的基因片段。所有的突变和修饰只改变DNA序列,而不改变其翻译所得的氨基酸序列。结果,在5’端将4个位点的G、C突变为T、A,3’端删除全部非编码区330 bp(包括其中的TA富集序列),并增加原核强终止子TAA,这样,使基因序列由850 bp缩短到520 bp。PCR产物经过1.2%琼脂糖电泳,结果显示明显的520 bp大小的亮带(见图1)。
 0, http://www.100md.com
0, http://www.100md.com图1PCR扩增突变和修饰后的IFN-α2b基因琼脂糖凝胶电泳图0, http://www.100md.com
Fig 1Electrophoretic pattern of IFN-α2b gene after PCR amplification0, http://www.100md.com
1:p27/EcoRⅠ;2:PCR product;3:λDNA/HindⅢ marker0, http://www.100md.com
2.2 PCR产物IFN-α2b基因的核苷酸序列测定 PCR产物用1.2%琼脂糖电泳回收、纯化,与pGEM-T载体连接,构建成测序载体pGEM-TIFNab。对插入测序载体的IFN-α2b基因序列进行DNA序列分析。结果表明:PCR扩增产物序列与实验设计序列完全相符(测序图略)。0, http://www.100md.com
2.3 重组IFN-α2b基因原核表达载体的构建 与原序列相比,PCR获得的IFN-α2b基因片段有5’端核苷酸突变和3’端非编码区删除修饰。为了分别研究这两个区域的变化对表达水平的影响,实验中利用PvuⅡ、XbaⅠ及PstⅠ位点,对基因片段进行重新酶切、连接组合,总共有4种组合的片段:①5’端突变、3’端删除非编码区(命名为IFNab);②5’端突变、3’端保留非编码区(命名为IFNad);③5’端不变、3’端删除非编码区(命名为IFNcb);④5’端不变、3’端保留非编码区(命名为IFNcd)。将以上基因片段分别插入同种载体pBV321,分别得到相应的4种表达载体pIFNab、pIFNcd、pIFNcb及pIFNad。构建程序见图2。
 0, http://www.100md.com
0, http://www.100md.com图2原核表达载体pIFNab、pIFNcd、pIFNad及pIFNcb的构建
Fig 2Construction of expression plasmids pIFNab、pIFNcd、pIFNad and pIFNcb]0cnh, 百拇医药
2.4 重组IFN-α2b在大肠杆菌中的表达]0cnh, 百拇医药
2.4.1 rIFN-α2b在大肠杆菌中的表达及SDS-PAGE:4种表达质粒分别转化大肠杆菌进行表达,盐酸胍裂解,硫酸铵沉淀,蒸溜水透析24 h。12%SDS-PAGE结果如图3所示,在19 kD处出现新增蛋白带,这条蛋白带的电泳行为与IFN-α2b的特性相符。
 ]0cnh, 百拇医药
]0cnh, 百拇医药图3表达产物的SDS-PAGE电泳分析]0cnh, 百拇医药
Fig 3SDS-PAGE analysis of expression product]0cnh, 百拇医药
1:molecular weight standard;2,3,4,7:pBV321;5:pIFNab;6:pIFNad;8:pIFNcb;9:pIFNcd]0cnh, 百拇医药
2.4.2 rIFN-α2b的抗病毒活性效价测定:溶菌酶裂解法获得粗制IFN-α2b,采用VSV-WISH细胞病变抑制法测定其活性效价。结果:未经突变和修饰的IFN-α2b基因原序列载体(pIFNcd),表达产物的效价为1.74×107 U/L菌液,设此值为1,5’端突变而3’端未删除者(pIFNad),效价降低为0.5;5’端突变同时3’端删除者(pIFNab),效价降低为0.67;3’端删除但5’端未突变者(pIFNcb),效价提高到4,见表1。]0cnh, 百拇医药
表1 rIFN-α2b的活性效价测定]0cnh, 百拇医药
Tab 1 rIFN-α2b activity expressed in E.coli plasmids]0cnh, 百拇医药
activity]0cnh, 百拇医药
(IU/L)]0cnh, 百拇医药
ratio to]0cnh, 百拇医药
original
pIFNcd(original sequence).g9}, 百拇医药
1.74×107.g9}, 百拇医药
1.g9}, 百拇医药
pIFNad(5’mutated).g9}, 百拇医药
8.80×106.g9}, 百拇医药
0.5.g9}, 百拇医药
pIFNab(5’mutated,3’removal).g9}, 百拇医药
1.16×107.g9}, 百拇医药
0.67.g9}, 百拇医药
pIFNcb(3’removal).g9}, 百拇医药
7.10×107.g9}, 百拇医药
4.g9}, 百拇医药
P<0.01,each activity is an average value of 3 experiments..g9}, 百拇医药
3 讨论.g9}, 百拇医药
在原核系统表达真核基因,其表达效率受转录和翻译两方面调控[3]。影响转录的因素包括启动子、增强子、SD序列、转录终止子等,这是构建表达载体时必须考虑的。而影响翻译的因素多与目的基因序列本身的结构有关,包括mRNA 5’端翻译起始区(TIR)的二级结构稳定性、3’端非编码区(包括其中可能存在的TA富集序列)、SD序列与起始密码子间距离等[4,5]。IFN-α2b基因是真核基因,目前国内外都已在原核系统表达成功,并在转录水平得到较好调控,但在翻译水平的调控还未见报道。本研究对IFN-α2b基因的5’和3’端作了一系列的突变和修饰,从翻译水平上调控其在原核系统的表达。在5’端,将4个位点的G、C突变为A、T,结果突变后对IFN-α2b基因的表达起负调控作用。我们借助计算机软件,选择ATG下游50个核苷酸,分析了IFN-α2b基因翻译起始区(TIR)突变前后的二级结构及自由能(ΔG),结果如图4。突变了4个核苷酸残基后,序列自身形成的二级结构稳定性较突变前增强,ΔG由-9.2 kcal/mol降至-13.0 kcal/mol,二级结构的稳定性增高。可能mRNA TIR结构稳定性增强不利于它与核糖体的接近和结合[6],从而阻碍翻译的起始。为了研究3’端非编码区对IFN-α2b基因在原核系统翻译水平的影响,我们用PCR方法完全去除了3’端侧翼区,结果表达水平明显提高。据报导:许多细胞因子的3’端非翻译区都有一段TA富集序列,能被特异性核酸酶识别,可能参与mRNA的降解[7,8]。另外,有文献报道,3’端TA富集区还可能通过改变mRNA的二级结构而影响mRNA的有效翻译[9]。我们发现,IFN-α2b基因序列的3’端非翻译区内也有一段TA富集序列,提示该区对表达水平有负面影响(见下图)。我们删除了包括该区在内的所有3’端侧翼,解除了抑制作用,表达水平提高。

图4IFN-α2b基因序列TIR区的二级结构和ΔG*/wow6, 百拇医药
Fig 4Secondary structure and ΔG prediction of IFN-α2b gene sequence TIR
 */wow6, 百拇医药
*/wow6, 百拇医药[作者简介] 胡守旺(1964-),男,安徽合肥市人,主治医师,硕士,主要从事细胞因子基因工程及病毒基因研究。*/wow6, 百拇医药
[参考文献]*/wow6, 百拇医药
[1] SAMBROOK J,FRITSCH EF,MANIATIS T.Molecular cloning, a laboratory manual [M].USA:Cold Spring Harbor Press,1989.*/wow6, 百拇医药
[2] 侯云德.病毒基因工程原理及方法[M].北京:人民卫生出版社,1985.166-175.*/wow6, 百拇医药
[3] GOLD L.Posttranscriptional regulatory mechanisms in Escherichia coli[J].Ann Rev Biophs Chem,1988,57(2):199-223.*/wow6, 百拇医药
[4] TESSIER LH,SONDERMEYER P,FAURE T,et al.The influence of mRNA primary and secondary structure on human IFN-gamma gene expression in E.coli[J].Nucl Acids Res,1984,12(20):7 663-7 675.*/wow6, 百拇医药
[5] DE SMIT MH,VAN DUIN J.Control of translation by mRNA secondary structure in Escherichia coli.A quantitative analysis of literature data[J].J Mol Biol,1994,244(2):144-150.*/wow6, 百拇医药
[6] 张智清,侯云德.应用PRPL串联启动子和clty857调控基因高效表达人γ干扰素调控[J].病毒学报,1988,4(2):97-101.*/wow6, 百拇医药
[7] KRUYS V,MARINX O,SHAW G,et al.Translation blockade imposed by cytokine-derived UA-rich sequence[J].Science,1989,245(4 920):852-855.*/wow6, 百拇医药
[8] KRUYS V,WATHELET M,POUPARTP,et al.The 3’untranslated region of the human interferon-beta mRNA has an inhibitory effect on translation[J].Proc Natl Acad Sci USA,1987,84(17):6 030-6 036.*/wow6, 百拇医药
[9] SHAW G,KAMAN R.A conserved AU sequence from the 3’ untranslated region of GM-CSF mRNA mediates selective mRNA degradation[J].Cell,1986,46(5):659-663.*/wow6, 百拇医药
[收稿日期] 2000-01-27; [修回日期] 2000-04-28(胡守旺 梁希若 吴淑华)