腺病毒载体介导的人类B7.1基因修饰的肿瘤细胞疫苗*
作者:刘雪丰 张连峰 鞠丽梅 曾 苹 马耀文 李万波 蔡有余
单位:中国协和医科大学 中国医学科学院实验动物研究所,北京 100021
关键词:腺病毒载体;B7.1;;肿瘤细胞疫苗
解剖学报/980413 摘 要 为了证明腺病毒载体可做为将B7基因导入肿瘤细胞的替代载体,达到提高肿瘤细胞疫苗效应的目的,且不存在逆转录病毒载体的局限性,用同源重组的方法构建了表达人类B7.1cDNA的重组人类5型腺病毒(AdB7.1),并用它感染小鼠乳腺癌细胞系EMF\-6和大鼠神经胶质瘤细胞系C6,检测B7.1基因在感染过的肿瘤细胞中的表达;用AdB7.1感染过的肿瘤细胞给同基因宿主(BALB/c小鼠和Wistar大鼠)接种,观察它们在体内的致瘤性及对肿瘤的防治作用;用51Cr-释放法对用各种肿瘤细胞免疫后3周的动物脾淋巴细胞进行CTLs杀伤活性的测定,来检测其细胞免疫活性。结果的Northern blot分析表明:AdB7.1感染过的肿瘤细胞表达了B7.1基因。接种/侵袭实验和CTLs杀伤活性的测定实验表明,与野生型肿瘤细胞相比,表达B7.1的肿瘤细胞在动物体内的致瘤性降低(P<0.01),能诱导针对野生型肿瘤的高水平的系统性免疫应答和细胞毒T细胞活性,对肿瘤也有一定的防治作用。本研究的结论是,腺病毒载体可代替逆转录病毒载体将B7.1基因导入肿瘤细胞,提高肿瘤细胞疫苗的抗肿瘤作用。它操作简单,感染效率高,避免了使用逆转录病毒载体的局限性。
, http://www.100md.com
机体对肿瘤的免疫主要是细胞免疫,抗肿瘤免疫治疗的目的就是要诱导一个能有效消除散布肿瘤的T细胞免疫应答。近来的研究工作已证明,除了由T细胞受体传递的抗原特异的信号外,由T细胞表面分子CD28传递的共刺激信号对T细胞的完全激活也是必要的。由CD28介导的共刺激信号对分泌IL-2的CD4+的效应细胞的产生和CD8+的细胞毒T细胞(cytotoxic T lymphocytes,CTLs)产生是必要的[1,2]。B7是CD28的配体,在被抗原呈递细胞(antigen presenting cells,APCs)表达时可提供对T细胞的共刺激[3],该分子被命名为CD80或B7.1,并表明是共刺激配体B7基因家族的成员,该家族也包括B7.2[4,5]。
在动物模型上的研究表明,用逆转录病毒载体将B7.1基因导入肿瘤细胞在动物体内诱导了特异而长期的抗肿瘤免疫应答[6~8]。然而逆转录病毒载体的低效性和细胞转染后的操作限制了这一方法的临床应用。腺病毒载体由于其诸多的优点[9],可做为将B7.1基因导入肿瘤细胞的替代载体。在这一研究中,我们构建了表达人类B7.1的重组腺病毒载体(AdB7.1),并用它感染小鼠乳腺癌细胞系EMF6和大鼠神经胶质瘤细胞系C6。Northern blot分析表明B7.1基因在这两种细胞中均得以表达。用表达B7.1的肿瘤细胞接种于同基因宿主,观察它们在动物体内的致瘤性及对肿瘤的防治作用,结果表明:与野生型肿瘤细胞相比,表达B7.1的肿瘤细胞在动物体内的致瘤性明显下降(P<0.01),且能诱导针对野生型肿瘤细胞的系统性免疫应答和高水平CTLs活性,对肿瘤有一定的防治作用。
, 百拇医药
材料和方法
1. 腺病毒载体的构建(图1)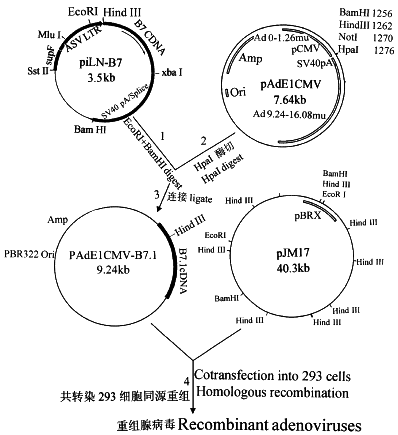
图1 表达人类B7.1基因的重组5型腺病毒载体的构建策略
(步骤1~4参见材料与方法中的概述)
Fig.1 Construction strategy of rAd5 vectors expressing human B7.1 cDNA.Number 1-4 refer to the steps as outlined in Materials and Methods.
1.1 piln-B7.1长约3.5kb,携带B7.1cDNA,是在MC1060中表达的逆转录病毒载体质粒,B7.1cDNA长约857bp(美国Pharmaceutical Research Institute 的Bill Brady博士惠赠)。用EcolR Ⅰ和BamH Ⅰ对该质粒进行双酶切,得到含有B7.1cDNA的长达1.8kb的片段。
, 百拇医药
1.2 PAdE1CMV,长7.64kb,是带有腺病毒左端0~1.6μm(其中位于1.3~9.2μm的E1区缺失)的穿梭质粒(美国Baxter基因治疗部分子生物学研究室的张维维博士惠赠)。用Hpa Ⅰ将该质粒切成线状。
1.3 用T4噬菌体DNA连接酶把含有B7.1cDNA的片段与线状的pAdE1CMV连接起来,形成环状的pAdE1CMV-B7.1。
1.4 PJM17,克隆了5型腺病毒基因组(其中E3区缺失)的质粒(加拿大Micribix Biosystems In)。用pAdE1CMV与PJM17共转染293细胞,经同源重组产生含有B7.1cDNA的重组腺病毒AdB7.1。共转染所用的Lipofectin试剂盒购自Gibico BRL公司,按试剂盒上的说明书操作。按文献[10]所述的方法纯化蚀斑,PCR鉴定阳性蚀斑,然后扩增和测定滴度[11]。所用的B7.1特异引物为5′-ATGTCGACATGGTTATCCACGTGA-3′和5′-GAGGATCCTTATATACTAGGTGTAG-3′,腺病毒载体特异的引物为5′-TCGTTTCTCAGCAGCTGTTG-3′和5′-ATCTGAACTCAAAGGGTGG-3′。为了简化,图1仅显示了AdB7.1的构建过程。含有报告基因LacZ的重组腺病毒载体AdLacZ也以类似的步骤同时构建,做为对照。LacZ重组腺病毒载体的鉴定采用X-gal染色法[12]。
, 百拇医药
2. 体外感染
EMF6来自BALB/c小鼠的乳腺癌细胞系,本室冻存。C6来自Wistar大鼠的神经胶质瘤细胞系,本室冻存。于感染前1d接种一定数量的细胞,按一定的感染强度(multiplicity of infection,MOI)计算所需病毒量,用PBS稀释至一定体积(0.5ml/60mm平皿)。感染时,弃去原培养液,加上一定体积的稀释好的病毒悬液,室温下作用1h,每间隔5min摇晃1次。之后加入完全培养基,放入37℃孵箱,培养48h。
3. Northern blot检测B7.1mRNA的表达
用酸性胍-苯酚-氯仿一步法提取肿瘤细胞总RNA,取30μg甲醛变性胶电泳后,转到硝酸纤维素膜上,预杂交后与经α-32P标记的B7.1探针杂交、洗膜、放射自显影。
, 百拇医药
4.动物接种实验
BALB/c小鼠,4~6周。Wistar大鼠,3周龄,体重70g,均购于本所繁育场。收集待接种的细胞,用生理盐水洗2次,最后悬于生理盐水中。用4号针头分别接种到鼠的腋窝或腹股沟皮下。对免疫接种或免疫治疗用的肿瘤细胞要首先用300mg/L的丝裂霉素C处理1h,然后用生理盐水洗2次,最后悬于生理盐水中,接种动物。每周测量1次肿瘤的生长情况。用测径器测瘤块的2个互相垂直的直径,把两者相加,然后除以2来计算肿瘤的大小。
5. 用51Cr释放法检测CTLs的杀伤活性
将与动物接种相同的肿瘤细胞用300mg/L的丝裂霉素C处理1h,洗后做为刺激细胞(S)。用被接种3~4周后的动物的脾淋巴细胞作为反应细胞(R)。以R/S为100/1的比例将反应细胞与刺激细胞共培养(PRMI1640,10%小牛血清)5d,收获脾细胞。以相应的野生型肿瘤细胞为靶细胞(T),用150mCi/L的51Cr(购于 Amersham,U.K.)标记靶细胞1h,洗涤后按不同的比例与反应细胞混合培养,18h后,用γ计数器测定上清中51Cr的量,按下式计算细胞毒活性: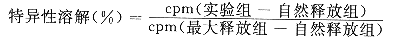
, 百拇医药
6. 统计学分析
采用t检验,P<0.05时,认为差异显著。
结果
1. 重组腺病毒AdB7.1的构建及其介导B7.1基因在肿瘤细胞中的表达
按材料和方法1中所述的步骤构建重组腺病毒AdB7.1,经筛选、扩增和纯化后,再按方法2中所述的方法感染EMF6和C6。提取用AdB7.1和AdlacZ感染(MOI 50)2d后的EMF6和C6细胞总RNA,用B7.1cDNA作为探针进行Northern blot分析。结果表明,这些肿瘤细胞中未检测到内源性B7.1mRNA的表达,AdB7.1能介导外源性B7.1mRNA在这些肿瘤细胞中高效表达(图2)。
, 百拇医药
图2 由腺病毒介导的B7.1mRNA在EMF6和C6中表达的Northern blot分析
1.AdlacZ感染的C6 2.AdB7.1感染的C6 3.Adlac Z感染的EMF6 4.AdB7.1感染的EMF6
Fig.2 Northern blotting analysis of B7.1 mRNA expression mediated by adenoviruses in EMF6 and C6
1.C6-AdlacZ; 2.C6-AdB7.1; 3.EMF6-AdlacZ; 4.EMF6-AdB7.1
, 百拇医药
2. B7.1的表达对肿瘤细胞在体内致瘤性的影响
将每种动物分为3组,每组15只。第1组用野生型肿瘤细胞皮下注射;第2组用AdlacZ感染(MOI 50)过的肿瘤细胞皮下注射;第3组用AdB7.1感染(MOI 50)过的肿瘤细胞进行皮下注射;注射的细胞数为1×107细胞/动物。然后每周测量1次肿瘤的大小,每组动物肿瘤的大小取15只动物的平均值,结果(图3)表明,AdlacZ感染(MOI 50)过的肿瘤细胞和野生型肿瘤细胞在体内的致瘤性没有显著差异(P>0.05),Ad-B7.1感染过的肿瘤细胞在体内的致瘤性比前两者明显低(P<0.01),且肿瘤有自动消退的趋势,这说明B7.1的分泌降低了肿瘤细胞在体内的致瘤性。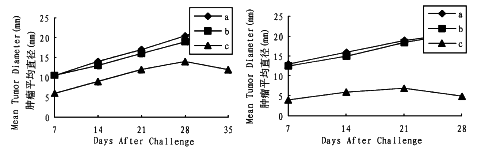
图3 野生型肿瘤细胞和B7.1修饰的肿瘤细胞在动物体内的生长曲线
, 百拇医药
a.野生型肿瘤细胞 b.Adlac Z感染的肿瘤细胞 c.AdB7.1感染的肿瘤细胞
A.EMF6在BALB/c小鼠中的生长情况 B.C6在Wistar大鼠中的生长情况
Fig.3 Growth kinetics of unmodified and B7.1 cDNA modified tumor cells in vivo.
a: wild-type tumor cells; b:AdlacZ-infected tumor cells; c:AdB7.1-infected tumor cells.
A:Growth of EMF6 tumor cells in BALB/c mice. B:Growth of C6 tumor cells in Wistar rats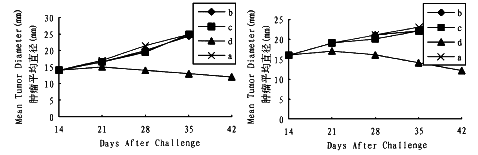
, 百拇医药
图4 B7.1修饰的肿瘤细胞疫苗对已发肿瘤的治疗作用
a.用野生型肿瘤细胞注射 b.用Adlac Z感染过的肿瘤细胞注射 c.用AdB7.1感染过的肿瘤细胞注射 d.不注射任何肿瘤细胞
Fig.4 Immunotherapy of established transplantation tumor by B7.1 cDNA transduced tumor cells.
a:injected with wild-type tumor cells; b:injected with AdlacZ-infected tumor cells; c:injected with AdB7.1-infected tumor cells; d:no injection A:EMF6 B:C6
, 百拇医药
3. B7.1修饰的肿瘤细胞对已发肿瘤的治疗作用
对40只动物进行皮下注射肿瘤细胞(1×107细胞/动物),2周后当瘤块达到约15mm时,将动物分成4组,每组10只。第1组皮下注射灭活处理过的野生型肿瘤细胞;第2组皮下注射灭活处理过的AdlacZ感染(MOI 50)过的肿瘤细胞;第3组皮下注射灭活的Ad-B7.1感染(MOI 50)过的肿瘤细胞;第4组不接种任何肿瘤细胞,顺其自然。1、2、3组在2周后重复接种治疗。结果(图4)表明:Ad-B7.1感染过的肿瘤细胞对已发肿瘤的治疗作用较野生型肿细胞及AdlacZ感染的肿瘤细胞均明显增强(P<0.05)。
4. B7.1修饰的肿瘤细胞疫苗对肿瘤的免疫预防作用
将30只动物分为3组,每组10只,用1×107灭活处理的肿瘤细胞/只动物进行皮下接种。第1组接种野生型肿瘤细胞;第2组接种AdlacZ感染的肿瘤细胞;第3组接种Ad-B7.1感染过的肿瘤细胞。2周后重复接种。再过2周用1×107未经灭活处理的野生型肿瘤细胞进行皮下注射。肿瘤在体内的生长情况见图5。结果表明B7.1修饰的肿瘤细胞疫苗对随后用野生型肿瘤侵袭的免疫预防作用较野生型肿瘤细胞及AdlacZ感染的肿瘤细胞显著增强(P<0.01)。
, 百拇医药
5. B7.1的表达对自身肿瘤特异的CTLs的诱导作用
动物分别用野生型肿瘤细胞、AdlacZ感染的肿瘤细胞及AdB7.1感染的肿瘤细胞皮下注射,3~4周后无菌取脾,分离出T淋巴细胞,用51Cr释放法测定其CTLs的活性,结果(图6)表明:B7.1修饰的肿瘤细胞对CTLs的诱导能力明显高于野生型肿瘤细胞及AdlacZ感染的肿瘤细胞。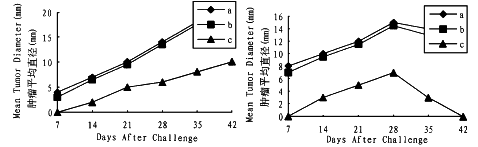
图5 B7.1修饰的肿瘤细胞疫苗对随后用野生型肿瘤侵袭的免疫预防作用
a.用野生型肿瘤细胞免疫接种 b.用Adlac Z感染过的肿瘤细胞免疫接种 c.用AdB7.1感染过的肿瘤细胞免疫接种
Fig.5 Immunoprophlaxis of B7.1 cDNA modified tumor cell vaccines to subsequent challenge with corresponding wild-type tumor cells.
, 百拇医药
a:vaccinated with wild-type tumor cells; b:vaccinated with AdlacZ-infected tumor cells; c:vaccinated with AdB7.1-infected tumor cells; A:EMF6 B:C6
图6 B7.1修饰的肿瘤细胞疫苗对CTLs的诱导作用
a.野生型肿瘤细胞 b.Adlac Z感染的肿瘤细胞 c.AdB7.1感染的肿瘤细胞
Fig.6 Induction of B7.1 cDNA modified tumor cells to CTLs.
a:wild-type tumor cells; b:AdlacZ-infected tumor cells; c:AdB7.1-infected tumor cells. A:EMF6 B:C6
, 百拇医药
讨论
肿瘤细胞不能诱导抗肿瘤的T细胞应答,可能是由于缺乏与MHC分子复合的肿瘤抗原或共刺激分子而不能得到适当的刺激。虽然缺乏特异性异己的肿瘤抗原仍是许多肿瘤细胞的特点,但近来的研究表明,抗肿瘤免疫应答的缺乏可能是由于缺乏所需的共刺激信号的传递[13]。许多缺乏B7表达的肿瘤细胞免疫原性不佳。一些在小鼠模型上的研究证明,B7.1在肿瘤细胞上的表达能提供T细胞激活和肿瘤排斥所必需的共刺激信号[14]。我们的结果表明,小鼠乳腺癌细胞系EMF6和大鼠神经胶质瘤细胞系C6在被B7.1基因修饰后为动物体内T细胞的增殖提供了共刺激信号,免疫原性增强,在动物体内的致瘤性明显下降。AdB7.1-C6细胞在动物体内形成的肿瘤有自然消退趋势。接种/侵袭实验表明,B7.1基因修饰的肿瘤细胞疫苗分别对各自的肿瘤有防治作用,但C6的效果要明显一些。这可能是由于不同的肿瘤所表达的细胞表面分子不同所致。最近有些研究者用IL-12和B7.1cDNA转染的肿瘤细胞做为疫苗,在对已发肿瘤的治疗和诱导机体的保护性免疫方面取的较好效果[15]。这提示,对那些B7.1基因修饰效果不明显的肿瘤细胞可采用与其他细胞因子协同作用的方式来增强其免疫原性。无论如何,B7.1在诱导肿瘤特异的T细胞免疫应答中起着重要作用。而腺病毒载体的使用使基因修饰的肿瘤细胞疫苗操作简单化,增强了其可行性和实用性。
, http://www.100md.com
收稿1998-02 修回1997-05
参考文献
[1]Harding F,McArthur J G,Raulet D,et al.CD28-mediated singnalling co-stimulates murine T cell and prevents induction of anergy in T-cell clones.Nature,1992,356(8):607
[2]Harding F A,Allison J P.CD28-B7 interaction allow the induction of CD8+ cytotoxic T lymphocytes in the absense of exogenous help.J Exp Med,1993,177(11):1791
[3]Razi-Woff Z,Freeman G J,Benacerraf B,et al.Expression and function of murine B7 antigen,the major costimulatory molecule expressed by peritonal exuadate cells.Pro Natl Acad Sci USA,1992,89(32):4210
, 百拇医药
[4]Freeman G J,Gribben T G,Boussiotis V A,et al.Cloning of B7-2:a CTLA4 counter-receptor that costimulates human T-cell production.Science,1993,262(41):909
[5]Freeman G J,Borriello F,Hodes R J,et al.Uncovering of functional alternative CTLA-4 counter-receptor in B7-deficient mice.Science,1993,262(41):907
[6]Townsend S,Su F W,Atherton J M,et al.Specificity and longivity of antitumor immune response induced by B7-transfected tumors.Cancer Research,1994,54(12):6477
, 百拇医药
[7]Wang Y C,Zhu L H,Hugh R M,et al.Induction of autologous tumorspecific cytotoxic T-lympocyte activity against a human renal carcinoma cell line by B7-1(CD80) costimulation.Journal of Immunotherapy,1996,19(1):1
[8]Heuer J G,McClung T,Gonin R,et al.Retrovirus-mediated gene transfer of B7-1 and MHC class Ⅱ converts a poorly immunogenic neuroblastoma into a highly immunogenic one.Human Gene Therapy,1996,7(6):2059
[9]李春海,郭亚军.肿瘤分子生物学研究进展.北京:军事医学科学院出版社,1996,10:30
, 百拇医药
[10]Graham F L,Prevec L.Method for construction of adenovirus vectors.Molecular Biotechnology,1995,3(3):207
[11]Beck T C,Noel R J,Coats W S,et al.Use of recombinent adenovirus for metabolic engineering of mammalians cells.Methods in Cell Biology,1994,43:161
[12]Lamping K G,Rios C D,Chun J A,et al.Intrapericardial administration of adenovirus for gene transfer.Am.J.Physiol.1997,272(1Pt2):H310
, 百拇医药 [13]Chen L.Linshey P S,Hellitroin K E.Costimulation of T cells for tumor immunity.Immunol Today,1993,14(8):483
[14]Chen L,McGowan P,Ashe S,et al.Tumor immunogenicity determines the effect of B7 costimulation on T cell-mediated tumour immunity.J Exp Med,1994,179(9):523
[15]Zitvogel L,Robbins P D,Storkas J,et al.Interleukin-12 and B7.1 costimulation cooperate in the induction of effective antitumor immunity and therapy of established tumors.Eur J Immunol,1996,26(6):1335
, 百拇医药
ADENOVIRUS-MEDIATED B7.1 GENE MODIFIED
TUMOR CELL VACCINES
Liu Xuefeng, Zhang Lianfeng, Ju Limei, Zeng Ping, Ma Yaowen,Li Wanbo,Cai YouyuΔ
(Institute of Laboratory Animal Science,PUMC and CAMS,Beijing)
Previous studies have shown that introduction of B7.1 cDNA into tumors using retroviral vectors enhanced antitumor effects.A limiting factor for potential clinical application of this approach is the low efficiency of infection of retroviral vectors and subsequent manipulations of infected cells.The aim of this study was to show that adenovirus can work as an alternative vector for B7 gene expression in tumor cells to heighten the antitumor effects of tumor cell vaccines without the limitation for clinical application which exists in retroviral vectors.In this study,we constructed replication-defective recombinant human type 5 adenoviruses,deficient in the E1 and E3 region of the genome,with incorporated human B7.1 cDNA by homologous recombination in vivo.Infection of EMF6 cells(breast cancer cell lines come from BALB/c mice) and C6 cells(glioma cell line come from Wistar rats) with these constructions and examination of expression of B7.1 cDNA was performed.The tumor cell infected with either AdB7.1 or AdlacZ was injected s.c.to syngeneic host(BALB/c mice and Wistar rats)to investigate their tumorigenicity in vivo and therapeutic/prophylaxis effects on tumor.Three weeks after immunization with variety of tumor cells,51Cr-release assay was performed to test the cellular immunity activities.Analysis of Northern blot indicated that the expression of B7.1 in EMF6 and C6 cell lines infected with these adenoviruses was in high efficiency.There was no endogenous expression of B7.1 in these cell lines.Immunization/challenge experiments and 51Cr-release assay demonstrated that Ad-B7.1 infected tumor cells showed a reduced tumorigenicity in vivo(P<0.01),and could induce higher immunity than those infected with AdlacZ and had certain prophylaxis and cure effects to tumors.Adenovirus vectors can serve as an alternative vector for B7.1 gene expression in tumor cells to enhance the tumor vaccine potency.Because of simpler manipulation and higher transferring efficiency,adenovirus vectors haven't limitation that retroviral vector has.
KEY WORDS Adenovirus vectors; B7.1; Tumor cell vaccines
△Department of genetics,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences (CAMS) and Peking Union Medical College(PUMC),Beijing 100021,China
* 卫生部基金资助课题(No.94-1-050), 百拇医药
单位:中国协和医科大学 中国医学科学院实验动物研究所,北京 100021
关键词:腺病毒载体;B7.1;;肿瘤细胞疫苗
解剖学报/980413 摘 要 为了证明腺病毒载体可做为将B7基因导入肿瘤细胞的替代载体,达到提高肿瘤细胞疫苗效应的目的,且不存在逆转录病毒载体的局限性,用同源重组的方法构建了表达人类B7.1cDNA的重组人类5型腺病毒(AdB7.1),并用它感染小鼠乳腺癌细胞系EMF\-6和大鼠神经胶质瘤细胞系C6,检测B7.1基因在感染过的肿瘤细胞中的表达;用AdB7.1感染过的肿瘤细胞给同基因宿主(BALB/c小鼠和Wistar大鼠)接种,观察它们在体内的致瘤性及对肿瘤的防治作用;用51Cr-释放法对用各种肿瘤细胞免疫后3周的动物脾淋巴细胞进行CTLs杀伤活性的测定,来检测其细胞免疫活性。结果的Northern blot分析表明:AdB7.1感染过的肿瘤细胞表达了B7.1基因。接种/侵袭实验和CTLs杀伤活性的测定实验表明,与野生型肿瘤细胞相比,表达B7.1的肿瘤细胞在动物体内的致瘤性降低(P<0.01),能诱导针对野生型肿瘤的高水平的系统性免疫应答和细胞毒T细胞活性,对肿瘤也有一定的防治作用。本研究的结论是,腺病毒载体可代替逆转录病毒载体将B7.1基因导入肿瘤细胞,提高肿瘤细胞疫苗的抗肿瘤作用。它操作简单,感染效率高,避免了使用逆转录病毒载体的局限性。
, http://www.100md.com
机体对肿瘤的免疫主要是细胞免疫,抗肿瘤免疫治疗的目的就是要诱导一个能有效消除散布肿瘤的T细胞免疫应答。近来的研究工作已证明,除了由T细胞受体传递的抗原特异的信号外,由T细胞表面分子CD28传递的共刺激信号对T细胞的完全激活也是必要的。由CD28介导的共刺激信号对分泌IL-2的CD4+的效应细胞的产生和CD8+的细胞毒T细胞(cytotoxic T lymphocytes,CTLs)产生是必要的[1,2]。B7是CD28的配体,在被抗原呈递细胞(antigen presenting cells,APCs)表达时可提供对T细胞的共刺激[3],该分子被命名为CD80或B7.1,并表明是共刺激配体B7基因家族的成员,该家族也包括B7.2[4,5]。
在动物模型上的研究表明,用逆转录病毒载体将B7.1基因导入肿瘤细胞在动物体内诱导了特异而长期的抗肿瘤免疫应答[6~8]。然而逆转录病毒载体的低效性和细胞转染后的操作限制了这一方法的临床应用。腺病毒载体由于其诸多的优点[9],可做为将B7.1基因导入肿瘤细胞的替代载体。在这一研究中,我们构建了表达人类B7.1的重组腺病毒载体(AdB7.1),并用它感染小鼠乳腺癌细胞系EMF6和大鼠神经胶质瘤细胞系C6。Northern blot分析表明B7.1基因在这两种细胞中均得以表达。用表达B7.1的肿瘤细胞接种于同基因宿主,观察它们在动物体内的致瘤性及对肿瘤的防治作用,结果表明:与野生型肿瘤细胞相比,表达B7.1的肿瘤细胞在动物体内的致瘤性明显下降(P<0.01),且能诱导针对野生型肿瘤细胞的系统性免疫应答和高水平CTLs活性,对肿瘤有一定的防治作用。
, 百拇医药
材料和方法
1. 腺病毒载体的构建(图1)

图1 表达人类B7.1基因的重组5型腺病毒载体的构建策略
(步骤1~4参见材料与方法中的概述)
Fig.1 Construction strategy of rAd5 vectors expressing human B7.1 cDNA.Number 1-4 refer to the steps as outlined in Materials and Methods.
1.1 piln-B7.1长约3.5kb,携带B7.1cDNA,是在MC1060中表达的逆转录病毒载体质粒,B7.1cDNA长约857bp(美国Pharmaceutical Research Institute 的Bill Brady博士惠赠)。用EcolR Ⅰ和BamH Ⅰ对该质粒进行双酶切,得到含有B7.1cDNA的长达1.8kb的片段。
, 百拇医药
1.2 PAdE1CMV,长7.64kb,是带有腺病毒左端0~1.6μm(其中位于1.3~9.2μm的E1区缺失)的穿梭质粒(美国Baxter基因治疗部分子生物学研究室的张维维博士惠赠)。用Hpa Ⅰ将该质粒切成线状。
1.3 用T4噬菌体DNA连接酶把含有B7.1cDNA的片段与线状的pAdE1CMV连接起来,形成环状的pAdE1CMV-B7.1。
1.4 PJM17,克隆了5型腺病毒基因组(其中E3区缺失)的质粒(加拿大Micribix Biosystems In)。用pAdE1CMV与PJM17共转染293细胞,经同源重组产生含有B7.1cDNA的重组腺病毒AdB7.1。共转染所用的Lipofectin试剂盒购自Gibico BRL公司,按试剂盒上的说明书操作。按文献[10]所述的方法纯化蚀斑,PCR鉴定阳性蚀斑,然后扩增和测定滴度[11]。所用的B7.1特异引物为5′-ATGTCGACATGGTTATCCACGTGA-3′和5′-GAGGATCCTTATATACTAGGTGTAG-3′,腺病毒载体特异的引物为5′-TCGTTTCTCAGCAGCTGTTG-3′和5′-ATCTGAACTCAAAGGGTGG-3′。为了简化,图1仅显示了AdB7.1的构建过程。含有报告基因LacZ的重组腺病毒载体AdLacZ也以类似的步骤同时构建,做为对照。LacZ重组腺病毒载体的鉴定采用X-gal染色法[12]。
, 百拇医药
2. 体外感染
EMF6来自BALB/c小鼠的乳腺癌细胞系,本室冻存。C6来自Wistar大鼠的神经胶质瘤细胞系,本室冻存。于感染前1d接种一定数量的细胞,按一定的感染强度(multiplicity of infection,MOI)计算所需病毒量,用PBS稀释至一定体积(0.5ml/60mm平皿)。感染时,弃去原培养液,加上一定体积的稀释好的病毒悬液,室温下作用1h,每间隔5min摇晃1次。之后加入完全培养基,放入37℃孵箱,培养48h。
3. Northern blot检测B7.1mRNA的表达
用酸性胍-苯酚-氯仿一步法提取肿瘤细胞总RNA,取30μg甲醛变性胶电泳后,转到硝酸纤维素膜上,预杂交后与经α-32P标记的B7.1探针杂交、洗膜、放射自显影。
, 百拇医药
4.动物接种实验
BALB/c小鼠,4~6周。Wistar大鼠,3周龄,体重70g,均购于本所繁育场。收集待接种的细胞,用生理盐水洗2次,最后悬于生理盐水中。用4号针头分别接种到鼠的腋窝或腹股沟皮下。对免疫接种或免疫治疗用的肿瘤细胞要首先用300mg/L的丝裂霉素C处理1h,然后用生理盐水洗2次,最后悬于生理盐水中,接种动物。每周测量1次肿瘤的生长情况。用测径器测瘤块的2个互相垂直的直径,把两者相加,然后除以2来计算肿瘤的大小。
5. 用51Cr释放法检测CTLs的杀伤活性
将与动物接种相同的肿瘤细胞用300mg/L的丝裂霉素C处理1h,洗后做为刺激细胞(S)。用被接种3~4周后的动物的脾淋巴细胞作为反应细胞(R)。以R/S为100/1的比例将反应细胞与刺激细胞共培养(PRMI1640,10%小牛血清)5d,收获脾细胞。以相应的野生型肿瘤细胞为靶细胞(T),用150mCi/L的51Cr(购于 Amersham,U.K.)标记靶细胞1h,洗涤后按不同的比例与反应细胞混合培养,18h后,用γ计数器测定上清中51Cr的量,按下式计算细胞毒活性:
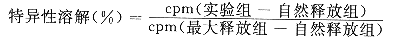
, 百拇医药
6. 统计学分析
采用t检验,P<0.05时,认为差异显著。
结果
1. 重组腺病毒AdB7.1的构建及其介导B7.1基因在肿瘤细胞中的表达
按材料和方法1中所述的步骤构建重组腺病毒AdB7.1,经筛选、扩增和纯化后,再按方法2中所述的方法感染EMF6和C6。提取用AdB7.1和AdlacZ感染(MOI 50)2d后的EMF6和C6细胞总RNA,用B7.1cDNA作为探针进行Northern blot分析。结果表明,这些肿瘤细胞中未检测到内源性B7.1mRNA的表达,AdB7.1能介导外源性B7.1mRNA在这些肿瘤细胞中高效表达(图2)。

, 百拇医药
图2 由腺病毒介导的B7.1mRNA在EMF6和C6中表达的Northern blot分析
1.AdlacZ感染的C6 2.AdB7.1感染的C6 3.Adlac Z感染的EMF6 4.AdB7.1感染的EMF6
Fig.2 Northern blotting analysis of B7.1 mRNA expression mediated by adenoviruses in EMF6 and C6
1.C6-AdlacZ; 2.C6-AdB7.1; 3.EMF6-AdlacZ; 4.EMF6-AdB7.1
, 百拇医药
2. B7.1的表达对肿瘤细胞在体内致瘤性的影响
将每种动物分为3组,每组15只。第1组用野生型肿瘤细胞皮下注射;第2组用AdlacZ感染(MOI 50)过的肿瘤细胞皮下注射;第3组用AdB7.1感染(MOI 50)过的肿瘤细胞进行皮下注射;注射的细胞数为1×107细胞/动物。然后每周测量1次肿瘤的大小,每组动物肿瘤的大小取15只动物的平均值,结果(图3)表明,AdlacZ感染(MOI 50)过的肿瘤细胞和野生型肿瘤细胞在体内的致瘤性没有显著差异(P>0.05),Ad-B7.1感染过的肿瘤细胞在体内的致瘤性比前两者明显低(P<0.01),且肿瘤有自动消退的趋势,这说明B7.1的分泌降低了肿瘤细胞在体内的致瘤性。

图3 野生型肿瘤细胞和B7.1修饰的肿瘤细胞在动物体内的生长曲线
, 百拇医药
a.野生型肿瘤细胞 b.Adlac Z感染的肿瘤细胞 c.AdB7.1感染的肿瘤细胞
A.EMF6在BALB/c小鼠中的生长情况 B.C6在Wistar大鼠中的生长情况
Fig.3 Growth kinetics of unmodified and B7.1 cDNA modified tumor cells in vivo.
a: wild-type tumor cells; b:AdlacZ-infected tumor cells; c:AdB7.1-infected tumor cells.
A:Growth of EMF6 tumor cells in BALB/c mice. B:Growth of C6 tumor cells in Wistar rats

, 百拇医药
图4 B7.1修饰的肿瘤细胞疫苗对已发肿瘤的治疗作用
a.用野生型肿瘤细胞注射 b.用Adlac Z感染过的肿瘤细胞注射 c.用AdB7.1感染过的肿瘤细胞注射 d.不注射任何肿瘤细胞
Fig.4 Immunotherapy of established transplantation tumor by B7.1 cDNA transduced tumor cells.
a:injected with wild-type tumor cells; b:injected with AdlacZ-infected tumor cells; c:injected with AdB7.1-infected tumor cells; d:no injection A:EMF6 B:C6
, 百拇医药
3. B7.1修饰的肿瘤细胞对已发肿瘤的治疗作用
对40只动物进行皮下注射肿瘤细胞(1×107细胞/动物),2周后当瘤块达到约15mm时,将动物分成4组,每组10只。第1组皮下注射灭活处理过的野生型肿瘤细胞;第2组皮下注射灭活处理过的AdlacZ感染(MOI 50)过的肿瘤细胞;第3组皮下注射灭活的Ad-B7.1感染(MOI 50)过的肿瘤细胞;第4组不接种任何肿瘤细胞,顺其自然。1、2、3组在2周后重复接种治疗。结果(图4)表明:Ad-B7.1感染过的肿瘤细胞对已发肿瘤的治疗作用较野生型肿细胞及AdlacZ感染的肿瘤细胞均明显增强(P<0.05)。
4. B7.1修饰的肿瘤细胞疫苗对肿瘤的免疫预防作用
将30只动物分为3组,每组10只,用1×107灭活处理的肿瘤细胞/只动物进行皮下接种。第1组接种野生型肿瘤细胞;第2组接种AdlacZ感染的肿瘤细胞;第3组接种Ad-B7.1感染过的肿瘤细胞。2周后重复接种。再过2周用1×107未经灭活处理的野生型肿瘤细胞进行皮下注射。肿瘤在体内的生长情况见图5。结果表明B7.1修饰的肿瘤细胞疫苗对随后用野生型肿瘤侵袭的免疫预防作用较野生型肿瘤细胞及AdlacZ感染的肿瘤细胞显著增强(P<0.01)。
, 百拇医药
5. B7.1的表达对自身肿瘤特异的CTLs的诱导作用
动物分别用野生型肿瘤细胞、AdlacZ感染的肿瘤细胞及AdB7.1感染的肿瘤细胞皮下注射,3~4周后无菌取脾,分离出T淋巴细胞,用51Cr释放法测定其CTLs的活性,结果(图6)表明:B7.1修饰的肿瘤细胞对CTLs的诱导能力明显高于野生型肿瘤细胞及AdlacZ感染的肿瘤细胞。

图5 B7.1修饰的肿瘤细胞疫苗对随后用野生型肿瘤侵袭的免疫预防作用
a.用野生型肿瘤细胞免疫接种 b.用Adlac Z感染过的肿瘤细胞免疫接种 c.用AdB7.1感染过的肿瘤细胞免疫接种
Fig.5 Immunoprophlaxis of B7.1 cDNA modified tumor cell vaccines to subsequent challenge with corresponding wild-type tumor cells.
, 百拇医药
a:vaccinated with wild-type tumor cells; b:vaccinated with AdlacZ-infected tumor cells; c:vaccinated with AdB7.1-infected tumor cells; A:EMF6 B:C6

图6 B7.1修饰的肿瘤细胞疫苗对CTLs的诱导作用
a.野生型肿瘤细胞 b.Adlac Z感染的肿瘤细胞 c.AdB7.1感染的肿瘤细胞
Fig.6 Induction of B7.1 cDNA modified tumor cells to CTLs.
a:wild-type tumor cells; b:AdlacZ-infected tumor cells; c:AdB7.1-infected tumor cells. A:EMF6 B:C6
, 百拇医药
讨论
肿瘤细胞不能诱导抗肿瘤的T细胞应答,可能是由于缺乏与MHC分子复合的肿瘤抗原或共刺激分子而不能得到适当的刺激。虽然缺乏特异性异己的肿瘤抗原仍是许多肿瘤细胞的特点,但近来的研究表明,抗肿瘤免疫应答的缺乏可能是由于缺乏所需的共刺激信号的传递[13]。许多缺乏B7表达的肿瘤细胞免疫原性不佳。一些在小鼠模型上的研究证明,B7.1在肿瘤细胞上的表达能提供T细胞激活和肿瘤排斥所必需的共刺激信号[14]。我们的结果表明,小鼠乳腺癌细胞系EMF6和大鼠神经胶质瘤细胞系C6在被B7.1基因修饰后为动物体内T细胞的增殖提供了共刺激信号,免疫原性增强,在动物体内的致瘤性明显下降。AdB7.1-C6细胞在动物体内形成的肿瘤有自然消退趋势。接种/侵袭实验表明,B7.1基因修饰的肿瘤细胞疫苗分别对各自的肿瘤有防治作用,但C6的效果要明显一些。这可能是由于不同的肿瘤所表达的细胞表面分子不同所致。最近有些研究者用IL-12和B7.1cDNA转染的肿瘤细胞做为疫苗,在对已发肿瘤的治疗和诱导机体的保护性免疫方面取的较好效果[15]。这提示,对那些B7.1基因修饰效果不明显的肿瘤细胞可采用与其他细胞因子协同作用的方式来增强其免疫原性。无论如何,B7.1在诱导肿瘤特异的T细胞免疫应答中起着重要作用。而腺病毒载体的使用使基因修饰的肿瘤细胞疫苗操作简单化,增强了其可行性和实用性。
, http://www.100md.com
收稿1998-02 修回1997-05
参考文献
[1]Harding F,McArthur J G,Raulet D,et al.CD28-mediated singnalling co-stimulates murine T cell and prevents induction of anergy in T-cell clones.Nature,1992,356(8):607
[2]Harding F A,Allison J P.CD28-B7 interaction allow the induction of CD8+ cytotoxic T lymphocytes in the absense of exogenous help.J Exp Med,1993,177(11):1791
[3]Razi-Woff Z,Freeman G J,Benacerraf B,et al.Expression and function of murine B7 antigen,the major costimulatory molecule expressed by peritonal exuadate cells.Pro Natl Acad Sci USA,1992,89(32):4210
, 百拇医药
[4]Freeman G J,Gribben T G,Boussiotis V A,et al.Cloning of B7-2:a CTLA4 counter-receptor that costimulates human T-cell production.Science,1993,262(41):909
[5]Freeman G J,Borriello F,Hodes R J,et al.Uncovering of functional alternative CTLA-4 counter-receptor in B7-deficient mice.Science,1993,262(41):907
[6]Townsend S,Su F W,Atherton J M,et al.Specificity and longivity of antitumor immune response induced by B7-transfected tumors.Cancer Research,1994,54(12):6477
, 百拇医药
[7]Wang Y C,Zhu L H,Hugh R M,et al.Induction of autologous tumorspecific cytotoxic T-lympocyte activity against a human renal carcinoma cell line by B7-1(CD80) costimulation.Journal of Immunotherapy,1996,19(1):1
[8]Heuer J G,McClung T,Gonin R,et al.Retrovirus-mediated gene transfer of B7-1 and MHC class Ⅱ converts a poorly immunogenic neuroblastoma into a highly immunogenic one.Human Gene Therapy,1996,7(6):2059
[9]李春海,郭亚军.肿瘤分子生物学研究进展.北京:军事医学科学院出版社,1996,10:30
, 百拇医药
[10]Graham F L,Prevec L.Method for construction of adenovirus vectors.Molecular Biotechnology,1995,3(3):207
[11]Beck T C,Noel R J,Coats W S,et al.Use of recombinent adenovirus for metabolic engineering of mammalians cells.Methods in Cell Biology,1994,43:161
[12]Lamping K G,Rios C D,Chun J A,et al.Intrapericardial administration of adenovirus for gene transfer.Am.J.Physiol.1997,272(1Pt2):H310
, 百拇医药 [13]Chen L.Linshey P S,Hellitroin K E.Costimulation of T cells for tumor immunity.Immunol Today,1993,14(8):483
[14]Chen L,McGowan P,Ashe S,et al.Tumor immunogenicity determines the effect of B7 costimulation on T cell-mediated tumour immunity.J Exp Med,1994,179(9):523
[15]Zitvogel L,Robbins P D,Storkas J,et al.Interleukin-12 and B7.1 costimulation cooperate in the induction of effective antitumor immunity and therapy of established tumors.Eur J Immunol,1996,26(6):1335
, 百拇医药
ADENOVIRUS-MEDIATED B7.1 GENE MODIFIED
TUMOR CELL VACCINES
Liu Xuefeng, Zhang Lianfeng, Ju Limei, Zeng Ping, Ma Yaowen,Li Wanbo,Cai YouyuΔ
(Institute of Laboratory Animal Science,PUMC and CAMS,Beijing)
Previous studies have shown that introduction of B7.1 cDNA into tumors using retroviral vectors enhanced antitumor effects.A limiting factor for potential clinical application of this approach is the low efficiency of infection of retroviral vectors and subsequent manipulations of infected cells.The aim of this study was to show that adenovirus can work as an alternative vector for B7 gene expression in tumor cells to heighten the antitumor effects of tumor cell vaccines without the limitation for clinical application which exists in retroviral vectors.In this study,we constructed replication-defective recombinant human type 5 adenoviruses,deficient in the E1 and E3 region of the genome,with incorporated human B7.1 cDNA by homologous recombination in vivo.Infection of EMF6 cells(breast cancer cell lines come from BALB/c mice) and C6 cells(glioma cell line come from Wistar rats) with these constructions and examination of expression of B7.1 cDNA was performed.The tumor cell infected with either AdB7.1 or AdlacZ was injected s.c.to syngeneic host(BALB/c mice and Wistar rats)to investigate their tumorigenicity in vivo and therapeutic/prophylaxis effects on tumor.Three weeks after immunization with variety of tumor cells,51Cr-release assay was performed to test the cellular immunity activities.Analysis of Northern blot indicated that the expression of B7.1 in EMF6 and C6 cell lines infected with these adenoviruses was in high efficiency.There was no endogenous expression of B7.1 in these cell lines.Immunization/challenge experiments and 51Cr-release assay demonstrated that Ad-B7.1 infected tumor cells showed a reduced tumorigenicity in vivo(P<0.01),and could induce higher immunity than those infected with AdlacZ and had certain prophylaxis and cure effects to tumors.Adenovirus vectors can serve as an alternative vector for B7.1 gene expression in tumor cells to enhance the tumor vaccine potency.Because of simpler manipulation and higher transferring efficiency,adenovirus vectors haven't limitation that retroviral vector has.
KEY WORDS Adenovirus vectors; B7.1; Tumor cell vaccines
△Department of genetics,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences (CAMS) and Peking Union Medical College(PUMC),Beijing 100021,China
* 卫生部基金资助课题(No.94-1-050), 百拇医药