免疫应答中小鼠脾GAP-43神经支配的可塑性——神经纤维数量和分布的变化
作者:杨 宏* 王 凌 黄传书 鞠 躬
单位:第四军医大学神经科学研究所神经免疫调节研究室 西安 710032;*军事医学科学院基础医学研究所神经生物学研究室,北京 100850
关键词:神经免疫调节;生长相关蛋白-43;脾;神经支配;小鼠
解剖学报/980405 摘 要 为了解脾交感神经在免疫功能增强时的形态变化,用免疫组织化学方法观察了BALB/c小鼠脾内生长相关蛋白样免疫反应(GAP-43-LI)性神经在结核菌素衍生蛋白(PPD)诱发的免疫反应高峰期数量和分布的变化。结果显示,动物在接受两次PPD注射(21d+7d)后,脾GAP-43-LI神经纤维密度明显增加并伴有分布和形态的变化。于对照动物,脾GAP-43-LI神经纤维主要分布于血管周围,少量伸入动脉周围淋巴鞘的脾基质中,而在免疫刺激的动物,不仅血管周围的神经纤维明显增多,动脉周围淋巴鞘外层、边缘区和红髓等免疫应答活跃的部位也出现许多神经纤维。神经纤维分支和纤维上膨体明显增多。以上结果提示:免疫应答中脾神经成分发生活跃的结构重塑,这些变化有可能与神经的免疫调节功能有关。
, 百拇医药
近年来的大量研究事实证明,神经、内分泌和免疫系统之间存在着相互影响和相互调节。免疫细胞产生的多种细胞因子可作为信使将免疫反应的信息传递给中枢神经系统,后者将信息整合后通过目前公认的神经内分泌和自主神经两大途径对免疫功能进行调节。初级和次级免疫器官的淋巴组织中神经纤维的发现为研究两大系统的功能联系开辟了广阔的视野。作为机体中神经系统与免疫系统直接接触的场所,脾的神经支配以及神经与脾免疫功能之间的关系得到了大量的研究。已知脾交感神经不仅仅是传统意义上的血管支配神经,它们在脾实质中也广泛分布;α、β肾上腺素受体及神经肽受体广泛存在于脾免疫细胞之上,并能介导相应激素对免疫细胞功能的影响;儿茶酚胺在体外、体内均能调节淋巴细胞的功能及去除交感神经支配对于脾的免疫功能产生极大影响[1,2]等事实证明,免疫器官的神经支配是神经免疫调节的重要途径之一。
以上多数工作是通过刺激或损毁交感神经来观察免疫功能改变的,而通过改变免疫状态来观察神经成分变化的研究很少。有报道老年大鼠脾交感神经的密度下降,间接表明神经支配密度与免疫功能的强弱成正比。而免疫功能增强的状态下脾交感神经密度有无改变尚未见报道。本实验中我们以生长相关蛋白(GAP-43)免疫反应作为脾交感神经纤维标记,研究在抗原刺激后抗体产生最高峰期BALB/c小鼠脾内神经的改变,借以了解脾神经在免疫功能增强时的可塑性,为深入探讨脾交感神经的免疫调节机理提供依据。
, 百拇医药
材料和方法
1.动物和实验处理
选7~8周龄,体重20~25g的雄性BALB/c小鼠18只,实验组和对照组各6只,另有6只用于探索免疫方案的前期实验。动物饲养在恒温、恒湿、定期消毒的环境中,饲以小鼠专用块食和清水。实验组动物接受2次免疫,抗原为结核菌素衍生蛋白PPD(中国药品生物制品鉴定所)。初次免疫时将抗原与福氏完全佐剂(Sigma公司)混合,每只动物腹腔注射500μl,含PPD 30μg。动物存活21d后接受第2次免疫注射,这次将抗原溶于消毒生理盐水,每只动物腹腔注射500μl,含抗原30μg。7d后将动物处死。对照组动物在相同的时间点接受2次消毒生理盐水腹腔注射,每只500μl,此实验方案根据前期实验组尾静脉取血、间接ELISA法测定血清中抗PPD特异性抗体的滴度而确定。在初次免疫后第9d有一抗体高峰,追加免疫后第7d出现第2个更高的峰(图1)。
2.组织处理和免疫组织化学
, http://www.100md.com
动物全部以1%戊巴比妥钠深麻(30mg/kg i.p.),经主动脉灌注生理盐水10ml,继而灌注4℃的4%多聚甲醛-磷酸缓冲溶液10min。取出脾浸入相同固定液中后固定8~12h,称脾重,转入含20%蔗糖的磷酸缓冲液中4℃下浸泡12h。沿与脾长轴垂直的方向将脾分为4等份,取靠中线的一块自脾门向被膜方向做冰冻切片(厚30μm),每5张切片中收集1张于0.01mol/L,pH7.4的磷酸钾盐缓冲液(KPBS)中。切片用甲醇+0.1%H2O2处理15min,以消除内源性过氧化物酶活性,0.05mol/L Tris-盐酸缓冲液(TBS)洗(5min×3),浸入由TBS稀释的2%牛血清白蛋白(BSA)中封闭60min,直接进入由含2%BSA、1.8%叠氮钠、0.1% Tween-20 的双倍盐 Tris-盐酸缓冲液(TBS2T)稀释的特异性绵羊抗GAP-43 IgG(1∶1 000)中4℃下孵育36~48h,特异性抗体由美国哈佛大学 Benowitz教授惠赠。孵育结束后,切片在TBS2T中洗30min,入TBS2T稀释的羊抗兔生物素化IgG(Sigma公司,1∶200)室温孵育120min,TBS2T洗(10min×3),入TBS稀释的ABC复合物(Sigma公司,1∶200)室温孵育100min,TBS洗(5min×3)。切片进入含0.05%DAB,2.5%硫酸镍铵,0.01%H2O2的0.1mol/L,pH6.2醋酸缓冲液中呈色10~15min。贴片,必要时以1%中性红复染。室温晾干,100%酒精脱水、二甲苯透明,DPX封片。行空白对照实验。抗体的特异性检验采用吸收实验,详见文献[3]。
, http://www.100md.com
3.定量分析
对每例动物所有的脾切片逐张进行分析。在10倍显微镜下,从每张切片的左上角开始,向下移动视野,每隔4个视野取1个作分析用。为确保相邻上下扫描的视野没有重叠,两排之间相隔一视野的宽度。在Camera Lucida(Nikon,Japan)下,用统一粗细的笔画出白、红髓的轮廓和其中的阳性神经纤维。用Leica 570℃图像分析仪测定每个视野中白髓和红髓的面积和其中神经纤维的长度。计算出单位面积内神经纤维的总长度。
4.抗PPD特异性抗体的检测
采用间接ELISA法,其程序如下:进口ELISA板包被抗原(PPD 10mg/L)4℃过夜,1%BSA 37℃封闭1h,加入从1∶20开始稀释的免疫小鼠血清,37℃孵育1h,加HRP标记的羊抗鼠抗体(美国Sigma公司,1∶1 000)37℃,1h,四甲基联苯胺(TMB)呈色,2mol/L硫酸终止反应,ELISA读数仪(型号)检测结果。以上各反应步骤之间均以PBS Tween-20洗涤。
, 百拇医药
结 果
脾重测量结果显示免疫应答动物脾的重量明显高于对照组(P<0.01),除镜下发现生发中心增多以外,脾的一般结构未出现明显变化。
ELISA检测结果表明,血中抗PPD抗体滴度于初次免疫后第9d达到第1个高峰,追加免疫后第7d达到第2个且更高的高峰(图1)。
对照动物脾内GAP-43-LI神经纤维分布于中央动脉和其分支周围,同时有少数纤维伸入动脉周围淋巴鞘(PALS)的淋巴实质中,但一般只到达内层,偶见少数神经纤维分布于边缘区(图2a,2b)。在接近脾门的PALS中阳性神经纤维分布较密集。红髓中可见到少量细而短的GAP-43-LI纤维。大多数神经纤维上膨体较少。
免疫刺激动物脾内血管周GAP-43-LI神经丛密度明显增大(图3a,3b),许多血管周神经丛的神经纤维上出现大量膨体(图3c)。自血管周神经丛伸向PALS 的神经纤维明显增多(图3d),PALS外层、PALS与边缘区交界区阳性神经纤维增多,有些神经纤维伸入边缘区(图3e~3g)。另一明显变化是神经纤维增粗、膨体增多(图3g,3h)。红髓内神经纤维密度也明显增加,带有膨体的神经纤维位于红髓髓索或密集地围绕在末梢小动脉的周围(图3i)。虽然接受免疫的动物脾内生发中心增多,但生发中心内几乎无神经分布。定量分析结果显示,PPD免疫组动物脾红髓和白髓内GAP-43-LI神经纤维密度明显高于对照组(图4)。于实验组和对照组的个别动物可见少数性质不明的GAP-43-LI细胞,其数量多少与免疫刺激无任何关系。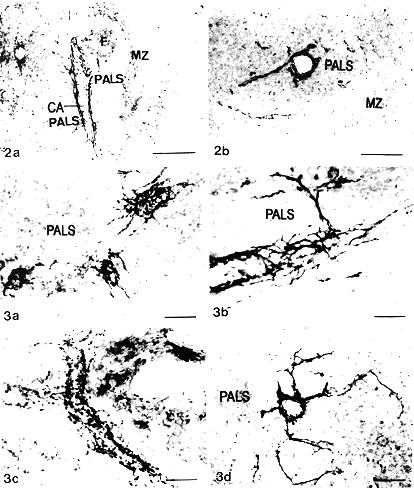
, http://www.100md.com
图2 对照小鼠脾抗GAP-43抗体染色结果,中性红复染。
2a 示GAP-43-LI血管周神经丛,有小量神经纤维伸入动脉周围淋巴鞘(PALS)的实质中。CA.中央动脉 PALS.动脉周围淋巴鞘 MZ.边缘区 标尺示40μm
2b 示阳性神经纤维主要见于PALS 的内层,偶见于边缘区。神经纤维较细,膨体和分支较少 标尺示20μm
Fig.2 The spleen of contral mouse spleen stained with anti-GAP-43 IgG,counter stained with neutral red.(2a).GAP-43-LI nerve plexus around the central artery,with a small amout of fibers extending to the parenchyma of the PALS.CA:central artery,PALS:periarterial lymphocyte sheath,MZ:marginal zone.Bar=40μm.(2b):immunoreactive nerve fibers in the inner part of the PALS,which occasionally can be seen in the marginal zone.Nerve fibers are thin,with a small amount of varicosities and branches.Bar=20μm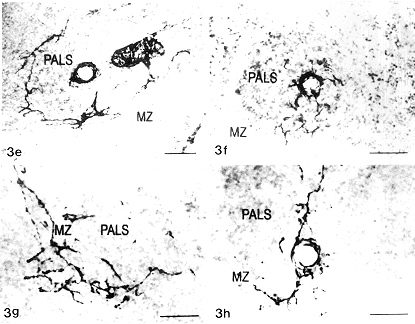
, http://www.100md.com
图3 PPD免疫小鼠脾抗GAP-43抗体染色结果,中性红复染。
3a,3b 示浓密的血管周神经丛,神经纤维向PALS的实质中伸展。标尺示10μm
3c 示血管周神经纤维上的大量膨体 标尺示10μm
3d 示自动脉周神经丛伸向PALS分支丰富的神经纤维 标尺示20μm
图3e~3g 示PALS、边缘区的阳性神经纤维 标尺示20μm(3e),标尺示10μm(3f,3g)
3h 示PALS 中带有不同大小膨体的神经纤维 标尺示10μm
3i 示红髓中分布于末梢小动脉周围(↑)和髓索内(Δ)的神经纤维 标尺示10μm
, http://www.100md.com Fig.3 The spleen of mouse immunized with PPD,stained with anti-GAP-43 IgG,counter stained with neutral red.(3a,3b):A dense periarterial nerve plexus.The nerve fibers extend to the parenchyma of the PALS.Bar=10μm(3c):Extremely rich varicosities appear in the nerve fibers.Bar=10μm.(3d):Richly branching nerve fibers in the PALS radiating out from the periarterial plexus.Bar=20μm.
Fig.3e~3g Nerve fibers in the outer parts of the PALS and the marginal zone.Bar=20μm(3e),Bar=10μm(3f,3g).(3h):Fibers in the PALS with varicosities of different sizes.Bar=10μm (3i):Nerve fibers around the terminal arteriole (thin arrow)and in the splenic cord of the red pulp.(arrow heads).Bar=10μm
, 百拇医药
空白对照实验未发现任何阳性染色。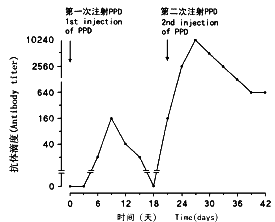
图1 PPD免疫后血中抗PPD抗体摘度的变化时程
Fig.1 Time course of the titer of the antibody
against PPD after PPD immunization.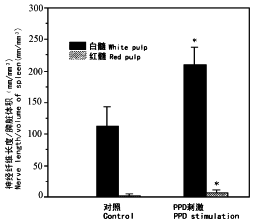
图4 GAP-43样神经纤维在正常和PPD
免疫的BALB/c小鼠脾脏中的密度
Fig.4 Density of the GAP-43-LI nerve fibers
, http://www.100md.com
in the spleen of control and PPD immunized
BALB/c mice(*,P<0.05).
讨 论
可塑性是中枢和外周神经普遍的特性。神经细胞以改变自身功能、形态特性的方式对外界刺激作出反应以适应各种功能的需要。生长相关蛋白(GAP-43)是神经特异的膜结合蛋白,与轴突出芽和重塑有关[3]。我们曾经证实,支配脾的神经普遍含有GAP-43,GAP-43-ir神经大部分属于交感神经,少部分属于非交感神经[4]。
本实验结果证实,在胸腺依赖性抗原PPD诱发的免疫应答中,于抗体产生高峰期脾内GAP-43-LI神经纤维出现密度明显增加、神经分支和膨体增多以及神经自血管周围向淋巴实质中(PALS外层、边缘区和髓索)伸展等形态和分布上的变化。本实验脾脏内的神经数量是用单位面积总长度来计算的,因此必须考虑免疫后脾脏体积(重量)的变化,同样数量的神经纤维在体积增加的情况下其密度下降,反之则增加。在本实验中脾脏的体积在免疫后有较大的增加,因此,实际脾脏神经纤维的增加应更为明显。有趣的是,免疫应答中神经纤维增多的几个部位包括动脉周围淋巴鞘外层、边缘区和红髓与文献中报道的胸腺依赖性或非依赖性抗原刺激后抗体形成细胞存在的部位非常吻合[5]。这些部位虽然属于B淋巴细胞分布区,但在胸腺非依赖性抗原诱发的免疫反应中,产生干扰素(IFN-γ)的T淋巴细胞也正是分布于以上3个部位并且与产生抗体的细胞并置排列[6,7],说明这些结构是脾脏中免疫反应活跃的部位。本实验中免疫应答高峰期神经纤维变化出现于这些部位,更强烈提示了神经与免疫功能之间的密切关系。
, 百拇医药
免疫功能状态改变时神经纤维数量和形态的变化也见于淋巴结[8],这种变化的机制目前尚不完全清楚。因为胚胎发育中脾内去甲肾上腺素能神经与免疫细胞相伴出现[9],而且成年动物的初级和次级淋巴器官中有较丰富的交感神经支配,这些事实提示了胚胎和成年脾组织中某种维持神经生长存活物质存在的可能性。事实上,脾T、B淋巴细胞能够产生具有活性的神经生长因子(NGF)已得到证实[10]。NGF、脑源性神经营养因子(BDNF)、神经营养素-3,4(NT-3,NT-4)等神经营养素的mRNA也已发现于胸腺和脾脏[11],进一步提示免疫器官自身能够产生神经营养素。体外实验证实,淋巴器官组织块能够诱导共同培养的交感神经节神经的生长,这种作用能够被抗NGF抗体完全阻断[12]。经感染性刺激的淋巴器官组织块具有更强的神经诱生作用,而且除NGF外,免疫活性细胞所产生的细胞因子如IL-1、IL-3、IL-6、GM-CSF等均有一定的神经诱导作用[12~15]。以上实验依据从不同角度支持了本实验的结果。虽然目前尚不知我们的实验条件下神经营养性因子的表达和分泌是否增加,但有报道免疫细胞内NT-4 mRNA水平在 ConA、LPS或感染的刺激下有所增高[11]。正是由于多种神经营养性因子、细胞因子的共同作用,使神经纤维在免疫反应中得以发生与功能相适应的变化。在我们的实验中,脾GAP-43-LI神经纤维的形态学变化有着区域的特殊性,神经纤维有向免疫反应激烈的部位伸展的趋势,这也反应出在免疫应答时脾不同结构和区域内神经营养性因子和细胞因子的生成量可能有所差别。边缘区和红髓作为免疫应答的前沿,有大量巨噬细胞聚集,我们最近的工作证实,边缘区和红髓的巨噬细胞呈NGF免疫反应阳性。
, 百拇医药
有关交感神经对免疫功能的影响已有较多研究[1,2],有些问题尚存在争议。因外科或化学切除交感神经可导致免疫功能的增强,故相当一部分人认为交感神经对免疫功能起抑制作用,但也有去除交感神经不影响或增强免疫功能的报道。本研究的结果以及老年动物脾交感神经纤维密度降低的报道表明,脾交感神经纤维的密度与其免疫功能状态呈正比。神经纤维密度增加的同时是否伴有NA含量的改变有待进一步研究。有报道,于免疫应答各个不同阶段,脾NA水平出现明显变化[2]。由于许多证据证实NA对免疫功能起抑制作用,因而,本实验中免疫应答高峰期神经纤维数量、分支和膨体增加的结果有可能解释为,神经通过释放更多的神经递质及增加与免疫细胞的接触而对免疫反应起负反馈抑制作用。
收稿1997-12 修回1998-04
参考文献
[1]Frieman EM,Irwin MR.Modulation of immune cell function by the autonomic nervous system.Pharmacol Ther,1997,74(1):27
, http://www.100md.com
[2]Madden KS,Felten DL.Experimental basis for neural-immune interactions.Physiological Reviews,1995,75:(1)77
[3]Benowitz LI,Routtenberg A.A membrane phosphoprotein associated with neural development axonal regeneration,phospholipid metabolism and synaptic plasticity.TINS,1987,10(12):527
[4]杨 宏,邱建勇,鞠 躬.GAP-43免疫反应神经纤维在小鼠脾脏的分布及其性质的研究.神经解剖学杂志,1997,13(1):6
[5]Claassen E,Kors N,Van Rooyen N.Influence of carriers on the development and localization of anti-trinitrophenyl antibody forming cells in the murine spleen.Eur J Immunol,1986,16(3):271
, 百拇医药
[6]Van den Eertwegh AJM,Fasbender MJ,Boersma WJA,et al.In vivo detection,Kinetics and characterization of interferon-gamma-producting cells during a thymus-dependent immune response:an immune-histochemical study.In Imhof B,Berrih-Aknin S,Ezine S (eds).Lymphatic Tissues and in Vivo Immune Response.New York:Marcel Dekker,1991:207
[7]Van den Eertwegh,AJM,Fasbender MJ,Schellekens MM,et al.In vivo kinetics and characterization if IFN-g-producing cells during a thymus-independent immune response.J Immunol,1991,147(2):439
, 百拇医药
[8]Novotny GEK,Heuer T,Schottelndreier A,et al.Plasticity of innervation of the medulla of axillary lymph nodes in the rat after antigenic stimulation.Anatomical Record,1994,238(2):213
[9]Ackerman KD,Madden KS,Livnat S,et al.Parallel development of noradrenergic innervation and cellular compartmentation in the rat spleen.Exp Neurol,1989,103(2):239
[10]Santambrogio L,Benedetti M,Chao MV,et al.Nerve growth factor production by lymphocytes.J Immunol,1994,153(10):4488
, 百拇医药
[11]Laurenzi MA,Barbany G,Timmusk T,et al.Expression of mRNA encoding neurotrophins and neurotrophin receptors in rat thymus,spleen tissue and immunocompetent cells.Eur J Biochem,1994,223(3):733
[12]Kannan K,Stead RH,Goldsmith CH,et al.Lymphoid tissue induce NGF-dependent and NGF-independent neurite outergrowth from rat superior cervical ganglia explants in culture.J Neurosci Res,1994,37(3):374
[13]Kannan Y,Bienenstock J,Ohta M,et al.Nerve growth factor and cytokines mediate lymphoid tissue-induced neurite outgrowth from mouse superior cervical ganglia in vitro.J Immunol,1996,156(1):313
, http://www.100md.com
[14]Satoh T,Nakamura S,Taga T,et al.Induction of neuronal differentiation in PC12 cells by B-cell stimulatory factor 2/interleukin 6.Mol Cell Biol,1988,8(8):3546
[15]Haugen PK,Letourneau PC.Interleukin-2 enhances chick and rat sympathetic,but not sensory,neurite outgrowth.J Neurosci Res,1990,25(4):443
PLASTICITY OF GAP-43 INNERVATION OF THE SPLEEN
DURING IMMUNE RESPONSE IN THE MOUSE
, 百拇医药
CHANGES IN NUMBER AND DISTRIBUTION
OF THE NERVE FIBERS
Yang Hong*,Wang Ling,Huang Chuanshu Ju Gong△
(Department of Neuroimmunomodulation,Institute of Neurosciences,The Fourth Military Medical University,Xi'an;*Department of Neurobiology,Institute of Basic Medical Sciences,Beijing)
On purpose to know the morphologic changes of splenic nerves during actived immunological state,the present study investigates the amount and distribution of Growth Associated Protein(GAP-43)-like immunoreactive (LI) nerve fibers in the spleen of purified protein derivative from tuberculin(PPD) injected BALB/c mice immunohistochemically.A significant increase in the amount,as well as redistribution and morphological changes of the GAP-43-LI nerve fibers occurred in PPD immunized animals.In the control animals,the GAP-43-LI nerve fibers were found mainly distributed in association with vascular plexuses,with minor extension into the parenchyma of the inner zone of the periarterial lymphocyte sheath.In the immunized animals,in addition to denser vascular plexuses,more fibers appeared in the outer zones of periarterial lymphocyte sheath,the marginal zone,and the red pulp,all known to be the sites of active immune response.Furthermore,the nerve fibers tended to have more branches and bear richer varicosities.The results suggest that an active nerve remodeling takes place in the spleen during immune response,which may imply a mechanism through which nervous system regulates the immune responses.
KEY WORDS Neuroimmunomodulation;GAP-43;Spleen;Innervation;Mouse
△Department of Neuroimmunomodulation,Institute of Neurosciences,The Fourty Military Medical University,Xi'an 710032,China, 百拇医药(杨 宏* 王 凌 黄传书 鞠 躬)
单位:第四军医大学神经科学研究所神经免疫调节研究室 西安 710032;*军事医学科学院基础医学研究所神经生物学研究室,北京 100850
关键词:神经免疫调节;生长相关蛋白-43;脾;神经支配;小鼠
解剖学报/980405 摘 要 为了解脾交感神经在免疫功能增强时的形态变化,用免疫组织化学方法观察了BALB/c小鼠脾内生长相关蛋白样免疫反应(GAP-43-LI)性神经在结核菌素衍生蛋白(PPD)诱发的免疫反应高峰期数量和分布的变化。结果显示,动物在接受两次PPD注射(21d+7d)后,脾GAP-43-LI神经纤维密度明显增加并伴有分布和形态的变化。于对照动物,脾GAP-43-LI神经纤维主要分布于血管周围,少量伸入动脉周围淋巴鞘的脾基质中,而在免疫刺激的动物,不仅血管周围的神经纤维明显增多,动脉周围淋巴鞘外层、边缘区和红髓等免疫应答活跃的部位也出现许多神经纤维。神经纤维分支和纤维上膨体明显增多。以上结果提示:免疫应答中脾神经成分发生活跃的结构重塑,这些变化有可能与神经的免疫调节功能有关。
, 百拇医药
近年来的大量研究事实证明,神经、内分泌和免疫系统之间存在着相互影响和相互调节。免疫细胞产生的多种细胞因子可作为信使将免疫反应的信息传递给中枢神经系统,后者将信息整合后通过目前公认的神经内分泌和自主神经两大途径对免疫功能进行调节。初级和次级免疫器官的淋巴组织中神经纤维的发现为研究两大系统的功能联系开辟了广阔的视野。作为机体中神经系统与免疫系统直接接触的场所,脾的神经支配以及神经与脾免疫功能之间的关系得到了大量的研究。已知脾交感神经不仅仅是传统意义上的血管支配神经,它们在脾实质中也广泛分布;α、β肾上腺素受体及神经肽受体广泛存在于脾免疫细胞之上,并能介导相应激素对免疫细胞功能的影响;儿茶酚胺在体外、体内均能调节淋巴细胞的功能及去除交感神经支配对于脾的免疫功能产生极大影响[1,2]等事实证明,免疫器官的神经支配是神经免疫调节的重要途径之一。
以上多数工作是通过刺激或损毁交感神经来观察免疫功能改变的,而通过改变免疫状态来观察神经成分变化的研究很少。有报道老年大鼠脾交感神经的密度下降,间接表明神经支配密度与免疫功能的强弱成正比。而免疫功能增强的状态下脾交感神经密度有无改变尚未见报道。本实验中我们以生长相关蛋白(GAP-43)免疫反应作为脾交感神经纤维标记,研究在抗原刺激后抗体产生最高峰期BALB/c小鼠脾内神经的改变,借以了解脾神经在免疫功能增强时的可塑性,为深入探讨脾交感神经的免疫调节机理提供依据。
, 百拇医药
材料和方法
1.动物和实验处理
选7~8周龄,体重20~25g的雄性BALB/c小鼠18只,实验组和对照组各6只,另有6只用于探索免疫方案的前期实验。动物饲养在恒温、恒湿、定期消毒的环境中,饲以小鼠专用块食和清水。实验组动物接受2次免疫,抗原为结核菌素衍生蛋白PPD(中国药品生物制品鉴定所)。初次免疫时将抗原与福氏完全佐剂(Sigma公司)混合,每只动物腹腔注射500μl,含PPD 30μg。动物存活21d后接受第2次免疫注射,这次将抗原溶于消毒生理盐水,每只动物腹腔注射500μl,含抗原30μg。7d后将动物处死。对照组动物在相同的时间点接受2次消毒生理盐水腹腔注射,每只500μl,此实验方案根据前期实验组尾静脉取血、间接ELISA法测定血清中抗PPD特异性抗体的滴度而确定。在初次免疫后第9d有一抗体高峰,追加免疫后第7d出现第2个更高的峰(图1)。
2.组织处理和免疫组织化学
, http://www.100md.com
动物全部以1%戊巴比妥钠深麻(30mg/kg i.p.),经主动脉灌注生理盐水10ml,继而灌注4℃的4%多聚甲醛-磷酸缓冲溶液10min。取出脾浸入相同固定液中后固定8~12h,称脾重,转入含20%蔗糖的磷酸缓冲液中4℃下浸泡12h。沿与脾长轴垂直的方向将脾分为4等份,取靠中线的一块自脾门向被膜方向做冰冻切片(厚30μm),每5张切片中收集1张于0.01mol/L,pH7.4的磷酸钾盐缓冲液(KPBS)中。切片用甲醇+0.1%H2O2处理15min,以消除内源性过氧化物酶活性,0.05mol/L Tris-盐酸缓冲液(TBS)洗(5min×3),浸入由TBS稀释的2%牛血清白蛋白(BSA)中封闭60min,直接进入由含2%BSA、1.8%叠氮钠、0.1% Tween-20 的双倍盐 Tris-盐酸缓冲液(TBS2T)稀释的特异性绵羊抗GAP-43 IgG(1∶1 000)中4℃下孵育36~48h,特异性抗体由美国哈佛大学 Benowitz教授惠赠。孵育结束后,切片在TBS2T中洗30min,入TBS2T稀释的羊抗兔生物素化IgG(Sigma公司,1∶200)室温孵育120min,TBS2T洗(10min×3),入TBS稀释的ABC复合物(Sigma公司,1∶200)室温孵育100min,TBS洗(5min×3)。切片进入含0.05%DAB,2.5%硫酸镍铵,0.01%H2O2的0.1mol/L,pH6.2醋酸缓冲液中呈色10~15min。贴片,必要时以1%中性红复染。室温晾干,100%酒精脱水、二甲苯透明,DPX封片。行空白对照实验。抗体的特异性检验采用吸收实验,详见文献[3]。
, http://www.100md.com
3.定量分析
对每例动物所有的脾切片逐张进行分析。在10倍显微镜下,从每张切片的左上角开始,向下移动视野,每隔4个视野取1个作分析用。为确保相邻上下扫描的视野没有重叠,两排之间相隔一视野的宽度。在Camera Lucida(Nikon,Japan)下,用统一粗细的笔画出白、红髓的轮廓和其中的阳性神经纤维。用Leica 570℃图像分析仪测定每个视野中白髓和红髓的面积和其中神经纤维的长度。计算出单位面积内神经纤维的总长度。
4.抗PPD特异性抗体的检测
采用间接ELISA法,其程序如下:进口ELISA板包被抗原(PPD 10mg/L)4℃过夜,1%BSA 37℃封闭1h,加入从1∶20开始稀释的免疫小鼠血清,37℃孵育1h,加HRP标记的羊抗鼠抗体(美国Sigma公司,1∶1 000)37℃,1h,四甲基联苯胺(TMB)呈色,2mol/L硫酸终止反应,ELISA读数仪(型号)检测结果。以上各反应步骤之间均以PBS Tween-20洗涤。
, 百拇医药
结 果
脾重测量结果显示免疫应答动物脾的重量明显高于对照组(P<0.01),除镜下发现生发中心增多以外,脾的一般结构未出现明显变化。
ELISA检测结果表明,血中抗PPD抗体滴度于初次免疫后第9d达到第1个高峰,追加免疫后第7d达到第2个且更高的高峰(图1)。
对照动物脾内GAP-43-LI神经纤维分布于中央动脉和其分支周围,同时有少数纤维伸入动脉周围淋巴鞘(PALS)的淋巴实质中,但一般只到达内层,偶见少数神经纤维分布于边缘区(图2a,2b)。在接近脾门的PALS中阳性神经纤维分布较密集。红髓中可见到少量细而短的GAP-43-LI纤维。大多数神经纤维上膨体较少。
免疫刺激动物脾内血管周GAP-43-LI神经丛密度明显增大(图3a,3b),许多血管周神经丛的神经纤维上出现大量膨体(图3c)。自血管周神经丛伸向PALS 的神经纤维明显增多(图3d),PALS外层、PALS与边缘区交界区阳性神经纤维增多,有些神经纤维伸入边缘区(图3e~3g)。另一明显变化是神经纤维增粗、膨体增多(图3g,3h)。红髓内神经纤维密度也明显增加,带有膨体的神经纤维位于红髓髓索或密集地围绕在末梢小动脉的周围(图3i)。虽然接受免疫的动物脾内生发中心增多,但生发中心内几乎无神经分布。定量分析结果显示,PPD免疫组动物脾红髓和白髓内GAP-43-LI神经纤维密度明显高于对照组(图4)。于实验组和对照组的个别动物可见少数性质不明的GAP-43-LI细胞,其数量多少与免疫刺激无任何关系。

, http://www.100md.com
图2 对照小鼠脾抗GAP-43抗体染色结果,中性红复染。
2a 示GAP-43-LI血管周神经丛,有小量神经纤维伸入动脉周围淋巴鞘(PALS)的实质中。CA.中央动脉 PALS.动脉周围淋巴鞘 MZ.边缘区 标尺示40μm
2b 示阳性神经纤维主要见于PALS 的内层,偶见于边缘区。神经纤维较细,膨体和分支较少 标尺示20μm
Fig.2 The spleen of contral mouse spleen stained with anti-GAP-43 IgG,counter stained with neutral red.(2a).GAP-43-LI nerve plexus around the central artery,with a small amout of fibers extending to the parenchyma of the PALS.CA:central artery,PALS:periarterial lymphocyte sheath,MZ:marginal zone.Bar=40μm.(2b):immunoreactive nerve fibers in the inner part of the PALS,which occasionally can be seen in the marginal zone.Nerve fibers are thin,with a small amount of varicosities and branches.Bar=20μm


, http://www.100md.com
图3 PPD免疫小鼠脾抗GAP-43抗体染色结果,中性红复染。
3a,3b 示浓密的血管周神经丛,神经纤维向PALS的实质中伸展。标尺示10μm
3c 示血管周神经纤维上的大量膨体 标尺示10μm
3d 示自动脉周神经丛伸向PALS分支丰富的神经纤维 标尺示20μm
图3e~3g 示PALS、边缘区的阳性神经纤维 标尺示20μm(3e),标尺示10μm(3f,3g)
3h 示PALS 中带有不同大小膨体的神经纤维 标尺示10μm
3i 示红髓中分布于末梢小动脉周围(↑)和髓索内(Δ)的神经纤维 标尺示10μm
, http://www.100md.com Fig.3 The spleen of mouse immunized with PPD,stained with anti-GAP-43 IgG,counter stained with neutral red.(3a,3b):A dense periarterial nerve plexus.The nerve fibers extend to the parenchyma of the PALS.Bar=10μm(3c):Extremely rich varicosities appear in the nerve fibers.Bar=10μm.(3d):Richly branching nerve fibers in the PALS radiating out from the periarterial plexus.Bar=20μm.
Fig.3e~3g Nerve fibers in the outer parts of the PALS and the marginal zone.Bar=20μm(3e),Bar=10μm(3f,3g).(3h):Fibers in the PALS with varicosities of different sizes.Bar=10μm (3i):Nerve fibers around the terminal arteriole (thin arrow)and in the splenic cord of the red pulp.(arrow heads).Bar=10μm
, 百拇医药
空白对照实验未发现任何阳性染色。

图1 PPD免疫后血中抗PPD抗体摘度的变化时程
Fig.1 Time course of the titer of the antibody
against PPD after PPD immunization.

图4 GAP-43样神经纤维在正常和PPD
免疫的BALB/c小鼠脾脏中的密度
Fig.4 Density of the GAP-43-LI nerve fibers
, http://www.100md.com
in the spleen of control and PPD immunized
BALB/c mice(*,P<0.05).
讨 论
可塑性是中枢和外周神经普遍的特性。神经细胞以改变自身功能、形态特性的方式对外界刺激作出反应以适应各种功能的需要。生长相关蛋白(GAP-43)是神经特异的膜结合蛋白,与轴突出芽和重塑有关[3]。我们曾经证实,支配脾的神经普遍含有GAP-43,GAP-43-ir神经大部分属于交感神经,少部分属于非交感神经[4]。
本实验结果证实,在胸腺依赖性抗原PPD诱发的免疫应答中,于抗体产生高峰期脾内GAP-43-LI神经纤维出现密度明显增加、神经分支和膨体增多以及神经自血管周围向淋巴实质中(PALS外层、边缘区和髓索)伸展等形态和分布上的变化。本实验脾脏内的神经数量是用单位面积总长度来计算的,因此必须考虑免疫后脾脏体积(重量)的变化,同样数量的神经纤维在体积增加的情况下其密度下降,反之则增加。在本实验中脾脏的体积在免疫后有较大的增加,因此,实际脾脏神经纤维的增加应更为明显。有趣的是,免疫应答中神经纤维增多的几个部位包括动脉周围淋巴鞘外层、边缘区和红髓与文献中报道的胸腺依赖性或非依赖性抗原刺激后抗体形成细胞存在的部位非常吻合[5]。这些部位虽然属于B淋巴细胞分布区,但在胸腺非依赖性抗原诱发的免疫反应中,产生干扰素(IFN-γ)的T淋巴细胞也正是分布于以上3个部位并且与产生抗体的细胞并置排列[6,7],说明这些结构是脾脏中免疫反应活跃的部位。本实验中免疫应答高峰期神经纤维变化出现于这些部位,更强烈提示了神经与免疫功能之间的密切关系。
, 百拇医药
免疫功能状态改变时神经纤维数量和形态的变化也见于淋巴结[8],这种变化的机制目前尚不完全清楚。因为胚胎发育中脾内去甲肾上腺素能神经与免疫细胞相伴出现[9],而且成年动物的初级和次级淋巴器官中有较丰富的交感神经支配,这些事实提示了胚胎和成年脾组织中某种维持神经生长存活物质存在的可能性。事实上,脾T、B淋巴细胞能够产生具有活性的神经生长因子(NGF)已得到证实[10]。NGF、脑源性神经营养因子(BDNF)、神经营养素-3,4(NT-3,NT-4)等神经营养素的mRNA也已发现于胸腺和脾脏[11],进一步提示免疫器官自身能够产生神经营养素。体外实验证实,淋巴器官组织块能够诱导共同培养的交感神经节神经的生长,这种作用能够被抗NGF抗体完全阻断[12]。经感染性刺激的淋巴器官组织块具有更强的神经诱生作用,而且除NGF外,免疫活性细胞所产生的细胞因子如IL-1、IL-3、IL-6、GM-CSF等均有一定的神经诱导作用[12~15]。以上实验依据从不同角度支持了本实验的结果。虽然目前尚不知我们的实验条件下神经营养性因子的表达和分泌是否增加,但有报道免疫细胞内NT-4 mRNA水平在 ConA、LPS或感染的刺激下有所增高[11]。正是由于多种神经营养性因子、细胞因子的共同作用,使神经纤维在免疫反应中得以发生与功能相适应的变化。在我们的实验中,脾GAP-43-LI神经纤维的形态学变化有着区域的特殊性,神经纤维有向免疫反应激烈的部位伸展的趋势,这也反应出在免疫应答时脾不同结构和区域内神经营养性因子和细胞因子的生成量可能有所差别。边缘区和红髓作为免疫应答的前沿,有大量巨噬细胞聚集,我们最近的工作证实,边缘区和红髓的巨噬细胞呈NGF免疫反应阳性。
, 百拇医药
有关交感神经对免疫功能的影响已有较多研究[1,2],有些问题尚存在争议。因外科或化学切除交感神经可导致免疫功能的增强,故相当一部分人认为交感神经对免疫功能起抑制作用,但也有去除交感神经不影响或增强免疫功能的报道。本研究的结果以及老年动物脾交感神经纤维密度降低的报道表明,脾交感神经纤维的密度与其免疫功能状态呈正比。神经纤维密度增加的同时是否伴有NA含量的改变有待进一步研究。有报道,于免疫应答各个不同阶段,脾NA水平出现明显变化[2]。由于许多证据证实NA对免疫功能起抑制作用,因而,本实验中免疫应答高峰期神经纤维数量、分支和膨体增加的结果有可能解释为,神经通过释放更多的神经递质及增加与免疫细胞的接触而对免疫反应起负反馈抑制作用。
收稿1997-12 修回1998-04
参考文献
[1]Frieman EM,Irwin MR.Modulation of immune cell function by the autonomic nervous system.Pharmacol Ther,1997,74(1):27
, http://www.100md.com
[2]Madden KS,Felten DL.Experimental basis for neural-immune interactions.Physiological Reviews,1995,75:(1)77
[3]Benowitz LI,Routtenberg A.A membrane phosphoprotein associated with neural development axonal regeneration,phospholipid metabolism and synaptic plasticity.TINS,1987,10(12):527
[4]杨 宏,邱建勇,鞠 躬.GAP-43免疫反应神经纤维在小鼠脾脏的分布及其性质的研究.神经解剖学杂志,1997,13(1):6
[5]Claassen E,Kors N,Van Rooyen N.Influence of carriers on the development and localization of anti-trinitrophenyl antibody forming cells in the murine spleen.Eur J Immunol,1986,16(3):271
, 百拇医药
[6]Van den Eertwegh AJM,Fasbender MJ,Boersma WJA,et al.In vivo detection,Kinetics and characterization of interferon-gamma-producting cells during a thymus-dependent immune response:an immune-histochemical study.In Imhof B,Berrih-Aknin S,Ezine S (eds).Lymphatic Tissues and in Vivo Immune Response.New York:Marcel Dekker,1991:207
[7]Van den Eertwegh,AJM,Fasbender MJ,Schellekens MM,et al.In vivo kinetics and characterization if IFN-g-producing cells during a thymus-independent immune response.J Immunol,1991,147(2):439
, 百拇医药
[8]Novotny GEK,Heuer T,Schottelndreier A,et al.Plasticity of innervation of the medulla of axillary lymph nodes in the rat after antigenic stimulation.Anatomical Record,1994,238(2):213
[9]Ackerman KD,Madden KS,Livnat S,et al.Parallel development of noradrenergic innervation and cellular compartmentation in the rat spleen.Exp Neurol,1989,103(2):239
[10]Santambrogio L,Benedetti M,Chao MV,et al.Nerve growth factor production by lymphocytes.J Immunol,1994,153(10):4488
, 百拇医药
[11]Laurenzi MA,Barbany G,Timmusk T,et al.Expression of mRNA encoding neurotrophins and neurotrophin receptors in rat thymus,spleen tissue and immunocompetent cells.Eur J Biochem,1994,223(3):733
[12]Kannan K,Stead RH,Goldsmith CH,et al.Lymphoid tissue induce NGF-dependent and NGF-independent neurite outergrowth from rat superior cervical ganglia explants in culture.J Neurosci Res,1994,37(3):374
[13]Kannan Y,Bienenstock J,Ohta M,et al.Nerve growth factor and cytokines mediate lymphoid tissue-induced neurite outgrowth from mouse superior cervical ganglia in vitro.J Immunol,1996,156(1):313
, http://www.100md.com
[14]Satoh T,Nakamura S,Taga T,et al.Induction of neuronal differentiation in PC12 cells by B-cell stimulatory factor 2/interleukin 6.Mol Cell Biol,1988,8(8):3546
[15]Haugen PK,Letourneau PC.Interleukin-2 enhances chick and rat sympathetic,but not sensory,neurite outgrowth.J Neurosci Res,1990,25(4):443
PLASTICITY OF GAP-43 INNERVATION OF THE SPLEEN
DURING IMMUNE RESPONSE IN THE MOUSE
, 百拇医药
CHANGES IN NUMBER AND DISTRIBUTION
OF THE NERVE FIBERS
Yang Hong*,Wang Ling,Huang Chuanshu Ju Gong△
(Department of Neuroimmunomodulation,Institute of Neurosciences,The Fourth Military Medical University,Xi'an;*Department of Neurobiology,Institute of Basic Medical Sciences,Beijing)
On purpose to know the morphologic changes of splenic nerves during actived immunological state,the present study investigates the amount and distribution of Growth Associated Protein(GAP-43)-like immunoreactive (LI) nerve fibers in the spleen of purified protein derivative from tuberculin(PPD) injected BALB/c mice immunohistochemically.A significant increase in the amount,as well as redistribution and morphological changes of the GAP-43-LI nerve fibers occurred in PPD immunized animals.In the control animals,the GAP-43-LI nerve fibers were found mainly distributed in association with vascular plexuses,with minor extension into the parenchyma of the inner zone of the periarterial lymphocyte sheath.In the immunized animals,in addition to denser vascular plexuses,more fibers appeared in the outer zones of periarterial lymphocyte sheath,the marginal zone,and the red pulp,all known to be the sites of active immune response.Furthermore,the nerve fibers tended to have more branches and bear richer varicosities.The results suggest that an active nerve remodeling takes place in the spleen during immune response,which may imply a mechanism through which nervous system regulates the immune responses.
KEY WORDS Neuroimmunomodulation;GAP-43;Spleen;Innervation;Mouse
△Department of Neuroimmunomodulation,Institute of Neurosciences,The Fourty Military Medical University,Xi'an 710032,China, 百拇医药(杨 宏* 王 凌 黄传书 鞠 躬)