甾体类性激素对培养的胸腺上皮细胞增殖相关信号转导的调节
作者:何威 王占友 坂部贡清木勘治
单位:何威 王占友 坂部贡清木勘治 中国医科大学组织学胚胎学教研室,沈阳 110001;* 日本东海大学医学部形态学讲座,日本259-1193
关键词:胸腺上皮细胞;性激素;增殖;细胞周期蛋白依赖激酶;信号转导
解剖学报990210 【摘要】 目的 探讨甾体类性激素(sex steroid)对胸腺上皮细胞增殖相关信号转导的调节机制。 方法 用免疫印迹法(immunoblotting)及免疫组织化学法(immunohistochemistry)研究甾体类性激素在体外培养大鼠胸腺上皮细胞株(IT-45R1)蛋白激酶C相关的信号转导途径中的作用机制。 结果 (1)甾体类性激素诱导的胸腺上皮细胞的增殖受甾体类性激素和血浆抑制因子相互作用产生的质膜相关信号途径的调节;(2)细胞周期蛋白依赖激酶系在胸腺上皮细胞的细胞周期中起重要作用;(3)5α-双氢睾酮在10-10mol/L增强细胞周期蛋白依赖激酶系的调节,而17β-E2则呈浓度依赖性抑制细胞周期蛋白依赖激酶系的调节。 结论 胸腺上皮细胞增殖相关信号的转导是几条途径相互作用的结果。
, 百拇医药
SEX STEROIDS MODULATE THE PROLIFERATION SIGNALTRANSDUCTION IN CULTURED THYMUSEPITHELIAL CELLS
He Wei△,Wang Zhanyou,Kou Sakabe*,Kanji seiki*
(Department of Histology and Embryology,China Medical University,Shenyang;
*Department of Morphology,Tokai Univeristy,School of Medicine,Japan)
【Abstract】 Objective This paper was to expound the modulation mechanism of sex steriod hormones(SHs) on the proliferation related signal transduction of thymus epithelial cell(TEC).Methods The mechanism of action of SHs on the protein kinase C(PKC)-related signal transduction pathway was examined in cultured rat TEC line(IT-45R1)with immunoblotting and immunohistochemistry.Results (1)proliferation of TECs in response to SHs is mediated by plasma membrane associated signal pathways generated as a result of interactions between SHs and plasma-borne inhibitors;(2)the action of cyclins and cyclin-dependent families,such as cdc2 kinases,play a key role in cell cycle progression in TECs;(3)the DHT in 10-10mol/L enhanced the modulation of cyclin-dependent kinase familes,but the 17β-E2 shown as the concentration-dependent,inhibited the modulation of cyclin-dependent kinase families. Conclusion The transduction of TEC proliferation related signal was the result of interaction through many pathways.
, http://www.100md.com
【Key words】 Thymus epithelial cells;Sex hormones; Proliferation; Cyclin-dependent kinase;Singal transduction
大量研究表明,性激素(sex hormones,SHs)是哺乳动物胸腺免疫应答的调节因子。胸腺上皮细胞(thymus epithelial cell,TECs)的增殖和功能与胸腺上皮细胞对SHs的敏感性密切相关[1,2]。青春期后的胸腺退化主要是由于胸腺组织暴露于体循环中高水平的SHs所致[3]。但是SHs影响胸腺功能的作用机制尚不完全清楚。我们曾报道[1],SHs使大鼠TEC株IT-45R1的蛋白激酶C(protein kinase C,PKC)活性迅速增强。Rajkumar[4]的研究结果表明,蛋白激酶抑制因子抑制大鼠子宫雌激素诱导的DNA合成。这些研究结果提示,蛋白激酶在性激素敏感细胞(包括TECs)的SHs诱导的信号转导中起关键作用。细胞周期包括G1、S、G2和M 4个时期,该过程的调节因子,即细胞周期蛋白依赖激酶(cyclin-dependent kinases,Cdk)及其调节因子14-3-3是PKC相关信号转导中的重要表达因子。因此,本研究探讨了SHs对培养胸腺上皮细胞CdK及其调节因子14-3-3的影响。
, http://www.100md.com
材料和方法
1.细胞株
胸腺上皮细胞株IT-45R1来自于大鼠胸腺[5],该细胞株具有上皮细胞特征,对SHs高度敏感且具有产生各种胸腺激素的能力[2,5]。
2.化学试剂
将双氢睾酮(5α-DHT)和雌二醇(17β-E2)(Sigma产品)分别溶于纯乙醇中,制备成3×10-5mol/L浓度,并于-20℃保存。使用前用DMEM培养基稀释,使乙醇最终浓度低于1/1 000。
3.培养条件和实验设计
IT-45R1细胞株在含有5%胎牛血清(FBS)的DMEM培养基中继代培养。为测定细胞增殖,以2.5×104/ml浓度加于12孔培养板或8室载玻片上(Napieville,IL,USA)用下述方法37℃、5%CO2箱培养。
, 百拇医药
由于TECs来源于大鼠的胸腺,所以TECs的增殖周期要用来自Wistar种系大鼠的同种血清来检测。为了使半抗原这种热敏感蛋白质变性,大鼠血清在56℃灭活30min,血清中的SHs用0.5%活性炭-0.05%右旋糖酐T70于37.5℃吸附1h。经如此处理的血清被称为活性炭-右旋糖酐处理血清(CDS)。CDS已被证明含有抑制细胞增殖的热稳定蛋白[1]。用这种CDS培养基IT-45R1细胞可稳定(非增殖状态)培养5d,然后加入SHs溶液,培养72h,收获细胞,用于下列分析。
4.CdK和蛋白激酶调节因子14-3-3的免疫印迹分析
将经SHs处理的IT-45R1细胞于4℃悬浮于10mmol/L Tris-HCl(pH7.4)溶液(该溶液含有3mmol/L MgCl2,1mmol/L PMSF和10mmol/L巯基乙醇)15min,制备细胞匀浆,高速离心后取上清进行免疫印迹[6]。使用小鼠单克隆抗细胞周期蛋白A、B1抗体,小鼠单克隆抗细胞周期蛋白依赖激酶(oncogene science)和抗活化的14-3-3(Morinaga Bio-Science,Japan)抗体。免疫印迹复合物用Tropix Western-Light试剂盒(Tropix,Bedford,MA,USA)测定,反应带用IBM PS/V(IBM Japan,Tokyo,Japan)和Argus-10图像处理仪(Hamamatsu Photonics K.K.,Japan)分析。
, http://www.100md.com
5.细胞周期蛋白依赖激酶的免疫组织化学分析
将经SHs处理的培养TECs用PBS洗涤后,4%多聚甲醛/PBS固定30min。洗涤后,10%正常羊血清室温孵育20min;小鼠单克隆抗细胞周期蛋白A、B1抗体,以及小鼠单克隆抗细胞周期蛋白依赖激酶cdc2抗体,4℃湿盒中过夜;生物素化的羊抗小鼠IgG室温1h;过氧化物酶标记的亲和素中室温30min;DAB-H2O2显色10min;甲绿复染细胞核后显微镜下观察。
结 果
1.SH对TEC增殖的影响
加5α-DHT于含有10%CDS的培养基使TEC的增殖产生双相反应。激素浓度为3×10-10mol/L时,细胞增殖达高峰;当激素浓度为3×10-7mol/L时,导致细胞增殖进行性减少。17β-E\-2从低浓度到高浓度抑制细胞增殖(图1)。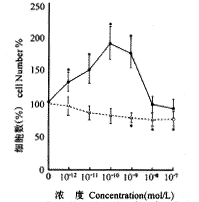
, 百拇医药
图1 10%CDS中生长的TEC增殖产量。培养液中含有(●)3×10-12~3×10-7mol/L 5α-DHT及(○)3×10-12~3×10-7mol/L 17β-E2。数值为来源于4个样本的平均值±标准差。*与对照组(未添加性激素)相比,P<0.01
Fig.1 Cell proliferation yields obtained when TEC were grown in 10% CDS.The serum was supplemented with:(●)3×10-12 to 3×10-7mol/L 5α-DHT;(○)3×10-12 to 3×10-7mol/L 17β-E2.Values are the means ±s of four determinations.*P<0.01,vs the control (no hormone).
, 百拇医药
2.血清浓度对TEC增殖的影响
CDS对TEC增殖显示有统计学意义的抑制作用,这种抑制作用在加入3×10-10mol/L 5α-DHT后消失(图2)。反之,17β-E2不影响CDS的抑制作用(数据未出示)。
3.SHs对TEC Cdk的表达及其调节因子14-3-3活性的影响
图2 含有3×10-10mol/L 5α-DHT培养基中CDS血清浓度对TEC增殖的影响.(□)为仅添加1%~30%CDS;(■)为CDS加上3×10-10mol/L 5α-DHT.数值来源于6个样本的平均值±标准差.*与单独添加CDS相比,P<0.01
Fig.2 Effect of serum concentrations on cell proloferaion when TECs were grown in medium supplemented whith 1 to 30% CDS alone(□) or plus 3×10-10mol/L of 5α-DHT(■).Values are the means ±s of six determinations.* P<0.01,vs CDS alone.
, 百拇医药
Cdk是细胞周期中的重要因子。周期蛋白A促进细胞从G1期向S期过渡,周期蛋白B1促进S期向G2期的过渡。图3a和3b表明周期蛋白A的免疫印迹分析结果:在用3×10-10mol/L及更低浓度的5α-DHT孵育的TECs,强烈诱导了周期蛋白A的表达,而该激素水平在3×10-9mol/L及更高时,表达则明显减少;在17β-E2处理组,周期蛋白A的表达呈剂量依赖性抑制作用,在剂量超过3×10-10mol/L时,表达明显减少。周期蛋白B1及周期蛋白
图3a 经5α-DHT及17β-E2处理的TEC提取液中周期蛋白A分子的免疫印迹。激素浓度为3×10-12~3×10-7mol/L,蛋白印迹带经发光检测药盒显影
, http://www.100md.com
Fig.3a Immunoblotting of peptide bands containing cyclin A molecules in the extract from TEC treated with 3×10-12 to 3×10-7mol/L of 5α-DHT and 17β-E2.Peptide bands were visualized by iuminescence detection.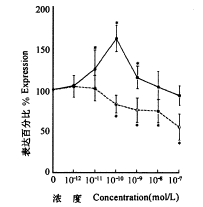
图3b 经5α-DHT及17β-E2处理的TEC提取液中,周期蛋白A分子的免疫印迹强度分析。染色强度是把激素浓度为0时的对照组作为100%分析的结果。数值来源于4个样本的平均值±标准差。*与对照组相比,P<0.05
Fig.3b Photometnic intensity of the immunoblot staining of cyclin A from TECs treated with 3×10-12 to 3×10-7mol/L of 5α-DHT(●)and 17β-E2(○).Staining intensity at zero SH concentration is designated as control 100%.Values are means ±s of four determinations.*P<0.05,vs the control.
, http://www.100md.com
依赖激酶cdc2的免疫印迹分析结果与周期蛋白A几乎相同(数据未出示)。图4a和4b表明蛋白激酶调节因子14-3-3的免疫印迹分析结果。用5α-DHT孵育的TECs呈14-3-3活化的双相反应。高峰时5α-DHT浓度为3×10-10mol/L,当该激素浓度为3×10-9mol/L及更高时,14-3-3则进行性减少;而17β-E2不论浓度高低均不诱导14-3-3的活化。
图4a 经5α-DHT和17β-E2处理的TEC提取液中14-3-3分子的免疫印迹。激素浓度为3×10-12~3×10-7mol/L,蛋白印迹带经发光检测药盒显影
Fig.4a Immunoblotting of peptide bands containing 14-3-3 molecules from the extract from TEC treated with 3×10-12to 3×10-7mol/L of 5α-DHT and 17β-E2.Peptide bands were visualized by luminescence detection.
, 百拇医药
图4b 经5α-DHT和17β-E2处理的TEC提取液中14-3-3分子的免疫印迹强度分析。染色强度是把激素浓度为0时的对照组作为100%分析的结果。数值来源于4个样本的平均值±标准差。*与对照组相比,P<0.05
Fig.4b Photometric intensity of the immunoblot staining of 14-3-3 from TECs treated with 3×10-12to 3×10-7mol/L of 5α-DHT(●)and 17β-E2(○).Staining intensity at zero SH concentration is designated control 100%.Values are means ±s of four determinations.*P<0.05,vs the control.
4.SHs对TECs周期因子免疫组织化学染色的影响
, 百拇医药
附表表明,周期蛋白A、B1和cdc2周期蛋白依赖激酶在不同浓度SH孵育后的TEC细胞内的染色附表 TEC的周期蛋白A、B1、周期蛋白
依赖激酶cdc2的免疫染色强度
Table Immunostaining intensity of cyclin A,cyclin B1,and cdc2 in the TEC line 浓度
concentration
(mol/L)
5α-DHT
17β-E2
0
, 百拇医药
-12
-11
-10
-9
-8
-7
0
-12
-11
-10
-9
-8
-7
周期蛋白A
, 百拇医药
N



+
±
±
+
+
+
+
, http://www.100md.com
±
±
cyclin A
C



±
±

, http://www.100md.com
+
+
+
±
±
周期蛋白B1
N
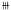
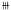

+
, http://www.100md.com +
±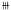


+
+
±
±
cyclin B1
C
-
-
, 百拇医药
-
-
-
-
-
-
-
-
-
-
-
-
激酶cdc2
N
, http://www.100md.com
+
+
+
+
±
±
+
+
+
±
±
±
-
, 百拇医药
cdc2
C


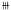
+
+
±

+
, http://www.100md.com
+
±
±
±
N.细胞核 C.细胞质 染色强度经镜下观察分级:( )很强 (
)很强 ( )强 (
)强 ( )中 (+)弱 (±)很弱 (-)阴性
)中 (+)弱 (±)很弱 (-)阴性
N:nucleus,C:cytoplasm Grading of staining intensity determined by visual observations:( )very strong,(
)very strong,( )strong,(
)strong,( )moderate,(+)weak,(±)very wead and (-)negative.
)moderate,(+)weak,(±)very wead and (-)negative.
, 百拇医药
强度及分布。细胞周期蛋白A的免疫染色在用3×10-10mol/L 5α-DHT孵育的TECs的核及胞浆内均能见到,但当5α-DHT浓度大于3×10-8mol/L时,染色则进行性减弱;在用3×10-10mol/L 5α-DHT孵育的TECs,细胞周期蛋白B1免疫染色特异性地局限于细胞核上(图5a),当5α-DHT浓度大于3×10-9mol/L 时,染色明显减弱(图5b)。cdc2的特异性染色在用3×10-10mol/L 5α-DHT孵育的TECs的胞核和胞浆内均可见到,但当5α-DHT浓度增高时,则导致进行性减弱。17β-E2在高、低浓度均对周期蛋白A、B1和周期蛋白依赖激酶cdc2的免疫染色产生抑制作用。

, 百拇医药
图5a 3×10-10mol/L 5α-DHT处理的TECs中周期蛋白B1的免疫组织化学染色。染色阳性颗粒局限于细胞核 ×360
Fig.5a Immunohistochemical staining of cyclin B1 in TECs treated with 3×10-10mol/L of 5α-DHT.Cyclin B1 staining is exclusively localized in the nucleus,with no cyclin B1 staining in the extranuclear compartment ×360
图5b 3×10-9mol/L 5α-DHT处理的TECs中周期蛋白B1的免疫组织化学染色。染色强度比3×10-10mol/L 5α-DHT处理组(图5a)明显减弱 ×360
, http://www.100md.com
Fig.5b Immunohistochemical staining of cyclin B1 in TEc treated with 3×10-9mol/L of 5α-DHT.A progressive loss of Cyclin B1 staining is seen compared to TECs treated with 3×10-10mol/L of 5α-DHT shown in Fig.5a ×360
讨 论
IT-45R1胸腺上皮细胞株已被证明是探讨SH调节细胞增殖机制的可靠工具[1]。关于SHs影响细胞增殖的作用机制,过去一直认为是一种“genomic”作用,即SHs通过渗透进入细胞,通过细胞质或细胞核内的受体调节特异性的SHs反应性DNA的表达,从而影响细胞增殖。近年来的细胞生物学和免疫学研究结果表明,SH参与TECs增殖的促进/抑制途径,并且是一种快速作用。最近我们提出,SH在细胞周期的第一阶段(G0到G1期)会使不含SH的血清的抑制作用消失,然后激活质膜相关信号途径,紧接着在第2阶段(G1到G2期)SH直接抑制细胞周期进程,这称之为SH诱导的细胞增殖的“关闭抑制作用”[1,7,8]。
, 百拇医药
本研究结果支持上述假说。5α-DHT处理组的TEC增殖,高峰在低浓度水平(3×10-10mol/L),然后随着浓度增高呈进行性减少;17β-E2处理组无论浓度高低均产生抑制作用。细胞周期蛋白依赖激酶的实验结果表明,SH诱导的TEC增殖,至少有一部分是由于细胞周期蛋白依赖激酶及其相关因子的作用。近年来的研究表明,14-3-3作为蛋白激酶的关键性调节因子已被人们广泛接受[9]。本实验结果表明,SH诱导的细胞周期蛋白依赖激酶活性的波动,是通过14-3-3来调节的,即SH首先影响蛋白激酶调节因子14-3-3的表达,然后继发性地调节细胞周期蛋白依赖激酶的活性,从而影响TEC的增殖。
我们最近提供了SH信号作用于细胞表面的证据,也提供了提高TECs的PKC活性的最适有效SH浓度[1]。然而,Steinsapir 等(1991)和Audy等(1996)的研究表明,SH诱导的细胞增殖与SH敏感细胞的Ca2+内流密切相关,即Ca2+活化的和PKC相关信号转导途径是SH诱导的细胞增殖的关键[10,11]。总之,胸腺上皮细胞株的细胞增殖也被性激素诱导的质膜相关途径(non-genomic作用)所调节。细胞内的信号转导,在多数情况下,是几条途径相互作用的结果。有关这些途径复杂的作用机制还有待于进一步探明。
, http://www.100md.com
参考文献
[1]Ssakabe K,Kawashima I,Urano R,et al.Effects of sex steroids on the proliferation of thymic epithelial cells in a culture model:A role of protein kinase C.Immunol Cell Biol,1994,72(3):193
[2]He W,Sakabe K,Seiki K,et al.Sex steroid modulation of thymic hormone production in thymus epithelial cell culture.Pathophysiol,1996,3(3):169
[3]Grossman CJ,Roselle GA.The interrelation ship of the HPG-thymic axis and immune system regulation.J Steroid Biochem,1983,19(1):461
, http://www.100md.com
[4]Rajkumar K.Effect of protein kinase-C inhibitor on estradiol-induced deoxyribonucleic acid synthesis in rats.Steroids,1993,58(3):100
[5]Itch T,Aizu S,Kasahara S,et al.Establishment of a functional epithelial cell line from the rat thymus a cell line that induces the differentiation of rat bone marrow cells into T cell lineage.Biomed Res,1981,2(1):11
[6]Sakabe K,Seiki K,Sakai N,et al.Establishment of crostsalk between the thymus and brain at an early stage of fetal life in the rat.Med Sci Res,1996,24(7):439
, http://www.100md.com
[7]Olea N,Sakabe K,Soto AM,et al.The proliferative effect of “antiandrogens”on the androgen-sensitive human prostate tumor cell line LNCaP.Endocrinology,1990,126(3):1457
[8]Soto AM,Lin TM.Sakabe K,et al.Variants of the human prostate LNCaP cell line as tools to study discrete components of the androgen-mediated proliferative response.Oncol Res,1995,7(10-11):545
[9]Isobe T,Hiyane Y,Ichimura T,et al.Activation of protein kinase C by the 14-3-3 protein homologous with Exol protein that stimulates calcium-dependent exocytosis.FEBS Lett,1992,308(2):121
[10]Steinsapir J,Socci R,Reinach P.Effects of androgen on intracellular calcium of LNCaP cells.Biochem Biophys Res Commun,1991,179(1):90
[11]Audy MC,Vacher P,Dufy B.17β-estradiol stumulates a rapid Ca2+influx in LNCaP human prostate cancer cells.Eur J Endocrinol,1996,135(3):367, 百拇医药
单位:何威 王占友 坂部贡清木勘治 中国医科大学组织学胚胎学教研室,沈阳 110001;* 日本东海大学医学部形态学讲座,日本259-1193
关键词:胸腺上皮细胞;性激素;增殖;细胞周期蛋白依赖激酶;信号转导
解剖学报990210 【摘要】 目的 探讨甾体类性激素(sex steroid)对胸腺上皮细胞增殖相关信号转导的调节机制。 方法 用免疫印迹法(immunoblotting)及免疫组织化学法(immunohistochemistry)研究甾体类性激素在体外培养大鼠胸腺上皮细胞株(IT-45R1)蛋白激酶C相关的信号转导途径中的作用机制。 结果 (1)甾体类性激素诱导的胸腺上皮细胞的增殖受甾体类性激素和血浆抑制因子相互作用产生的质膜相关信号途径的调节;(2)细胞周期蛋白依赖激酶系在胸腺上皮细胞的细胞周期中起重要作用;(3)5α-双氢睾酮在10-10mol/L增强细胞周期蛋白依赖激酶系的调节,而17β-E2则呈浓度依赖性抑制细胞周期蛋白依赖激酶系的调节。 结论 胸腺上皮细胞增殖相关信号的转导是几条途径相互作用的结果。
, 百拇医药
SEX STEROIDS MODULATE THE PROLIFERATION SIGNALTRANSDUCTION IN CULTURED THYMUSEPITHELIAL CELLS
He Wei△,Wang Zhanyou,Kou Sakabe*,Kanji seiki*
(Department of Histology and Embryology,China Medical University,Shenyang;
*Department of Morphology,Tokai Univeristy,School of Medicine,Japan)
【Abstract】 Objective This paper was to expound the modulation mechanism of sex steriod hormones(SHs) on the proliferation related signal transduction of thymus epithelial cell(TEC).Methods The mechanism of action of SHs on the protein kinase C(PKC)-related signal transduction pathway was examined in cultured rat TEC line(IT-45R1)with immunoblotting and immunohistochemistry.Results (1)proliferation of TECs in response to SHs is mediated by plasma membrane associated signal pathways generated as a result of interactions between SHs and plasma-borne inhibitors;(2)the action of cyclins and cyclin-dependent families,such as cdc2 kinases,play a key role in cell cycle progression in TECs;(3)the DHT in 10-10mol/L enhanced the modulation of cyclin-dependent kinase familes,but the 17β-E2 shown as the concentration-dependent,inhibited the modulation of cyclin-dependent kinase families. Conclusion The transduction of TEC proliferation related signal was the result of interaction through many pathways.
, http://www.100md.com
【Key words】 Thymus epithelial cells;Sex hormones; Proliferation; Cyclin-dependent kinase;Singal transduction
大量研究表明,性激素(sex hormones,SHs)是哺乳动物胸腺免疫应答的调节因子。胸腺上皮细胞(thymus epithelial cell,TECs)的增殖和功能与胸腺上皮细胞对SHs的敏感性密切相关[1,2]。青春期后的胸腺退化主要是由于胸腺组织暴露于体循环中高水平的SHs所致[3]。但是SHs影响胸腺功能的作用机制尚不完全清楚。我们曾报道[1],SHs使大鼠TEC株IT-45R1的蛋白激酶C(protein kinase C,PKC)活性迅速增强。Rajkumar[4]的研究结果表明,蛋白激酶抑制因子抑制大鼠子宫雌激素诱导的DNA合成。这些研究结果提示,蛋白激酶在性激素敏感细胞(包括TECs)的SHs诱导的信号转导中起关键作用。细胞周期包括G1、S、G2和M 4个时期,该过程的调节因子,即细胞周期蛋白依赖激酶(cyclin-dependent kinases,Cdk)及其调节因子14-3-3是PKC相关信号转导中的重要表达因子。因此,本研究探讨了SHs对培养胸腺上皮细胞CdK及其调节因子14-3-3的影响。
, http://www.100md.com
材料和方法
1.细胞株
胸腺上皮细胞株IT-45R1来自于大鼠胸腺[5],该细胞株具有上皮细胞特征,对SHs高度敏感且具有产生各种胸腺激素的能力[2,5]。
2.化学试剂
将双氢睾酮(5α-DHT)和雌二醇(17β-E2)(Sigma产品)分别溶于纯乙醇中,制备成3×10-5mol/L浓度,并于-20℃保存。使用前用DMEM培养基稀释,使乙醇最终浓度低于1/1 000。
3.培养条件和实验设计
IT-45R1细胞株在含有5%胎牛血清(FBS)的DMEM培养基中继代培养。为测定细胞增殖,以2.5×104/ml浓度加于12孔培养板或8室载玻片上(Napieville,IL,USA)用下述方法37℃、5%CO2箱培养。
, 百拇医药
由于TECs来源于大鼠的胸腺,所以TECs的增殖周期要用来自Wistar种系大鼠的同种血清来检测。为了使半抗原这种热敏感蛋白质变性,大鼠血清在56℃灭活30min,血清中的SHs用0.5%活性炭-0.05%右旋糖酐T70于37.5℃吸附1h。经如此处理的血清被称为活性炭-右旋糖酐处理血清(CDS)。CDS已被证明含有抑制细胞增殖的热稳定蛋白[1]。用这种CDS培养基IT-45R1细胞可稳定(非增殖状态)培养5d,然后加入SHs溶液,培养72h,收获细胞,用于下列分析。
4.CdK和蛋白激酶调节因子14-3-3的免疫印迹分析
将经SHs处理的IT-45R1细胞于4℃悬浮于10mmol/L Tris-HCl(pH7.4)溶液(该溶液含有3mmol/L MgCl2,1mmol/L PMSF和10mmol/L巯基乙醇)15min,制备细胞匀浆,高速离心后取上清进行免疫印迹[6]。使用小鼠单克隆抗细胞周期蛋白A、B1抗体,小鼠单克隆抗细胞周期蛋白依赖激酶(oncogene science)和抗活化的14-3-3(Morinaga Bio-Science,Japan)抗体。免疫印迹复合物用Tropix Western-Light试剂盒(Tropix,Bedford,MA,USA)测定,反应带用IBM PS/V(IBM Japan,Tokyo,Japan)和Argus-10图像处理仪(Hamamatsu Photonics K.K.,Japan)分析。
, http://www.100md.com
5.细胞周期蛋白依赖激酶的免疫组织化学分析
将经SHs处理的培养TECs用PBS洗涤后,4%多聚甲醛/PBS固定30min。洗涤后,10%正常羊血清室温孵育20min;小鼠单克隆抗细胞周期蛋白A、B1抗体,以及小鼠单克隆抗细胞周期蛋白依赖激酶cdc2抗体,4℃湿盒中过夜;生物素化的羊抗小鼠IgG室温1h;过氧化物酶标记的亲和素中室温30min;DAB-H2O2显色10min;甲绿复染细胞核后显微镜下观察。
结 果
1.SH对TEC增殖的影响
加5α-DHT于含有10%CDS的培养基使TEC的增殖产生双相反应。激素浓度为3×10-10mol/L时,细胞增殖达高峰;当激素浓度为3×10-7mol/L时,导致细胞增殖进行性减少。17β-E\-2从低浓度到高浓度抑制细胞增殖(图1)。

, 百拇医药
图1 10%CDS中生长的TEC增殖产量。培养液中含有(●)3×10-12~3×10-7mol/L 5α-DHT及(○)3×10-12~3×10-7mol/L 17β-E2。数值为来源于4个样本的平均值±标准差。*与对照组(未添加性激素)相比,P<0.01
Fig.1 Cell proliferation yields obtained when TEC were grown in 10% CDS.The serum was supplemented with:(●)3×10-12 to 3×10-7mol/L 5α-DHT;(○)3×10-12 to 3×10-7mol/L 17β-E2.Values are the means ±s of four determinations.*P<0.01,vs the control (no hormone).
, 百拇医药
2.血清浓度对TEC增殖的影响
CDS对TEC增殖显示有统计学意义的抑制作用,这种抑制作用在加入3×10-10mol/L 5α-DHT后消失(图2)。反之,17β-E2不影响CDS的抑制作用(数据未出示)。
3.SHs对TEC Cdk的表达及其调节因子14-3-3活性的影响

图2 含有3×10-10mol/L 5α-DHT培养基中CDS血清浓度对TEC增殖的影响.(□)为仅添加1%~30%CDS;(■)为CDS加上3×10-10mol/L 5α-DHT.数值来源于6个样本的平均值±标准差.*与单独添加CDS相比,P<0.01
Fig.2 Effect of serum concentrations on cell proloferaion when TECs were grown in medium supplemented whith 1 to 30% CDS alone(□) or plus 3×10-10mol/L of 5α-DHT(■).Values are the means ±s of six determinations.* P<0.01,vs CDS alone.
, 百拇医药
Cdk是细胞周期中的重要因子。周期蛋白A促进细胞从G1期向S期过渡,周期蛋白B1促进S期向G2期的过渡。图3a和3b表明周期蛋白A的免疫印迹分析结果:在用3×10-10mol/L及更低浓度的5α-DHT孵育的TECs,强烈诱导了周期蛋白A的表达,而该激素水平在3×10-9mol/L及更高时,表达则明显减少;在17β-E2处理组,周期蛋白A的表达呈剂量依赖性抑制作用,在剂量超过3×10-10mol/L时,表达明显减少。周期蛋白B1及周期蛋白

图3a 经5α-DHT及17β-E2处理的TEC提取液中周期蛋白A分子的免疫印迹。激素浓度为3×10-12~3×10-7mol/L,蛋白印迹带经发光检测药盒显影
, http://www.100md.com
Fig.3a Immunoblotting of peptide bands containing cyclin A molecules in the extract from TEC treated with 3×10-12 to 3×10-7mol/L of 5α-DHT and 17β-E2.Peptide bands were visualized by iuminescence detection.

图3b 经5α-DHT及17β-E2处理的TEC提取液中,周期蛋白A分子的免疫印迹强度分析。染色强度是把激素浓度为0时的对照组作为100%分析的结果。数值来源于4个样本的平均值±标准差。*与对照组相比,P<0.05
Fig.3b Photometnic intensity of the immunoblot staining of cyclin A from TECs treated with 3×10-12 to 3×10-7mol/L of 5α-DHT(●)and 17β-E2(○).Staining intensity at zero SH concentration is designated as control 100%.Values are means ±s of four determinations.*P<0.05,vs the control.
, http://www.100md.com
依赖激酶cdc2的免疫印迹分析结果与周期蛋白A几乎相同(数据未出示)。图4a和4b表明蛋白激酶调节因子14-3-3的免疫印迹分析结果。用5α-DHT孵育的TECs呈14-3-3活化的双相反应。高峰时5α-DHT浓度为3×10-10mol/L,当该激素浓度为3×10-9mol/L及更高时,14-3-3则进行性减少;而17β-E2不论浓度高低均不诱导14-3-3的活化。

图4a 经5α-DHT和17β-E2处理的TEC提取液中14-3-3分子的免疫印迹。激素浓度为3×10-12~3×10-7mol/L,蛋白印迹带经发光检测药盒显影
Fig.4a Immunoblotting of peptide bands containing 14-3-3 molecules from the extract from TEC treated with 3×10-12to 3×10-7mol/L of 5α-DHT and 17β-E2.Peptide bands were visualized by luminescence detection.

, 百拇医药
图4b 经5α-DHT和17β-E2处理的TEC提取液中14-3-3分子的免疫印迹强度分析。染色强度是把激素浓度为0时的对照组作为100%分析的结果。数值来源于4个样本的平均值±标准差。*与对照组相比,P<0.05
Fig.4b Photometric intensity of the immunoblot staining of 14-3-3 from TECs treated with 3×10-12to 3×10-7mol/L of 5α-DHT(●)and 17β-E2(○).Staining intensity at zero SH concentration is designated control 100%.Values are means ±s of four determinations.*P<0.05,vs the control.
4.SHs对TECs周期因子免疫组织化学染色的影响
, 百拇医药
附表表明,周期蛋白A、B1和cdc2周期蛋白依赖激酶在不同浓度SH孵育后的TEC细胞内的染色附表 TEC的周期蛋白A、B1、周期蛋白
依赖激酶cdc2的免疫染色强度
Table Immunostaining intensity of cyclin A,cyclin B1,and cdc2 in the TEC line 浓度
concentration
(mol/L)
5α-DHT
17β-E2
0
, 百拇医药
-12
-11
-10
-9
-8
-7
0
-12
-11
-10
-9
-8
-7
周期蛋白A
, 百拇医药
N




+
±
±

+
+
+
+
, http://www.100md.com
±
±
cyclin A
C



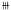

±
±


, http://www.100md.com
+
+
+
±
±
周期蛋白B1
N
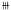
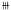
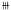

+
, http://www.100md.com +
±
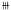


+
+
±
±
cyclin B1
C
-
-
, 百拇医药
-
-
-
-
-
-
-
-
-
-
-
-
激酶cdc2
N
, http://www.100md.com
+
+
+

+
±
±
+
+
+
±
±
±
-
, 百拇医药
cdc2
C



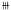
+
+
±


+
, http://www.100md.com
+
±
±
±
N.细胞核 C.细胞质 染色强度经镜下观察分级:(
 )很强 (
)很强 ( )强 (
)强 ( )中 (+)弱 (±)很弱 (-)阴性
)中 (+)弱 (±)很弱 (-)阴性N:nucleus,C:cytoplasm Grading of staining intensity determined by visual observations:(
 )very strong,(
)very strong,( )strong,(
)strong,( )moderate,(+)weak,(±)very wead and (-)negative.
)moderate,(+)weak,(±)very wead and (-)negative., 百拇医药
强度及分布。细胞周期蛋白A的免疫染色在用3×10-10mol/L 5α-DHT孵育的TECs的核及胞浆内均能见到,但当5α-DHT浓度大于3×10-8mol/L时,染色则进行性减弱;在用3×10-10mol/L 5α-DHT孵育的TECs,细胞周期蛋白B1免疫染色特异性地局限于细胞核上(图5a),当5α-DHT浓度大于3×10-9mol/L 时,染色明显减弱(图5b)。cdc2的特异性染色在用3×10-10mol/L 5α-DHT孵育的TECs的胞核和胞浆内均可见到,但当5α-DHT浓度增高时,则导致进行性减弱。17β-E2在高、低浓度均对周期蛋白A、B1和周期蛋白依赖激酶cdc2的免疫染色产生抑制作用。


, 百拇医药
图5a 3×10-10mol/L 5α-DHT处理的TECs中周期蛋白B1的免疫组织化学染色。染色阳性颗粒局限于细胞核 ×360
Fig.5a Immunohistochemical staining of cyclin B1 in TECs treated with 3×10-10mol/L of 5α-DHT.Cyclin B1 staining is exclusively localized in the nucleus,with no cyclin B1 staining in the extranuclear compartment ×360
图5b 3×10-9mol/L 5α-DHT处理的TECs中周期蛋白B1的免疫组织化学染色。染色强度比3×10-10mol/L 5α-DHT处理组(图5a)明显减弱 ×360
, http://www.100md.com
Fig.5b Immunohistochemical staining of cyclin B1 in TEc treated with 3×10-9mol/L of 5α-DHT.A progressive loss of Cyclin B1 staining is seen compared to TECs treated with 3×10-10mol/L of 5α-DHT shown in Fig.5a ×360
讨 论
IT-45R1胸腺上皮细胞株已被证明是探讨SH调节细胞增殖机制的可靠工具[1]。关于SHs影响细胞增殖的作用机制,过去一直认为是一种“genomic”作用,即SHs通过渗透进入细胞,通过细胞质或细胞核内的受体调节特异性的SHs反应性DNA的表达,从而影响细胞增殖。近年来的细胞生物学和免疫学研究结果表明,SH参与TECs增殖的促进/抑制途径,并且是一种快速作用。最近我们提出,SH在细胞周期的第一阶段(G0到G1期)会使不含SH的血清的抑制作用消失,然后激活质膜相关信号途径,紧接着在第2阶段(G1到G2期)SH直接抑制细胞周期进程,这称之为SH诱导的细胞增殖的“关闭抑制作用”[1,7,8]。
, 百拇医药
本研究结果支持上述假说。5α-DHT处理组的TEC增殖,高峰在低浓度水平(3×10-10mol/L),然后随着浓度增高呈进行性减少;17β-E2处理组无论浓度高低均产生抑制作用。细胞周期蛋白依赖激酶的实验结果表明,SH诱导的TEC增殖,至少有一部分是由于细胞周期蛋白依赖激酶及其相关因子的作用。近年来的研究表明,14-3-3作为蛋白激酶的关键性调节因子已被人们广泛接受[9]。本实验结果表明,SH诱导的细胞周期蛋白依赖激酶活性的波动,是通过14-3-3来调节的,即SH首先影响蛋白激酶调节因子14-3-3的表达,然后继发性地调节细胞周期蛋白依赖激酶的活性,从而影响TEC的增殖。
我们最近提供了SH信号作用于细胞表面的证据,也提供了提高TECs的PKC活性的最适有效SH浓度[1]。然而,Steinsapir 等(1991)和Audy等(1996)的研究表明,SH诱导的细胞增殖与SH敏感细胞的Ca2+内流密切相关,即Ca2+活化的和PKC相关信号转导途径是SH诱导的细胞增殖的关键[10,11]。总之,胸腺上皮细胞株的细胞增殖也被性激素诱导的质膜相关途径(non-genomic作用)所调节。细胞内的信号转导,在多数情况下,是几条途径相互作用的结果。有关这些途径复杂的作用机制还有待于进一步探明。
, http://www.100md.com
参考文献
[1]Ssakabe K,Kawashima I,Urano R,et al.Effects of sex steroids on the proliferation of thymic epithelial cells in a culture model:A role of protein kinase C.Immunol Cell Biol,1994,72(3):193
[2]He W,Sakabe K,Seiki K,et al.Sex steroid modulation of thymic hormone production in thymus epithelial cell culture.Pathophysiol,1996,3(3):169
[3]Grossman CJ,Roselle GA.The interrelation ship of the HPG-thymic axis and immune system regulation.J Steroid Biochem,1983,19(1):461
, http://www.100md.com
[4]Rajkumar K.Effect of protein kinase-C inhibitor on estradiol-induced deoxyribonucleic acid synthesis in rats.Steroids,1993,58(3):100
[5]Itch T,Aizu S,Kasahara S,et al.Establishment of a functional epithelial cell line from the rat thymus a cell line that induces the differentiation of rat bone marrow cells into T cell lineage.Biomed Res,1981,2(1):11
[6]Sakabe K,Seiki K,Sakai N,et al.Establishment of crostsalk between the thymus and brain at an early stage of fetal life in the rat.Med Sci Res,1996,24(7):439
, http://www.100md.com
[7]Olea N,Sakabe K,Soto AM,et al.The proliferative effect of “antiandrogens”on the androgen-sensitive human prostate tumor cell line LNCaP.Endocrinology,1990,126(3):1457
[8]Soto AM,Lin TM.Sakabe K,et al.Variants of the human prostate LNCaP cell line as tools to study discrete components of the androgen-mediated proliferative response.Oncol Res,1995,7(10-11):545
[9]Isobe T,Hiyane Y,Ichimura T,et al.Activation of protein kinase C by the 14-3-3 protein homologous with Exol protein that stimulates calcium-dependent exocytosis.FEBS Lett,1992,308(2):121
[10]Steinsapir J,Socci R,Reinach P.Effects of androgen on intracellular calcium of LNCaP cells.Biochem Biophys Res Commun,1991,179(1):90
[11]Audy MC,Vacher P,Dufy B.17β-estradiol stumulates a rapid Ca2+influx in LNCaP human prostate cancer cells.Eur J Endocrinol,1996,135(3):367, 百拇医药