大鼠中枢神经系统肾母细胞瘤过度表达基因mRNA神经元的发育原位杂交与RT-PCR研究
作者:苏炳银 蔡文琴 张成岗** Perbal B***
单位:苏炳银 蔡文琴 张成岗* *Perbal B* * 第三军医大学组织学胚胎学教研室,重庆 400038;***Universite Paris Ⅶ,Paris France
关键词:肾母细胞瘤过度表达基因(nov)-mRNA;中枢神经系统;发育;大鼠
解剖学报990206 【摘要】 目的 研究大鼠CNS肾母细胞瘤过度表达基因(nov)mRNA神经元的发育。 方法 原位杂交组织化学和逆转录PCR。 结果 P0~P4:原位杂交方法最早检测到nov mRNA神经元是P0,P0~P4阳性信号均较弱,分布于脑桥和脊髓等。P5:丘脑部分核团和海马锥体细胞层观察到阳性神经元。P8:nov mRNA神经元数目增多,边缘系统及丘脑明显阳性;大脑皮质和下丘脑阳性较弱。P15:丘脑、下丘脑和大脑皮质nov mRNA神经元增多,其余核团稳定在P8水平。P30:在脑干观察到强烈的阳性信号,大脑皮质强阳性,海马、丘脑和下丘脑标记较强。P60:脑桥和延髓的标记仍然很强,大脑皮质、丘脑和下丘脑的阳性信号稳定在P30水平。P300:nov mRNA神经元显著减少,阳性信号明显减弱。逆转录PCR检测结果与原位杂交所得结果基本相符,在出生前2d检测到nov mRNA,其表达高峰出现在P30~P60之间,随之下降,P150和P300表达弱。 结论 nov基因与其他早期反应基因不同,其表达高峰不是在胚胎发育早期,而是在近性成熟时期,提示nov基因主要在神经系统发育、分化及功能活动中起作用。
, 百拇医药
DEVELOPMENT OF nov mRNA NEURONS IN CENTRAL NERVOUSSYSTEM OF THE RATIN SITU HYBRIDIZATION HISTOCHEMISTRY AND RT-PCR STUDY
Su Bingyin, Cai Wenqin△,Zhang Chenggang, Perbal B*
(Department of Histology and Embryology,The Third Military Medical University, Chongqing; *Université Paris Ⅶ, Paris, France)
【Abstract】 Objective Examine the development of nephroblastoma overexpressed gene (nov) mRNA neurons in the central nervous system (CNS) of rats. Methods In situ hibridization histochemistry (ISHH) using digoxigenin-labeled cRNA probes and reverse transcription-polymerase chain reaction (RT-PCR). Results In P0-P4,neurons expressing nov mRNA were detected firstly on P0 by ISHH. The hybridization signal was very weak in P0-P4, mainly distributed in facial nucleus, trigeminal nucleus, ventral and dorsal horn of spinal cord. On P5, positive neurons were found in some nucleus of thalamus and pyramidal layer of hippocampus. The number of nov mRNA neurons increased on P8. The positive neurons widely distributed in limbic system including hippocampus, amygdaloid nucleus, globus pallidus and lateral septal nucleus. The hybridization signal was strong in ventral posteromedial thalamic nucleus and ventral posterolateral thalamic nucleus, while they were weak in cerebral cortex and hypothalamus.On P15,the number of nov mRNA neurons increased in mediodorsal thalamic nucleus,posterior thalamic nucleus,dorsal hypothalamic nucleus,ventromedial hypothalamic nucleus,paraventricular hypothalamic nucleus and cerebral cortex.On P30,the strongest positive signal was found in facial nucleus,a group of vestibular nucleus,dorsal and ventral cochlear nucleus.Stronger positive signal was also observed in cerebral cortex.Hippocampus,thalamus and hypothalamus showed middle intensity of hybridization signal.On P60,the positive signal remained strong in pone and medulla.Stronger positive signal was detected in giganocellular reticular nucleus,suprafacial nucleus and dorsal cochlear nucleus.The positive signal in cerebral cortex,thalamus and hypothalamus was equal to the level of P30,on P300,the number of nov mRNA neurons reduced significantly,and the intensity of the positive signal was decreased remarkably,especially in cerebral cortex, hippocampus, amygdaloid nucleus and globus pallidus.The results of reverse transcription-polymerase chain reaction correlated well with the results of in situ hybridization histochemistry.nov mRNA was detected on E18.The peak of expression appeared during P30-P60,and reduced gradually on P150 and P300.Conclusion Our results show that nov gene is different from the other immediate early genes.The peak of expression is not at early stage of embryo,but during P30-P60,suggesting that nov gene may play an important role in differentiationof of CNS and maintain the function of CNS.
, 百拇医药
【Key words】 Nephroblastoma overexpressed gene(nov); Central nervous system; Development; Rat
最近,人们发现了几种高度相关的基因,即结缔组织生长因子(connective tissue growth factor,CTGF)、cyr61和肾母细胞瘤过度表达基因(nephroblastoma overexpressed gene,nov),它们合在一起称CCN家族,属于即刻-早期基因的一种类型,与c-fos等经典的即刻-早期基因不同[1,2]。
nov基因是法国Perbal B等新近克隆出来的,由于在鸡肾母细胞瘤中高表达,故命名为肾母细胞瘤过度表达基因,随后的研究表明它是原癌基因的一种。编码产物(NOV蛋白)是一种胰岛素样生长因子(insulin-like growth factor,IGF)结合蛋白(IGF-binding protein,IGFBP),通过调节IGFs与其受体结合而发挥作用[3~5]。用原位杂交组织化学方法证实在成年大鼠中枢神经系统中nov mRNA分布广泛,提示在大鼠中枢神经系统中nov基因可能起着重要的作用[6]。为了探讨nov基因在整个个体发生过程包括老年阶段的表达变化,本实验拟用原位杂交组织化学和逆转录PCR方法对大鼠中枢神经系统nov mRNA神经元的发育进行系统研究,并进而探讨nov基因与神经系统发育的相关性及对神经系统可能的调控作用。
, 百拇医药
材料和方法
1. 试剂
限制性内切酶XbaI、地高辛标记试剂盒(SP6/T7)、抗地高辛抗体(工作浓度1∶1 000)、碱性磷酸酶显色剂NBT/BCIP(工作浓度1∶100),PCR试剂盒均购自德国Boehringer Mannheim公司。
2. 材料
Wistar大鼠,体重200~230g,雌、雄分笼饲养数日,合笼后至检出阴栓为E0,出生时记为P0,用于PCR取材时直接断头,取大脑皮质,提取总RNA。原位杂交组织化学分别取P0~P5、P8、P15、P30、P60、P300,每组5只,断头取脑、脊髓于Zamboni液中固定10h,再浸入含30%蔗糖的Zamboni液中(4℃)至组织块沉入瓶底,30μm厚连续冰冻切片漂于Zamboni液中备用。
, 百拇医药 3. cRNA核酸探针的制备
含nov原癌基因重组质粒(pBX1.5)按氯化钙法程序操作[7]。经宿主菌HB101(本室吴康博士惠赠)扩增,按碱裂解法分离纯化,所扩增质粒(长度4.5kb)经限制性内切酶XbaI酶切为3.5kb和1kb两个片断。回收含T7启动子的3.5kb片断,采用地高辛标记系统体外转录成含624nt的cRNA探针。
4. 原位杂交组织化学染色程序
用漂浮法进行nov mRNA原位杂交组织化学染色[7]:0.1mol/L PBS(pH7.2)漂洗5min×3次,0.1mol/L 甘氨酸/PBS漂洗5min,0.3%Triton X-100/PBS漂洗25min,蛋白酶K(2mg/L)37℃孵育25min(于0.1mol/L Tris.5HCL pH8.0;0.05mol/L EDTA缓冲液中),4%多聚甲醛中漂洗5min, 0.1mol/L PBS漂洗5min×3次,浸入新配制的0.1mol/L Tris.5HCL(pH8.0,含0.25%乙酸酐)5min,2×SSC 10min,切片在含0.5mg/L地高辛标记的nov cRNA探针的杂交液中42℃反应24h后,4×SSC中漂洗15min,2×SSC(含RNAase A 20mg/L)中漂洗30min(37℃),1×SSC、0.5×SSC中各漂洗10min(37℃),0.05mol/L PBS漂洗10min×2次,将切片转入碱性磷酸酶标记的抗地高辛抗体中孵育4h(37℃),0.05mol/L PBS漂洗10min×3次,TSM1、TSM2中各漂洗10min×2次,继之用NBT/BCIP显色液显色[7],室温3~5h,然后裱片、脱水、DPX封片。
, 百拇医药
为了检验本实验的专一性和可靠性,作以下阴性对照。(1)将切片用RNA酶进行预处理后杂交;(2)以不含探针的杂交缓冲液取代含Dig-nov-cRNA探针的杂交液;(3)以正常羊血清代替羊抗Dig抗体-Ap复合物。
5.RT-PCR定量检测大鼠脑不同发育时期nov mRNA
分别取E18、P5、P15、P30、P60、P150和P300大鼠,每组3只。脑组织总RNA提取按文献方法进行[8],用1μg RNA加20μl的反应液(50mmol/L KCl,3mmol/L MgCl2,10mmol/L Tris.5HCl pH8.3,1mmol/L DTT,5μmol/L随机引物,500μmol/L 4dNTPS,26U RNASin,8U M-MLV反转录酶),37℃ 1h后,100℃加热5min使逆转录酶失活。根据人nov基因第5外显子序列设计引物,上游:5′CTAAGCTTTAGTCTT CAG CTC CAG C 3′,下游:5′ CTGAATTCCTCAAAGCCATCC ACC 3′。PCR的反应总体积为30μl,含上述逆转录反应液2μl,200μmol/L dNTPs,10×Buffer 2.5μl,96.6℃ 3min预变性后,94℃ 60s,55℃ 60s,72℃ 60s循环30次,反应产物置2%琼脂糖凝胶电泳,摄片,扫描半定量。
, 百拇医药
结 果
1. 大鼠中枢神经系统nov mRNA神经元的发育原位杂交组织化学结果
大鼠CNS不同发育阶段nov mRNA神经元的分布规律总结于附表,阳性标记强度分为++++(很强),+++(强),++(中),+(弱)。
附表 大鼠CNS中nov mRNA神经元的发育规律
Table The developmental distribution of nov mRNA neurons in the CNS of rats 发育阶段developmental
stage
颞叶皮质
temporal
, 百拇医药
cortex
海马CAl区
CAl field of
hippocampus
丘脑
thalamus
脑干
brain
stem
脊髓
spinal
cord
, 百拇医药 P0~P4
0
0
0
+
+
P5
+
+
+
+
+
P8
++
, 百拇医药
++
++
++
++
P15
+++
++
+++
+++
++
P30
++++
++
, http://www.100md.com +++
++++
+++
P60
++++
++
+++
++++
+++
P300
+
+
+
++
, 百拇医药
++
The density of nov mRNA neurons(0,+,++,+++,++++)are showed.
P0~P4:P0和P1仅延髓中央网状核和三叉神经脊束核有标记很弱的nov mRNA神经元。P2,在小脑的蒲肯野细胞层检测到阳性细胞。P3和P4在脑桥网状核、三叉神经脊束核、脊髓前后角开始出现标记较弱的nov mRNA神经元。
P5:除脑干的上述核团和脊髓前后角nov mRNA表达有所增强外,丘脑腹后内、外侧核、下丘脑出现标记神经元,海马锥体细胞层和大脑皮质内外锥体层观察到阳性神经元。
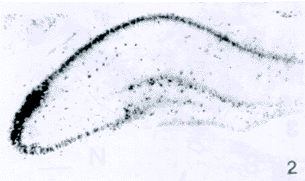
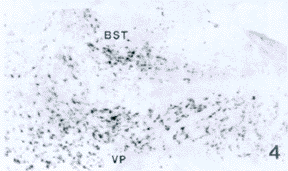
P8:nov mRNA神经元数目增多,阳性标记增强。在大脑皮质阳性细胞分布广泛,尤以颞叶皮质听区明显,内锥体层有较为明显的标记,其他各层标记较弱(图1)。nov mRNA神经元在边缘系统等脑区广泛分布,如海马的阳性细胞遍布于锥体细胞层,其他各层有散在的呈强阳性标记的神经元(图2);杏仁核簇,前脑前端尾壳核头部阳性细胞稀疏,前脑中部尾壳核尾部阳性细胞密集,使得尾壳核及位于其下外方的杏仁中央核成为明显的阳性核群;苍白球、腹侧苍白球以及位于其内侧的终纹床核,成为一个明显的阳性核群(图3,4);隔外侧核背部阳性细胞呈放射状分布。在下丘脑背侧区阳性细胞较少,散在分布。丘脑腹后外侧核与腹后内侧核检测到较为明显的阳性神经元。小脑蚓小叶及袢脚等的蒲肯野细胞有中等强度的阳性标记。脑干阳性神经元在分布上与P5相近而阳性标记增强。
, 百拇医药
P15:丘脑腹后内侧核、丘脑腹后外侧核阳性细胞呈非常明显的核团分布(图5),丘脑内侧背核和丘脑后核发现标记明显的阳性细胞,较之P8时下丘脑的核团表达明显增强,分布在下丘脑背侧核、下丘脑腹内侧核、下丘脑室旁核和结节外侧核。大脑皮质阳性信号增强,除内锥体层外,外锥体层细胞亦有较强表达。杏仁核簇和尾壳核表达稳定在P8水平。脑干的舌下神经前置核和巨细胞网状核亦出现明显的标记。总体来说,P15较之P8阳性细胞分布范围和表达强度均有所增强。
P30:脑干强烈的阳性信号出现在此期间内。脑桥面神经核分布着大而标记强的神经元,核团轮廓非常清楚,界限明显(图6)。前庭神经核群是脑桥中一个显著标记核群,界限分明,其中前庭神经外侧核神经元大而稀疏,前庭神经内侧核神经元小而密集,前庭上核细胞大小和密集程度介于两者之间(图7)。脑桥中另一个显著的阳性核群是蜗神经背侧核和蜗神经腹侧核,阳性细胞小而密集,邻近的三叉神经脊束核亦有明显的标记。在大脑皮质各区均有较强标记信号,尤以梨状前皮质明显,阳性细胞主要为内、外锥体层细胞。海马的CA1~CA4区均有中等强度的标记,为锥体层细胞,丘脑腹后内、外侧核、丘脑背核、下丘脑多数核团、有较强的表达。
, 百拇医药
P60:脑桥和延髓阳性标记仍然很强。脑桥巨细胞网状核有较大的阳性神经元,面神经上核观察到大型的阳性神经元,杂交信号很强,蜗神经背核,延髓舌下神经前置核,巨细胞网状核都有明显的阳性信号。小脑除蒲肯野细胞阳性标记增强(图8)外,小脑顶核,小脑外侧核出现阳性标记。大脑皮质、丘脑和下丘脑阳性信号稳定在P30水平。
P300:出生后10个月大鼠脑内nov mRNA神经元显著减少,阳性信号明显减弱。大脑皮质仅内锥体层尚有表达,海马、杏仁核簇、苍白球等nov mRNA表达下降尤为突出,在脑桥面神经核nov mRNA神经元数目没有减少,但阳性信号明显减弱。脊髓前角阳性信号仍保持一定水平。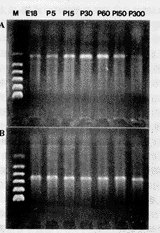
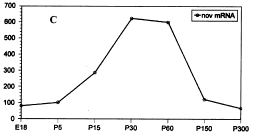
图9 RT-PCR检测结果:a.不同发育时期nov mRNA的表达b.β-actin表达在各标本基本一致,以为参照 c.nov mRNA表达的图像分析
, http://www.100md.com
Fig.9 Analysis of nov mRNA expression by RT-PCR a.nov mRNA expression in different stage b.β-actin mRNA expression was used to ensure equal taking of RNA sample c.Image analysis of nov mRNA expression
2. 大鼠脑发育过程中nov mRNA表达变化RT-PCR结果
逆转录PCR检测结果与原位杂交所得结果基本相符,在出生前2d检测到nov mRNA的表达,其表达高峰出现在P30~P60之间,随之下降,P150和P300表达弱(图9a)。7个时相点同时重复3次,经t检验绘成曲线图(图9c)。
, 百拇医药
图1 P8颞叶皮质听区nov mRNA神经元。内锥体层(IPL)阳性标记明显,其他各层标记较弱 ×40
Fig.1 nov mRNA neurons in temporal cortex,auditory area on P8.Relatively stronger hybridization signal was localized in internal pyramidal layer(IPL).The other layers showed weak signal. ×40
图2 P8 nov mRNA神经元遍布于海马锥体细胞层 ×40
Fig.2 nov mRNA neurons were widely distributed in pyramidal layer of hippocampus on P8. ×40
, 百拇医药
图3 P8苍白球 nov mRNA神经元 ×100
Fig.3 nov mRNA neurons in globus pallidus on P8. ×100
图4 P8腹侧苍白球(VP)和终纹床核(BST)nov mRNA神经元 ×40
Fig.4 nov mRNA neurons in ventral pallidum(VP) and bed nucleus of the stria terminalis (BST) on P8. ×40

图5 P15丘脑腹后外侧核(VPL)与腹后内侧核(VPM)nov mRNA神经元 ×40
, http://www.100md.com
Fig.5 nov mRNA neurons with strong hybridization signal in ventral posteromidial thalamic nucleus (VPM) and ventral posterolateral thalamic nucleus(VPL) on P15. ×40
图6 P30脑桥面神经核分布着大而阳性标记强的nov mRNA神经元 ×40
Fig.6 Strong labeled nov mRNA neurons distributed in facial nucleus are large insize. ×40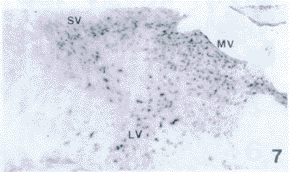

图7 P30由前庭神经外侧核(LV)、前庭神经内侧核(MV)和前庭上核(SV)组成的阳性核群 ×40
, 百拇医药
Fig.7 Lateral vestibular nucleus(LV),medial vestibular nucleus(MV) and superior vestibular(SV) are the positive nucleus group on P30. ×40
图8 P60呈nov mRNA强阳性标记的小脑蒲肯野细胞层 ×40
Fig.8 Purkinje cell layer with strong hybridization signal on P60.×40
讨 论
本研究用原位杂交组织化学和逆转录PCR技术从定性和定量两个方面研究了大鼠中枢神经系统nov mRNA神经元的发育。结果显示,大鼠出生后(P0)首先在脑干观察到nov mRNA神经元的分布,继之分布范围扩大,阳性信号增强。在P30和P60时观察到nov mRNA阳性神经元分布范围最广,阳性信号最强,而后逐渐降低。P300时表达量很低。在人胚胎4个月时已观察到nov mRNA神经元,出现的时间 比在大鼠要早[9]。Joliot等[10]用Northern印迹杂交的方法检测到在成年鸡肺和脑组织中存在大量的nov mRNA,但在鸡胚脑组织未检测到nov mRNA的表达,证实在进化上越高等的动物,nov mRNA神经元发育越早。逆转录PCR检测到nov mRNA表达的时间比原位杂交检测到的稍早,即出生前2d已检测到nov mRNA的表达。推测一方面可能是由于PCR的扩增起了信号放大作用;另一方面可能是大鼠生前的脑组织只能用贴片法进行原位杂交,不如漂片法(切片漂浮在液体里,杂交过程在ependoff管中完成)敏感,致使检出的时间比PCR稍后。但总体上是相符的,表达高峰都出现在P30~P60之间。原位杂交和逆转录PCR的结合,从定性和定量两方面研究了大鼠中枢神经系统nov mRNA神经元的发育和分布,两方面的数据互为印证和补充。先前的研究观察到在成年大鼠中枢神经系统nov mRNA分布广泛[6],本研究所得结果与之相符,表达高峰出现在近成年的P30~P60之间。
, 百拇医药
组织细胞由于受生长因子或癌基因等的刺激可在短短的几分钟引起一系列基因的表达[11],这些即刻-早期反应基因的表达产物多数是细胞核内的DNA调节蛋白,或者叫转录因子如c-fos、c-jun等,另一类即早基因的表达产物包括分泌到细胞外蛋白,主要参与一系列复杂生物学过程,如分化和伤口愈合等[12],nov基因就是后一家族的早期反应基因,这个家族另外两个成员Cyr61和CTGF都是生长相关或与细胞分化有关的因子,同属CCN家族成员(ctgf、cyr61和nov)。我们熟悉的第一类早期反应基因c-fos等在胚胎发育的早期表达量高,出生后及成年时期只有非常低的表达。而nov基因则不同,近成年时在大鼠中枢神经系统中出现表达的高峰,并在长时期内稳定在较高水平,提示nov基因可能在神经细胞分化及维持神经系统生理功能中起重要作用。此结果为我们深入认识即早基因提供了一个新的观点。由于CCN家族成员氨基酸序列的高度同源性,它们很可能有非常相似的功能[13]。因此,nov mRNA神经元在大鼠中枢神经系统的发育模式,为研究Cyr61及CTGF提供了有价值的参考资料。
, http://www.100md.com
近年来,PCR逐渐代替Northern检测mRNA的表达。在mRNA表达量低时,Northern无法检测,PCR的扩增可使灵敏度提高。同时,由于内参照和外参照的应用,使PCR的半定量为大家所接受。本研究的PCR结果为原位杂交组织化学研究nov基因在大鼠中枢神经系统的发育提供了有力的佐证。
九五全军科研基金(No.96M090)和十五年全军科研基金资助课题 * *现在军事医学科学院二所三室
参考文献
[1]O'brien TP,Yang GP,Sanders L,et al.Expression of cyr61,a growth factor-inducible immediate-early gene.Mol Cell Biol,1990,10(7):3569
[2]Bradham DM,Igarashi A,Potter RL,et al.Connective tissue growth factor:a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10.The Journal of Cell Biology,1991,114(6):1285
, 百拇医药
[3]Martinerie C,Viegas-pequignot E,Guenard I,et al.Physical mapping of human loci homologous to the chicken nov proto-oncogene.Oncogene,1992,7(12):2529
[4]Martinerie C,Huff V,Joubert I,et al.Structural analysis of the human nov proto-oncogene and expression in Wilms′ tumors.Oncogene,1994,9(9):2729
[5]Perbal B.Contribution of MAV-1-induced nephroblastoma to the study of genes involved in human Wilms′ tumor development.Crit Rev Oncog,1994,5(6):589
, 百拇医药
[6]苏炳银,蔡文琴,张成岗,等.肾母细胞瘤过度表达基因mRNA在成年大鼠中枢神经系统的原位杂交定位.解剖学报,1998,29(2):151
[7]蔡文琴,王伯云主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川科学技术出版社,1994:354~432
[8]Sambrook J,Fritsch EF,Maniatis T.Molecular cloning,A laboratory manual.2nd ed. New York:Cold Spring Harbor Laboratory Press USA,1989:343-362
[9]苏炳银,蔡文琴,张成岗,等.人胚胎中枢神经系统nov mRNA神经元的发育——原位杂交研究,解剖学报,1999,30(1):48
[10]Joliot V,Martinerie C,Dambrine G,et al.Proviral rearragements and overexpression of a new cellular gene(nov)in myeloblastosis-associated virus type 1-induced nephroblastomas.Molecular and Cellular Biology,1992,12(1):10
, http://www.100md.com
[11]Lau LF,Nathans D.Genes induced by serum growth factor.In:Cohen P,Foulkes JG(eds).The Hormonal Regulation of Gene Transcription.Amsterdam:Elsevier,1991:165-201
[12]Ryseck R P,Macdonal-Brave H,Mattei M-G,et al.Structure,mapping,and expression of fisp-12,a growth factor-inducible gene encoding a secreted cystein-rich protein.Cell Growth and Differentiation,1991,2:225
[13]Yang GP,Lau LF.Cyr61,product of a growth factor-inducible immediate early gene,is associated with the extracellular matrix and the cell surface.Cell Growth and Differentiation,1991,2:351, 百拇医药(苏炳银 蔡文琴 张成岗** Perbal B***)
单位:苏炳银 蔡文琴 张成岗* *Perbal B* * 第三军医大学组织学胚胎学教研室,重庆 400038;***Universite Paris Ⅶ,Paris France
关键词:肾母细胞瘤过度表达基因(nov)-mRNA;中枢神经系统;发育;大鼠
解剖学报990206 【摘要】 目的 研究大鼠CNS肾母细胞瘤过度表达基因(nov)mRNA神经元的发育。 方法 原位杂交组织化学和逆转录PCR。 结果 P0~P4:原位杂交方法最早检测到nov mRNA神经元是P0,P0~P4阳性信号均较弱,分布于脑桥和脊髓等。P5:丘脑部分核团和海马锥体细胞层观察到阳性神经元。P8:nov mRNA神经元数目增多,边缘系统及丘脑明显阳性;大脑皮质和下丘脑阳性较弱。P15:丘脑、下丘脑和大脑皮质nov mRNA神经元增多,其余核团稳定在P8水平。P30:在脑干观察到强烈的阳性信号,大脑皮质强阳性,海马、丘脑和下丘脑标记较强。P60:脑桥和延髓的标记仍然很强,大脑皮质、丘脑和下丘脑的阳性信号稳定在P30水平。P300:nov mRNA神经元显著减少,阳性信号明显减弱。逆转录PCR检测结果与原位杂交所得结果基本相符,在出生前2d检测到nov mRNA,其表达高峰出现在P30~P60之间,随之下降,P150和P300表达弱。 结论 nov基因与其他早期反应基因不同,其表达高峰不是在胚胎发育早期,而是在近性成熟时期,提示nov基因主要在神经系统发育、分化及功能活动中起作用。
, 百拇医药
DEVELOPMENT OF nov mRNA NEURONS IN CENTRAL NERVOUSSYSTEM OF THE RATIN SITU HYBRIDIZATION HISTOCHEMISTRY AND RT-PCR STUDY
Su Bingyin, Cai Wenqin△,Zhang Chenggang, Perbal B*
(Department of Histology and Embryology,The Third Military Medical University, Chongqing; *Université Paris Ⅶ, Paris, France)
【Abstract】 Objective Examine the development of nephroblastoma overexpressed gene (nov) mRNA neurons in the central nervous system (CNS) of rats. Methods In situ hibridization histochemistry (ISHH) using digoxigenin-labeled cRNA probes and reverse transcription-polymerase chain reaction (RT-PCR). Results In P0-P4,neurons expressing nov mRNA were detected firstly on P0 by ISHH. The hybridization signal was very weak in P0-P4, mainly distributed in facial nucleus, trigeminal nucleus, ventral and dorsal horn of spinal cord. On P5, positive neurons were found in some nucleus of thalamus and pyramidal layer of hippocampus. The number of nov mRNA neurons increased on P8. The positive neurons widely distributed in limbic system including hippocampus, amygdaloid nucleus, globus pallidus and lateral septal nucleus. The hybridization signal was strong in ventral posteromedial thalamic nucleus and ventral posterolateral thalamic nucleus, while they were weak in cerebral cortex and hypothalamus.On P15,the number of nov mRNA neurons increased in mediodorsal thalamic nucleus,posterior thalamic nucleus,dorsal hypothalamic nucleus,ventromedial hypothalamic nucleus,paraventricular hypothalamic nucleus and cerebral cortex.On P30,the strongest positive signal was found in facial nucleus,a group of vestibular nucleus,dorsal and ventral cochlear nucleus.Stronger positive signal was also observed in cerebral cortex.Hippocampus,thalamus and hypothalamus showed middle intensity of hybridization signal.On P60,the positive signal remained strong in pone and medulla.Stronger positive signal was detected in giganocellular reticular nucleus,suprafacial nucleus and dorsal cochlear nucleus.The positive signal in cerebral cortex,thalamus and hypothalamus was equal to the level of P30,on P300,the number of nov mRNA neurons reduced significantly,and the intensity of the positive signal was decreased remarkably,especially in cerebral cortex, hippocampus, amygdaloid nucleus and globus pallidus.The results of reverse transcription-polymerase chain reaction correlated well with the results of in situ hybridization histochemistry.nov mRNA was detected on E18.The peak of expression appeared during P30-P60,and reduced gradually on P150 and P300.Conclusion Our results show that nov gene is different from the other immediate early genes.The peak of expression is not at early stage of embryo,but during P30-P60,suggesting that nov gene may play an important role in differentiationof of CNS and maintain the function of CNS.
, 百拇医药
【Key words】 Nephroblastoma overexpressed gene(nov); Central nervous system; Development; Rat
最近,人们发现了几种高度相关的基因,即结缔组织生长因子(connective tissue growth factor,CTGF)、cyr61和肾母细胞瘤过度表达基因(nephroblastoma overexpressed gene,nov),它们合在一起称CCN家族,属于即刻-早期基因的一种类型,与c-fos等经典的即刻-早期基因不同[1,2]。
nov基因是法国Perbal B等新近克隆出来的,由于在鸡肾母细胞瘤中高表达,故命名为肾母细胞瘤过度表达基因,随后的研究表明它是原癌基因的一种。编码产物(NOV蛋白)是一种胰岛素样生长因子(insulin-like growth factor,IGF)结合蛋白(IGF-binding protein,IGFBP),通过调节IGFs与其受体结合而发挥作用[3~5]。用原位杂交组织化学方法证实在成年大鼠中枢神经系统中nov mRNA分布广泛,提示在大鼠中枢神经系统中nov基因可能起着重要的作用[6]。为了探讨nov基因在整个个体发生过程包括老年阶段的表达变化,本实验拟用原位杂交组织化学和逆转录PCR方法对大鼠中枢神经系统nov mRNA神经元的发育进行系统研究,并进而探讨nov基因与神经系统发育的相关性及对神经系统可能的调控作用。
, 百拇医药
材料和方法
1. 试剂
限制性内切酶XbaI、地高辛标记试剂盒(SP6/T7)、抗地高辛抗体(工作浓度1∶1 000)、碱性磷酸酶显色剂NBT/BCIP(工作浓度1∶100),PCR试剂盒均购自德国Boehringer Mannheim公司。
2. 材料
Wistar大鼠,体重200~230g,雌、雄分笼饲养数日,合笼后至检出阴栓为E0,出生时记为P0,用于PCR取材时直接断头,取大脑皮质,提取总RNA。原位杂交组织化学分别取P0~P5、P8、P15、P30、P60、P300,每组5只,断头取脑、脊髓于Zamboni液中固定10h,再浸入含30%蔗糖的Zamboni液中(4℃)至组织块沉入瓶底,30μm厚连续冰冻切片漂于Zamboni液中备用。
, 百拇医药 3. cRNA核酸探针的制备
含nov原癌基因重组质粒(pBX1.5)按氯化钙法程序操作[7]。经宿主菌HB101(本室吴康博士惠赠)扩增,按碱裂解法分离纯化,所扩增质粒(长度4.5kb)经限制性内切酶XbaI酶切为3.5kb和1kb两个片断。回收含T7启动子的3.5kb片断,采用地高辛标记系统体外转录成含624nt的cRNA探针。
4. 原位杂交组织化学染色程序
用漂浮法进行nov mRNA原位杂交组织化学染色[7]:0.1mol/L PBS(pH7.2)漂洗5min×3次,0.1mol/L 甘氨酸/PBS漂洗5min,0.3%Triton X-100/PBS漂洗25min,蛋白酶K(2mg/L)37℃孵育25min(于0.1mol/L Tris.5HCL pH8.0;0.05mol/L EDTA缓冲液中),4%多聚甲醛中漂洗5min, 0.1mol/L PBS漂洗5min×3次,浸入新配制的0.1mol/L Tris.5HCL(pH8.0,含0.25%乙酸酐)5min,2×SSC 10min,切片在含0.5mg/L地高辛标记的nov cRNA探针的杂交液中42℃反应24h后,4×SSC中漂洗15min,2×SSC(含RNAase A 20mg/L)中漂洗30min(37℃),1×SSC、0.5×SSC中各漂洗10min(37℃),0.05mol/L PBS漂洗10min×2次,将切片转入碱性磷酸酶标记的抗地高辛抗体中孵育4h(37℃),0.05mol/L PBS漂洗10min×3次,TSM1、TSM2中各漂洗10min×2次,继之用NBT/BCIP显色液显色[7],室温3~5h,然后裱片、脱水、DPX封片。
, 百拇医药
为了检验本实验的专一性和可靠性,作以下阴性对照。(1)将切片用RNA酶进行预处理后杂交;(2)以不含探针的杂交缓冲液取代含Dig-nov-cRNA探针的杂交液;(3)以正常羊血清代替羊抗Dig抗体-Ap复合物。
5.RT-PCR定量检测大鼠脑不同发育时期nov mRNA
分别取E18、P5、P15、P30、P60、P150和P300大鼠,每组3只。脑组织总RNA提取按文献方法进行[8],用1μg RNA加20μl的反应液(50mmol/L KCl,3mmol/L MgCl2,10mmol/L Tris.5HCl pH8.3,1mmol/L DTT,5μmol/L随机引物,500μmol/L 4dNTPS,26U RNASin,8U M-MLV反转录酶),37℃ 1h后,100℃加热5min使逆转录酶失活。根据人nov基因第5外显子序列设计引物,上游:5′CTAAGCTTTAGTCTT CAG CTC CAG C 3′,下游:5′ CTGAATTCCTCAAAGCCATCC ACC 3′。PCR的反应总体积为30μl,含上述逆转录反应液2μl,200μmol/L dNTPs,10×Buffer 2.5μl,96.6℃ 3min预变性后,94℃ 60s,55℃ 60s,72℃ 60s循环30次,反应产物置2%琼脂糖凝胶电泳,摄片,扫描半定量。
, 百拇医药
结 果
1. 大鼠中枢神经系统nov mRNA神经元的发育原位杂交组织化学结果
大鼠CNS不同发育阶段nov mRNA神经元的分布规律总结于附表,阳性标记强度分为++++(很强),+++(强),++(中),+(弱)。
附表 大鼠CNS中nov mRNA神经元的发育规律
Table The developmental distribution of nov mRNA neurons in the CNS of rats 发育阶段developmental
stage
颞叶皮质
temporal
, 百拇医药
cortex
海马CAl区
CAl field of
hippocampus
丘脑
thalamus
脑干
brain
stem
脊髓
spinal
cord
, 百拇医药 P0~P4
0
0
0
+
+
P5
+
+
+
+
+
P8
++
, 百拇医药
++
++
++
++
P15
+++
++
+++
+++
++
P30
++++
++
, http://www.100md.com +++
++++
+++
P60
++++
++
+++
++++
+++
P300
+
+
+
++
, 百拇医药
++
The density of nov mRNA neurons(0,+,++,+++,++++)are showed.
P0~P4:P0和P1仅延髓中央网状核和三叉神经脊束核有标记很弱的nov mRNA神经元。P2,在小脑的蒲肯野细胞层检测到阳性细胞。P3和P4在脑桥网状核、三叉神经脊束核、脊髓前后角开始出现标记较弱的nov mRNA神经元。
P5:除脑干的上述核团和脊髓前后角nov mRNA表达有所增强外,丘脑腹后内、外侧核、下丘脑出现标记神经元,海马锥体细胞层和大脑皮质内外锥体层观察到阳性神经元。
P8:nov mRNA神经元数目增多,阳性标记增强。在大脑皮质阳性细胞分布广泛,尤以颞叶皮质听区明显,内锥体层有较为明显的标记,其他各层标记较弱(图1)。nov mRNA神经元在边缘系统等脑区广泛分布,如海马的阳性细胞遍布于锥体细胞层,其他各层有散在的呈强阳性标记的神经元(图2);杏仁核簇,前脑前端尾壳核头部阳性细胞稀疏,前脑中部尾壳核尾部阳性细胞密集,使得尾壳核及位于其下外方的杏仁中央核成为明显的阳性核群;苍白球、腹侧苍白球以及位于其内侧的终纹床核,成为一个明显的阳性核群(图3,4);隔外侧核背部阳性细胞呈放射状分布。在下丘脑背侧区阳性细胞较少,散在分布。丘脑腹后外侧核与腹后内侧核检测到较为明显的阳性神经元。小脑蚓小叶及袢脚等的蒲肯野细胞有中等强度的阳性标记。脑干阳性神经元在分布上与P5相近而阳性标记增强。
, 百拇医药
P15:丘脑腹后内侧核、丘脑腹后外侧核阳性细胞呈非常明显的核团分布(图5),丘脑内侧背核和丘脑后核发现标记明显的阳性细胞,较之P8时下丘脑的核团表达明显增强,分布在下丘脑背侧核、下丘脑腹内侧核、下丘脑室旁核和结节外侧核。大脑皮质阳性信号增强,除内锥体层外,外锥体层细胞亦有较强表达。杏仁核簇和尾壳核表达稳定在P8水平。脑干的舌下神经前置核和巨细胞网状核亦出现明显的标记。总体来说,P15较之P8阳性细胞分布范围和表达强度均有所增强。
P30:脑干强烈的阳性信号出现在此期间内。脑桥面神经核分布着大而标记强的神经元,核团轮廓非常清楚,界限明显(图6)。前庭神经核群是脑桥中一个显著标记核群,界限分明,其中前庭神经外侧核神经元大而稀疏,前庭神经内侧核神经元小而密集,前庭上核细胞大小和密集程度介于两者之间(图7)。脑桥中另一个显著的阳性核群是蜗神经背侧核和蜗神经腹侧核,阳性细胞小而密集,邻近的三叉神经脊束核亦有明显的标记。在大脑皮质各区均有较强标记信号,尤以梨状前皮质明显,阳性细胞主要为内、外锥体层细胞。海马的CA1~CA4区均有中等强度的标记,为锥体层细胞,丘脑腹后内、外侧核、丘脑背核、下丘脑多数核团、有较强的表达。
, 百拇医药
P60:脑桥和延髓阳性标记仍然很强。脑桥巨细胞网状核有较大的阳性神经元,面神经上核观察到大型的阳性神经元,杂交信号很强,蜗神经背核,延髓舌下神经前置核,巨细胞网状核都有明显的阳性信号。小脑除蒲肯野细胞阳性标记增强(图8)外,小脑顶核,小脑外侧核出现阳性标记。大脑皮质、丘脑和下丘脑阳性信号稳定在P30水平。
P300:出生后10个月大鼠脑内nov mRNA神经元显著减少,阳性信号明显减弱。大脑皮质仅内锥体层尚有表达,海马、杏仁核簇、苍白球等nov mRNA表达下降尤为突出,在脑桥面神经核nov mRNA神经元数目没有减少,但阳性信号明显减弱。脊髓前角阳性信号仍保持一定水平。


图9 RT-PCR检测结果:a.不同发育时期nov mRNA的表达b.β-actin表达在各标本基本一致,以为参照 c.nov mRNA表达的图像分析
, http://www.100md.com
Fig.9 Analysis of nov mRNA expression by RT-PCR a.nov mRNA expression in different stage b.β-actin mRNA expression was used to ensure equal taking of RNA sample c.Image analysis of nov mRNA expression
2. 大鼠脑发育过程中nov mRNA表达变化RT-PCR结果
逆转录PCR检测结果与原位杂交所得结果基本相符,在出生前2d检测到nov mRNA的表达,其表达高峰出现在P30~P60之间,随之下降,P150和P300表达弱(图9a)。7个时相点同时重复3次,经t检验绘成曲线图(图9c)。


, 百拇医药
图1 P8颞叶皮质听区nov mRNA神经元。内锥体层(IPL)阳性标记明显,其他各层标记较弱 ×40
Fig.1 nov mRNA neurons in temporal cortex,auditory area on P8.Relatively stronger hybridization signal was localized in internal pyramidal layer(IPL).The other layers showed weak signal. ×40
图2 P8 nov mRNA神经元遍布于海马锥体细胞层 ×40
Fig.2 nov mRNA neurons were widely distributed in pyramidal layer of hippocampus on P8. ×40


, 百拇医药
图3 P8苍白球 nov mRNA神经元 ×100
Fig.3 nov mRNA neurons in globus pallidus on P8. ×100
图4 P8腹侧苍白球(VP)和终纹床核(BST)nov mRNA神经元 ×40
Fig.4 nov mRNA neurons in ventral pallidum(VP) and bed nucleus of the stria terminalis (BST) on P8. ×40


图5 P15丘脑腹后外侧核(VPL)与腹后内侧核(VPM)nov mRNA神经元 ×40
, http://www.100md.com
Fig.5 nov mRNA neurons with strong hybridization signal in ventral posteromidial thalamic nucleus (VPM) and ventral posterolateral thalamic nucleus(VPL) on P15. ×40
图6 P30脑桥面神经核分布着大而阳性标记强的nov mRNA神经元 ×40
Fig.6 Strong labeled nov mRNA neurons distributed in facial nucleus are large insize. ×40


图7 P30由前庭神经外侧核(LV)、前庭神经内侧核(MV)和前庭上核(SV)组成的阳性核群 ×40
, 百拇医药
Fig.7 Lateral vestibular nucleus(LV),medial vestibular nucleus(MV) and superior vestibular(SV) are the positive nucleus group on P30. ×40
图8 P60呈nov mRNA强阳性标记的小脑蒲肯野细胞层 ×40
Fig.8 Purkinje cell layer with strong hybridization signal on P60.×40
讨 论
本研究用原位杂交组织化学和逆转录PCR技术从定性和定量两个方面研究了大鼠中枢神经系统nov mRNA神经元的发育。结果显示,大鼠出生后(P0)首先在脑干观察到nov mRNA神经元的分布,继之分布范围扩大,阳性信号增强。在P30和P60时观察到nov mRNA阳性神经元分布范围最广,阳性信号最强,而后逐渐降低。P300时表达量很低。在人胚胎4个月时已观察到nov mRNA神经元,出现的时间 比在大鼠要早[9]。Joliot等[10]用Northern印迹杂交的方法检测到在成年鸡肺和脑组织中存在大量的nov mRNA,但在鸡胚脑组织未检测到nov mRNA的表达,证实在进化上越高等的动物,nov mRNA神经元发育越早。逆转录PCR检测到nov mRNA表达的时间比原位杂交检测到的稍早,即出生前2d已检测到nov mRNA的表达。推测一方面可能是由于PCR的扩增起了信号放大作用;另一方面可能是大鼠生前的脑组织只能用贴片法进行原位杂交,不如漂片法(切片漂浮在液体里,杂交过程在ependoff管中完成)敏感,致使检出的时间比PCR稍后。但总体上是相符的,表达高峰都出现在P30~P60之间。原位杂交和逆转录PCR的结合,从定性和定量两方面研究了大鼠中枢神经系统nov mRNA神经元的发育和分布,两方面的数据互为印证和补充。先前的研究观察到在成年大鼠中枢神经系统nov mRNA分布广泛[6],本研究所得结果与之相符,表达高峰出现在近成年的P30~P60之间。
, 百拇医药
组织细胞由于受生长因子或癌基因等的刺激可在短短的几分钟引起一系列基因的表达[11],这些即刻-早期反应基因的表达产物多数是细胞核内的DNA调节蛋白,或者叫转录因子如c-fos、c-jun等,另一类即早基因的表达产物包括分泌到细胞外蛋白,主要参与一系列复杂生物学过程,如分化和伤口愈合等[12],nov基因就是后一家族的早期反应基因,这个家族另外两个成员Cyr61和CTGF都是生长相关或与细胞分化有关的因子,同属CCN家族成员(ctgf、cyr61和nov)。我们熟悉的第一类早期反应基因c-fos等在胚胎发育的早期表达量高,出生后及成年时期只有非常低的表达。而nov基因则不同,近成年时在大鼠中枢神经系统中出现表达的高峰,并在长时期内稳定在较高水平,提示nov基因可能在神经细胞分化及维持神经系统生理功能中起重要作用。此结果为我们深入认识即早基因提供了一个新的观点。由于CCN家族成员氨基酸序列的高度同源性,它们很可能有非常相似的功能[13]。因此,nov mRNA神经元在大鼠中枢神经系统的发育模式,为研究Cyr61及CTGF提供了有价值的参考资料。
, http://www.100md.com
近年来,PCR逐渐代替Northern检测mRNA的表达。在mRNA表达量低时,Northern无法检测,PCR的扩增可使灵敏度提高。同时,由于内参照和外参照的应用,使PCR的半定量为大家所接受。本研究的PCR结果为原位杂交组织化学研究nov基因在大鼠中枢神经系统的发育提供了有力的佐证。
九五全军科研基金(No.96M090)和十五年全军科研基金资助课题 * *现在军事医学科学院二所三室
参考文献
[1]O'brien TP,Yang GP,Sanders L,et al.Expression of cyr61,a growth factor-inducible immediate-early gene.Mol Cell Biol,1990,10(7):3569
[2]Bradham DM,Igarashi A,Potter RL,et al.Connective tissue growth factor:a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10.The Journal of Cell Biology,1991,114(6):1285
, 百拇医药
[3]Martinerie C,Viegas-pequignot E,Guenard I,et al.Physical mapping of human loci homologous to the chicken nov proto-oncogene.Oncogene,1992,7(12):2529
[4]Martinerie C,Huff V,Joubert I,et al.Structural analysis of the human nov proto-oncogene and expression in Wilms′ tumors.Oncogene,1994,9(9):2729
[5]Perbal B.Contribution of MAV-1-induced nephroblastoma to the study of genes involved in human Wilms′ tumor development.Crit Rev Oncog,1994,5(6):589
, 百拇医药
[6]苏炳银,蔡文琴,张成岗,等.肾母细胞瘤过度表达基因mRNA在成年大鼠中枢神经系统的原位杂交定位.解剖学报,1998,29(2):151
[7]蔡文琴,王伯云主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川科学技术出版社,1994:354~432
[8]Sambrook J,Fritsch EF,Maniatis T.Molecular cloning,A laboratory manual.2nd ed. New York:Cold Spring Harbor Laboratory Press USA,1989:343-362
[9]苏炳银,蔡文琴,张成岗,等.人胚胎中枢神经系统nov mRNA神经元的发育——原位杂交研究,解剖学报,1999,30(1):48
[10]Joliot V,Martinerie C,Dambrine G,et al.Proviral rearragements and overexpression of a new cellular gene(nov)in myeloblastosis-associated virus type 1-induced nephroblastomas.Molecular and Cellular Biology,1992,12(1):10
, http://www.100md.com
[11]Lau LF,Nathans D.Genes induced by serum growth factor.In:Cohen P,Foulkes JG(eds).The Hormonal Regulation of Gene Transcription.Amsterdam:Elsevier,1991:165-201
[12]Ryseck R P,Macdonal-Brave H,Mattei M-G,et al.Structure,mapping,and expression of fisp-12,a growth factor-inducible gene encoding a secreted cystein-rich protein.Cell Growth and Differentiation,1991,2:225
[13]Yang GP,Lau LF.Cyr61,product of a growth factor-inducible immediate early gene,is associated with the extracellular matrix and the cell surface.Cell Growth and Differentiation,1991,2:351, 百拇医药(苏炳银 蔡文琴 张成岗** Perbal B***)