听源性惊厥易感大鼠中脑导水管周围灰质内突触素的表达
作者:刘猛 许鹿希
单位:刘猛 许鹿希(北京医科大学解剖学系,北京 100083)
关键词:突触素;导水管周围灰质;听源性惊厥;点燃;大鼠
解剖学报990306
【摘要】 目的 分析正常及点燃后听源性惊厥易感大鼠中脑导水管周围灰质(PAG)内突触密度的变化情况。方法 用免疫细胞化学方法和计算机图像分析技术。 结果 正常和点燃后听源性惊厥易感大鼠PAG内突触素P38免疫反应产物的校正光密度值(COD)均显著高于正常Wistar大鼠;点燃后听源性惊厥易感大鼠PAG背侧及背外侧两个亚区内突触素P38免疫反应产物的COD值显著高于正常听源性惊厥易感大鼠。 结论 PAG内突触密度的改变与听源性惊厥及其点燃过程密切相关。
EXPRESSION OF SYNAPTOPHYSIN IN PERIAQUEDUCTAL GRAY
, http://www.100md.com
IN AUDIOGENIC SEIZURES-PRONE RATS
Liu Meng, Xu LuxiΔ
(Department of Anatomy, Beijing Medical University, Beijing)
【Abstract】 Objective To find out the changes of synaptic density in the periaqueductalgray(PAG) of the naive and kindled audiogenic seizures-prone rats. Methods Immunocytochemistry and computer image analysis technique were used.Results The value of corrected optical density (COD) of the synaptophysin P38 immunoreactivity in the PAG of the naive and kindled audiogenic seizures-prone rats were significantly higher than that of the normal Wistar rats. The COD value in the dorsal and dorsolateral subdivisions of the PAG in the kindled audiogenic seizures-prone rats were significantly higher than that in the naive audiogenc seizures-prone rats. Conclusion Changes of synaptic density in the PAG may be related to the susceptibility of audiogenic seizures and its kindling process.
, 百拇医药
【Key words】 Synaptophysin; Periaqueductal gray; Audiogenic seizures; Kindling; Rat
突触素(synaptophysin)又称P38,是一种分子量为38kD的酸性钙结合糖蛋白,它作为一种内在膜蛋白,几乎存在于所有神经终末的突触前成分内,并选择性地分布在小突触囊泡膜的胞质面[1]。突触素P38参与Ca2+-依赖性的神经递质释放过程,并且与其他囊泡蛋白共同参与短时程及长时程突触可塑性的调节[2]。同时,P38作为突触囊泡的一种特异性标志蛋白,其数量和分布密度可间接反映突触的密度[3]。据此,本实验以P38免疫细胞化学反应的强度为指标,间接地对听源性惊厥易感大鼠(P77PMC)中脑导水管周围灰质(periaqueductal gray, PAG)各亚区突触的分布情况进行了研究。用光镜观察PAG各节段各亚区切片上突触密度的变化,以期在光镜水平上了解PAG在惊厥状态下超微结构的某些变化。
, 百拇医药
材料和方法
1. 建立听源性惊厥点燃模型
采用听源性惊厥易感大鼠(P77PMC,选自Wistar品系,由北京医科大学实验动物中心培育),每天给予1次铃声刺激(106dB,60s)以诱发P77PMC大鼠强直-阵挛性听源性惊厥发作,连续刺激40d,筛选其中惊厥发作超过20次者作为点燃大鼠。
2. 动物分组及切片制备
实验动物均为成年雄性,体重350~450g。共分3组,即NW组(normal Wistar rats,n=4):正常Wistar大鼠;NP组(naive P77PMC rats,n=4):未受处理的听源性惊厥易感大鼠;KP组(kindled P77PMC rats,n=4):听源性惊厥点燃后的P77PMC大鼠。
3组动物以复合麻醉剂(chloropent, 3 ml/kg)腹腔注射麻醉后,经左心室-升主动脉插管,室温下灌注生理盐水100~150 ml,随后灌注含4%多聚甲醛的0.1 mol/L磷酸盐缓冲液(pH7.4,4℃)300ml。脑组织于相同固定液中后固定24h,4℃。常规脱水,透明,石蜡(54~56℃)包埋。自延髓上段至缰连合作10 μm厚的冠状连续切片,裱于涂有铬矾明胶的载片上。
, 百拇医药
3. P38免疫细胞化学方法
3组切片经二甲苯脱蜡、0.01 mol/L磷酸盐生理盐水缓冲液(PBS,pH7.4)漂洗后,室温下分别入含0.3% Triton X-100的0.01 mol/L PBS、含0.3% H2O2的纯甲醇(封闭内源性过氧化物酶)及2%正常马血清(抑制非特异性IgG的结合)各30 min;之后入小鼠抗P38单克隆抗体(1∶200,Sigma),室温1h,之后入4℃冰箱,24h。再依次入生物素结合的马抗小鼠IgG(1∶200,Vector)和卵白素-生物素-过氧化物酶复合物(ABC)1∶100,Vector)中各孵育1.5h,室温。以上各步骤之间均以0.01 mol/L PBS充分漂洗。最后以含0.01% H2O2的0.04%DAB(二氨基联苯胺,TCI)溶液呈色5~10 min,常规脱水透明、中性树胶封片。阴性对照切片以0.01 mol/L PBS代替小鼠抗P38单克隆抗体,其余步骤相同。
, http://www.100md.com
4. 观察与分析
4.1 定性观察:在明视野显微镜下观察P38免疫反应产物的形态特点及其在PAG各亚区内的分布特点。
4.2 P38免疫反应产物在PAG各亚区分布的定量分析:突触素P38免疫反应产物的标记强度以光密度(optic density,A)值来表示。每只大鼠的PAG冠状连续切片,每隔150 μm取片,共取约15张切片(其中首侧段2张,尾侧段3张,中段8张),以计算机图像分析系统(Leica, Q550IW)测量每张切片左右两侧PAG各亚区内P38免疫反应产物的光密度值;由于内侧纵束和上、下丘连合几乎不着色,故每张切片以此处的光密度值作为背景值,各亚区光密度值减去背景值即得到校正光密度值(corrected optic density,CA),进行统计分析时采用此校正光密度值,以消除非特异性着色对结果的影响。最终每组大鼠PAG的每个亚区共得到120个CA值。各组的CA值以SPSS for Windows统计分析软件进行单因素的方差分析(one-way ANOVA)。
, http://www.100md.com
附表 各组大鼠PAG内P38免疫反应产物的CA值(×100)
Table CA value of P38 immunoreactivity in PAG in rats of groups(×100)
NW
NP
KP
ANOVA
NW
NP
KP
内侧亚区
medial subdivision
, 百拇医药
2.06±0.99
2.87±0.89
3.50±0.73
A
B
B
腹外侧亚区
ventrolateral subdvision
1.75±0.62
3.17±1.19
4.00±1.35
A
, http://www.100md.com
B
B
背侧亚区
dorsal subdivision
1.92±0.67
3.17±0.94
5.58±1.73
A
B
C
背外侧亚区
dorsolateral subdivision
, http://www.100md.com
1.38±0.74
2.90±0.75
4.88±1.81
A
B
C
*ANOVA为方差分析,A、B、C:不同字母之间表示有显著性差异(P<0.05),相同字母表示无显著性差异(P>0.05)
*ANOVA:analysis of variance. A B C: There is significant difference between different letters (P<0.05) and no significant difference between same letters(P>0.05)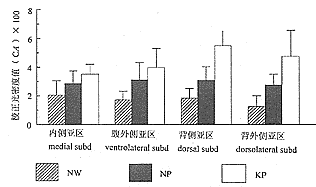
, 百拇医药
图5 各组大鼠PAG内P38免疫反应产物的校正光密度值(×100)
Fig. 5 CA value of P38 immunoreactivity in PAG in rats of groups(×100)
结 果
P38免疫反应产物为棕黄色点状或颗粒状沉积,主要分布在神经毡内,有些颗粒围绕在神经元周围,衬托出神经元胞体的轮廓。颗粒的大小不一,这与突触前终末的大小与突触类型有关,胞浆内颗粒状产物较少见,白质、血管及胶质细胞不着色,阴性对照切片未见P38免疫反应产物。
肉眼所见,各组大鼠PAG内P38免疫反应产物比较丰富,着色明显深于周围的上、下丘及被盖部其他结构,故PAG界限清晰;光镜下可见每一亚区内部P38免疫反应产物的分布也较为均匀,各亚区之间染色深浅的差异镜下不易区别;各组大鼠之间,可见PAG着色深浅有明显差异(图1~4),CA值的定量分析见附表与图5。
, 百拇医药
讨 论
1. 突触素P38的性质及其作用
突触素P38是一种分子量为38kD的酸性钙结合糖蛋白,特异性地分布在几乎是所有神经终末内小圆形或扁形(Ⅰ、Ⅱ型)突触前囊泡膜的质膜面,是一种重要的囊泡膜标志蛋白[1]。光镜下所见到的颗粒状阳性产物实际上就是成簇排列的突触囊泡[4]。由于P38的含量与突触密度正相关,因此通过测量P38免疫阳性产物的平均光密度值,可以反映出突触前囊泡的分布情况,并可推测突触数量或密度的变化,从而达到在光镜水平分析超微结构的目的。近年来,许多研究以P38为指标来探讨Alzheimer病、Huntington病等神经系统疾患及衰老状态下突触数量及密度的变化,并发现P38的衰减与突触丢失密切相关[5,6]。
近年来的研究表明,P38作为一种内在囊泡膜蛋白,参与多种与突触功能有关的活动,它参与Ca2+-依赖性的神经递质释放过程,并与长时程突触可塑性密切相关。长时程增强(long-term potentiation, LTP)的诱导与维持伴随着突触形态的可塑性变化,形态的可塑性改变最终又使突触的功能增强。这种形态上的变化包括突触前改变和突触后改变,囊泡数量增加及分布的变化是突触前改变主要形式,而囊泡数量的增加又必然伴随着P38合成的增加。另一方面,在衰老及其他病理情况下,LPT的能力下降,P38的含量及囊泡数量也逐渐减少[7,8]。
, 百拇医药
点燃可诱导神经元轴突生长、突触重建及新突触形成等可塑性变化[9,10],同时,点燃过程需要有蛋白的合成[11],由此可推测点燃过程也应有P38的合成。可见,P38是描述神经系统可塑性的有效指标之一。
2. PAG内的突触素P38与听源性惊厥及其点燃的关系
本实验的结果显示:(1) NP组大鼠PAG各亚区内P38表达较NW组明显增强,说明P77PMC大鼠PAG与正常Wistar大鼠PAG之间已经在超微结构上,即突触水平上出现了差异,P77PMC大鼠PAG内的突触密度或囊泡密度较正常Wistar大鼠明显增高,由于P77PMC大鼠自筛选至今已传至23代,这种突触密度的变化可能源于P77PMC大鼠某种遗传因素的改变,此改变导致了PAG内神经元生长分化的异常,从而使其突触结构发生改变,推测这种突触水平的变化可能与P77PMC大鼠的惊厥易感性有关,但其机制尚不清楚;(2) 反复听源性惊厥发作导致点燃后,PAG背侧及背外侧亚区P38表达水平较NW、NP两组显著增强,说明听源性惊厥反复发作可使P77PMC大鼠PAG内发生明显的可塑性改变,突触密度或囊泡密度显著增加。这种可塑性变化的机制可能与该两亚区内c-fos基因的反复表达有关,c-fos作为核内第三信使,参与启动和调控靶基因的表达,而某些靶基因的表达产物可以长时程调节神经元的功能,一次性的c-fos表达可能不足以引起靶基因表达的明显改变,但反复惊厥发作导致的PAG背及背外侧亚区内大量神经元反复c-fos表达可能最终会使某些与生长相关的靶基因的表达显著增强,从而使其转录、合成的产物参与突触数量及结构等方面的可塑性改变。已知编码细胞骨架蛋白、突触囊泡蛋白、离子通道、受体等结构蛋白的基因都可能是受即刻早期基因调控的靶基因[12]。但目前为止,对c-fos基因调控哪些靶基因、这些靶基因又如何来调节细胞的反应以及这些反应对癫痫的影响尚知之甚少,而且关于点燃现象中形态学变化的研究也尚无一致结果。
, 百拇医药
另一种可塑性变化的可能机制与LTP类似,反复惊厥发作导致PAG背外侧及背侧亚区内大量的谷氨酸能神经元兴奋,谷氨酸释放持续增多,通过Ca2+、NMDA受体及代谢性谷氨酸受体、逆行信使(一氧化氮)等一系列物质的参与,最终使突触形态发生变化,突触形态变化又导致突触功能的增强[7],而点燃与LTP的确具有某些共同的神经机制,两者可相互易化[13,14]。
PAG腹外侧亚区,特别是尾侧段的腹外侧亚区内谷氨酸能神经元较少而GABA能神经元较多,是一个主要发挥抑制性作用的中枢,有文献表明,点燃现象主要是依靠兴奋性的增强而不是抑制性的减弱来实现的[15]。此区可能不参加突触可塑性的变化,其内Fos蛋白的靶基因可能不是合成突触囊泡蛋白的基因,故P38表达没有明显的增强;同样,由于此区内缺乏丰富的兴奋性氨基酸及其受体,故LTP样可塑性变化也不明显。
本实验虽然揭示了正常及点燃后P77PMC大鼠PAG内突触密度的变化,但其他如突触类型、突触曲率、穿孔突触(perforated synapse)比率、活性带长度等反映突触可塑性的指标的改变尚需电镜研究证实。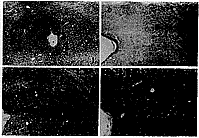
, http://www.100md.com
图 版 说 明
图1 KP组大鼠PAG内P38免疫反应产物的分布 ×70
图2~4 NW组(图2)、NP组(图3)和KP组(图4)大鼠PAG内P38免疫反应产物的分布 ×150 D.背侧亚区 DL.背外侧亚区
Explanation of figures
Fig.1 The distribution of P38 immunoreactivity in PAG of KP rats ×70
Fig.2-4 The distribution of P38 immunoreactivity in PAG of NW(Fig.2), NP(Fig.3) and KP (Fig.4) rats ×110 D,dorsal subdivision DL,dorsolateral subdivision
, http://www.100md.com
△ Department of Anatomy, Beijing Medical University, Beijing 100083,China
参考文献
[1]Wiedenmann B, Franke W. Identification and localization of synaptophysin, an integral membrane glycoprotein of Mr 38 000 characteristic of presynaptic vesicles. Cell,1985,41(3):1017
[2]Catsicas S, Grenningloh G, Pich EM. Nerve-terminal proteins: to fuse to learn. TINS, 1994,17(9):368
, 百拇医药
[3]Saito S, Kobayashi S, Ohashi T. Decreased synaptic density in aged brains and its prevention by rearing under enriched enviroment as revealed by synaptophysin contents. J Neuroscience Reasearch,1994,39(1):157
[4]Masliah E, Terry RD, Alford M, et al. Quantitative immunohistochemistry of synaptophysin in human neocortex:an alternative method to estimate density of presynaptic terminal in paraffin sections. J Histochem and Cytochem,1990,38(6):837
, 百拇医药
[5]Masliah E, Terry RD, Alford M, et al. Cortical and subcortical patterns of synaptophysin-like immunoreactivity in Alzheimer's disease. Am J Pathol, 1991,138(1):235
[6]Goto S, Hirano A. Synaptophysin expression in the striatum in Huntington's disease. Aca Neuropathol,1993,80(1):88
[7]Lynch MA, Voss KL, Rodriguez J, et al. Increase in synaptic vesicle proteins accompanies long-term potentiation in the dentate gyrus. Neurosci,1994,60(1):1
, http://www.100md.com
[8]Lynch MA, Mullany P. Changes in protein synthesis and synthesis of the synaptic vesicle protein, synaptophysin, in entorhinal cortex following induction of long-term potentiation in dentate gyrus:an age-related study in the rat. Neuropharmacology,1997,36(7):973
[9]Hexx ST, Cavazos J. Synaptic recognization in the hippocampus induced by abnormal functional activity. Science, 1988,239(4844):1147
[10]Chang FL, Hawrylak N, Greenough WT. Astrocytic and synaptic response to kindling in hippocampal subfield CA1. I synaptogenesis in response to kindling in vitro. Brain Res,1993,603(2):309
, 百拇医药
[11]Cain D, Corcoran M, Staines W. Effects of protein. synthesis inhibition on kindling in the mouse. Exp Neurol.1980,68(3):409
[12]Morgan JI, Curran T. Proto-oncogene transcription factors and epilepsy. TINS, 1991,12(9):343
[13]Majkowski J. Kindling:a model for epilepsy and memory. Acta Neurol Scand, 1986,74(suppl 109):97
[14]Cain DP. Long-term potentiation and kindling:how similar are the mechanisms? TINS, 1989,12(1):6
[15]Cottrell GA, Robertson HA. Baclonfen exacerbates epileptic myoclonus in kindled rats. Neuropharmacology,1987,26(6):645
收稿1998-12 修回1998-03, 百拇医药
单位:刘猛 许鹿希(北京医科大学解剖学系,北京 100083)
关键词:突触素;导水管周围灰质;听源性惊厥;点燃;大鼠
解剖学报990306
【摘要】 目的 分析正常及点燃后听源性惊厥易感大鼠中脑导水管周围灰质(PAG)内突触密度的变化情况。方法 用免疫细胞化学方法和计算机图像分析技术。 结果 正常和点燃后听源性惊厥易感大鼠PAG内突触素P38免疫反应产物的校正光密度值(COD)均显著高于正常Wistar大鼠;点燃后听源性惊厥易感大鼠PAG背侧及背外侧两个亚区内突触素P38免疫反应产物的COD值显著高于正常听源性惊厥易感大鼠。 结论 PAG内突触密度的改变与听源性惊厥及其点燃过程密切相关。
EXPRESSION OF SYNAPTOPHYSIN IN PERIAQUEDUCTAL GRAY
, http://www.100md.com
IN AUDIOGENIC SEIZURES-PRONE RATS
Liu Meng, Xu LuxiΔ
(Department of Anatomy, Beijing Medical University, Beijing)
【Abstract】 Objective To find out the changes of synaptic density in the periaqueductalgray(PAG) of the naive and kindled audiogenic seizures-prone rats. Methods Immunocytochemistry and computer image analysis technique were used.Results The value of corrected optical density (COD) of the synaptophysin P38 immunoreactivity in the PAG of the naive and kindled audiogenic seizures-prone rats were significantly higher than that of the normal Wistar rats. The COD value in the dorsal and dorsolateral subdivisions of the PAG in the kindled audiogenic seizures-prone rats were significantly higher than that in the naive audiogenc seizures-prone rats. Conclusion Changes of synaptic density in the PAG may be related to the susceptibility of audiogenic seizures and its kindling process.
, 百拇医药
【Key words】 Synaptophysin; Periaqueductal gray; Audiogenic seizures; Kindling; Rat
突触素(synaptophysin)又称P38,是一种分子量为38kD的酸性钙结合糖蛋白,它作为一种内在膜蛋白,几乎存在于所有神经终末的突触前成分内,并选择性地分布在小突触囊泡膜的胞质面[1]。突触素P38参与Ca2+-依赖性的神经递质释放过程,并且与其他囊泡蛋白共同参与短时程及长时程突触可塑性的调节[2]。同时,P38作为突触囊泡的一种特异性标志蛋白,其数量和分布密度可间接反映突触的密度[3]。据此,本实验以P38免疫细胞化学反应的强度为指标,间接地对听源性惊厥易感大鼠(P77PMC)中脑导水管周围灰质(periaqueductal gray, PAG)各亚区突触的分布情况进行了研究。用光镜观察PAG各节段各亚区切片上突触密度的变化,以期在光镜水平上了解PAG在惊厥状态下超微结构的某些变化。
, 百拇医药
材料和方法
1. 建立听源性惊厥点燃模型
采用听源性惊厥易感大鼠(P77PMC,选自Wistar品系,由北京医科大学实验动物中心培育),每天给予1次铃声刺激(106dB,60s)以诱发P77PMC大鼠强直-阵挛性听源性惊厥发作,连续刺激40d,筛选其中惊厥发作超过20次者作为点燃大鼠。
2. 动物分组及切片制备
实验动物均为成年雄性,体重350~450g。共分3组,即NW组(normal Wistar rats,n=4):正常Wistar大鼠;NP组(naive P77PMC rats,n=4):未受处理的听源性惊厥易感大鼠;KP组(kindled P77PMC rats,n=4):听源性惊厥点燃后的P77PMC大鼠。
3组动物以复合麻醉剂(chloropent, 3 ml/kg)腹腔注射麻醉后,经左心室-升主动脉插管,室温下灌注生理盐水100~150 ml,随后灌注含4%多聚甲醛的0.1 mol/L磷酸盐缓冲液(pH7.4,4℃)300ml。脑组织于相同固定液中后固定24h,4℃。常规脱水,透明,石蜡(54~56℃)包埋。自延髓上段至缰连合作10 μm厚的冠状连续切片,裱于涂有铬矾明胶的载片上。
, 百拇医药
3. P38免疫细胞化学方法
3组切片经二甲苯脱蜡、0.01 mol/L磷酸盐生理盐水缓冲液(PBS,pH7.4)漂洗后,室温下分别入含0.3% Triton X-100的0.01 mol/L PBS、含0.3% H2O2的纯甲醇(封闭内源性过氧化物酶)及2%正常马血清(抑制非特异性IgG的结合)各30 min;之后入小鼠抗P38单克隆抗体(1∶200,Sigma),室温1h,之后入4℃冰箱,24h。再依次入生物素结合的马抗小鼠IgG(1∶200,Vector)和卵白素-生物素-过氧化物酶复合物(ABC)1∶100,Vector)中各孵育1.5h,室温。以上各步骤之间均以0.01 mol/L PBS充分漂洗。最后以含0.01% H2O2的0.04%DAB(二氨基联苯胺,TCI)溶液呈色5~10 min,常规脱水透明、中性树胶封片。阴性对照切片以0.01 mol/L PBS代替小鼠抗P38单克隆抗体,其余步骤相同。
, http://www.100md.com
4. 观察与分析
4.1 定性观察:在明视野显微镜下观察P38免疫反应产物的形态特点及其在PAG各亚区内的分布特点。
4.2 P38免疫反应产物在PAG各亚区分布的定量分析:突触素P38免疫反应产物的标记强度以光密度(optic density,A)值来表示。每只大鼠的PAG冠状连续切片,每隔150 μm取片,共取约15张切片(其中首侧段2张,尾侧段3张,中段8张),以计算机图像分析系统(Leica, Q550IW)测量每张切片左右两侧PAG各亚区内P38免疫反应产物的光密度值;由于内侧纵束和上、下丘连合几乎不着色,故每张切片以此处的光密度值作为背景值,各亚区光密度值减去背景值即得到校正光密度值(corrected optic density,CA),进行统计分析时采用此校正光密度值,以消除非特异性着色对结果的影响。最终每组大鼠PAG的每个亚区共得到120个CA值。各组的CA值以SPSS for Windows统计分析软件进行单因素的方差分析(one-way ANOVA)。
, http://www.100md.com
附表 各组大鼠PAG内P38免疫反应产物的CA值(×100)
Table CA value of P38 immunoreactivity in PAG in rats of groups(×100)
NW
NP
KP
ANOVA
NW
NP
KP
内侧亚区
medial subdivision
, 百拇医药
2.06±0.99
2.87±0.89
3.50±0.73
A
B
B
腹外侧亚区
ventrolateral subdvision
1.75±0.62
3.17±1.19
4.00±1.35
A
, http://www.100md.com
B
B
背侧亚区
dorsal subdivision
1.92±0.67
3.17±0.94
5.58±1.73
A
B
C
背外侧亚区
dorsolateral subdivision
, http://www.100md.com
1.38±0.74
2.90±0.75
4.88±1.81
A
B
C
*ANOVA为方差分析,A、B、C:不同字母之间表示有显著性差异(P<0.05),相同字母表示无显著性差异(P>0.05)
*ANOVA:analysis of variance. A B C: There is significant difference between different letters (P<0.05) and no significant difference between same letters(P>0.05)

, 百拇医药
图5 各组大鼠PAG内P38免疫反应产物的校正光密度值(×100)
Fig. 5 CA value of P38 immunoreactivity in PAG in rats of groups(×100)
结 果
P38免疫反应产物为棕黄色点状或颗粒状沉积,主要分布在神经毡内,有些颗粒围绕在神经元周围,衬托出神经元胞体的轮廓。颗粒的大小不一,这与突触前终末的大小与突触类型有关,胞浆内颗粒状产物较少见,白质、血管及胶质细胞不着色,阴性对照切片未见P38免疫反应产物。
肉眼所见,各组大鼠PAG内P38免疫反应产物比较丰富,着色明显深于周围的上、下丘及被盖部其他结构,故PAG界限清晰;光镜下可见每一亚区内部P38免疫反应产物的分布也较为均匀,各亚区之间染色深浅的差异镜下不易区别;各组大鼠之间,可见PAG着色深浅有明显差异(图1~4),CA值的定量分析见附表与图5。
, 百拇医药
讨 论
1. 突触素P38的性质及其作用
突触素P38是一种分子量为38kD的酸性钙结合糖蛋白,特异性地分布在几乎是所有神经终末内小圆形或扁形(Ⅰ、Ⅱ型)突触前囊泡膜的质膜面,是一种重要的囊泡膜标志蛋白[1]。光镜下所见到的颗粒状阳性产物实际上就是成簇排列的突触囊泡[4]。由于P38的含量与突触密度正相关,因此通过测量P38免疫阳性产物的平均光密度值,可以反映出突触前囊泡的分布情况,并可推测突触数量或密度的变化,从而达到在光镜水平分析超微结构的目的。近年来,许多研究以P38为指标来探讨Alzheimer病、Huntington病等神经系统疾患及衰老状态下突触数量及密度的变化,并发现P38的衰减与突触丢失密切相关[5,6]。
近年来的研究表明,P38作为一种内在囊泡膜蛋白,参与多种与突触功能有关的活动,它参与Ca2+-依赖性的神经递质释放过程,并与长时程突触可塑性密切相关。长时程增强(long-term potentiation, LTP)的诱导与维持伴随着突触形态的可塑性变化,形态的可塑性改变最终又使突触的功能增强。这种形态上的变化包括突触前改变和突触后改变,囊泡数量增加及分布的变化是突触前改变主要形式,而囊泡数量的增加又必然伴随着P38合成的增加。另一方面,在衰老及其他病理情况下,LPT的能力下降,P38的含量及囊泡数量也逐渐减少[7,8]。
, 百拇医药
点燃可诱导神经元轴突生长、突触重建及新突触形成等可塑性变化[9,10],同时,点燃过程需要有蛋白的合成[11],由此可推测点燃过程也应有P38的合成。可见,P38是描述神经系统可塑性的有效指标之一。
2. PAG内的突触素P38与听源性惊厥及其点燃的关系
本实验的结果显示:(1) NP组大鼠PAG各亚区内P38表达较NW组明显增强,说明P77PMC大鼠PAG与正常Wistar大鼠PAG之间已经在超微结构上,即突触水平上出现了差异,P77PMC大鼠PAG内的突触密度或囊泡密度较正常Wistar大鼠明显增高,由于P77PMC大鼠自筛选至今已传至23代,这种突触密度的变化可能源于P77PMC大鼠某种遗传因素的改变,此改变导致了PAG内神经元生长分化的异常,从而使其突触结构发生改变,推测这种突触水平的变化可能与P77PMC大鼠的惊厥易感性有关,但其机制尚不清楚;(2) 反复听源性惊厥发作导致点燃后,PAG背侧及背外侧亚区P38表达水平较NW、NP两组显著增强,说明听源性惊厥反复发作可使P77PMC大鼠PAG内发生明显的可塑性改变,突触密度或囊泡密度显著增加。这种可塑性变化的机制可能与该两亚区内c-fos基因的反复表达有关,c-fos作为核内第三信使,参与启动和调控靶基因的表达,而某些靶基因的表达产物可以长时程调节神经元的功能,一次性的c-fos表达可能不足以引起靶基因表达的明显改变,但反复惊厥发作导致的PAG背及背外侧亚区内大量神经元反复c-fos表达可能最终会使某些与生长相关的靶基因的表达显著增强,从而使其转录、合成的产物参与突触数量及结构等方面的可塑性改变。已知编码细胞骨架蛋白、突触囊泡蛋白、离子通道、受体等结构蛋白的基因都可能是受即刻早期基因调控的靶基因[12]。但目前为止,对c-fos基因调控哪些靶基因、这些靶基因又如何来调节细胞的反应以及这些反应对癫痫的影响尚知之甚少,而且关于点燃现象中形态学变化的研究也尚无一致结果。
, 百拇医药
另一种可塑性变化的可能机制与LTP类似,反复惊厥发作导致PAG背外侧及背侧亚区内大量的谷氨酸能神经元兴奋,谷氨酸释放持续增多,通过Ca2+、NMDA受体及代谢性谷氨酸受体、逆行信使(一氧化氮)等一系列物质的参与,最终使突触形态发生变化,突触形态变化又导致突触功能的增强[7],而点燃与LTP的确具有某些共同的神经机制,两者可相互易化[13,14]。
PAG腹外侧亚区,特别是尾侧段的腹外侧亚区内谷氨酸能神经元较少而GABA能神经元较多,是一个主要发挥抑制性作用的中枢,有文献表明,点燃现象主要是依靠兴奋性的增强而不是抑制性的减弱来实现的[15]。此区可能不参加突触可塑性的变化,其内Fos蛋白的靶基因可能不是合成突触囊泡蛋白的基因,故P38表达没有明显的增强;同样,由于此区内缺乏丰富的兴奋性氨基酸及其受体,故LTP样可塑性变化也不明显。
本实验虽然揭示了正常及点燃后P77PMC大鼠PAG内突触密度的变化,但其他如突触类型、突触曲率、穿孔突触(perforated synapse)比率、活性带长度等反映突触可塑性的指标的改变尚需电镜研究证实。

, http://www.100md.com
图 版 说 明
图1 KP组大鼠PAG内P38免疫反应产物的分布 ×70
图2~4 NW组(图2)、NP组(图3)和KP组(图4)大鼠PAG内P38免疫反应产物的分布 ×150 D.背侧亚区 DL.背外侧亚区
Explanation of figures
Fig.1 The distribution of P38 immunoreactivity in PAG of KP rats ×70
Fig.2-4 The distribution of P38 immunoreactivity in PAG of NW(Fig.2), NP(Fig.3) and KP (Fig.4) rats ×110 D,dorsal subdivision DL,dorsolateral subdivision
, http://www.100md.com
△ Department of Anatomy, Beijing Medical University, Beijing 100083,China
参考文献
[1]Wiedenmann B, Franke W. Identification and localization of synaptophysin, an integral membrane glycoprotein of Mr 38 000 characteristic of presynaptic vesicles. Cell,1985,41(3):1017
[2]Catsicas S, Grenningloh G, Pich EM. Nerve-terminal proteins: to fuse to learn. TINS, 1994,17(9):368
, 百拇医药
[3]Saito S, Kobayashi S, Ohashi T. Decreased synaptic density in aged brains and its prevention by rearing under enriched enviroment as revealed by synaptophysin contents. J Neuroscience Reasearch,1994,39(1):157
[4]Masliah E, Terry RD, Alford M, et al. Quantitative immunohistochemistry of synaptophysin in human neocortex:an alternative method to estimate density of presynaptic terminal in paraffin sections. J Histochem and Cytochem,1990,38(6):837
, 百拇医药
[5]Masliah E, Terry RD, Alford M, et al. Cortical and subcortical patterns of synaptophysin-like immunoreactivity in Alzheimer's disease. Am J Pathol, 1991,138(1):235
[6]Goto S, Hirano A. Synaptophysin expression in the striatum in Huntington's disease. Aca Neuropathol,1993,80(1):88
[7]Lynch MA, Voss KL, Rodriguez J, et al. Increase in synaptic vesicle proteins accompanies long-term potentiation in the dentate gyrus. Neurosci,1994,60(1):1
, http://www.100md.com
[8]Lynch MA, Mullany P. Changes in protein synthesis and synthesis of the synaptic vesicle protein, synaptophysin, in entorhinal cortex following induction of long-term potentiation in dentate gyrus:an age-related study in the rat. Neuropharmacology,1997,36(7):973
[9]Hexx ST, Cavazos J. Synaptic recognization in the hippocampus induced by abnormal functional activity. Science, 1988,239(4844):1147
[10]Chang FL, Hawrylak N, Greenough WT. Astrocytic and synaptic response to kindling in hippocampal subfield CA1. I synaptogenesis in response to kindling in vitro. Brain Res,1993,603(2):309
, 百拇医药
[11]Cain D, Corcoran M, Staines W. Effects of protein. synthesis inhibition on kindling in the mouse. Exp Neurol.1980,68(3):409
[12]Morgan JI, Curran T. Proto-oncogene transcription factors and epilepsy. TINS, 1991,12(9):343
[13]Majkowski J. Kindling:a model for epilepsy and memory. Acta Neurol Scand, 1986,74(suppl 109):97
[14]Cain DP. Long-term potentiation and kindling:how similar are the mechanisms? TINS, 1989,12(1):6
[15]Cottrell GA, Robertson HA. Baclonfen exacerbates epileptic myoclonus in kindled rats. Neuropharmacology,1987,26(6):645
收稿1998-12 修回1998-03, 百拇医药