集落刺激因子-1受体在小鼠皮层神经元的表达*
作者:王亚奇 刘宗惠 于雪 崔月汉
单位:海军总医院神经外科,北京 100037
关键词:集落刺激因子受体;原位杂交;免疫组织化学;小鼠
解剖学报990408 【摘要】 目的 对体外培养神经元是否具有表达、合成集落刺激因子受体(CSF-1R或c-fms)的能力进行观察。 方法 在用免疫双标记的方法确定培养细胞确系神经元的基础上,采用原位杂交组织化学和免疫组织化学的方法,在mRNA和蛋白质两个水平检查神经元是否拥有集落刺激因子受体。 结果 神经元具有表达并合成CSF-1受体(c-fms)的能力。 结论 CSF-1对神经元的保护作用至少部分是通过其对神经元的直接影响实现的。
EXPRESSION OF CSF-1 RECEPTOR(c-fms) ON CORTICAL
, 百拇医药
NEURON OF MICE IN VITRO
Wang YaqiΔ, Liu Zonghui, Yu Xue, Cui Yuehan
(Department of Neurosurgery Navy General Hospital, Beijing)
【Abstract】 Objective To investigate the existence of CSF-1 receptor(c-fms) on neuron. Methods The culturing neurons were identified by double immunofluorescent stainings of neuron specific enolase (NSE) and c-fms. The expression and production of c-fms on neuron were examined by in situ hybridization histochemical technique and immunocytochemical methods respectively.Results Neuron could express and produce CSF-1 receptor.Conclusion CSF-1, in addition to its effect on microglia, may affect neurons directly by potentiating neurons survival.
, 百拇医药
【Key words】 CSF-1 receptor; Immunocytochemistry; in situ; Hybridization histochemistry;Mouse
体内、外实验均已证明,集落刺激因子-1(CSF-1)对神经元具有保护作用,尤其是在神经元受损时[1~3]。有些学者认为,CSF-1通过刺激脑内小胶质细胞,由后者在释放炎症因子的同时释放神经营养因子而起到神经元保护作用的,其主要依据是,小胶质细胞是脑内CSF-1受体的拥有者[4]。研究表明,小胶质细胞受适当刺激后,可释放某些营养因子[5]同时也释放大量炎症因子和毒性因子,如小胶质细胞反应过度所释放的大量的白介素-1(IL-1),其自身及所引发的炎症反应均可导致神经元的严重损伤。鉴于小胶质对神经元影响的复杂性,本研究拟应用原位杂交和免疫组织化学等方法,对神经元能否表达并合成CSF-1受体、即能否接受该因子的直接作用进行了观察,以期解释该因子对神经元保护作用机制。
, http://www.100md.com
材料和方法
1.抗体
本实验选用了3种不同的抗CSF-1受体(c-fms)抗体:(1)抗c-fms整体分子抗体(Cambridge Research Biochemicals,England)。(2)选择性抗c-fms分子膜外段抗体(Upstate Biotechnology INC, N. Y.)。(3)选择性抗c-fms分子膜内段抗体(Upstate Biotechnology INC,N.Y.)。
2.探针制备
用DNA合成仪合成含有48个核苷酸的寡聚核苷酸探针(VCDNA services Calgary Canada),该探针选择性的互补于鼠CSF-1受体(c-fms)mRNA 904~951碱基序列(膜外段)[6]。用地高辛探针标记试剂盒(Boehringer Mannheim)作末端标记。
, 百拇医药
3. 细胞培养
按照文献[3]取小鼠脑皮层组织作神经元培养。将细胞接种于直径60mm的组织培养盘中。每盘中含6张poly-Lysine包被的玻片。细胞密度为5×105/盘,培养液为无血清DMEM或Honegger培养液。培养神经元的鉴定见下(4.4)
4. 免疫细胞化学
4.1 实验组:无血清脑皮层神经元培养5d后,将载有培养细胞的玻片,用冷Dulbecco生理平衡液(DPBS)冲洗后移入预冷(-20℃)甲醇固定10min,DPBS冲洗,然后用含有2%无脂奶粉的DPBS温育20min,以消除非特异性染色。第一抗体为1∶200稀释的兔抗c-fms抗体,4℃孵育过夜。第二抗体为生物素标记的抗兔IgG抗体(1∶500,Vector),室温30~45min。然后在卵白素-生物素-辣根过氧化物酶复合物(1∶100,Vector)中室温1h。上述各步骤间,均经含2%无脂奶粉的DPBS充分冲洗。呈色反应液为含0.1%H2O2,0.05%DAB,1.5%NiSO4的醋酸缓冲液(pH6.0),室温下显色1min。显色后经脱水,封片。
, 百拇医药
4.2 对照1:替代实验。用未经免疫的兔正常血清替代第一抗体(抗c-fms)孵育,其他处理同实验组。
4.3 对照2:吸收试验。分别用表达CSF-受体(c-fms)的小鼠巨噬细胞系5/10.14和不表达CSF受体(c-fms)EL4鼠淋巴瘤细胞与抗c-fms抗血清在37℃共孵育30min后离心,取上清液代替第一抗体进行免疫组织化学染色,其他处理同实验组。
4.4 对照3:双标记实验,以确定所标记细胞是否为神经元。用抗神经元特异性烯醇化酶(NSE)的单克隆小鼠抗体(耶鲁大学D.J.Barnstable,惠赠)1∶200稀释与抗c-fms多克隆兔抗体共孵育同一载有培养细胞的玻片,4℃孵育过夜。选用罗达明标记驴抗鼠IgG(Jackson Research Laboratory)和FITC标记的驴抗兔IgG(Jackson Research Laboratory)作为标记抗体稀释度均为1∶100,室温孵育1h。充分漂洗后用甘油:DBPS(1∶1)封片。Zeiss荧光显微镜观察、摄片。
, http://www.100md.com
5.分子原位杂交组织化学
5.1 实验组:将携有培养细胞的玻片,移入0.03mol/L PBS漂洗后(用DEPC处理过的双蒸水配制),迅速换入含4%多聚甲醛,5%冰醋酸的磷酸缓冲液中室温下固定细胞30min。0.03mol/L PBS充分漂洗(30min×2),入70%酒精4℃下保存。杂交前,经5×SSC漂洗后移入杂交缓冲液。其液含50%甲酰胺,4×SSC,1×Denhart溶液1%十二烷基肌氨酸钠,0.02mol/L PB(pH7.0),10%硫酸葡聚糖,0.5g/L热变性鱼精子DNA,0.2mol/L二硫苏糖醇以及0.002μg/L地高辛标记探针。在湿盒中42℃孵育16~18h后,在1×SSC中,于55℃洗4次,每次15min。然后用1∶2 000稀释的碱性磷酸酶标记的抗地高辛抗体(Boehringer Mannheim)孵育,室温下1h。漂洗后入含NBT,X-phosphate(Boehringer Mannheim)的Tris缓冲液显色。DPBS冲洗 以中止反应。甘油:DPBS(1∶1)封片。
, http://www.100md.com
5.2 对照试验:在杂交液中加入过量(800倍于标记探针)的未标记的同源冷探针或过量的具有相同长度和相似C-G含量比的未标记的无关探针行杂交反应,其他处理同实验组。
结 果
1.免疫组织化学组
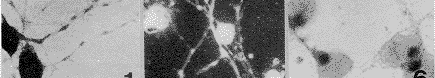
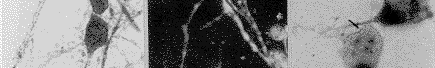
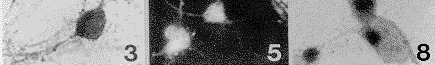
用3种针对CSF-1受体(c-fms)分子不同部分的抗体作免疫细胞染色,尽管免疫反应强度有所区别,但几乎所有细胞均显示免疫染色阳性(图1)。抗体吸收和替代实验的结果为用相关细胞系(携CSF-1受体的鼠巨噬细胞系5/10.14)吸收过的抗血清作免疫染色结果阴性(图2);用无关细胞系(不具有CSF-1受体的鼠淋巴细胞瘤EL4细胞)吸收过的抗血清作免疫染色,尽管染色强度较实验组略弱,但仍为阳性(图3);用非免疫同源兔血清替代实验用抗血清进行免疫染色,结果阴性。应用c-fms与NSE免疫双标记方法显示,所有标记细胞均为双重染色的双标记细胞。说明阳性细胞确系神经元(图4,5)。
, http://www.100md.com
2.原位杂交组
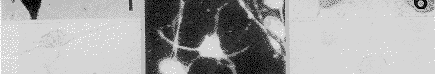
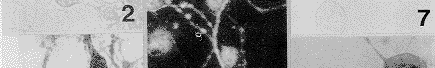
用地高辛标记特异性针对c-fms膜外段的探针在培养神经元上作原位杂交结果显示:全部培养神经元均表达c-fms mRNA。反应产物存在于胞浆,有向细胞一极集中趋势,并向大的突起内延伸(图6)。加入过量同源的冷探针组为阴性反应(图7);加入非同源冷探针组反应强度不变(图8)。
讨 论
随着神经内分泌免疫这一学科的兴起,近年来,有关细胞因子在神经系统中的功能意义的研究颇多。集落刺激因子CSF-1由于其在体内、外研究中均显示了对神经元的保护作用而引起了神经科学界的关注[1~3]。CSF-1基因敲除(gene knock out)小鼠(op/opmice)除显示低存活率和骨发育障碍外,尚有明确的脑发育迟滞和障碍。说明其在脑发育过程中也具有重要的作用[2]。于是CSF-1是如何并通过什么途径实现其对神经系统影响的,就成为进一步研究所必须解答的问题之一。而神经元是否拥有该因子的受体则是回答这一问题的关键。为此,本研究用免疫组织化学和原位杂交的方法在采用严格对照实验证明所用抗体、探针特异性的基础上,证实神经元自身具有表达并合成这一受体的能力,为CSF-1直接影响神经元功能活动提供了结构基础。说明该因子不仅参与了脑损伤过程中对小胶质细胞的功能调节,且可能直接作用于神经元,进而影响其功能。CSF-1受体(c-fms)是fms原癌基因编码的跨膜蛋白,酪氨酸激酶受体家族的成员之一[7,8]。研究表明与c-fms同属这一受体家族的c-kit与其相应配体(stem cell factor)结合后也产生相应的神经元保护效应。提示这类细胞因子及其相应受体对神经系统功能调解的研究具有广泛前景。
, http://www.100md.com
神经元能表达并合成CSF-1受体是CSF-1可能对神经元实施影响的前提。而存在于神经元表面的CSF-1受体是否具有生物学活性,换言之该受体能否与相应配体结合进而激活细胞内信号转导系统发挥其作用,是确定该因子能否直接影响神经元功能活动的关键,也是我们下一步工作的重点。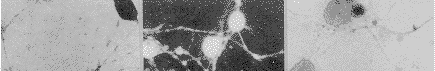

, 百拇医药
图版说明
图1 用抗c-fms抗血清行培养神经元免疫组织化学染色,所有培养细胞均显示c-fms样免疫反应阳性 ×600
图2 用经c-fms阳性细胞系(5/10.14)吸收过的抗c-fms血清行免疫组织化学染色,结果阴性 ×600
图3 用经c-fms阴性细胞系(EL4)吸收过的抗c-fms血清行免疫组织化学染色,所有培养细胞均显示c-fms样免疫反应性,但染色强度较吸收前有所减弱 ×600
图4,5 用抗c-fms和抗NSE免疫荧光双标记方法显示,c-fms一样(图4)和NSE一样(图5)免疫反应性定位在同一神经元上 ×600
图6 选用地高辛标记的选择性针对c-fms mRNA的寡聚核苷酸探针,在体外培养神经元上行原位杂交组织化学反应。所有神经元中均出现强杂交信号 ×800
, http://www.100md.com
图7 地高辛标记探针与过量(×800)未标记的同源冷探针混合行杂交反应,神经元中无杂交信号出现 ×800
图8 地高辛标记探针与过量(×800)未标记的异源冷探针混合行杂交反应,杂交信号与实验组无异
Explanation of figures
Fig. 1 Cultured neurons were treated with anti-CSF-1R(c-fms) antiserum. The neurons showed c-fms-like immunoreactivity. ×600
Fig. 2 Cultured neurons were treaied with anti-CSF-1R(c-fms) antiserum adsorbed with CSF-1Rpositive 5/10 14 cells. The neurons werenegative for c-fms-like immunoreactivit
, 百拇医药
Fig. 3 Cultured neuron treated with anti-CSF-IR(c-frns) antiserum adsorbed with CSF-1R negative EL4 cells. the neurons showed c-fms-likeimmunoreactivity. ×600
Fig. 4 , 5 Double immunofluorescent staining of anti-NSE and anticfms on cultured neurons. cfms(Fig4) and NSE(Fig 5) immunoreactivitywere co-localized in the same neurons. ×600
Fig-6 Neurons in culture were hybridized with DIG-labeled probe complementary to CSF-1R(c-fms) mRNA only. All of the neurons were labeled. × 800
, 百拇医药
Fig. 7 Neurons in culture were hybridized with DIG-labeled probe complemeniary to CSF-1R(cfms) mRNA plus a 800fold excess of cold unlabeled probe. None of the neurons were labeled. ×800
Fig. 8 Neurons in culture were hybridized with DIG-labeled probe complemeniary to CSF-1R(cfms) mRNA plus a 800-fold excess of dissimilar probe with sirnilar length and G-C content. All of the neurons were labeled. ×800
△ Department of Neurosurgery, Navy General Hospital, 6 Fucheng Road Beijing 100037,China
, 百拇医药
参考文献
1 Berezovskaya O, Maysinger D, Fedoroff S. Colony stimulating factor-1 potentiates neuronal survival in cerebral cortex ischemic lesion. Acta Neuropathol,1996,92(5):479
2 Michaelson MD, Bieri PL,Mehler MF, et al. CSF-1 deficiency in mice results in abnormal brain development. Development,1996,122(9):2661
3 Wang YQ, Berezovskaya O, Fedoroff S. Expression of colony stimulating factor-1 receptor(CSF-1) by CNS neurons in mice. J Neurosci Res, 1999,in press
, http://www.100md.com
4 Sawada M, Suzumura A, Marunouchi T. Cytokine network in the central nervous system and its roles in growth and differentiation of glial and neuronal cells. Int J Dev Neurosci,1995,13(3/4):253
5 Nagata K, Takei N, Nakajima K, et al. Microglia conditioned medium promotes survival and development of cultured mesencephalic neurons from embryonic rat brain. J Neurosci Res,1993,34(3):357
6 Rothwell VM, Rohrschneider LR. Murine c-fms cDNA:cloning, sequence analysis and retroviral expression. Oncogene Res,1987,1(4):311
7 Sherr CJ. Colony stimulating factor-1 receptor. Blood, 1990,75(1):1
8 Hunter T. Tyrosine phosphorylation:past, present and future. Biochem Soc Transact,1996,24(2):307
收稿1998-10 修回1999-04, 百拇医药
单位:海军总医院神经外科,北京 100037
关键词:集落刺激因子受体;原位杂交;免疫组织化学;小鼠
解剖学报990408 【摘要】 目的 对体外培养神经元是否具有表达、合成集落刺激因子受体(CSF-1R或c-fms)的能力进行观察。 方法 在用免疫双标记的方法确定培养细胞确系神经元的基础上,采用原位杂交组织化学和免疫组织化学的方法,在mRNA和蛋白质两个水平检查神经元是否拥有集落刺激因子受体。 结果 神经元具有表达并合成CSF-1受体(c-fms)的能力。 结论 CSF-1对神经元的保护作用至少部分是通过其对神经元的直接影响实现的。
EXPRESSION OF CSF-1 RECEPTOR(c-fms) ON CORTICAL
, 百拇医药
NEURON OF MICE IN VITRO
Wang YaqiΔ, Liu Zonghui, Yu Xue, Cui Yuehan
(Department of Neurosurgery Navy General Hospital, Beijing)
【Abstract】 Objective To investigate the existence of CSF-1 receptor(c-fms) on neuron. Methods The culturing neurons were identified by double immunofluorescent stainings of neuron specific enolase (NSE) and c-fms. The expression and production of c-fms on neuron were examined by in situ hybridization histochemical technique and immunocytochemical methods respectively.Results Neuron could express and produce CSF-1 receptor.Conclusion CSF-1, in addition to its effect on microglia, may affect neurons directly by potentiating neurons survival.
, 百拇医药
【Key words】 CSF-1 receptor; Immunocytochemistry; in situ; Hybridization histochemistry;Mouse
体内、外实验均已证明,集落刺激因子-1(CSF-1)对神经元具有保护作用,尤其是在神经元受损时[1~3]。有些学者认为,CSF-1通过刺激脑内小胶质细胞,由后者在释放炎症因子的同时释放神经营养因子而起到神经元保护作用的,其主要依据是,小胶质细胞是脑内CSF-1受体的拥有者[4]。研究表明,小胶质细胞受适当刺激后,可释放某些营养因子[5]同时也释放大量炎症因子和毒性因子,如小胶质细胞反应过度所释放的大量的白介素-1(IL-1),其自身及所引发的炎症反应均可导致神经元的严重损伤。鉴于小胶质对神经元影响的复杂性,本研究拟应用原位杂交和免疫组织化学等方法,对神经元能否表达并合成CSF-1受体、即能否接受该因子的直接作用进行了观察,以期解释该因子对神经元保护作用机制。
, http://www.100md.com
材料和方法
1.抗体
本实验选用了3种不同的抗CSF-1受体(c-fms)抗体:(1)抗c-fms整体分子抗体(Cambridge Research Biochemicals,England)。(2)选择性抗c-fms分子膜外段抗体(Upstate Biotechnology INC, N. Y.)。(3)选择性抗c-fms分子膜内段抗体(Upstate Biotechnology INC,N.Y.)。
2.探针制备
用DNA合成仪合成含有48个核苷酸的寡聚核苷酸探针(VCDNA services Calgary Canada),该探针选择性的互补于鼠CSF-1受体(c-fms)mRNA 904~951碱基序列(膜外段)[6]。用地高辛探针标记试剂盒(Boehringer Mannheim)作末端标记。
, 百拇医药
3. 细胞培养
按照文献[3]取小鼠脑皮层组织作神经元培养。将细胞接种于直径60mm的组织培养盘中。每盘中含6张poly-Lysine包被的玻片。细胞密度为5×105/盘,培养液为无血清DMEM或Honegger培养液。培养神经元的鉴定见下(4.4)
4. 免疫细胞化学
4.1 实验组:无血清脑皮层神经元培养5d后,将载有培养细胞的玻片,用冷Dulbecco生理平衡液(DPBS)冲洗后移入预冷(-20℃)甲醇固定10min,DPBS冲洗,然后用含有2%无脂奶粉的DPBS温育20min,以消除非特异性染色。第一抗体为1∶200稀释的兔抗c-fms抗体,4℃孵育过夜。第二抗体为生物素标记的抗兔IgG抗体(1∶500,Vector),室温30~45min。然后在卵白素-生物素-辣根过氧化物酶复合物(1∶100,Vector)中室温1h。上述各步骤间,均经含2%无脂奶粉的DPBS充分冲洗。呈色反应液为含0.1%H2O2,0.05%DAB,1.5%NiSO4的醋酸缓冲液(pH6.0),室温下显色1min。显色后经脱水,封片。
, 百拇医药
4.2 对照1:替代实验。用未经免疫的兔正常血清替代第一抗体(抗c-fms)孵育,其他处理同实验组。
4.3 对照2:吸收试验。分别用表达CSF-受体(c-fms)的小鼠巨噬细胞系5/10.14和不表达CSF受体(c-fms)EL4鼠淋巴瘤细胞与抗c-fms抗血清在37℃共孵育30min后离心,取上清液代替第一抗体进行免疫组织化学染色,其他处理同实验组。
4.4 对照3:双标记实验,以确定所标记细胞是否为神经元。用抗神经元特异性烯醇化酶(NSE)的单克隆小鼠抗体(耶鲁大学D.J.Barnstable,惠赠)1∶200稀释与抗c-fms多克隆兔抗体共孵育同一载有培养细胞的玻片,4℃孵育过夜。选用罗达明标记驴抗鼠IgG(Jackson Research Laboratory)和FITC标记的驴抗兔IgG(Jackson Research Laboratory)作为标记抗体稀释度均为1∶100,室温孵育1h。充分漂洗后用甘油:DBPS(1∶1)封片。Zeiss荧光显微镜观察、摄片。
, http://www.100md.com
5.分子原位杂交组织化学
5.1 实验组:将携有培养细胞的玻片,移入0.03mol/L PBS漂洗后(用DEPC处理过的双蒸水配制),迅速换入含4%多聚甲醛,5%冰醋酸的磷酸缓冲液中室温下固定细胞30min。0.03mol/L PBS充分漂洗(30min×2),入70%酒精4℃下保存。杂交前,经5×SSC漂洗后移入杂交缓冲液。其液含50%甲酰胺,4×SSC,1×Denhart溶液1%十二烷基肌氨酸钠,0.02mol/L PB(pH7.0),10%硫酸葡聚糖,0.5g/L热变性鱼精子DNA,0.2mol/L二硫苏糖醇以及0.002μg/L地高辛标记探针。在湿盒中42℃孵育16~18h后,在1×SSC中,于55℃洗4次,每次15min。然后用1∶2 000稀释的碱性磷酸酶标记的抗地高辛抗体(Boehringer Mannheim)孵育,室温下1h。漂洗后入含NBT,X-phosphate(Boehringer Mannheim)的Tris缓冲液显色。DPBS冲洗 以中止反应。甘油:DPBS(1∶1)封片。
, http://www.100md.com
5.2 对照试验:在杂交液中加入过量(800倍于标记探针)的未标记的同源冷探针或过量的具有相同长度和相似C-G含量比的未标记的无关探针行杂交反应,其他处理同实验组。
结 果
1.免疫组织化学组
用3种针对CSF-1受体(c-fms)分子不同部分的抗体作免疫细胞染色,尽管免疫反应强度有所区别,但几乎所有细胞均显示免疫染色阳性(图1)。抗体吸收和替代实验的结果为用相关细胞系(携CSF-1受体的鼠巨噬细胞系5/10.14)吸收过的抗血清作免疫染色结果阴性(图2);用无关细胞系(不具有CSF-1受体的鼠淋巴细胞瘤EL4细胞)吸收过的抗血清作免疫染色,尽管染色强度较实验组略弱,但仍为阳性(图3);用非免疫同源兔血清替代实验用抗血清进行免疫染色,结果阴性。应用c-fms与NSE免疫双标记方法显示,所有标记细胞均为双重染色的双标记细胞。说明阳性细胞确系神经元(图4,5)。
, http://www.100md.com
2.原位杂交组
用地高辛标记特异性针对c-fms膜外段的探针在培养神经元上作原位杂交结果显示:全部培养神经元均表达c-fms mRNA。反应产物存在于胞浆,有向细胞一极集中趋势,并向大的突起内延伸(图6)。加入过量同源的冷探针组为阴性反应(图7);加入非同源冷探针组反应强度不变(图8)。
讨 论
随着神经内分泌免疫这一学科的兴起,近年来,有关细胞因子在神经系统中的功能意义的研究颇多。集落刺激因子CSF-1由于其在体内、外研究中均显示了对神经元的保护作用而引起了神经科学界的关注[1~3]。CSF-1基因敲除(gene knock out)小鼠(op/opmice)除显示低存活率和骨发育障碍外,尚有明确的脑发育迟滞和障碍。说明其在脑发育过程中也具有重要的作用[2]。于是CSF-1是如何并通过什么途径实现其对神经系统影响的,就成为进一步研究所必须解答的问题之一。而神经元是否拥有该因子的受体则是回答这一问题的关键。为此,本研究用免疫组织化学和原位杂交的方法在采用严格对照实验证明所用抗体、探针特异性的基础上,证实神经元自身具有表达并合成这一受体的能力,为CSF-1直接影响神经元功能活动提供了结构基础。说明该因子不仅参与了脑损伤过程中对小胶质细胞的功能调节,且可能直接作用于神经元,进而影响其功能。CSF-1受体(c-fms)是fms原癌基因编码的跨膜蛋白,酪氨酸激酶受体家族的成员之一[7,8]。研究表明与c-fms同属这一受体家族的c-kit与其相应配体(stem cell factor)结合后也产生相应的神经元保护效应。提示这类细胞因子及其相应受体对神经系统功能调解的研究具有广泛前景。
, http://www.100md.com
神经元能表达并合成CSF-1受体是CSF-1可能对神经元实施影响的前提。而存在于神经元表面的CSF-1受体是否具有生物学活性,换言之该受体能否与相应配体结合进而激活细胞内信号转导系统发挥其作用,是确定该因子能否直接影响神经元功能活动的关键,也是我们下一步工作的重点。







, 百拇医药
图版说明
图1 用抗c-fms抗血清行培养神经元免疫组织化学染色,所有培养细胞均显示c-fms样免疫反应阳性 ×600
图2 用经c-fms阳性细胞系(5/10.14)吸收过的抗c-fms血清行免疫组织化学染色,结果阴性 ×600
图3 用经c-fms阴性细胞系(EL4)吸收过的抗c-fms血清行免疫组织化学染色,所有培养细胞均显示c-fms样免疫反应性,但染色强度较吸收前有所减弱 ×600
图4,5 用抗c-fms和抗NSE免疫荧光双标记方法显示,c-fms一样(图4)和NSE一样(图5)免疫反应性定位在同一神经元上 ×600
图6 选用地高辛标记的选择性针对c-fms mRNA的寡聚核苷酸探针,在体外培养神经元上行原位杂交组织化学反应。所有神经元中均出现强杂交信号 ×800
, http://www.100md.com
图7 地高辛标记探针与过量(×800)未标记的同源冷探针混合行杂交反应,神经元中无杂交信号出现 ×800
图8 地高辛标记探针与过量(×800)未标记的异源冷探针混合行杂交反应,杂交信号与实验组无异
Explanation of figures
Fig. 1 Cultured neurons were treated with anti-CSF-1R(c-fms) antiserum. The neurons showed c-fms-like immunoreactivity. ×600
Fig. 2 Cultured neurons were treaied with anti-CSF-1R(c-fms) antiserum adsorbed with CSF-1Rpositive 5/10 14 cells. The neurons werenegative for c-fms-like immunoreactivit
, 百拇医药
Fig. 3 Cultured neuron treated with anti-CSF-IR(c-frns) antiserum adsorbed with CSF-1R negative EL4 cells. the neurons showed c-fms-likeimmunoreactivity. ×600
Fig. 4 , 5 Double immunofluorescent staining of anti-NSE and anticfms on cultured neurons. cfms(Fig4) and NSE(Fig 5) immunoreactivitywere co-localized in the same neurons. ×600
Fig-6 Neurons in culture were hybridized with DIG-labeled probe complementary to CSF-1R(c-fms) mRNA only. All of the neurons were labeled. × 800
, 百拇医药
Fig. 7 Neurons in culture were hybridized with DIG-labeled probe complemeniary to CSF-1R(cfms) mRNA plus a 800fold excess of cold unlabeled probe. None of the neurons were labeled. ×800
Fig. 8 Neurons in culture were hybridized with DIG-labeled probe complemeniary to CSF-1R(cfms) mRNA plus a 800-fold excess of dissimilar probe with sirnilar length and G-C content. All of the neurons were labeled. ×800
△ Department of Neurosurgery, Navy General Hospital, 6 Fucheng Road Beijing 100037,China
, 百拇医药
参考文献
1 Berezovskaya O, Maysinger D, Fedoroff S. Colony stimulating factor-1 potentiates neuronal survival in cerebral cortex ischemic lesion. Acta Neuropathol,1996,92(5):479
2 Michaelson MD, Bieri PL,Mehler MF, et al. CSF-1 deficiency in mice results in abnormal brain development. Development,1996,122(9):2661
3 Wang YQ, Berezovskaya O, Fedoroff S. Expression of colony stimulating factor-1 receptor(CSF-1) by CNS neurons in mice. J Neurosci Res, 1999,in press
, http://www.100md.com
4 Sawada M, Suzumura A, Marunouchi T. Cytokine network in the central nervous system and its roles in growth and differentiation of glial and neuronal cells. Int J Dev Neurosci,1995,13(3/4):253
5 Nagata K, Takei N, Nakajima K, et al. Microglia conditioned medium promotes survival and development of cultured mesencephalic neurons from embryonic rat brain. J Neurosci Res,1993,34(3):357
6 Rothwell VM, Rohrschneider LR. Murine c-fms cDNA:cloning, sequence analysis and retroviral expression. Oncogene Res,1987,1(4):311
7 Sherr CJ. Colony stimulating factor-1 receptor. Blood, 1990,75(1):1
8 Hunter T. Tyrosine phosphorylation:past, present and future. Biochem Soc Transact,1996,24(2):307
收稿1998-10 修回1999-04, 百拇医药