镉对大鼠前列腺损伤及锌保护的超微结构与硫胺素焦磷酸酶细胞化学的研究
作者:罗子国 李维信
单位:罗子国(重庆医科大学电镜室,生殖医学超微结构实验室,重庆,400016);李维信(重庆医科大学电镜室,生殖医学超微结构实验室,重庆,400016)
关键词:前列腺;超微结构;硫胺素焦磷酸酶(TPPase);镉;锌;大鼠
解剖学报000419 【摘要】 目的 研究镉对大鼠前列腺腹侧叶的超微结构影响及锌保护作用。 方法 小剂量氯化镉(2 mg/kg体重)及锌腹腔内注射后用透射电镜观察及硫胺素焦磷酸酶(TPPase)电镜细胞化学定量分析。 结果 镉注射后4 h,前列腺上皮主细胞出现轻微的超微结构改变,3~7 d呈明显退变,15 d退变减轻,出现粗面内质网(RER)形成的同心圆性小体,30~60 d基本恢复正常。镉注射后4 h,TPPase反应产物较正常组减少,3 d和15 d进一步减少。锌保护组较相应的单纯镉组的超微结构损伤轻,且TPPase反应产物也较多。 结论 镉对大鼠前列腺腹侧叶上皮主细胞早期直接损伤较轻,所致TPPase反应产物减少明显。锌对镉所致主细胞超微结构损伤及TPPase活性降低均有保护作用。研究镉对大鼠前列腺腹侧叶的超微结构影响及锌保护作用。 方法 小剂量氯化镉(2 mg/kg体重)及锌腹腔内注射后用透射电镜观察及硫胺素焦磷酸酶(TPPase)电镜细胞化学定量分析。 结果 镉注射后4 h,前列腺上皮主细胞出现轻微的超微结构改变,3~7 d呈明显退变,15 d退变减轻,出现粗面内质网(RER)形成的同心圆性小体,30~60 d基本恢复正常。镉注射后4 h,TPPase反应产物较正常组减少,3 d和15 d进一步减少。锌保护组较相应的单纯镉组的超微结构损伤轻,且TPPase反应产物也较多。 结论 镉对大鼠前列腺腹侧叶上皮主细胞早期直接损伤较轻,所致TPPase反应产物减少明显。锌对镉所致主细胞超微结构损伤及TPPase活性降低均有保护作用。
, 百拇医药
【中图分类号】 R994.6 【文献标识码】 A 【文章编号】 0529-1356(2000)04-368
THE INJURIOUS EFFECTS OF CADMIUM AND PROTECTION
OF ZINC ON ULTRASTRUCTURE AND CYTOCHEMISTRY OF
TPPase OF PROSTATE IN RAT
LUO Zi-guo LI Wei-xin
(Laboratory of Electron Microscopy, Chongqing University of Medical Sciences, Chongqing 400016, China)
, 百拇医药
【Abstract】 Objective
To study the ultrastructural effects of cadmium(Cd) and protection of zinc(Zn) on ventral prostate in rat. Methods The rats were intraperitoneally injected with CdCl2 (2 mg/kg body weight) and Cd+Zn. The specimens were investigated by transmission electron microscope and quantitative analysis of the changes of the cytochemical reactive product of TPPase. Results Mild ultrastructural alterations of principal cells of prostate were detected after 4 hours of Cd treatment. The changes became most prominent within 3-7 days, but tended to alleviate after 15 days. After 30-60 days, the cells had recovered almost to normal. TPPase reactive product of principal cells decreased 4 hours after Cd treatment and became further reduced after 3 and 15 days. The protective effects of Zn on Cd-induced injuries and TPPase reactivity of principal cells were pronounced. Conclusion The early directed injurious effects of Cd on the ultrastructure and TPPase activity in principal cells of ventral prostate in rat were milder. Zn had obvious protective effects on the injuries by cadmium.
, 百拇医药
【Key words】 Ventral prostate; Ultrastructure; TPPase; Cadmium; Zinc; Rat
前列腺是雄性生殖系统的重要附属性腺,其分泌物占精液成分的30%,同时可分泌多种活性物质。它的正常结构和功能依赖雄激素的作用,阉割大鼠后前列腺体积明显变小,上皮萎缩[1]。镉可致多器官损害,半衰期很长,对人的生殖功能具有潜在的危害性[2]。镉在电池、电镀及半导体工业中应用广泛,对其毒害作用的研究受到了多学科的重视。我们曾报道小剂量氯化镉(2 mg/kg体重)可致大鼠睾丸、附睾、精囊腺和输精管出现超微结构的明显损伤,雄激素水平下降,锌对镉所致损伤有保护作用[3~6]。有关镉对前列腺的影响,文献报道多集中在通过饮水给药或注射后长期所致的慢性损伤。对正常人及前列腺增生和前列腺癌患者的前列腺组织与血浆中镉、锌浓度的关系也有报道[7~9]。但有关镉对前列腺早期损伤及锌保护作用尚未见报道。本研究通过超微结构观察及高尔基复合体标志酶TPPase电镜细胞化学定量分析,探讨小剂量氯化镉对大鼠前列腺腹侧叶上皮主细胞的影响和锌的保护作用及其机理。
, http://www.100md.com
材料和方法
1. 动物分组、取材及电镜样品制备
健康成年雄性Wistar大鼠51只,体重195~240 g,分单纯镉组、镉加锌组和对照组,其中单纯镉组32只,镉加锌组8只,对照组11只。单纯镉组按2 mg/kg体重剂量,一次腹腔内注射0.1%氯化镉(生理盐水配制),分别于4 h、1、3、7、15、30及60 d取材。镉加锌组分3次注射,先注射1%醋酸锌15 mg/kg体重,2 h后注射氯化镉2 mg/kg体重和醋酸锌50 mg/kg体重,再间隔2 h注射醋酸锌15 mg/kg体重,醋酸锌总剂量为80 mg/kg体重,分别于3 d和15 d后取材,对照组腹腔内注射等体积的生理盐水。氯化镉、醋酸锌的注射剂量及方法参照Saksena[10]等的报道。
切取大鼠前列腺腹侧叶左叶小块组织,用磷酸盐缓冲液配制的4%戊二醛及1%四氧化锇作预固定和后固定(pH7.2~7.4),酒精及丙酮逐级脱水,作半薄切片经1%次甲基蓝-天青Ⅱ染色后,光镜下定位腺泡,再制备超薄切片。用醋酸双氧铀及枸橼酸铅染色,H-600型透射电镜观察。
, 百拇医药
2. TPPase 电镜细胞化学样品制备
取单纯镉注射后4 h、3 d、15 d及镉加锌3 d、15 d和对照组共6组动物前列腺腹侧叶右叶小块组织,经提纯的2.5%戊二醛固定1 h,再制备厚约100μm的薄片,置入孵育液(主要含硫胺素焦磷酸、氯化锰、硝酸铅等)37℃孵育90 min。对照孵育液去底物硫胺素焦磷酸。孵育后用Tris-Maleate缓冲液漂洗30 min(pH7.2),转入磷酸盐缓冲液(pH 7.2~7.4),经1%四氧化锇后固定1 h,再转入常规电镜样品制备,但超薄切片不经枸橼酸铅染色。
3. 主细胞TPPase电镜细胞化学定量分析
透射电镜下恒定放大25 000倍,每组随机拍摄上皮不同主细胞核上区胞质高尔基复合体区10张,共60张照片。运用CM-2000生物医学图像分析系统对照片TPPase反应产物总面积与背景面积之比(TA/BA)进行测量。所有测量数据均以平均值±标准差( ±s)表示,采用方差分析,并作多组比较。SPSS 8.0软件运算,微机自动处理结果。
±s)表示,采用方差分析,并作多组比较。SPSS 8.0软件运算,微机自动处理结果。
, 百拇医药
结 果
1. 大鼠前列腺腹侧叶正常超微结构
正常大鼠前列腺腹侧叶上皮属假复层柱状上皮,由主细胞和基细胞组成。主细胞胞质在电镜下可分为顶区、高尔基区、核周区和基底区。顶部微绒毛(MV)长短不等,部分主细胞顶区可见含有中等或低电子密度的分泌颗粒及有衣小泡。高尔基区具有多个高尔基复合体,高尔基复合体含有典型的扁平囊泡、运输小泡及不同电子密度的分泌泡。高尔基区胞质内,还具有少量多泡小体及一些溶酶体。核周区含有大量平行排列的粗面内质网(RER),其腔内含有低电子密度的絮状物质。基底部有散在的RER和线粒体。核位于细胞的基底部,呈圆形或椭圆形,异染色质较少,核仁明显(图1)。
2. 镉对前列腺腹侧叶主细胞损伤的超微结构改变
镉注射后4 h即见大部分主细胞的部分线粒体有内室肿胀,其中一些线粒体还有髓样结构改变。此外,在部分主细胞侧壁质膜也见有髓样结构,但RER基本正常(图2)。镉注射24 h后,主细胞的上述改变加重,表现为有较多线粒体内室肿胀,髓样结构数量增多,且见部分主细胞的高尔基复合体扁平囊泡明显扩大,排列紊乱。3~7 d阶段,上皮主细胞线粒体广泛肿胀伴空泡化,高尔基复合体扁平囊泡的扩张更加严重,甚至有少数主细胞高尔基复合体的扁平囊泡膜破裂,融合成多个不规则的大空泡。部分主细胞核异染色质边集,但RER基本正常(图3)。15 d组,大多数主细胞的高尔基复合体扁平囊泡仅有轻度扩张,但其腔内充满低电子密度的絮状物质,而分泌颗粒极少见,提示其排泌功能受阻。溶酶体数量普遍增多,微绒毛稀少且短(图4)。30 d组,高尔基复合体数量较少,但形态基本正常,溶酶体数量更加增多,且部分主细胞内RER形成同心圆小体及出现池内封隔(图5)。镉注射后60 d,上皮大部分主细胞超微结构基本恢复正常,少数主细胞线粒体仍有轻度肿胀及有较多髓样结构,RER及分泌颗粒也较正常明显减少。
, 百拇医药
3. 锌对镉所致大鼠前列腺腹侧叶上皮主细胞损伤的保护
镉锌联合注射后3 d,上皮主细胞退变较单纯镉组轻,仅见部分线粒体内室肿胀及少量的髓样结构,高尔基复合体扁平囊泡轻度扩张,RER无明显改变(图6)。镉锌联合注射后15 d,与相应单纯镉组比较,其保护作用最为明显。表现为线粒体和高尔基复合体形态普遍基本正常,仍有部分RER腔扩张,腔内有大量低电子密度的物质蓄积,溶酶体也较单纯镉组少。细胞表面微绒毛减少,可见一些分泌颗粒(图7)。
4. 前列腺腹侧叶主细胞TPPase酶学图像分析结果
正常大鼠前列腺腹侧叶上皮主细胞高尔基复合体发达,TPPase反应产物呈高电子密度颗粒状,分布于高尔基复合体成熟面的扁平囊泡,其数量较多(图8)。在其他细胞器及胞质中呈阴性。
镉注射后4 h,高尔基复合体扁平囊泡内TPPase反应产物分布较松散且颗粒较大,数量减少。3 d和15 d组TPPase反应产物颗粒小而分散,数量进一步减少(图9,10)。锌保护3 d组TPPase反应产物数量与相应单纯镉组无明显差别(图11),而锌保护15 d组TPPase反应产物则较相应单纯镉组有明显增多(图12)。
, 百拇医药
图像分析结果经统计学处理表明,镉注射后4 h及3、15 d酶反应产物与背景面积之比(TA/BA)与对照组比较有显著差异(P<0.05),3组之间均有显著性差异(P<0.05),且呈递减趋势。锌保护3 d组与对照组(TA/BA)之间有显著性差异(P<0.05),与单纯镉3 d组之间无显著性差异(TA/BA),而锌保护15 d组与对照组(TA/BA)之间无显著性差异(P>0.05),与单纯镉15 d组(TA/BA)比则有显著性差异(P<0.05)。结果见附表。
附表 硫胺素焦磷酸酶(TPPase)超微酶学定量分析TA/BA( ±s)
±s)
Table Image analysis of ultrastructural localization of TPPase reactive product TA/BA( ±s) 给药后时间(time of treatment)
±s) 给药后时间(time of treatment)
, http://www.100md.com
组别(group)
4小时(4 h)
3日(3d)
15日(15d)
镉(Cd)
0.01 082±0.0 008 207a,b
0.0 070±0.0 008 470a,c,d
0.005 059±0.0 006 067a,b,c
镉+锌(Cd+Zn)
0.007 646±0.001 030a,c,d
, http://www.100md.com
0.01 782±0.002 480b,c,d
对照(control)
0.01 846±0.002 280
注:a.与对照组比较P<0.05;b.与单纯镉3d组及Cd+Zn3d组比较P<0.05;c.与单纯镉4 h比较P<0.05;d.与单纯镉15d组比较P<0.5;Notes:a,compared with control, P<0.05; b,compared with 3d after Cd and 3d after Cd+Zn,P<0.05; c,compared with 4 h after Cd; P<0.05; d,compared with 15d after Cd讨 论
大鼠前列腺腹侧叶上皮主细胞呈高柱状,具有旺盛的合成及分泌蛋白质的超微结构基础,表现为主细胞内有丰富的RER和发达的高尔基复合体。本研究重点观察了镉对大鼠前列腺这些结构的超微结构损伤和定位于高尔基复合体的TPPase活性影响,以及锌的保护作用。Fowler[2]等报道,小剂量CdCl2(2mg/kg体重)腹腔内注射只能选择性损伤大鼠睾丸而不引起其他器官改变。李维信[3~6]等的研究则认为该剂量的CdCl2不仅损伤睾丸,而且可致附睾、精囊腺及输精管超微结构损伤及AlPase、TPPase和G-6-Pase活性降低。Hoffmann[9]等报道用较大剂量的CdCl2(4.5 mg/kg~10.05 mg/kg体重)腹腔内多次注射后170~240 d,可致大鼠前列腺上皮主细胞出现不典型增生。Battersby[7]等研究结果表明含5 ppmCdCl2饮水喂养20周后,大鼠前列腺腹侧叶上皮无明显超微结构改变,而含50 ppmCdCl2饮水52周后,见主细胞出现不典型增生,但未见癌细胞。本研究结果表明:镉注射后4 h,大鼠前列腺腹侧叶主细胞已出现线粒体肿胀和髓样结构,24 h后改变加重,3~7 d损伤最明显,主要表现为线粒体肿胀,高尔基复合体扁平囊泡扩张,排列紊乱。15 d以后退变有所减轻。60 d后主细胞基本恢复正常,但部分主细胞的线粒体仍有轻度肿胀。
, 百拇医药
本研究所见镉所致前列腺上皮主细胞的早期损伤系肿胀溶解性的病理改变,与我们在睾丸、附睾、精囊腺及输精管所见的改变相似,说明镉对前列腺主细胞也有直接损伤作用。镉损伤机理与脂质过氧化作用有关,它可能通过抑制超氧化物岐化酶(SOD)活性,使活性中间氧水平升高,间接诱发细胞膜脂质过氧化,而致膜通透性增高。也有人认为游离的镉离子能抑制定位于膜上的磷脂合成酶系,最终使膜的类脂构成发生改变而致细胞损伤[5]。本研究结果见大鼠前列腺主细胞早期的损伤以线粒体及高尔基复合体为主,而RER的改变很轻,这与我们在附睾及精囊腺所见有不同,其原因尚待进一步研究。15 d以后主细胞出现RER排成的同心圆小体及池内封隔现象,以及溶酶体数量增多,可能与镉能损伤睾丸间质细胞而致雄激素水平下降有关[4]。文献报道大鼠阉割后4 h,可见前列腺腹侧叶主细胞的RER呈同心圆状排列和自噬体形成,溶酶体数量增多[1,11]。对RER的同心圆小体出现原因有不同的观点,有人认为这是一种细胞退行性改变,也有人认为是增生性变化。一般认为池内封隔是含RER丰富的细胞处理过剩RER或细胞萎缩的表现,而上述两者皆与自噬体形成有关[12]。
, http://www.100md.com
TPPase是高尔基复合体的标志酶,与高尔基复合体内糖基化过程中的糖基转移酶活性有密切关系,它定位于成熟面扁平囊泡,系细胞合成分泌功能状态的重要标记。镉注射后4 h,TPPase反应产物明显减少,3 d和15 d进一步减少。4 h和3 d组TPPase反应产物减少与镉对主细胞的直接损伤所致肿胀溶解性改变有关[3~6]。此外该酶反应产物的减少还先于超微结构的改变,这也提示镉具有直接损伤作用。豚鼠阉割后6周前列腺背侧叶及精囊腺主细胞高尔基复合体的TPPase反应产物才有减少,说明雄激素水平下降所致的损伤出现较晚[4]。陶均等[13]用Tamoxifen (100 mg/kg体重)喂养大鼠5 d后见前列腺腹侧叶主细胞TPPase反应产物减少。本研究所见镉注射后15 d出现的TPPase反应产物明显减少,提示与镉致睾丸间质细胞损伤所引起的血清睾酮浓度下降的进一步加重损伤有关。
锌是维持哺乳动物生殖器官功能不可缺少的微量元素。我们曾报道锌对镉所致大鼠睾丸、附睾及输精管损伤皆有良好的保护作用[3,5,6]。正常人血浆锌镉浓度的比值仅为前列腺组织的1/3,在前列腺疾病(前列腺增生及前列腺癌)状态下,这一比值明显变大[8],说明锌对维持前列腺的正常功能具有重要的作用。本研究结果表明,锌对镉所致前列腺主细胞的超微结构损伤及TPPase活性均有明显的保护作用。其机理可能与通过诱导金属硫蛋白(MT)的产生,以更多的Cd-MT结合形式贮存在胞质内,以及锌能直接与镉竞争主要大分子上的高亲和位点,从而减少镉的直接损伤作用有关。本研究15 d锌保护组TPPase反应产物的明显增多,可能与锌对镉所致睾丸间质细胞损伤所具有的保护作用,促使前列腺主细胞退变减轻有关。
, 百拇医药
本文图1~12见插图第17,18页
图1 正常大鼠前列腺腹侧叶主细胞,可见细胞核(N)、粗面内质网(RER)、高尔基区(↑↑)、线粒体(▲)、分泌颗粒(↑)、腺腔(Lu) ×5 000
Fig.1 Principal cells of ventral prostate from normal rat. N, nuclei;RER, rough endoplasmic reticulum; Golji region(↑↑); Mitochdria(▲);secretory granule(↑);Lu,lumen.×5 000
图2 镉注射后4 h,细胞核(N)正常,线粒体内可见髓样结构(My) ×10 000
, 百拇医药
Fig.2 4h after Cd treatment, N, nuclei; My, mylin figure in Mitochondria and plasma membrane.×10 000
图3 镉注射后3 d,高尔基复合体(Go)扩张,线粒体(Mi)肿胀,并有髓样结构。粗面内质网基本正常 ×10 000
Fig.3 Dilation of Golji complex(Go) and swelling of mitochondria(Mi) of principal cell from 3 days after Cd treatment.×10 000
图4 镉注射后15 d,高尔基复合体轻度扩张,溶酶体(Ly)、粗面内质网基本正常 ×8 000
, 百拇医药
Fig.4 Milder dilation of Golji complex(Go); Iysosome(Ly) of principal cell from 15 days after Cd treatment.×10 000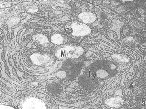
图5 镉注射后30 d,主细胞粗面内质网形成的内同心圆性小体,其内有溶酶体和肿胀的线粒体(Mi),并可见池内封隔(▲) ×20 000
Fig.5 Concentric lamellar body of RER from 30 days after Cd treatment. Mi, mitochondria; Ly, lysosome; ▲,Intracisternal sequestration of RER ×20 000
, 百拇医药
图6 镉锌联合注射后3 d,主细胞线粒体肿胀,细胞核、高尔基复合体轻度扩张,Lu.腺腔 ×10 000
Fig.6 Swelling of mitochondria(Mi),N,nuclei; and milder dilation of Golji complex(Go); lumen(Lu) of 3 days Cd+Zn treatment.×10 000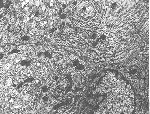
图7 镉锌联合注射后15d,主细胞基本正常。×8000
Fig.7 Principal cells almost normal of 15days Vd+Zn treatment.×8000
, 百拇医药
图8 正常大鼠前列腺主细胞高尔基复合体TPPase反应产物多。×25000
Fig.8 TPPase reactive product of Go in principal cell from prostate of normal rat.×25000
图9 镉注射后3d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.9 TPPase reactive product of Go in principal cell from prostate 3 days after Cd treatment.×25000
, http://www.100md.com 图10 镉注射后15d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.10 TPPase reactive product of Goin principal cell from prostate 15 days after Cd treatment.×25000
图11 镉锌联合体注射后3d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.11 TPPase teactive product of Go principal cell from prostate 3 days after Cd add Zn treatnent.×25000
, http://www.100md.com
图12 镉锌联合注射后15d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.11 TPPase teactive product of Go principal cell from prostate 15 days after Cd add Zn treatnent.×25000
【作者简介】 罗子国(1963—),男(汉族),四川剑阁县人,医学硕士,讲师
参考文献
[1]Gunn SA, Gould TC. Vasculature of the testis and adnexa. In:Greep RO, et al(eds). Handbook of Physiology. Section 7:Endocrinology. Vol 5:Male Reproductive System(M). Washington:Am Physiol Soc, 1975:362-368.
, 百拇医药
[2]Fowler AJ, Singh DN, Dwivedi C. Effect of cadmium on meiosis[J]. Bull Environm Contam Toxicol, 1982,29(4):412-415.
[3]李维信,廖晓岗,唐宜,等.镉对大鼠睾丸的损伤及锌保护作用的超微结构研究[J].解剖学报,1988,19(1):74~78.
[4]徐晨,李维信.镉对大鼠精囊腺超微结构及TPPase细胞化学和血清睾酮含量的影响[J].解剖学报,1997,28(3):209~214.
[5]罗子国,李维信.镉对大鼠输精管损伤及锌保护的超微结构与葡萄糖-6-磷酸酶细胞化学的研究[J].解剖学报,1999,30(1):86~89.
[6]廖晓岗,李维信.镉对大鼠睾丸间质细胞损伤及锌对其保护的形态学研究[J].生殖与避孕,1999,19(5):290~295.
, http://www.100md.com
[7]Bettersby S, Chandler JA, Morton MS. The effect of orally administered cadmium on the ultrastructure of the rat prostate[J]. Urol Res,1982,10(3):123-130.
[8]Ogunlewe JO, Osegbe DN. Zinc and cadmium concentrations in indigenous blacks with normal, hypertrophic, and malignant prostate[J]. Cancer, 1989,63(7):1388-1392.
[9]Hoffmann L, Putzke HP, Bendel L, et al. Electron microscopic results on the ventral prostate of the rat after CdCl2 administration. A contribution towards etiology of the cancer of the prostate[J]. J Cancer Res Clin Oncol,1988,114(3):273-278.
, 百拇医药
[10]Saksena S, White MJ, Mertzluff J, et al. Prevention of cadmium-induced sterility by zinc in the male rat[J]. Contraception, 1983,27(5):521-530.
[11]Wilson MJ, Whitaker JN, Sinha AA. Immunocytochemical localization of cathepsin D in rat ventral prostate:evidence for castration-induced expression of cathepsin D in basal cells[J]. Anat Rec, 1991,229(3):321-333.
[12]Ghadially FN. Ultrastructural pathology of the cell and matrix[M]. Vol 1, 3rd ed, London:Butterworths, 1988:516-571.
[13]陶均,朱继业,王一飞,等.Tamoxifen对大鼠前列腺上皮细胞形态结构及酸性磷酸酶、硫胺素焦磷酸酶活性的影响[J].细胞生物学杂志,1986,8(4):171~174.
【收稿日期】 1999-12-24
【修回日期】 2000-05-08, 百拇医药
单位:罗子国(重庆医科大学电镜室,生殖医学超微结构实验室,重庆,400016);李维信(重庆医科大学电镜室,生殖医学超微结构实验室,重庆,400016)
关键词:前列腺;超微结构;硫胺素焦磷酸酶(TPPase);镉;锌;大鼠
解剖学报000419 【摘要】 目的 研究镉对大鼠前列腺腹侧叶的超微结构影响及锌保护作用。 方法 小剂量氯化镉(2 mg/kg体重)及锌腹腔内注射后用透射电镜观察及硫胺素焦磷酸酶(TPPase)电镜细胞化学定量分析。 结果 镉注射后4 h,前列腺上皮主细胞出现轻微的超微结构改变,3~7 d呈明显退变,15 d退变减轻,出现粗面内质网(RER)形成的同心圆性小体,30~60 d基本恢复正常。镉注射后4 h,TPPase反应产物较正常组减少,3 d和15 d进一步减少。锌保护组较相应的单纯镉组的超微结构损伤轻,且TPPase反应产物也较多。 结论 镉对大鼠前列腺腹侧叶上皮主细胞早期直接损伤较轻,所致TPPase反应产物减少明显。锌对镉所致主细胞超微结构损伤及TPPase活性降低均有保护作用。研究镉对大鼠前列腺腹侧叶的超微结构影响及锌保护作用。 方法 小剂量氯化镉(2 mg/kg体重)及锌腹腔内注射后用透射电镜观察及硫胺素焦磷酸酶(TPPase)电镜细胞化学定量分析。 结果 镉注射后4 h,前列腺上皮主细胞出现轻微的超微结构改变,3~7 d呈明显退变,15 d退变减轻,出现粗面内质网(RER)形成的同心圆性小体,30~60 d基本恢复正常。镉注射后4 h,TPPase反应产物较正常组减少,3 d和15 d进一步减少。锌保护组较相应的单纯镉组的超微结构损伤轻,且TPPase反应产物也较多。 结论 镉对大鼠前列腺腹侧叶上皮主细胞早期直接损伤较轻,所致TPPase反应产物减少明显。锌对镉所致主细胞超微结构损伤及TPPase活性降低均有保护作用。
, 百拇医药
【中图分类号】 R994.6 【文献标识码】 A 【文章编号】 0529-1356(2000)04-368
THE INJURIOUS EFFECTS OF CADMIUM AND PROTECTION
OF ZINC ON ULTRASTRUCTURE AND CYTOCHEMISTRY OF
TPPase OF PROSTATE IN RAT
LUO Zi-guo LI Wei-xin
(Laboratory of Electron Microscopy, Chongqing University of Medical Sciences, Chongqing 400016, China)
, 百拇医药
【Abstract】 Objective
To study the ultrastructural effects of cadmium(Cd) and protection of zinc(Zn) on ventral prostate in rat. Methods The rats were intraperitoneally injected with CdCl2 (2 mg/kg body weight) and Cd+Zn. The specimens were investigated by transmission electron microscope and quantitative analysis of the changes of the cytochemical reactive product of TPPase. Results Mild ultrastructural alterations of principal cells of prostate were detected after 4 hours of Cd treatment. The changes became most prominent within 3-7 days, but tended to alleviate after 15 days. After 30-60 days, the cells had recovered almost to normal. TPPase reactive product of principal cells decreased 4 hours after Cd treatment and became further reduced after 3 and 15 days. The protective effects of Zn on Cd-induced injuries and TPPase reactivity of principal cells were pronounced. Conclusion The early directed injurious effects of Cd on the ultrastructure and TPPase activity in principal cells of ventral prostate in rat were milder. Zn had obvious protective effects on the injuries by cadmium.
, 百拇医药
【Key words】 Ventral prostate; Ultrastructure; TPPase; Cadmium; Zinc; Rat
前列腺是雄性生殖系统的重要附属性腺,其分泌物占精液成分的30%,同时可分泌多种活性物质。它的正常结构和功能依赖雄激素的作用,阉割大鼠后前列腺体积明显变小,上皮萎缩[1]。镉可致多器官损害,半衰期很长,对人的生殖功能具有潜在的危害性[2]。镉在电池、电镀及半导体工业中应用广泛,对其毒害作用的研究受到了多学科的重视。我们曾报道小剂量氯化镉(2 mg/kg体重)可致大鼠睾丸、附睾、精囊腺和输精管出现超微结构的明显损伤,雄激素水平下降,锌对镉所致损伤有保护作用[3~6]。有关镉对前列腺的影响,文献报道多集中在通过饮水给药或注射后长期所致的慢性损伤。对正常人及前列腺增生和前列腺癌患者的前列腺组织与血浆中镉、锌浓度的关系也有报道[7~9]。但有关镉对前列腺早期损伤及锌保护作用尚未见报道。本研究通过超微结构观察及高尔基复合体标志酶TPPase电镜细胞化学定量分析,探讨小剂量氯化镉对大鼠前列腺腹侧叶上皮主细胞的影响和锌的保护作用及其机理。
, http://www.100md.com
材料和方法
1. 动物分组、取材及电镜样品制备
健康成年雄性Wistar大鼠51只,体重195~240 g,分单纯镉组、镉加锌组和对照组,其中单纯镉组32只,镉加锌组8只,对照组11只。单纯镉组按2 mg/kg体重剂量,一次腹腔内注射0.1%氯化镉(生理盐水配制),分别于4 h、1、3、7、15、30及60 d取材。镉加锌组分3次注射,先注射1%醋酸锌15 mg/kg体重,2 h后注射氯化镉2 mg/kg体重和醋酸锌50 mg/kg体重,再间隔2 h注射醋酸锌15 mg/kg体重,醋酸锌总剂量为80 mg/kg体重,分别于3 d和15 d后取材,对照组腹腔内注射等体积的生理盐水。氯化镉、醋酸锌的注射剂量及方法参照Saksena[10]等的报道。
切取大鼠前列腺腹侧叶左叶小块组织,用磷酸盐缓冲液配制的4%戊二醛及1%四氧化锇作预固定和后固定(pH7.2~7.4),酒精及丙酮逐级脱水,作半薄切片经1%次甲基蓝-天青Ⅱ染色后,光镜下定位腺泡,再制备超薄切片。用醋酸双氧铀及枸橼酸铅染色,H-600型透射电镜观察。
, 百拇医药
2. TPPase 电镜细胞化学样品制备
取单纯镉注射后4 h、3 d、15 d及镉加锌3 d、15 d和对照组共6组动物前列腺腹侧叶右叶小块组织,经提纯的2.5%戊二醛固定1 h,再制备厚约100μm的薄片,置入孵育液(主要含硫胺素焦磷酸、氯化锰、硝酸铅等)37℃孵育90 min。对照孵育液去底物硫胺素焦磷酸。孵育后用Tris-Maleate缓冲液漂洗30 min(pH7.2),转入磷酸盐缓冲液(pH 7.2~7.4),经1%四氧化锇后固定1 h,再转入常规电镜样品制备,但超薄切片不经枸橼酸铅染色。
3. 主细胞TPPase电镜细胞化学定量分析
透射电镜下恒定放大25 000倍,每组随机拍摄上皮不同主细胞核上区胞质高尔基复合体区10张,共60张照片。运用CM-2000生物医学图像分析系统对照片TPPase反应产物总面积与背景面积之比(TA/BA)进行测量。所有测量数据均以平均值±标准差(
 ±s)表示,采用方差分析,并作多组比较。SPSS 8.0软件运算,微机自动处理结果。
±s)表示,采用方差分析,并作多组比较。SPSS 8.0软件运算,微机自动处理结果。, 百拇医药
结 果
1. 大鼠前列腺腹侧叶正常超微结构
正常大鼠前列腺腹侧叶上皮属假复层柱状上皮,由主细胞和基细胞组成。主细胞胞质在电镜下可分为顶区、高尔基区、核周区和基底区。顶部微绒毛(MV)长短不等,部分主细胞顶区可见含有中等或低电子密度的分泌颗粒及有衣小泡。高尔基区具有多个高尔基复合体,高尔基复合体含有典型的扁平囊泡、运输小泡及不同电子密度的分泌泡。高尔基区胞质内,还具有少量多泡小体及一些溶酶体。核周区含有大量平行排列的粗面内质网(RER),其腔内含有低电子密度的絮状物质。基底部有散在的RER和线粒体。核位于细胞的基底部,呈圆形或椭圆形,异染色质较少,核仁明显(图1)。
2. 镉对前列腺腹侧叶主细胞损伤的超微结构改变
镉注射后4 h即见大部分主细胞的部分线粒体有内室肿胀,其中一些线粒体还有髓样结构改变。此外,在部分主细胞侧壁质膜也见有髓样结构,但RER基本正常(图2)。镉注射24 h后,主细胞的上述改变加重,表现为有较多线粒体内室肿胀,髓样结构数量增多,且见部分主细胞的高尔基复合体扁平囊泡明显扩大,排列紊乱。3~7 d阶段,上皮主细胞线粒体广泛肿胀伴空泡化,高尔基复合体扁平囊泡的扩张更加严重,甚至有少数主细胞高尔基复合体的扁平囊泡膜破裂,融合成多个不规则的大空泡。部分主细胞核异染色质边集,但RER基本正常(图3)。15 d组,大多数主细胞的高尔基复合体扁平囊泡仅有轻度扩张,但其腔内充满低电子密度的絮状物质,而分泌颗粒极少见,提示其排泌功能受阻。溶酶体数量普遍增多,微绒毛稀少且短(图4)。30 d组,高尔基复合体数量较少,但形态基本正常,溶酶体数量更加增多,且部分主细胞内RER形成同心圆小体及出现池内封隔(图5)。镉注射后60 d,上皮大部分主细胞超微结构基本恢复正常,少数主细胞线粒体仍有轻度肿胀及有较多髓样结构,RER及分泌颗粒也较正常明显减少。
, 百拇医药
3. 锌对镉所致大鼠前列腺腹侧叶上皮主细胞损伤的保护
镉锌联合注射后3 d,上皮主细胞退变较单纯镉组轻,仅见部分线粒体内室肿胀及少量的髓样结构,高尔基复合体扁平囊泡轻度扩张,RER无明显改变(图6)。镉锌联合注射后15 d,与相应单纯镉组比较,其保护作用最为明显。表现为线粒体和高尔基复合体形态普遍基本正常,仍有部分RER腔扩张,腔内有大量低电子密度的物质蓄积,溶酶体也较单纯镉组少。细胞表面微绒毛减少,可见一些分泌颗粒(图7)。
4. 前列腺腹侧叶主细胞TPPase酶学图像分析结果
正常大鼠前列腺腹侧叶上皮主细胞高尔基复合体发达,TPPase反应产物呈高电子密度颗粒状,分布于高尔基复合体成熟面的扁平囊泡,其数量较多(图8)。在其他细胞器及胞质中呈阴性。
镉注射后4 h,高尔基复合体扁平囊泡内TPPase反应产物分布较松散且颗粒较大,数量减少。3 d和15 d组TPPase反应产物颗粒小而分散,数量进一步减少(图9,10)。锌保护3 d组TPPase反应产物数量与相应单纯镉组无明显差别(图11),而锌保护15 d组TPPase反应产物则较相应单纯镉组有明显增多(图12)。
, 百拇医药
图像分析结果经统计学处理表明,镉注射后4 h及3、15 d酶反应产物与背景面积之比(TA/BA)与对照组比较有显著差异(P<0.05),3组之间均有显著性差异(P<0.05),且呈递减趋势。锌保护3 d组与对照组(TA/BA)之间有显著性差异(P<0.05),与单纯镉3 d组之间无显著性差异(TA/BA),而锌保护15 d组与对照组(TA/BA)之间无显著性差异(P>0.05),与单纯镉15 d组(TA/BA)比则有显著性差异(P<0.05)。结果见附表。
附表 硫胺素焦磷酸酶(TPPase)超微酶学定量分析TA/BA(
 ±s)
±s)Table Image analysis of ultrastructural localization of TPPase reactive product TA/BA(
 ±s) 给药后时间(time of treatment)
±s) 给药后时间(time of treatment), http://www.100md.com
组别(group)
4小时(4 h)
3日(3d)
15日(15d)
镉(Cd)
0.01 082±0.0 008 207a,b
0.0 070±0.0 008 470a,c,d
0.005 059±0.0 006 067a,b,c
镉+锌(Cd+Zn)
0.007 646±0.001 030a,c,d
, http://www.100md.com
0.01 782±0.002 480b,c,d
对照(control)
0.01 846±0.002 280
注:a.与对照组比较P<0.05;b.与单纯镉3d组及Cd+Zn3d组比较P<0.05;c.与单纯镉4 h比较P<0.05;d.与单纯镉15d组比较P<0.5;Notes:a,compared with control, P<0.05; b,compared with 3d after Cd and 3d after Cd+Zn,P<0.05; c,compared with 4 h after Cd; P<0.05; d,compared with 15d after Cd讨 论
大鼠前列腺腹侧叶上皮主细胞呈高柱状,具有旺盛的合成及分泌蛋白质的超微结构基础,表现为主细胞内有丰富的RER和发达的高尔基复合体。本研究重点观察了镉对大鼠前列腺这些结构的超微结构损伤和定位于高尔基复合体的TPPase活性影响,以及锌的保护作用。Fowler[2]等报道,小剂量CdCl2(2mg/kg体重)腹腔内注射只能选择性损伤大鼠睾丸而不引起其他器官改变。李维信[3~6]等的研究则认为该剂量的CdCl2不仅损伤睾丸,而且可致附睾、精囊腺及输精管超微结构损伤及AlPase、TPPase和G-6-Pase活性降低。Hoffmann[9]等报道用较大剂量的CdCl2(4.5 mg/kg~10.05 mg/kg体重)腹腔内多次注射后170~240 d,可致大鼠前列腺上皮主细胞出现不典型增生。Battersby[7]等研究结果表明含5 ppmCdCl2饮水喂养20周后,大鼠前列腺腹侧叶上皮无明显超微结构改变,而含50 ppmCdCl2饮水52周后,见主细胞出现不典型增生,但未见癌细胞。本研究结果表明:镉注射后4 h,大鼠前列腺腹侧叶主细胞已出现线粒体肿胀和髓样结构,24 h后改变加重,3~7 d损伤最明显,主要表现为线粒体肿胀,高尔基复合体扁平囊泡扩张,排列紊乱。15 d以后退变有所减轻。60 d后主细胞基本恢复正常,但部分主细胞的线粒体仍有轻度肿胀。
, 百拇医药
本研究所见镉所致前列腺上皮主细胞的早期损伤系肿胀溶解性的病理改变,与我们在睾丸、附睾、精囊腺及输精管所见的改变相似,说明镉对前列腺主细胞也有直接损伤作用。镉损伤机理与脂质过氧化作用有关,它可能通过抑制超氧化物岐化酶(SOD)活性,使活性中间氧水平升高,间接诱发细胞膜脂质过氧化,而致膜通透性增高。也有人认为游离的镉离子能抑制定位于膜上的磷脂合成酶系,最终使膜的类脂构成发生改变而致细胞损伤[5]。本研究结果见大鼠前列腺主细胞早期的损伤以线粒体及高尔基复合体为主,而RER的改变很轻,这与我们在附睾及精囊腺所见有不同,其原因尚待进一步研究。15 d以后主细胞出现RER排成的同心圆小体及池内封隔现象,以及溶酶体数量增多,可能与镉能损伤睾丸间质细胞而致雄激素水平下降有关[4]。文献报道大鼠阉割后4 h,可见前列腺腹侧叶主细胞的RER呈同心圆状排列和自噬体形成,溶酶体数量增多[1,11]。对RER的同心圆小体出现原因有不同的观点,有人认为这是一种细胞退行性改变,也有人认为是增生性变化。一般认为池内封隔是含RER丰富的细胞处理过剩RER或细胞萎缩的表现,而上述两者皆与自噬体形成有关[12]。
, http://www.100md.com
TPPase是高尔基复合体的标志酶,与高尔基复合体内糖基化过程中的糖基转移酶活性有密切关系,它定位于成熟面扁平囊泡,系细胞合成分泌功能状态的重要标记。镉注射后4 h,TPPase反应产物明显减少,3 d和15 d进一步减少。4 h和3 d组TPPase反应产物减少与镉对主细胞的直接损伤所致肿胀溶解性改变有关[3~6]。此外该酶反应产物的减少还先于超微结构的改变,这也提示镉具有直接损伤作用。豚鼠阉割后6周前列腺背侧叶及精囊腺主细胞高尔基复合体的TPPase反应产物才有减少,说明雄激素水平下降所致的损伤出现较晚[4]。陶均等[13]用Tamoxifen (100 mg/kg体重)喂养大鼠5 d后见前列腺腹侧叶主细胞TPPase反应产物减少。本研究所见镉注射后15 d出现的TPPase反应产物明显减少,提示与镉致睾丸间质细胞损伤所引起的血清睾酮浓度下降的进一步加重损伤有关。
锌是维持哺乳动物生殖器官功能不可缺少的微量元素。我们曾报道锌对镉所致大鼠睾丸、附睾及输精管损伤皆有良好的保护作用[3,5,6]。正常人血浆锌镉浓度的比值仅为前列腺组织的1/3,在前列腺疾病(前列腺增生及前列腺癌)状态下,这一比值明显变大[8],说明锌对维持前列腺的正常功能具有重要的作用。本研究结果表明,锌对镉所致前列腺主细胞的超微结构损伤及TPPase活性均有明显的保护作用。其机理可能与通过诱导金属硫蛋白(MT)的产生,以更多的Cd-MT结合形式贮存在胞质内,以及锌能直接与镉竞争主要大分子上的高亲和位点,从而减少镉的直接损伤作用有关。本研究15 d锌保护组TPPase反应产物的明显增多,可能与锌对镉所致睾丸间质细胞损伤所具有的保护作用,促使前列腺主细胞退变减轻有关。
, 百拇医药
本文图1~12见插图第17,18页

图1 正常大鼠前列腺腹侧叶主细胞,可见细胞核(N)、粗面内质网(RER)、高尔基区(↑↑)、线粒体(▲)、分泌颗粒(↑)、腺腔(Lu) ×5 000
Fig.1 Principal cells of ventral prostate from normal rat. N, nuclei;RER, rough endoplasmic reticulum; Golji region(↑↑); Mitochdria(▲);secretory granule(↑);Lu,lumen.×5 000

图2 镉注射后4 h,细胞核(N)正常,线粒体内可见髓样结构(My) ×10 000
, 百拇医药
Fig.2 4h after Cd treatment, N, nuclei; My, mylin figure in Mitochondria and plasma membrane.×10 000

图3 镉注射后3 d,高尔基复合体(Go)扩张,线粒体(Mi)肿胀,并有髓样结构。粗面内质网基本正常 ×10 000
Fig.3 Dilation of Golji complex(Go) and swelling of mitochondria(Mi) of principal cell from 3 days after Cd treatment.×10 000

图4 镉注射后15 d,高尔基复合体轻度扩张,溶酶体(Ly)、粗面内质网基本正常 ×8 000
, 百拇医药
Fig.4 Milder dilation of Golji complex(Go); Iysosome(Ly) of principal cell from 15 days after Cd treatment.×10 000

图5 镉注射后30 d,主细胞粗面内质网形成的内同心圆性小体,其内有溶酶体和肿胀的线粒体(Mi),并可见池内封隔(▲) ×20 000
Fig.5 Concentric lamellar body of RER from 30 days after Cd treatment. Mi, mitochondria; Ly, lysosome; ▲,Intracisternal sequestration of RER ×20 000

, 百拇医药
图6 镉锌联合注射后3 d,主细胞线粒体肿胀,细胞核、高尔基复合体轻度扩张,Lu.腺腔 ×10 000
Fig.6 Swelling of mitochondria(Mi),N,nuclei; and milder dilation of Golji complex(Go); lumen(Lu) of 3 days Cd+Zn treatment.×10 000

图7 镉锌联合注射后15d,主细胞基本正常。×8000
Fig.7 Principal cells almost normal of 15days Vd+Zn treatment.×8000

, 百拇医药
图8 正常大鼠前列腺主细胞高尔基复合体TPPase反应产物多。×25000
Fig.8 TPPase reactive product of Go in principal cell from prostate of normal rat.×25000

图9 镉注射后3d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.9 TPPase reactive product of Go in principal cell from prostate 3 days after Cd treatment.×25000

, http://www.100md.com 图10 镉注射后15d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.10 TPPase reactive product of Goin principal cell from prostate 15 days after Cd treatment.×25000

图11 镉锌联合体注射后3d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.11 TPPase teactive product of Go principal cell from prostate 3 days after Cd add Zn treatnent.×25000

, http://www.100md.com
图12 镉锌联合注射后15d,主细胞高尔基复合体TPPase反应产物。×25000
Fig.11 TPPase teactive product of Go principal cell from prostate 15 days after Cd add Zn treatnent.×25000
【作者简介】 罗子国(1963—),男(汉族),四川剑阁县人,医学硕士,讲师
参考文献
[1]Gunn SA, Gould TC. Vasculature of the testis and adnexa. In:Greep RO, et al(eds). Handbook of Physiology. Section 7:Endocrinology. Vol 5:Male Reproductive System(M). Washington:Am Physiol Soc, 1975:362-368.
, 百拇医药
[2]Fowler AJ, Singh DN, Dwivedi C. Effect of cadmium on meiosis[J]. Bull Environm Contam Toxicol, 1982,29(4):412-415.
[3]李维信,廖晓岗,唐宜,等.镉对大鼠睾丸的损伤及锌保护作用的超微结构研究[J].解剖学报,1988,19(1):74~78.
[4]徐晨,李维信.镉对大鼠精囊腺超微结构及TPPase细胞化学和血清睾酮含量的影响[J].解剖学报,1997,28(3):209~214.
[5]罗子国,李维信.镉对大鼠输精管损伤及锌保护的超微结构与葡萄糖-6-磷酸酶细胞化学的研究[J].解剖学报,1999,30(1):86~89.
[6]廖晓岗,李维信.镉对大鼠睾丸间质细胞损伤及锌对其保护的形态学研究[J].生殖与避孕,1999,19(5):290~295.
, http://www.100md.com
[7]Bettersby S, Chandler JA, Morton MS. The effect of orally administered cadmium on the ultrastructure of the rat prostate[J]. Urol Res,1982,10(3):123-130.
[8]Ogunlewe JO, Osegbe DN. Zinc and cadmium concentrations in indigenous blacks with normal, hypertrophic, and malignant prostate[J]. Cancer, 1989,63(7):1388-1392.
[9]Hoffmann L, Putzke HP, Bendel L, et al. Electron microscopic results on the ventral prostate of the rat after CdCl2 administration. A contribution towards etiology of the cancer of the prostate[J]. J Cancer Res Clin Oncol,1988,114(3):273-278.
, 百拇医药
[10]Saksena S, White MJ, Mertzluff J, et al. Prevention of cadmium-induced sterility by zinc in the male rat[J]. Contraception, 1983,27(5):521-530.
[11]Wilson MJ, Whitaker JN, Sinha AA. Immunocytochemical localization of cathepsin D in rat ventral prostate:evidence for castration-induced expression of cathepsin D in basal cells[J]. Anat Rec, 1991,229(3):321-333.
[12]Ghadially FN. Ultrastructural pathology of the cell and matrix[M]. Vol 1, 3rd ed, London:Butterworths, 1988:516-571.
[13]陶均,朱继业,王一飞,等.Tamoxifen对大鼠前列腺上皮细胞形态结构及酸性磷酸酶、硫胺素焦磷酸酶活性的影响[J].细胞生物学杂志,1986,8(4):171~174.
【收稿日期】 1999-12-24
【修回日期】 2000-05-08, 百拇医药