生物大分子的细胞核质转运
作者:李载权 唐朝枢 周爱儒
单位:李载权(北京大学第一医院心血管研究所,北京100034);唐朝枢(北京大学第一医院心血管研究所,北京100034);周爱儒(北京大学医学部生物化学与分子生物学系,北京 100083)
关键词:核孔复合体;细胞核质转运;核孔素;核转运蛋白;亲核素
生理科学进展000316 摘要 生物大分子通过细胞核孔复合体的转运是真核细胞基因复制、转录和翻译的必要环节,也是联系细胞核内外信号转递与参与细胞内核反应(即细胞增殖、分化、凋亡等核反应)调控的重要环节。本文主要介绍细胞核孔复合体结构、出入细胞核的转运过程及核转运蛋白与亲核素方面的研究进展,细胞核转运过程的深入研究在医药学基础和临床实践都有十分重要的意义。
学科分类号 Q257
, http://www.100md.com 真核细胞质和细胞核是功能不同的两个亚细胞部位,细胞核膜是二者分隔的重要屏障,核膜上分布的核孔复合体(nuclear pore complex, NPC)是沟通细胞核内外物质交流和信息交流的主要通道。生物大分子经NPC跨核膜转运(nucleocytoplasmic transport )是真核细胞基因复制、转录和翻译的必要环节,也是联系细胞内信号转递、参与细胞核反应(即细胞增殖、分化、凋亡等核反应)调控的重要环节。一般而言,分子量低于60kD的生物分子可自由通过NPC出入细胞核, 而60kD以上的生物大分子通过NPC情形较为复杂,其核质转运是一种耗能的需蛋白介导的主动转运过程,无论是入核(import)转运还是出核(export)转运均需耗能。该过程由核膜Ran蛋白水解GTP为转运提供能量,因此核质侧核膜高RanGTP和胞质侧核膜高RanGDP浓度的不对称性是核质转运的重要基础[1]。需入核转运的生物大分子通常有参与基因复制、转录的蛋白因子和各种酶系,如复制酶、转录酶、U snRNP、hnRNP蛋白颗粒和细胞核内转录调节因子如Stat3等,以及其他需入核才发挥作用的外源性大分子如基因治疗的外源重组DNA、病毒基因等;相反,需出核转运的生物大分子包括细胞核内各类RNA(rRNA、mRNA、tRNA)、U snRNP蛋白颗粒、NES蛋白等。生物大分子正常的出入核转运是真核细胞生长、增殖、分化和发育等生命活动的基本保证。
, 百拇医药
一、核孔复合体模型及其结构蛋白
根据高倍电子显微镜对青蛙卵细胞、昆虫细胞、脊椎动物细胞和酵母细胞等的研究人们提出了核孔复合体的圆柱状模型[2],该模型认为细胞核膜由内、外两层核膜组成,两核膜之间为核间腔(nuclear lumen);内外两侧核膜以外分别为核液面和胞质面;每个NPC由对称的8分子幅蛋白(spoke)将内、外两层核膜粘在一起且8分子幅蛋白相互围成一疏水孔道;孔中心有一中央插销蛋白(central plug,transporter),中央插销蛋白控制着生物大分子出入NPC的速率或启闭;幅蛋白与内层核膜融合为一胞质环(cytoplasmic ring),胞质环引出八根长30~50nm游离于胞质的胞质纤丝(cytoplasmic filament);同样,幅蛋白与外层核膜融合成一核质环(nuclear ring),核质环上引出八根长100nm提篮纤丝(basket filament),然后由一根终末环(terminal ring)将提篮纤丝的另一端连在一起形成提篮样网筐(nuclear basket)结构(图1)。核质环直接与核内核纤层蛋白(nuclear lamina)相连,终末环与核内纤丝样核网格(nuclear lattice)骨架蛋白相连,形成核内复杂的高级网格骨架基础。当生物小分子通过NPC进行自由扩散时NPC孔径约9 nm,生物大分子进行主动转运时孔径可达25nm,可见NPC结构并不完全是刚性的。NPC数目、位置和孔径均处于周期性变化,NPC随机分布于细胞核表面上,不同时期细胞核表面上NPC数目不一样,NPC数量最多时可达107个/核。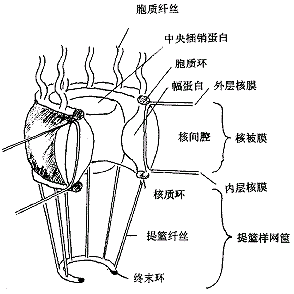
, http://www.100md.com
图1 细胞核孔复合体构造模型
组成NPC的特征蛋白为糖蛋白gp210和核孔素(nucleoporin, Nup)。糖蛋白gp210为一种跨核膜的N-连接糖蛋白,能与伴刀豆球蛋白A强烈结合,作用是将NPC固定于核膜上;核孔素为一组由8~12种O-连接糖蛋白构成的蛋白家族,与麦胚凝集素(WAG)亲和,广泛分布于NPC孔周围,在细胞质与细胞核内也可检出,作用与生物分子的核质转运有关。在分子结构上gp210有锚定NPC核膜的结合域及与亲核素蛋白结合的结合域,而核孔素蛋白分子上至少有三类重复序列,其中N末段有FG二肽结构域[3,4],这些序列都是生物大分子进行核质转运的分子基础。
二、 生物大分子的细胞核质转运过程[5]
在入核转运过程中存在于胞质中的具有核定位信号肽(nuclear location signal,NLS)的转运蛋白(简称NLS蛋白),首先与NPC附近Importin α结合,Importin α再与Importin β相结合形成NLS-Importin α/β复合体,然后NPC内核孔素蛋白通过其自身重复序列与Importin β结合,并将NLS-Importin α/β复合体定位(docking)在NPC胞质纤丝上,随后胞质纤丝发生弯曲将其复合体依次递呈到细胞NPC中央插销蛋白上,并与核质纤丝发生结合、解离平衡,复合体被送入细胞核内。复合体在通过NPC中央孔时所耗能量由RanGTPase水解GTP提供,同时激活Importin β,后者可使Importin α和NLS分别从NLS-Importin α/β复合体上释放下来,NLS分子在核内马达分子(motor)推动下沿核内骨架发生固相传输(solid transfer)。核内Importin β与RanGTP结合成二聚体再转运回胞质,胞质中Importin β/RanGTP二聚体在RanGTPase作用下解离为Importin β和RanGDP,Importin β继续参与下一轮NLS蛋白的入核转运;核内Importin α的出核转运过程较为复杂, 首先核内Importin α在CAS蛋白和RanGTP作用下形成三联体转运回胞质,然后三联体在胞质RanGTPase作用下解离为Importin α、CAS和RanGDP。最后胞质Importin α继续参与下一轮NLS蛋白的入核转运过程,CAS则直接返回细胞核内(图2,B)。
, 百拇医药
图2 生物大分子细胞核转运模式(A 出核转运, B 入核转运)
在出核转运过程中具有出核转运信号肽(Nuclear export signal,NES)的核转出蛋白(简称NES蛋白)存在于细胞核内。首先NES蛋白如CRM1(一种NES蛋白,出核因子-1,Exportin 1)与核内生物大分子如hnRNA等结合,然后与RanGTP结合形成复合体跨核膜转运进入细胞质。转运过程中会出现hn RNA的5’末端已经在胞质中而 hn RNA的3’末端还留在细胞核内,同时该复合体还结合有hnRNA 5’帽结合蛋白CBP20/80,此外伴随hnRNA的出核转运hnRNA也会发生转录后的加工修饰,使hnRNA变为成熟mRNA。胞质中出核复合体RanGTPase作用下解离为RanGDP和CRM1,释放出成熟mRNA。CRM1直接返回细胞核内,此时CRM1可再参与下一轮其它hnRNA分子的出核转运(图2,A)。
三、 核转运蛋白与亲核素家族
, http://www.100md.com
核转运蛋白中有一段保守的氨基酸序列与核质转运有关,如SV40大T抗原蛋白分子的NLS序列,其氨基酸序列为PKKKRKV,PKAI抑制蛋白的NES序列为LALKAGLDI,这些序列保证了核转运蛋白核转运的正确定向,实际上NLS或NES的氨基酸保守顺序可能还有其它一些种类[6]。NLS或NES蛋白结构除有与转运导向有关的氨基酸信号序列外,还有与生物大分子相结合的结合域起核转运的载体作用。核转运过程中,另一类蛋白质具有GLFG氨基酸结构,如Importin α、Importin β、CRM1、CAS蛋白等均直接参与生物大分子的出入核转运,统称为亲核素家族(Karyopherins),在这个家族中还有Kap123p、Pse1p和transportin等,目前已经发现上百个亲核素家族成员。CRM1蛋白较为特殊,除具有保守的NES导向序列外,同时也是亲核素家族中的一员。每个家族成员都有各自相应的生物学功能,如Importin α与NLS蛋白相连;Importin β与Importin α相连;CAS蛋白作为Importin α连接子,参与Importin α返回细胞质;Kap123p和 Pse1p参与mRNA出核RNP蛋白的再入核过程;CRM1结合mRNA和Rev并促进mRNA的出核。近年发现转运子(transportin)能识别M9信号肽,兼有识别经典核转运途径中NLS结构和参与Importin β转运导向的双重作用[7]。
, http://www.100md.com
生物大分子细胞核转运过程具有重要的医药学研究价值。在血管紧张素II刺激大脑神经细胞反应中细胞内信号分子转录调节因子Stat3,首先须进行入核转运,这一过程已经阐明,这对于深入了解高血压时神经细胞的作用机制奠定了基础[8];在恶性骨髓瘤遗传性染色体颠倒异位研究中发现核孔素NPU98基因与RNA解旋酶基因之间出现融合现象[9];同时入核转运过程的研究为核靶向转运新药的设计提供了新的思路[10]。综上说明,细胞核质转运过程及机制的研究具有重要的医药学价值。
国家自然科学基金资助课题(39730220)
参考文献
1,Izaurralde,E, Kutay,U, von-Kobbe,C, et al. The asymmetric distribution of the constituents of the Ran system is essential for transport into and out of the nucleus. EMBO J, 1997, 16∶6535~6547.
, http://www.100md.com
2,Ohno M, Fornerod M, Mattaj IW, et al. Nucleocytoplasmic Transport: The Last 200 Nanometers. Cell, 1998, 92∶327~336.
3,Doye V, Hurt E. From nucleoporins to nuclear pore complexes. Curr Opin Cell Biol, 1997, 9∶401~411.
4,Wozniak RW, Rout MP, Aitchison JD. Karyopherins and kissing cousins. Trends,Cell,Biol, 1998, 8∶184~188.
5,Gorlich D, Mattaj IW, Mattaj IW. Nucleocytoplasmic Transport. Science,1996, 271∶1513~1518.
, http://www.100md.com
6,Ullman KS, Powers MA, Forbes DJ. Nuclear Export Receptors: From Importin to Exportin. Cell, 1997, 90∶967~970.
7,Moroianu,J. Distinct nuclear import and export pathways mediated by members of the karyopherin beta family. J,Cell,Biochem, 1998, 70∶231~239.
8,Lu D, Yang H, Raizada MK. Involvement of p62 nucleoporin in angiotensin II-induced nuclear translocation of STAT3 in brain neurons. J,Neurosci, 1998, 18∶1329~1336.
, 百拇医药
9,Arai,Y, Hosoda,F, Kobayashi,H, et al. The inv(11)(p15q22) chromosome translocation of de novo and therapy-related myeloid malignancies results in fusion of the nucleoporin gene, NUP98, with the putative RNA helicase gene, DDX10. Blood, 1997, 89∶3936~3944.
10,Jans,DA, Chan,CK, Huebner,S. Signals mediating nuclear targeting and their regulation: application in drug delivery. Med,Res,Rev, 1998, 18∶189~223., 百拇医药
单位:李载权(北京大学第一医院心血管研究所,北京100034);唐朝枢(北京大学第一医院心血管研究所,北京100034);周爱儒(北京大学医学部生物化学与分子生物学系,北京 100083)
关键词:核孔复合体;细胞核质转运;核孔素;核转运蛋白;亲核素
生理科学进展000316 摘要 生物大分子通过细胞核孔复合体的转运是真核细胞基因复制、转录和翻译的必要环节,也是联系细胞核内外信号转递与参与细胞内核反应(即细胞增殖、分化、凋亡等核反应)调控的重要环节。本文主要介绍细胞核孔复合体结构、出入细胞核的转运过程及核转运蛋白与亲核素方面的研究进展,细胞核转运过程的深入研究在医药学基础和临床实践都有十分重要的意义。
学科分类号 Q257
, http://www.100md.com 真核细胞质和细胞核是功能不同的两个亚细胞部位,细胞核膜是二者分隔的重要屏障,核膜上分布的核孔复合体(nuclear pore complex, NPC)是沟通细胞核内外物质交流和信息交流的主要通道。生物大分子经NPC跨核膜转运(nucleocytoplasmic transport )是真核细胞基因复制、转录和翻译的必要环节,也是联系细胞内信号转递、参与细胞核反应(即细胞增殖、分化、凋亡等核反应)调控的重要环节。一般而言,分子量低于60kD的生物分子可自由通过NPC出入细胞核, 而60kD以上的生物大分子通过NPC情形较为复杂,其核质转运是一种耗能的需蛋白介导的主动转运过程,无论是入核(import)转运还是出核(export)转运均需耗能。该过程由核膜Ran蛋白水解GTP为转运提供能量,因此核质侧核膜高RanGTP和胞质侧核膜高RanGDP浓度的不对称性是核质转运的重要基础[1]。需入核转运的生物大分子通常有参与基因复制、转录的蛋白因子和各种酶系,如复制酶、转录酶、U snRNP、hnRNP蛋白颗粒和细胞核内转录调节因子如Stat3等,以及其他需入核才发挥作用的外源性大分子如基因治疗的外源重组DNA、病毒基因等;相反,需出核转运的生物大分子包括细胞核内各类RNA(rRNA、mRNA、tRNA)、U snRNP蛋白颗粒、NES蛋白等。生物大分子正常的出入核转运是真核细胞生长、增殖、分化和发育等生命活动的基本保证。
, 百拇医药
一、核孔复合体模型及其结构蛋白
根据高倍电子显微镜对青蛙卵细胞、昆虫细胞、脊椎动物细胞和酵母细胞等的研究人们提出了核孔复合体的圆柱状模型[2],该模型认为细胞核膜由内、外两层核膜组成,两核膜之间为核间腔(nuclear lumen);内外两侧核膜以外分别为核液面和胞质面;每个NPC由对称的8分子幅蛋白(spoke)将内、外两层核膜粘在一起且8分子幅蛋白相互围成一疏水孔道;孔中心有一中央插销蛋白(central plug,transporter),中央插销蛋白控制着生物大分子出入NPC的速率或启闭;幅蛋白与内层核膜融合为一胞质环(cytoplasmic ring),胞质环引出八根长30~50nm游离于胞质的胞质纤丝(cytoplasmic filament);同样,幅蛋白与外层核膜融合成一核质环(nuclear ring),核质环上引出八根长100nm提篮纤丝(basket filament),然后由一根终末环(terminal ring)将提篮纤丝的另一端连在一起形成提篮样网筐(nuclear basket)结构(图1)。核质环直接与核内核纤层蛋白(nuclear lamina)相连,终末环与核内纤丝样核网格(nuclear lattice)骨架蛋白相连,形成核内复杂的高级网格骨架基础。当生物小分子通过NPC进行自由扩散时NPC孔径约9 nm,生物大分子进行主动转运时孔径可达25nm,可见NPC结构并不完全是刚性的。NPC数目、位置和孔径均处于周期性变化,NPC随机分布于细胞核表面上,不同时期细胞核表面上NPC数目不一样,NPC数量最多时可达107个/核。

, http://www.100md.com
图1 细胞核孔复合体构造模型
组成NPC的特征蛋白为糖蛋白gp210和核孔素(nucleoporin, Nup)。糖蛋白gp210为一种跨核膜的N-连接糖蛋白,能与伴刀豆球蛋白A强烈结合,作用是将NPC固定于核膜上;核孔素为一组由8~12种O-连接糖蛋白构成的蛋白家族,与麦胚凝集素(WAG)亲和,广泛分布于NPC孔周围,在细胞质与细胞核内也可检出,作用与生物分子的核质转运有关。在分子结构上gp210有锚定NPC核膜的结合域及与亲核素蛋白结合的结合域,而核孔素蛋白分子上至少有三类重复序列,其中N末段有FG二肽结构域[3,4],这些序列都是生物大分子进行核质转运的分子基础。
二、 生物大分子的细胞核质转运过程[5]
在入核转运过程中存在于胞质中的具有核定位信号肽(nuclear location signal,NLS)的转运蛋白(简称NLS蛋白),首先与NPC附近Importin α结合,Importin α再与Importin β相结合形成NLS-Importin α/β复合体,然后NPC内核孔素蛋白通过其自身重复序列与Importin β结合,并将NLS-Importin α/β复合体定位(docking)在NPC胞质纤丝上,随后胞质纤丝发生弯曲将其复合体依次递呈到细胞NPC中央插销蛋白上,并与核质纤丝发生结合、解离平衡,复合体被送入细胞核内。复合体在通过NPC中央孔时所耗能量由RanGTPase水解GTP提供,同时激活Importin β,后者可使Importin α和NLS分别从NLS-Importin α/β复合体上释放下来,NLS分子在核内马达分子(motor)推动下沿核内骨架发生固相传输(solid transfer)。核内Importin β与RanGTP结合成二聚体再转运回胞质,胞质中Importin β/RanGTP二聚体在RanGTPase作用下解离为Importin β和RanGDP,Importin β继续参与下一轮NLS蛋白的入核转运;核内Importin α的出核转运过程较为复杂, 首先核内Importin α在CAS蛋白和RanGTP作用下形成三联体转运回胞质,然后三联体在胞质RanGTPase作用下解离为Importin α、CAS和RanGDP。最后胞质Importin α继续参与下一轮NLS蛋白的入核转运过程,CAS则直接返回细胞核内(图2,B)。

, 百拇医药
图2 生物大分子细胞核转运模式(A 出核转运, B 入核转运)
在出核转运过程中具有出核转运信号肽(Nuclear export signal,NES)的核转出蛋白(简称NES蛋白)存在于细胞核内。首先NES蛋白如CRM1(一种NES蛋白,出核因子-1,Exportin 1)与核内生物大分子如hnRNA等结合,然后与RanGTP结合形成复合体跨核膜转运进入细胞质。转运过程中会出现hn RNA的5’末端已经在胞质中而 hn RNA的3’末端还留在细胞核内,同时该复合体还结合有hnRNA 5’帽结合蛋白CBP20/80,此外伴随hnRNA的出核转运hnRNA也会发生转录后的加工修饰,使hnRNA变为成熟mRNA。胞质中出核复合体RanGTPase作用下解离为RanGDP和CRM1,释放出成熟mRNA。CRM1直接返回细胞核内,此时CRM1可再参与下一轮其它hnRNA分子的出核转运(图2,A)。
三、 核转运蛋白与亲核素家族
, http://www.100md.com
核转运蛋白中有一段保守的氨基酸序列与核质转运有关,如SV40大T抗原蛋白分子的NLS序列,其氨基酸序列为PKKKRKV,PKAI抑制蛋白的NES序列为LALKAGLDI,这些序列保证了核转运蛋白核转运的正确定向,实际上NLS或NES的氨基酸保守顺序可能还有其它一些种类[6]。NLS或NES蛋白结构除有与转运导向有关的氨基酸信号序列外,还有与生物大分子相结合的结合域起核转运的载体作用。核转运过程中,另一类蛋白质具有GLFG氨基酸结构,如Importin α、Importin β、CRM1、CAS蛋白等均直接参与生物大分子的出入核转运,统称为亲核素家族(Karyopherins),在这个家族中还有Kap123p、Pse1p和transportin等,目前已经发现上百个亲核素家族成员。CRM1蛋白较为特殊,除具有保守的NES导向序列外,同时也是亲核素家族中的一员。每个家族成员都有各自相应的生物学功能,如Importin α与NLS蛋白相连;Importin β与Importin α相连;CAS蛋白作为Importin α连接子,参与Importin α返回细胞质;Kap123p和 Pse1p参与mRNA出核RNP蛋白的再入核过程;CRM1结合mRNA和Rev并促进mRNA的出核。近年发现转运子(transportin)能识别M9信号肽,兼有识别经典核转运途径中NLS结构和参与Importin β转运导向的双重作用[7]。
, http://www.100md.com
生物大分子细胞核转运过程具有重要的医药学研究价值。在血管紧张素II刺激大脑神经细胞反应中细胞内信号分子转录调节因子Stat3,首先须进行入核转运,这一过程已经阐明,这对于深入了解高血压时神经细胞的作用机制奠定了基础[8];在恶性骨髓瘤遗传性染色体颠倒异位研究中发现核孔素NPU98基因与RNA解旋酶基因之间出现融合现象[9];同时入核转运过程的研究为核靶向转运新药的设计提供了新的思路[10]。综上说明,细胞核质转运过程及机制的研究具有重要的医药学价值。
国家自然科学基金资助课题(39730220)
参考文献
1,Izaurralde,E, Kutay,U, von-Kobbe,C, et al. The asymmetric distribution of the constituents of the Ran system is essential for transport into and out of the nucleus. EMBO J, 1997, 16∶6535~6547.
, http://www.100md.com
2,Ohno M, Fornerod M, Mattaj IW, et al. Nucleocytoplasmic Transport: The Last 200 Nanometers. Cell, 1998, 92∶327~336.
3,Doye V, Hurt E. From nucleoporins to nuclear pore complexes. Curr Opin Cell Biol, 1997, 9∶401~411.
4,Wozniak RW, Rout MP, Aitchison JD. Karyopherins and kissing cousins. Trends,Cell,Biol, 1998, 8∶184~188.
5,Gorlich D, Mattaj IW, Mattaj IW. Nucleocytoplasmic Transport. Science,1996, 271∶1513~1518.
, http://www.100md.com
6,Ullman KS, Powers MA, Forbes DJ. Nuclear Export Receptors: From Importin to Exportin. Cell, 1997, 90∶967~970.
7,Moroianu,J. Distinct nuclear import and export pathways mediated by members of the karyopherin beta family. J,Cell,Biochem, 1998, 70∶231~239.
8,Lu D, Yang H, Raizada MK. Involvement of p62 nucleoporin in angiotensin II-induced nuclear translocation of STAT3 in brain neurons. J,Neurosci, 1998, 18∶1329~1336.
, 百拇医药
9,Arai,Y, Hosoda,F, Kobayashi,H, et al. The inv(11)(p15q22) chromosome translocation of de novo and therapy-related myeloid malignancies results in fusion of the nucleoporin gene, NUP98, with the putative RNA helicase gene, DDX10. Blood, 1997, 89∶3936~3944.
10,Jans,DA, Chan,CK, Huebner,S. Signals mediating nuclear targeting and their regulation: application in drug delivery. Med,Res,Rev, 1998, 18∶189~223., 百拇医药