LPS+TNF-α致休克大鼠胃肠运动及屏障功能的改变
作者:次秀丽 王宝恩 张淑文 张宁宁
单位:北京友谊医院感染内科 北京市 100050
关键词:休克;内毒素;肿瘤坏死因子;胃肠运动;胃肠粘膜
摘 要 目的 观察内毒素和肿瘤坏死因子摘 要
目的 观察内毒素和肿瘤坏死因子(TNF)联合致休克模型大鼠胃肠运动功能改变及粘膜损伤的程度.
方法 采用Wistar ♂大鼠,用内毒素和人重组TNF-α联合致休克模型;将电极埋置在胃、十二指肠、空肠的浆膜面,记录大鼠的胃肠电活动,给大鼠灌胃碳末,测量碳末的推进速度,计数大鼠胃肠电快波频率(F)、振幅指数(AI)及碳末推进速度;取制膜后2h的肠系膜淋巴结、心、肝、脾、肺、肾和血进行细菌培养,观察肠道细菌的移位情况;制膜1h后给大鼠灌胃乳果糖/甘露醇混悬液,收集大鼠6h尿液,用高压液相技术测定尿中乳果糖和甘露醇含量,计算它们排出率之比,测定肠粘膜的通透性. 用χ2检验比较各组器官细菌感染率的不同,用t检验统计各组间其他各指标的差异,P<0.05有显著性差异.
, http://www.100md.com
结果 ①制模大鼠胃肠运动的改变:模型大鼠胃肠电活动明显抑制,快波的频率[Fre:胃电(1.32±0.30),十二指肠电(4.47±0.76),空肠电(4.07±1.25)次/min]及振幅指数[AI:胃电(13.70±3.23),十二指肠电(43.06±8.00),空肠电(30.79±7.49)μV/min]明显低于制模前[Fre:胃电(2.91±0.17) ,十二指肠电(17.52±2.43)空肠电(22.32±3.35)次/min;AI:胃电(26.18±3.45),十二指肠电(158.48±65.92),空肠电(149.12±27.52)μV/min],制模大鼠的肠推进速度明显低于正常大鼠(模型组vs 正常对照组:30.7%±3.6%vs 72.8%±3.9%,P<0.05) ②制模大鼠肠粘膜通透性升高:乳果糖排泄率/甘露醇排泄率12.2±1.2明显高于正常对照组0.06±0.01, P<0.05. 小肠组织蛋白中的二胺氧化酶活性降低[(0.04±0.04) vs (0.56±0.04)U/g]. 肠道细菌发生易位,易位率为100%,与正常对照组比较,P<0.05.
, http://www.100md.com
结论 内毒素与TNF联合可制伴有明显胃肠功能障碍的休克模型.
中国图书馆分类号 R57
Alterations of gastrointestinal motility and mucosal barrier in shock rat model induced by endotoxin plus TNF-α
CI Xiu-Li, WANG Bao-En, ZHANG Shu-Wen and ZHANG Ning-Ning
Department of Infectious Diseases, Beijing Friendship Hospital, Beijing 100050, China
Subject headings shoch; endotoxin; tumor necrosis factor; gastrointestinal motility; gastrointestinal mucosa
, http://www.100md.com
Abstract
AIM To study gut motility and mucosal barrier in a shock model induced by endotoxin and recombinant TNF-α in rats.
METHODS Male Wistar rats weighing 250g-300g, were intravenously injected with endotoxin plus recombinant human TNF-α to lower the systemic arterial pressure. Bipolar electromyograms were recorded from electrodes chronically implanted on the serosa of stomach, duodenum and jejunum, and the frequency and amplitude index of spiking activity were calculated. Oral carbon power was used to observe the function of intestinal propulsion. Two hours after the administration of drugs, mesenteric lymph node, liver, spleen, heart, kidney and blood samples were taken aseptically, and were homogenized in saline, and plated on McConkey's agar for culture at 37℃ for 24 hours. The prevalence of bacteria translocation and the number of bacteria in these tissues were calculated. Concentrations of endothelin, NO, nitric oxide syntheses, motilin, SOD, MDA, diamine oxidase (DAO)activity in blood and DAO in small intestine mucosa were measured. Six-hour urinary excretion of orally administered mannitol and lactulose was measured with high-performance liquid chromatography.
, 百拇医药
RESULTS The gastrointestinal electric activity was inhibited markedly (30 minutes after shock vs before shock; Fre: gastric electric activity 1.32±0.30 vs 2.91±0.17,duodenal 4.47±0.76 vs 17.52±2.43,jejunal 4.07±1.25 vs 22.32±3.35min;AI: gastric 13.70±3.23 vs 26.18±3.45,duodenal 43.06±8.00 vs 158.48±65.92,jejunal 30.79±7.49 vs 149.12±27.52μV/min and the rate of intestinal propulsion (shock group vs normal group:30.7%±3.6% vs 72.8%±3.92%,P<0.05) was slowed significantly. The damage of epithelial villi of the mucosa, the increased intestinal permeability of lactulose (the rate of the excretion of lactulose and mannitol in shock vs normal rats:12.2±1.2 vs 0.06±0.01,P<0.05),a decrease of diamine oxidase activity (shock rat vs normal rat:0.04±0.04 vs 0.56±0.04U/g)in gut and the gut bacteria translocation (shock rat vs normal rat:100% vs 0%)showed the impairment of gut barrier function.
, http://www.100md.com
CONCLUSION The gastrointestinal motility is inhibited and the intestinal permeability is increased in endotoxin and recombinant human tumor necrosis factor-α induced shock rats.
0 引言
多器官功能不全综合征(MODS)是继严重感染、创伤、手术、病理产科等之后同时或序贯发生的,以高代谢、高动力循环状态、过度的免疫反应为特征的临床综合征. MODS的病理生理环节之一为缺血缺氧、内毒素及炎性递质使肠粘膜功能受损,肠道细菌繁殖,细菌和内毒素向全身播散,最终导致MODS,MOSF[1],使疾病的死亡率明显升高. 因此保护胃肠道是重症疾病治疗中的重要环节. 内毒素是革兰阴性菌细胞壁的成分,是细菌的主要致病因素,它可刺激机体免疫系统产生大量的细胞因子、氧自由基等一系列因子造成组织器官的损伤;TNF是内毒素刺激产生的细胞因子之一,我们用内毒素与TNF联合致休克模型,观察此模型大鼠的胃肠运动状态及胃肠粘膜的损伤情况,为开发纠正胃肠功能障碍的新药,阻止MODS的发生提供模型.
, http://www.100md.com
1 材料和方法
1.1 材料 ♂Wistar大鼠,体重250g~300g,由本院动物室提供,随机分为:正常对照组和模型组两大组,每组又分:模型制作组、肠推进组、肠粘膜通透性组、细菌移位组,模型组中单加胃肠电组、每组动物数为10只,大肠杆菌0111B4内毒素(Sigma公司产品)和人重组TNF(购自军事医学科学院生物制剂发展中心).
1.2 方法
1.2.1 休克模型的制备 实验前1d颈动脉插管,导管经皮下隧道由颈背部穿出、固定. 禁食不禁水24h后在大鼠清醒自由活动的情况下,将主动脉导管接YH-4型压力传感器,用二导生理记录仪(成都仪器厂产品)记录大鼠的血压变化. 一半动物实验前1d 行动脉插管,同时腹腔注射大肠杆菌内毒素(8μg/kg),禁食不禁水24h后记录大鼠的正常血压,经尾静脉分别注入大肠杆菌内毒素(4mg/kg)和人重组TNF(5万U/kg),观察血压的动态变化,4h后处死,取脏器福尔马林固定送病理.
, http://www.100md.com
1.2.2 ①胃肠电观察的方法同前[2],分别计数休克前及休克后30min,90min时的每分钟峰电数目(频率)、振幅之和(振幅指数). ②碳末推进试验: 制模2h后按经典方法[3]测定肠推进速度. ③肠道细菌移位的观察: 制模2h后,断颈处死,取心脏血、心、肝、脾、肺、肾、肠系膜淋巴结,在普通麦糠凯固体培养基上进行血及器官匀浆液的细菌培养,计数细菌移位的发生率及器官中移位细菌数,同时测定心脏血的NO、NOS、MDA、SOD(化学法,南京建成生物工程研究所试剂盒)、内皮素和胃动素(放免法,东亚免疫技术研究所试剂盒). ④肠粘膜对乳果糖/甘露醇通透性的测定: 参照文献[5]的方法,制膜60分后灌胃乳果糖(丹东康复制药厂产品)和甘露醇(化学纯,国产)混悬液1mL,收集乳甘液灌胃后6h的尿用HPLC检测(带脉冲电化学检测器的高压液相离子色谱仪,美国DIONEX公司)尿中乳果糖和甘露醇的含量,计算6h尿中乳果糖和甘露醇排除率及两者排除率的比值. ⑤血及组织中二胺氧化酶的测定: 分光光度法测定[5].
, 百拇医药
统计学处理用χ2检验或t检验比较两组动物中不同数据的差异,P<0.05具有显著性差异.
2 结果
动脉血压有非常显著的变化(表1),病理变化也显著,模型组动物肺有不同程度的血管扩张、实变及胸膜下出血,回肠粘膜呈不同程度的病损,表现为范围不等的肠粘膜绒毛被覆上皮缺失,其表面及邻近肠腔内程度不等的脱落上皮细胞等聚集.
表1 TNF+LPS致大鼠休克前后血压的变化 (n=10,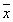 ±s,kPa)
±s,kPa)
组别
0
, http://www.100md.com
5
60
180
正常对照组
16.11±0.96
15.87±1.23
2.11±0.16
2.10±0.23
休克模型组
16.31±0.77
7.24±2.03bd
10.79±2.61b
, 百拇医药
5.41±1.03bd
bP<0.01,vs正常组;dP<0.01,vs 60分.
2.1 血MDA、SOD、NO、NOS、内皮素及胃动素水平的变化 制模大鼠血内皮素、NO均明显高于正常大鼠(P<0.05),但NOS活性没有明显差异;制模大鼠血丙二醛浓度升高,超氧化物歧化酶活性降低,与正常对照组相比P<0.05(表2). 休克大鼠血浆及小肠组织中胃动素(μg/L)水平与正常组比较明显下降(56±19vs380±86;15±7 vs 1461±410,P<0.05),统计结果示胃肠电快波频率及振幅指数与血浆及小肠组织胃动素水平呈正相关(r<1,P<0.05).
表2 模型动物血MDA,SOD,NO,NOS,内皮素的变化 (n=10,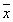 ±s,)
±s,)
, 百拇医药
MDA(μMol/L)
SOD(u/L)
内皮素(ng/L)
NO(μmol/L)
NOS(kU/L)
正常对照组
0.88±0.27
184±86
109±34
9±5
1.9±0.4
休克模型组
, 百拇医药
5.45±1.49b
105±34b
165±238b
310±160b
2.2±0.5
bP<0.01,vs 正常对照组.
2.2 休克前后胃肠电活动与动力的变化 休克大鼠的胃肠电频率及振幅指数明显降低(表3). 制模大鼠的肠推进速度为30.7%±3.6%,与正常组的72.8%±3.92%相比,肠推进速度明显减慢(P<0.05).
表3 大鼠休克前后胃肠电活动的变化 (n=10,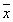 ±s)
±s)
, 百拇医药
特性
t/min
G0
G30
G90
D0
D30
D90
J0
J30
J90
频率(次/min)
2.9±0.2
, 百拇医药
1.3±0.3a
1.0±0.7a
17.5±2.4
4.5±0.8a
3.3±0.9ac
22.3±3.3
4.1±1.2a
1.9±0.6ac
振幅指数(μV/min)
26.2±3.4
, 百拇医药
13.7±3.2a
7.0±1.2ac
158.5±65.9
43.1±8.0a
11.4±4.3ac
149.1±27.5
30.8±7.5a
6.0±1.8ac
aP<0.05,vs 0;cP<0.05,vs 30;G:胃 D:十二指肠 J:空肠.
, http://www.100md.com
2.3 休克大鼠细菌移位的情况 正常大鼠各器官细菌培养均为阴性,休克大鼠各脏器均发生细菌移位,细菌移位发生率为100%,各器官移位细菌的数目以肠系膜淋巴结中最多,血中细菌感染率及移位的细菌数明显小于其他器官(表4).
表4 TNF+ENDT制模大鼠各脏器细菌移位发生数和细胞数呒 (n=10,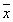 ±s)
±s)
分组
血
心
肝
脾
, 百拇医药 肺
肾
淋
发生数
正常对照
0
0
0
0
0
0
0
休克模型
2
, 百拇医药
8a
8a
10a
10a
8a
10a
细菌数
正常对照
0
0
0
0
, http://www.100md.com
0
0
0
(log CFU/g)
休克模型
0.3±0.01a
3.45±0.18c
3.81±0.31c
3.6±0.34c
3.70±0.35c
3.15±0.27c
, 百拇医药
3.97±0.13c
aP<0.05,cP<0.01,vs 对照组.
2.4 休克大鼠肠粘膜通透性及DAO 休克大鼠尿中乳果糖排除率明显升高,由正常的0.11%±0.07%升高到1.53%±0.19%,两者比较P<0.05,休克大鼠的甘露醇排泄率也明显减少,休克组的乳果糖排除率与甘露醇的排除率的比值,明显高于正常组(P<0.05). 休克大鼠血浆DAO活性升高(0.903±0.88) vs(2.89±0.88)kU/L,小肠组织蛋白中DAO活性降低(0.56±0.04) vs (0.04±0.04)U/g,与正常对照组相比P<0.01.
3 讨论
本试验表明内毒素和TNF联合致休克大鼠胃肠屏障功能严重受损,具体表现如下:①肠组织形态学改变: 回肠粘膜呈不同程度的病损,表现为范围不等的肠粘膜绒毛被覆上皮缺失. ②肠通透性增加: 此模型大鼠尿中乳果糖的排除率明显高于正常大鼠,但甘露醇的排泄率明显降低,说明大鼠的肠粘膜严重受损,大鼠的细胞旁途径增加,肠粘膜损伤,吸收面积减少而致. ③肠DAO活性下降: 本实验模型大鼠小肠组织中DAO活性明显下降,血中DAO活性升高进一步说明肠粘膜上皮受到严重损伤. ④肠道细菌移位: 正常大鼠的胃肠道外各脏器细菌培养均为阴性,而模型组大鼠的大部分胃肠道外各器官细菌培养阳性,而且以肠系膜淋巴结的阳性率最高,所培养出的细菌均是肠道中的常见菌如肠杆菌属细菌、假单胞菌属细菌、肠球菌等,说明此模型大鼠的肠道细菌发生移位. 内毒素和TNF单独可造成机体的损伤,两者合用产生协同作用[6],本实验也证实两者联合可使内毒素的用量较内毒素单独致休克用量小得多[2]. 两者产生协调作用的机制是复杂的,我们的试验结果表明氧应激、NO、内皮素参与了它们的致病过程,当然还有其他因素的参与[7],如粘膜缺氧、粘膜酸中毒、及TNF的直接作用.
, http://www.100md.com
可以肯定,内毒素和TNF联合可致严重的胃肠功能损伤,包括胃肠动力损伤及肠粘膜屏障损伤,此模型可用于粘膜保护药物或促胃肠动力药物药效的观察,与上述有关药物联合应用可进一步确定胃肠功能改变在MODS发生中的作用. 实验结果表明胃肠电的抑制程度与血浆胃动素的水平密切相关,血浆胃动素的测定是否可以作为胃肠动力障碍的辅助诊断指标值得进一步研究.
作者简介:次秀丽,女,1965年-12-01生,河北省栾成县人,汉族. 1986年河北医学院医学系本科毕业,1992年首都医学院硕士,1998年首都医科大学博士,助理研究员,主要从事中西医结合急救医学专业的科研工作,发表论文3篇.
通讯作者 王宝恩,100050,北京市宣武区永安路95号,北京友谊医院内科.
Correspondence to:Pro.WANG Bao-En, Department of Internal Medicine of Beijing Friendship Hospital, 95 Yong An Lu, Xuanwu Distract, Beijing 100050, China
, 百拇医药
Tel. +86.10.63014411 Ext.3205
4 参考文献
1 Swank GM, Deitch EA. Role of the gut in multiple organ failure: bacterial translocation and permeability changes. World J Surg, 1996;20:411-417
2 Ci XL, Wang BE, Guo CY, Chen L. The effect of dopamine on gastrointestinal electrical activity in normal and endotoxin-shock. Rats. Zhongguo Weizhongbing Yixue, 1997;9:710-712
, http://www.100md.com
3 Li YK Methodology of pharmacological experiment in herbal medicine, Shanghai: Shanghai scientific technology Press, 1991; 1st edition:320-321
4 Fleming SC, Kapembwa MS, Laker MF, Levin GE, Griffin GE. Rapid and simultaneous determination of lactulose and mannitol in urine, by HPLC with pulsed amperometric detection, for use in studies of intestinal permeability. Clin Chem, 1990;36:797-799
5 Lu JY, Yu J, He J, Jin Y, Xu HJ. The activity of DAO in plasma and small intestine meassured by photometry. An ji suan He Shengwu Ziyuan, 1996;18:28-29
, 百拇医药
6 Ciancio MJ, Hunt J, Jones SB, Filkins JP. Comparative and interactive in vivo effects of tumor necrosis factor-α and endotoxin. Circulat Shock, 1991;33:108-112
7 Aranow JS, Fink MP. Determination of intestinal barrier failure in critical illness. Br J Anaesth, 1996;77:71-81
收稿日期 1999-01-15 修回日期 1999-03-10, 百拇医药
单位:北京友谊医院感染内科 北京市 100050
关键词:休克;内毒素;肿瘤坏死因子;胃肠运动;胃肠粘膜
摘 要 目的 观察内毒素和肿瘤坏死因子摘 要
目的 观察内毒素和肿瘤坏死因子(TNF)联合致休克模型大鼠胃肠运动功能改变及粘膜损伤的程度.
方法 采用Wistar ♂大鼠,用内毒素和人重组TNF-α联合致休克模型;将电极埋置在胃、十二指肠、空肠的浆膜面,记录大鼠的胃肠电活动,给大鼠灌胃碳末,测量碳末的推进速度,计数大鼠胃肠电快波频率(F)、振幅指数(AI)及碳末推进速度;取制膜后2h的肠系膜淋巴结、心、肝、脾、肺、肾和血进行细菌培养,观察肠道细菌的移位情况;制膜1h后给大鼠灌胃乳果糖/甘露醇混悬液,收集大鼠6h尿液,用高压液相技术测定尿中乳果糖和甘露醇含量,计算它们排出率之比,测定肠粘膜的通透性. 用χ2检验比较各组器官细菌感染率的不同,用t检验统计各组间其他各指标的差异,P<0.05有显著性差异.
, http://www.100md.com
结果 ①制模大鼠胃肠运动的改变:模型大鼠胃肠电活动明显抑制,快波的频率[Fre:胃电(1.32±0.30),十二指肠电(4.47±0.76),空肠电(4.07±1.25)次/min]及振幅指数[AI:胃电(13.70±3.23),十二指肠电(43.06±8.00),空肠电(30.79±7.49)μV/min]明显低于制模前[Fre:胃电(2.91±0.17) ,十二指肠电(17.52±2.43)空肠电(22.32±3.35)次/min;AI:胃电(26.18±3.45),十二指肠电(158.48±65.92),空肠电(149.12±27.52)μV/min],制模大鼠的肠推进速度明显低于正常大鼠(模型组vs 正常对照组:30.7%±3.6%vs 72.8%±3.9%,P<0.05) ②制模大鼠肠粘膜通透性升高:乳果糖排泄率/甘露醇排泄率12.2±1.2明显高于正常对照组0.06±0.01, P<0.05. 小肠组织蛋白中的二胺氧化酶活性降低[(0.04±0.04) vs (0.56±0.04)U/g]. 肠道细菌发生易位,易位率为100%,与正常对照组比较,P<0.05.
, http://www.100md.com
结论 内毒素与TNF联合可制伴有明显胃肠功能障碍的休克模型.
中国图书馆分类号 R57
Alterations of gastrointestinal motility and mucosal barrier in shock rat model induced by endotoxin plus TNF-α
CI Xiu-Li, WANG Bao-En, ZHANG Shu-Wen and ZHANG Ning-Ning
Department of Infectious Diseases, Beijing Friendship Hospital, Beijing 100050, China
Subject headings shoch; endotoxin; tumor necrosis factor; gastrointestinal motility; gastrointestinal mucosa
, http://www.100md.com
Abstract
AIM To study gut motility and mucosal barrier in a shock model induced by endotoxin and recombinant TNF-α in rats.
METHODS Male Wistar rats weighing 250g-300g, were intravenously injected with endotoxin plus recombinant human TNF-α to lower the systemic arterial pressure. Bipolar electromyograms were recorded from electrodes chronically implanted on the serosa of stomach, duodenum and jejunum, and the frequency and amplitude index of spiking activity were calculated. Oral carbon power was used to observe the function of intestinal propulsion. Two hours after the administration of drugs, mesenteric lymph node, liver, spleen, heart, kidney and blood samples were taken aseptically, and were homogenized in saline, and plated on McConkey's agar for culture at 37℃ for 24 hours. The prevalence of bacteria translocation and the number of bacteria in these tissues were calculated. Concentrations of endothelin, NO, nitric oxide syntheses, motilin, SOD, MDA, diamine oxidase (DAO)activity in blood and DAO in small intestine mucosa were measured. Six-hour urinary excretion of orally administered mannitol and lactulose was measured with high-performance liquid chromatography.
, 百拇医药
RESULTS The gastrointestinal electric activity was inhibited markedly (30 minutes after shock vs before shock; Fre: gastric electric activity 1.32±0.30 vs 2.91±0.17,duodenal 4.47±0.76 vs 17.52±2.43,jejunal 4.07±1.25 vs 22.32±3.35min;AI: gastric 13.70±3.23 vs 26.18±3.45,duodenal 43.06±8.00 vs 158.48±65.92,jejunal 30.79±7.49 vs 149.12±27.52μV/min and the rate of intestinal propulsion (shock group vs normal group:30.7%±3.6% vs 72.8%±3.92%,P<0.05) was slowed significantly. The damage of epithelial villi of the mucosa, the increased intestinal permeability of lactulose (the rate of the excretion of lactulose and mannitol in shock vs normal rats:12.2±1.2 vs 0.06±0.01,P<0.05),a decrease of diamine oxidase activity (shock rat vs normal rat:0.04±0.04 vs 0.56±0.04U/g)in gut and the gut bacteria translocation (shock rat vs normal rat:100% vs 0%)showed the impairment of gut barrier function.
, http://www.100md.com
CONCLUSION The gastrointestinal motility is inhibited and the intestinal permeability is increased in endotoxin and recombinant human tumor necrosis factor-α induced shock rats.
0 引言
多器官功能不全综合征(MODS)是继严重感染、创伤、手术、病理产科等之后同时或序贯发生的,以高代谢、高动力循环状态、过度的免疫反应为特征的临床综合征. MODS的病理生理环节之一为缺血缺氧、内毒素及炎性递质使肠粘膜功能受损,肠道细菌繁殖,细菌和内毒素向全身播散,最终导致MODS,MOSF[1],使疾病的死亡率明显升高. 因此保护胃肠道是重症疾病治疗中的重要环节. 内毒素是革兰阴性菌细胞壁的成分,是细菌的主要致病因素,它可刺激机体免疫系统产生大量的细胞因子、氧自由基等一系列因子造成组织器官的损伤;TNF是内毒素刺激产生的细胞因子之一,我们用内毒素与TNF联合致休克模型,观察此模型大鼠的胃肠运动状态及胃肠粘膜的损伤情况,为开发纠正胃肠功能障碍的新药,阻止MODS的发生提供模型.
, http://www.100md.com
1 材料和方法
1.1 材料 ♂Wistar大鼠,体重250g~300g,由本院动物室提供,随机分为:正常对照组和模型组两大组,每组又分:模型制作组、肠推进组、肠粘膜通透性组、细菌移位组,模型组中单加胃肠电组、每组动物数为10只,大肠杆菌0111B4内毒素(Sigma公司产品)和人重组TNF(购自军事医学科学院生物制剂发展中心).
1.2 方法
1.2.1 休克模型的制备 实验前1d颈动脉插管,导管经皮下隧道由颈背部穿出、固定. 禁食不禁水24h后在大鼠清醒自由活动的情况下,将主动脉导管接YH-4型压力传感器,用二导生理记录仪(成都仪器厂产品)记录大鼠的血压变化. 一半动物实验前1d 行动脉插管,同时腹腔注射大肠杆菌内毒素(8μg/kg),禁食不禁水24h后记录大鼠的正常血压,经尾静脉分别注入大肠杆菌内毒素(4mg/kg)和人重组TNF(5万U/kg),观察血压的动态变化,4h后处死,取脏器福尔马林固定送病理.
, http://www.100md.com
1.2.2 ①胃肠电观察的方法同前[2],分别计数休克前及休克后30min,90min时的每分钟峰电数目(频率)、振幅之和(振幅指数). ②碳末推进试验: 制模2h后按经典方法[3]测定肠推进速度. ③肠道细菌移位的观察: 制模2h后,断颈处死,取心脏血、心、肝、脾、肺、肾、肠系膜淋巴结,在普通麦糠凯固体培养基上进行血及器官匀浆液的细菌培养,计数细菌移位的发生率及器官中移位细菌数,同时测定心脏血的NO、NOS、MDA、SOD(化学法,南京建成生物工程研究所试剂盒)、内皮素和胃动素(放免法,东亚免疫技术研究所试剂盒). ④肠粘膜对乳果糖/甘露醇通透性的测定: 参照文献[5]的方法,制膜60分后灌胃乳果糖(丹东康复制药厂产品)和甘露醇(化学纯,国产)混悬液1mL,收集乳甘液灌胃后6h的尿用HPLC检测(带脉冲电化学检测器的高压液相离子色谱仪,美国DIONEX公司)尿中乳果糖和甘露醇的含量,计算6h尿中乳果糖和甘露醇排除率及两者排除率的比值. ⑤血及组织中二胺氧化酶的测定: 分光光度法测定[5].
, 百拇医药
统计学处理用χ2检验或t检验比较两组动物中不同数据的差异,P<0.05具有显著性差异.
2 结果
动脉血压有非常显著的变化(表1),病理变化也显著,模型组动物肺有不同程度的血管扩张、实变及胸膜下出血,回肠粘膜呈不同程度的病损,表现为范围不等的肠粘膜绒毛被覆上皮缺失,其表面及邻近肠腔内程度不等的脱落上皮细胞等聚集.
表1 TNF+LPS致大鼠休克前后血压的变化 (n=10,
组别
0
, http://www.100md.com
5
60
180
正常对照组
16.11±0.96
15.87±1.23
2.11±0.16
2.10±0.23
休克模型组
16.31±0.77
7.24±2.03bd
10.79±2.61b
, 百拇医药
5.41±1.03bd
bP<0.01,vs正常组;dP<0.01,vs 60分.
2.1 血MDA、SOD、NO、NOS、内皮素及胃动素水平的变化 制模大鼠血内皮素、NO均明显高于正常大鼠(P<0.05),但NOS活性没有明显差异;制模大鼠血丙二醛浓度升高,超氧化物歧化酶活性降低,与正常对照组相比P<0.05(表2). 休克大鼠血浆及小肠组织中胃动素(μg/L)水平与正常组比较明显下降(56±19vs380±86;15±7 vs 1461±410,P<0.05),统计结果示胃肠电快波频率及振幅指数与血浆及小肠组织胃动素水平呈正相关(r<1,P<0.05).
表2 模型动物血MDA,SOD,NO,NOS,内皮素的变化 (n=10,
, 百拇医药
MDA(μMol/L)
SOD(u/L)
内皮素(ng/L)
NO(μmol/L)
NOS(kU/L)
正常对照组
0.88±0.27
184±86
109±34
9±5
1.9±0.4
休克模型组
, 百拇医药
5.45±1.49b
105±34b
165±238b
310±160b
2.2±0.5
bP<0.01,vs 正常对照组.
2.2 休克前后胃肠电活动与动力的变化 休克大鼠的胃肠电频率及振幅指数明显降低(表3). 制模大鼠的肠推进速度为30.7%±3.6%,与正常组的72.8%±3.92%相比,肠推进速度明显减慢(P<0.05).
表3 大鼠休克前后胃肠电活动的变化 (n=10,
, 百拇医药
特性
t/min
G0
G30
G90
D0
D30
D90
J0
J30
J90
频率(次/min)
2.9±0.2
, 百拇医药
1.3±0.3a
1.0±0.7a
17.5±2.4
4.5±0.8a
3.3±0.9ac
22.3±3.3
4.1±1.2a
1.9±0.6ac
振幅指数(μV/min)
26.2±3.4
, 百拇医药
13.7±3.2a
7.0±1.2ac
158.5±65.9
43.1±8.0a
11.4±4.3ac
149.1±27.5
30.8±7.5a
6.0±1.8ac
aP<0.05,vs 0;cP<0.05,vs 30;G:胃 D:十二指肠 J:空肠.
, http://www.100md.com
2.3 休克大鼠细菌移位的情况 正常大鼠各器官细菌培养均为阴性,休克大鼠各脏器均发生细菌移位,细菌移位发生率为100%,各器官移位细菌的数目以肠系膜淋巴结中最多,血中细菌感染率及移位的细菌数明显小于其他器官(表4).
表4 TNF+ENDT制模大鼠各脏器细菌移位发生数和细胞数呒 (n=10,
分组
血
心
肝
脾
, 百拇医药 肺
肾
淋
发生数
正常对照
0
0
0
0
0
0
0
休克模型
2
, 百拇医药
8a
8a
10a
10a
8a
10a
细菌数
正常对照
0
0
0
0
, http://www.100md.com
0
0
0
(log CFU/g)
休克模型
0.3±0.01a
3.45±0.18c
3.81±0.31c
3.6±0.34c
3.70±0.35c
3.15±0.27c
, 百拇医药
3.97±0.13c
aP<0.05,cP<0.01,vs 对照组.
2.4 休克大鼠肠粘膜通透性及DAO 休克大鼠尿中乳果糖排除率明显升高,由正常的0.11%±0.07%升高到1.53%±0.19%,两者比较P<0.05,休克大鼠的甘露醇排泄率也明显减少,休克组的乳果糖排除率与甘露醇的排除率的比值,明显高于正常组(P<0.05). 休克大鼠血浆DAO活性升高(0.903±0.88) vs(2.89±0.88)kU/L,小肠组织蛋白中DAO活性降低(0.56±0.04) vs (0.04±0.04)U/g,与正常对照组相比P<0.01.
3 讨论
本试验表明内毒素和TNF联合致休克大鼠胃肠屏障功能严重受损,具体表现如下:①肠组织形态学改变: 回肠粘膜呈不同程度的病损,表现为范围不等的肠粘膜绒毛被覆上皮缺失. ②肠通透性增加: 此模型大鼠尿中乳果糖的排除率明显高于正常大鼠,但甘露醇的排泄率明显降低,说明大鼠的肠粘膜严重受损,大鼠的细胞旁途径增加,肠粘膜损伤,吸收面积减少而致. ③肠DAO活性下降: 本实验模型大鼠小肠组织中DAO活性明显下降,血中DAO活性升高进一步说明肠粘膜上皮受到严重损伤. ④肠道细菌移位: 正常大鼠的胃肠道外各脏器细菌培养均为阴性,而模型组大鼠的大部分胃肠道外各器官细菌培养阳性,而且以肠系膜淋巴结的阳性率最高,所培养出的细菌均是肠道中的常见菌如肠杆菌属细菌、假单胞菌属细菌、肠球菌等,说明此模型大鼠的肠道细菌发生移位. 内毒素和TNF单独可造成机体的损伤,两者合用产生协同作用[6],本实验也证实两者联合可使内毒素的用量较内毒素单独致休克用量小得多[2]. 两者产生协调作用的机制是复杂的,我们的试验结果表明氧应激、NO、内皮素参与了它们的致病过程,当然还有其他因素的参与[7],如粘膜缺氧、粘膜酸中毒、及TNF的直接作用.
, http://www.100md.com
可以肯定,内毒素和TNF联合可致严重的胃肠功能损伤,包括胃肠动力损伤及肠粘膜屏障损伤,此模型可用于粘膜保护药物或促胃肠动力药物药效的观察,与上述有关药物联合应用可进一步确定胃肠功能改变在MODS发生中的作用. 实验结果表明胃肠电的抑制程度与血浆胃动素的水平密切相关,血浆胃动素的测定是否可以作为胃肠动力障碍的辅助诊断指标值得进一步研究.
作者简介:次秀丽,女,1965年-12-01生,河北省栾成县人,汉族. 1986年河北医学院医学系本科毕业,1992年首都医学院硕士,1998年首都医科大学博士,助理研究员,主要从事中西医结合急救医学专业的科研工作,发表论文3篇.
通讯作者 王宝恩,100050,北京市宣武区永安路95号,北京友谊医院内科.
Correspondence to:Pro.WANG Bao-En, Department of Internal Medicine of Beijing Friendship Hospital, 95 Yong An Lu, Xuanwu Distract, Beijing 100050, China
, 百拇医药
Tel. +86.10.63014411 Ext.3205
4 参考文献
1 Swank GM, Deitch EA. Role of the gut in multiple organ failure: bacterial translocation and permeability changes. World J Surg, 1996;20:411-417
2 Ci XL, Wang BE, Guo CY, Chen L. The effect of dopamine on gastrointestinal electrical activity in normal and endotoxin-shock. Rats. Zhongguo Weizhongbing Yixue, 1997;9:710-712
, http://www.100md.com
3 Li YK Methodology of pharmacological experiment in herbal medicine, Shanghai: Shanghai scientific technology Press, 1991; 1st edition:320-321
4 Fleming SC, Kapembwa MS, Laker MF, Levin GE, Griffin GE. Rapid and simultaneous determination of lactulose and mannitol in urine, by HPLC with pulsed amperometric detection, for use in studies of intestinal permeability. Clin Chem, 1990;36:797-799
5 Lu JY, Yu J, He J, Jin Y, Xu HJ. The activity of DAO in plasma and small intestine meassured by photometry. An ji suan He Shengwu Ziyuan, 1996;18:28-29
, 百拇医药
6 Ciancio MJ, Hunt J, Jones SB, Filkins JP. Comparative and interactive in vivo effects of tumor necrosis factor-α and endotoxin. Circulat Shock, 1991;33:108-112
7 Aranow JS, Fink MP. Determination of intestinal barrier failure in critical illness. Br J Anaesth, 1996;77:71-81
收稿日期 1999-01-15 修回日期 1999-03-10, 百拇医药