H7在脑损伤后血脑屏障损害中的作用
作者:李良平 徐如祥 王清华 杨志林
单位:第一军医大学珠江医院神经外科,广州 510282
关键词:脑损伤;血脑屏障;信号转导
创伤外科杂志000407 摘要: 目的 探讨蛋白激酶C(PKC)抑制剂H7在脑损伤后血脑屏障损害中的作用。方法 雄性SD大鼠48只,随机分为正常对照组、假手术组、脑损伤组和治疗组。治疗组于大鼠脑损伤后0.5小时腹腔注射PKC抑制H7(1mg/kg),12小时重复注射1次,伤后24小时应用分光光度计定量检测伊文氏兰渗出。结果 脑损伤后伊文氏兰明显渗出,治疗组渗出明显减少。结论 应用PKC抑制剂H7能明显阻止血脑屏障开放,可望在血脑屏障保护作用中提供新的治疗措施。
中图分类号:R651.102 文献标识码:A
文章编号:1009-4237(2000)04-0210-03
, http://www.100md.com
Effects of H7 on blood-brain barrier damage in brain injury
LI Liang-ping,XU Ru-xiang,WANG Qing-hua,et al.
(Department of Neurosurgery,Zhujiang Hospital,First Military Medical University,Guangzhou 510282)
Abstract: Objective To explore the effects of H7,a protein kinase C(PKC) inhibitor,on BBB damage in brain injury.Methods Forty-eight male SD rats were devided into 4 groups:control one,sham-operation one,brain injury one and H7-treatment one.The rats of the treatment group were peritoneally administered H7(1mg/kg)0.5h after brain injury and did the same 12h after brain injury.The permeation of Evans blue was observed quantitatively with a spectrophotometer.Results Evans blue was significantly permeated in the injured group while insignificantly in the H7-treated rats.Conclusion H7 can prevent BBB opening,which may provide a new way in BBB protection.
, http://www.100md.com
Key words:brain injury;blood-brain barrier;signal transduction
细胞内蛋白激酶C(PKC)激活可导致细胞通透性增加,脑微血管内皮细胞的PKC激活可导致血脑屏障的开放,脑水肿形成。研究脑损伤后PKC的信息转导通路可阐明血脑屏障损害的机理。
本研究采用伊文氏兰定量观察,探讨PKC抑制剂H7在脑损伤后血脑屏障损害中的作用。
材料与方法
1 实验分组
雄性SD大鼠48只,体重(250±30)g,随机分为正常对照组、假手术组、脑损伤组和H7治疗组,每组12只。治疗组于伤后0.5小时腹腔注射H7(1mg/kg),12小时后重复注射1次,H7的剂量选择参照Joo的方法[1]。动物均于伤后24小时处死。
, http://www.100md.com
2 脑损伤模型的建立
采用改进的Feeney氏[2]自由落体硬膜外撞击方法。实验动物用10%水合氯醛(0.35g/kg体重)腹腔内注射麻醉后,头部固定于立体定向仪上,剪去顶部皮毛,消毒皮肤后,沿中线左侧切开头皮,分离骨膜,用牙科钻于中线旁2mm处,紧挨冠状缝后开一直径5mm的圆形窗,硬膜保持完整。用20g砝码于30cm高处通过一金属导杆坠落,撞击置于硬膜上的5mm直径的圆形锥上制成脑损伤模型,致伤冲击力为600gcm,硬膜外置明胶海绵止血,骨窗用锌汀粉封闭,缝合头皮,置鼠笼畏养。
正常对照组不做任何处理。假手术组仅切开头皮和颅骨开窗,不致脑损伤,术后24小时处死。
3 脑组织伊文氏兰含量的测定
大鼠均于处死前1小时股静脉注射2%伊文氏兰3ml/kg。取脑时,为清除血液中染料,用生理盐水左心室灌注至右心耳流出清亮液体。取损伤侧皮质、海马,对侧皮质、海马分别称重,加入二倍体积二甲基甲酰胺,50°C水浴中孵育72小时,1500g离心10分钟,取上清,应用分光光度计在伊文氏兰最大吸收光谱635nm处检测吸光度,从标准曲线上查得伊文氏兰含量结果以μg/g脑组织表示。
, 百拇医药
4 统计学处理
应用单因素方差分析和各组均数t检验处理,P<0.05为显著性差异。
结 果
脑组织伊文氏兰定量测定结果:脑损伤后损伤侧皮质、海马,对侧皮质、海马伊文氏兰含量都明显高于正常对照组和假手术组。治疗组损伤侧海马、对侧皮质、海马,伊文氏兰含量接近正常,损伤侧皮质伊文氏兰含量明显高于正常对照组和假手术组,但明显低于脑损伤组(见附表、附图)。
附表 H7治疗后脑组织伊文氏兰含量的变化( ±s) 组 别
±s) 组 别
n
伊文氏兰含量(μg/g脑组织)
, 百拇医药
左侧皮质
右侧皮质
左侧海马
右侧海马
正常对照组
12
10.15±1.06
10.31±1.22
10.62±0.89
11.67±0.84
假手术组
12
, 百拇医药 10.96±0.43
10.87±0.37
10.61±0.66
10.55±0.49
脑损伤组
12
237.41±15.48**
20.97±0.38
20.38±0.79**
15.67±1.19*
H7治疗组
, 百拇医药
12
75.64±8.21**△△
11.67±1.31△△
11.96±0.76△△
10.43±0.85△△
*:P<0.05,**:P<0.01,与正常组相比较;△:P<0.05,△△:P<0.01与脑损伤组相比较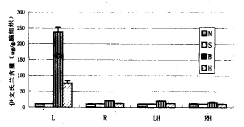
L-左侧皮质 R-右侧皮质 LH-左侧海马 RH-右侧海马
, 百拇医药
N-正常组 S-假手术组 B-脑损伤组 H-H7治疗组
附图 H7治疗后脑组织伊文氏兰含量的变化
讨 论
PKC是内皮细胞信息转导通路的一个重要环节,调节内皮细胞通透性,在脑微血管内皮细胞中参与了血脑屏障通透性调节,与脑水肿的发生发展密切相关。Patterson[3]报道,在牛肺动脉内皮细胞单层,应用PKC抑制剂和下调PKC都能明显抑制百日咳毒素诱发的细胞间裂隙形成和通透性增加。Joo[1]报道在大鼠脑缺血模型中双侧颈内动脉结扎后,脑组织明显水肿,应用PKC抑制剂H7后,脑水肿明显减轻,提示PKC参与了血脑屏障开放的调节作用。本文通过对大鼠脑损伤后伊文氏兰渗出的定量研究,证明H7能明显阻止血脑屏障的开放。脑损伤后血脑屏障破坏分为可逆性损害和不可逆损害。各种介质作用的非直接损伤区,如同侧海马,对侧皮质、海马,血脑屏障可逆性开放,H7几乎能完全阻断血脑屏障可逆性开放。从本实验结果可知损伤侧周围皮质不可逆性损伤严重,存在血管断裂,伊文氏兰渗出最明显,H7部分阻断伊文氏渗出,达到60%。H7在脑损伤后血脑屏障损害中起着重要作用,有明显阻断血脑屏障开放的作用。
, 百拇医药
脑损伤后血脑屏障开放的主要方式是内皮细胞间裂隙形成,通透性增加,可能有二方面调节机制:(1)轴向的收缩,主要由肌球蛋白轻链激酶(MLCK)调节作用;(2)束缚力量,即细胞-细胞,细胞-基质粘附作用。PKC可使粘着斑蛋白激酶激活,作用于粘着斑蛋白和踝蛋白(vinculin and talin)等,使细胞骨架结构重组,细胞回缩,通透性增加[4,5]。脑损伤后各种神经介质和自由基释放可导致脑微血管内皮细胞PKC激活,细胞收缩和回缩,细胞间裂隙形成,通透性增加,血脑屏障开放,加重脑水肿的发生、发展。PKC抑制剂H7能阻止PKC的作用,阻止细胞骨架结构重排,减少内皮质细胞通透性,在脑微血管内皮细胞,阻止血脑屏障的开放。
参考文献:
[1]Joo F,Tosaki A,Olah Z,et al.Inhibition by H7 of the protein kinase C prevents formation of brain edema in sprague bawley CFY rats[J].Brain Res.1989,490(6):141-143.
, 百拇医药
[2]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:I methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):66-67.
[3]Patterson CE,Stasek JK,Schaphorst KL,et al.Machanisms pertussis toxin-induced barrier dysfunction in bovine pulmonary artery endothelial cell monolayers[J].Am J Physiol,1995,268(6pt1):2926-2934.
[4]Schaphorst KL,Pavalko FM,Patterson CE.Thrombin-mediated focal adhesion plaque reorganization in endothelium:role of protein phosphorylation[J].Am J Respir Cell Mol Biol,1997,17(4):443-455.
[5]Garcia JA,Verin AD,Schaphorst KL.Regulation of thrombin-mediated endothelial cell contraction and permeability[J].Semin Thromb Hemost,1996,22(4):309-315.
收稿日期:1999-08-30;修回日期:2000-06-12, 百拇医药
单位:第一军医大学珠江医院神经外科,广州 510282
关键词:脑损伤;血脑屏障;信号转导
创伤外科杂志000407 摘要: 目的 探讨蛋白激酶C(PKC)抑制剂H7在脑损伤后血脑屏障损害中的作用。方法 雄性SD大鼠48只,随机分为正常对照组、假手术组、脑损伤组和治疗组。治疗组于大鼠脑损伤后0.5小时腹腔注射PKC抑制H7(1mg/kg),12小时重复注射1次,伤后24小时应用分光光度计定量检测伊文氏兰渗出。结果 脑损伤后伊文氏兰明显渗出,治疗组渗出明显减少。结论 应用PKC抑制剂H7能明显阻止血脑屏障开放,可望在血脑屏障保护作用中提供新的治疗措施。
中图分类号:R651.102 文献标识码:A
文章编号:1009-4237(2000)04-0210-03
, http://www.100md.com
Effects of H7 on blood-brain barrier damage in brain injury
LI Liang-ping,XU Ru-xiang,WANG Qing-hua,et al.
(Department of Neurosurgery,Zhujiang Hospital,First Military Medical University,Guangzhou 510282)
Abstract: Objective To explore the effects of H7,a protein kinase C(PKC) inhibitor,on BBB damage in brain injury.Methods Forty-eight male SD rats were devided into 4 groups:control one,sham-operation one,brain injury one and H7-treatment one.The rats of the treatment group were peritoneally administered H7(1mg/kg)0.5h after brain injury and did the same 12h after brain injury.The permeation of Evans blue was observed quantitatively with a spectrophotometer.Results Evans blue was significantly permeated in the injured group while insignificantly in the H7-treated rats.Conclusion H7 can prevent BBB opening,which may provide a new way in BBB protection.
, http://www.100md.com
Key words:brain injury;blood-brain barrier;signal transduction
细胞内蛋白激酶C(PKC)激活可导致细胞通透性增加,脑微血管内皮细胞的PKC激活可导致血脑屏障的开放,脑水肿形成。研究脑损伤后PKC的信息转导通路可阐明血脑屏障损害的机理。
本研究采用伊文氏兰定量观察,探讨PKC抑制剂H7在脑损伤后血脑屏障损害中的作用。
材料与方法
1 实验分组
雄性SD大鼠48只,体重(250±30)g,随机分为正常对照组、假手术组、脑损伤组和H7治疗组,每组12只。治疗组于伤后0.5小时腹腔注射H7(1mg/kg),12小时后重复注射1次,H7的剂量选择参照Joo的方法[1]。动物均于伤后24小时处死。
, http://www.100md.com
2 脑损伤模型的建立
采用改进的Feeney氏[2]自由落体硬膜外撞击方法。实验动物用10%水合氯醛(0.35g/kg体重)腹腔内注射麻醉后,头部固定于立体定向仪上,剪去顶部皮毛,消毒皮肤后,沿中线左侧切开头皮,分离骨膜,用牙科钻于中线旁2mm处,紧挨冠状缝后开一直径5mm的圆形窗,硬膜保持完整。用20g砝码于30cm高处通过一金属导杆坠落,撞击置于硬膜上的5mm直径的圆形锥上制成脑损伤模型,致伤冲击力为600gcm,硬膜外置明胶海绵止血,骨窗用锌汀粉封闭,缝合头皮,置鼠笼畏养。
正常对照组不做任何处理。假手术组仅切开头皮和颅骨开窗,不致脑损伤,术后24小时处死。
3 脑组织伊文氏兰含量的测定
大鼠均于处死前1小时股静脉注射2%伊文氏兰3ml/kg。取脑时,为清除血液中染料,用生理盐水左心室灌注至右心耳流出清亮液体。取损伤侧皮质、海马,对侧皮质、海马分别称重,加入二倍体积二甲基甲酰胺,50°C水浴中孵育72小时,1500g离心10分钟,取上清,应用分光光度计在伊文氏兰最大吸收光谱635nm处检测吸光度,从标准曲线上查得伊文氏兰含量结果以μg/g脑组织表示。
, 百拇医药
4 统计学处理
应用单因素方差分析和各组均数t检验处理,P<0.05为显著性差异。
结 果
脑组织伊文氏兰定量测定结果:脑损伤后损伤侧皮质、海马,对侧皮质、海马伊文氏兰含量都明显高于正常对照组和假手术组。治疗组损伤侧海马、对侧皮质、海马,伊文氏兰含量接近正常,损伤侧皮质伊文氏兰含量明显高于正常对照组和假手术组,但明显低于脑损伤组(见附表、附图)。
附表 H7治疗后脑组织伊文氏兰含量的变化(
 ±s) 组 别
±s) 组 别n
伊文氏兰含量(μg/g脑组织)
, 百拇医药
左侧皮质
右侧皮质
左侧海马
右侧海马
正常对照组
12
10.15±1.06
10.31±1.22
10.62±0.89
11.67±0.84
假手术组
12
, 百拇医药 10.96±0.43
10.87±0.37
10.61±0.66
10.55±0.49
脑损伤组
12
237.41±15.48**
20.97±0.38
20.38±0.79**
15.67±1.19*
H7治疗组
, 百拇医药
12
75.64±8.21**△△
11.67±1.31△△
11.96±0.76△△
10.43±0.85△△
*:P<0.05,**:P<0.01,与正常组相比较;△:P<0.05,△△:P<0.01与脑损伤组相比较

L-左侧皮质 R-右侧皮质 LH-左侧海马 RH-右侧海马
, 百拇医药
N-正常组 S-假手术组 B-脑损伤组 H-H7治疗组
附图 H7治疗后脑组织伊文氏兰含量的变化
讨 论
PKC是内皮细胞信息转导通路的一个重要环节,调节内皮细胞通透性,在脑微血管内皮细胞中参与了血脑屏障通透性调节,与脑水肿的发生发展密切相关。Patterson[3]报道,在牛肺动脉内皮细胞单层,应用PKC抑制剂和下调PKC都能明显抑制百日咳毒素诱发的细胞间裂隙形成和通透性增加。Joo[1]报道在大鼠脑缺血模型中双侧颈内动脉结扎后,脑组织明显水肿,应用PKC抑制剂H7后,脑水肿明显减轻,提示PKC参与了血脑屏障开放的调节作用。本文通过对大鼠脑损伤后伊文氏兰渗出的定量研究,证明H7能明显阻止血脑屏障的开放。脑损伤后血脑屏障破坏分为可逆性损害和不可逆损害。各种介质作用的非直接损伤区,如同侧海马,对侧皮质、海马,血脑屏障可逆性开放,H7几乎能完全阻断血脑屏障可逆性开放。从本实验结果可知损伤侧周围皮质不可逆性损伤严重,存在血管断裂,伊文氏兰渗出最明显,H7部分阻断伊文氏渗出,达到60%。H7在脑损伤后血脑屏障损害中起着重要作用,有明显阻断血脑屏障开放的作用。
, 百拇医药
脑损伤后血脑屏障开放的主要方式是内皮细胞间裂隙形成,通透性增加,可能有二方面调节机制:(1)轴向的收缩,主要由肌球蛋白轻链激酶(MLCK)调节作用;(2)束缚力量,即细胞-细胞,细胞-基质粘附作用。PKC可使粘着斑蛋白激酶激活,作用于粘着斑蛋白和踝蛋白(vinculin and talin)等,使细胞骨架结构重组,细胞回缩,通透性增加[4,5]。脑损伤后各种神经介质和自由基释放可导致脑微血管内皮细胞PKC激活,细胞收缩和回缩,细胞间裂隙形成,通透性增加,血脑屏障开放,加重脑水肿的发生、发展。PKC抑制剂H7能阻止PKC的作用,阻止细胞骨架结构重排,减少内皮质细胞通透性,在脑微血管内皮细胞,阻止血脑屏障的开放。
参考文献:
[1]Joo F,Tosaki A,Olah Z,et al.Inhibition by H7 of the protein kinase C prevents formation of brain edema in sprague bawley CFY rats[J].Brain Res.1989,490(6):141-143.
, 百拇医药
[2]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:I methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):66-67.
[3]Patterson CE,Stasek JK,Schaphorst KL,et al.Machanisms pertussis toxin-induced barrier dysfunction in bovine pulmonary artery endothelial cell monolayers[J].Am J Physiol,1995,268(6pt1):2926-2934.
[4]Schaphorst KL,Pavalko FM,Patterson CE.Thrombin-mediated focal adhesion plaque reorganization in endothelium:role of protein phosphorylation[J].Am J Respir Cell Mol Biol,1997,17(4):443-455.
[5]Garcia JA,Verin AD,Schaphorst KL.Regulation of thrombin-mediated endothelial cell contraction and permeability[J].Semin Thromb Hemost,1996,22(4):309-315.
收稿日期:1999-08-30;修回日期:2000-06-12, 百拇医药