缺锌抑制体外培养大鼠成骨细胞的增殖及分化*
作者:岑小波 赵瀛兰 王瑞淑 项鹏 吴兆锋
单位:岑小波 王瑞淑(华西医科大学公共卫生学院,成都 610041);赵瀛兰(贵州省人民医院内科);项鹏 吴兆锋(华西医科大学生物化学教研室)
关键词:锌;成骨细胞;增殖;分化
卫生研究990115 摘要 为了研究缺锌对体外培养大鼠成骨细胞增殖和分化的影响,从大鼠颅骨分离出成骨细胞,并于DMEM培养基中进行传代培养。锌特异性络合剂TPEN络合掉培养基中的锌建立细胞体外培养的缺锌模型。采用3H-TdR掺入法确定成骨细胞在不同时点DNA的合成状况,同时应用流式细胞仪进行细胞周期的分析;采用组织学方法观察细胞骨架的变化、3H-脯氨酸掺入法确定胶原蛋白的合成;采用酶动力学和放免方法分别测定碱性磷酸酶活性和骨钙素含量。结果表明,缺锌组成骨细胞3H-TdR掺入量在各个时点明显低于对照组,细胞被阻滞于细胞周期中G2/M期,这与细胞骨架受损密切相关。缺锌组胶原蛋白合成、骨钙素含量及碱性磷酸酶活性明显低于对照组。但缺锌补锌组的各个指标与对照组相比无统计学差异。因此,缺锌能够抑制体外培养大鼠成骨细胞的增殖和分化。
, 百拇医药
中图分类号 Q581 Q344.5
Zinc deficiency inhibited the proliferation and
differentiation of rat osteoblast in vitro
Cen Xiaobo, Zhao Yinglan, Wang Ruishu, Xiang Peng, et al.
Department of Nutrition & Food Hygiene, Collage of Public Health
West China University of Medical Sciences, Chengdu 610041, China
, 百拇医药
The effect of zinc deficiency on proliferation and differentiation of rat osteoblast was studied in vitro. The osteoblasts were isolated from the rat calvaria, and were subcultured in DMEM medium. Zinc deficiency model in cell culture was made by chelating zinc from the medium with a special chelator TPEN. Incorporation of 3H-thymidine was measured to show the DNA synthesis at different time point, and cell cycle was analyzed by flow cytometry. A histochemistry method was used to detect changes of osteoblast cytoskeleton. Incorporation of 3H-proline was measured to show the synthesis of collagen. Alkaline phosphatase activity (AKP) and osteocalcin content were measured by enzyme dynamics method and radioimunoassay respectively. The results showed that the incorporation of 3H-thymidine in the zinc deficient group was significantly less than that in the control group at different time points. The cells were blocked at G2/M phase of cell cycle, which is related to the impairment of cytoskeleton. Collagen synthesis, osteocalcin content and AKP activity in the zinc deficient group were reduced significantly as compared with those in the control group. But no differences in all the measurements were observed between the control group and the group of zinc deficiency supplemented with zinc. Therefore, it was concluded that zinc deficiency inhibited the proliferation and differentiation of rat osteoblast in vitro.
, 百拇医药
Key words:zinc, osteoblast, proliferation, differentiation
锌是人体所必需的微量元素,它参与了机体新陈代谢的各个方面。近年来的研究表明锌与骨代谢及机能的关系非常密切[1]。锌可以促进动物骨发育以及骨钙化,促进体外培养的MC3T3-E1成骨细胞蛋白质及DNA的合成[2]。流行病学调查资料表明锌缺乏可使动物及人体生长发育迟缓、骨龄延迟,缺乏严重时尚可引起动物骨骼畸形;锌缺乏也与妇女经绝期后骨质减少、骨质疏松密切相关[3]。我国是一个农业大国,尤其在农村,植物性食物在家庭膳食结构中占较大比例;加上影响锌吸收的因素较多,所以很容易造成机体锌缺乏。本次采用体外培养的大鼠成骨细胞研究缺锌对其增殖及分化的影响,为充分发挥锌的营养及药理作用提供实验依据。
1 材料与方法
1.1 主要生化试剂
, 百拇医药
DMEM培养基(GibcoBRL);小牛血清(华西生化制品厂);胰蛋白酶、Ⅳ型胶原酶、ZnSO4.7H2O及N,N,N’,N’-tetrakis-2-pyridyl methl-ethyline diamine(TPEN)均为Sigma产品。3H-胸腺嘧啶核苷酸(3H-TdR),3H-脯氨酸及骨钙素放免测定试剂盒由上海原子能研究所提供。
1.2 方法
1.2.1 大鼠成骨细胞的分离及体外培养 参照Hiroko等的方法进行大鼠颅骨成骨细胞的分离培养[4]。将妊娠第19~21天的SD雌性大鼠用乙醚麻醉后,在无菌条件下迅速剖腹,从子宫中取出胎鼠。分离出胎鼠颅骨,仔细剥除骨膜和结缔组织。用Hank's液清洗三次后,将其剪碎,加入含0.25%胰酶和0.1%胶原酶的消化液。37℃恒温振摇消化5min,收集细胞悬液,弃去。重新加入上述消化液消化60min,收集细胞悬液,经100μm孔径的金属网过滤后,1000r/min离心10min,弃上清。细胞沉淀用无血清DMEM培养基洗涤2次,加入含10%小牛血清的DMEM培养液调整细胞密度为5×105/ml。取细胞悬液1ml加入25ml培养瓶中,加入DMEM培养液,于37℃、5%CO2培养箱中进行培养。原代培养细胞融合后开始进行传代培养。一般取4~8代的细胞进行实验。
, 百拇医药
1.2.2 实验分组 实验分为3个组:(1)对照组,培养基为基础培养基;(2)缺锌组,培养基TPEN浓度为10μmol/L;(3)缺锌补锌组,培养基TPEN及Zn2+的浓度均为10μmol/L。
1.2.3 测定指标及方法
1.2.3.1 成骨细胞DNA合成 采用3H-TdR掺入法。取对数生长期细胞1×104接种于96孔板中。各实验组设立3个复孔。培养36h后,弃掉旧培养液,换上各组相应的培养基,同时各孔加入3.7×104Bq3H-TdR,置于CO2孵箱中培养。分别于6、12、24、48h后弃去上清,加入0.25%胰蛋白酶消化分离细胞,用多头细胞收集器将细胞收集于玻纤滤纸上。60℃烘干滤纸,置于闪烁瓶内,加入闪烁液后于液闪计数仪中测定cpm(count per minute,每分钟计数)。
, http://www.100md.com
1.2.3.2 细胞周期测定 采用流式细胞仪进行检测。各组待测细胞用PBS洗涤2次后,迅速注入预冷的75%乙醇中,振荡混匀,4℃过夜。再用PBS洗涤细胞,以除去乙醇。溴化乙啶在暗处对细胞染色,30min后上机检测。
1.2.3.3 细胞骨架观察 取出载有细胞的小盖片,用0.1mol/L PBS漂洗2次,每次3min后,用1% TritonX-100抽提缓冲液作用5min,0.1mol/L PBS漂洗2次,每次5min后,用2.5%戊二醛中固定20min。取出盖片用蒸馏水漂洗2次。然后用0.2%考马氏亮蓝染色液染色60min,蒸馏水洗3次。然后置于37℃烘箱内20min后,用树胶封片、观察、摄影记录。
1.2.3.4 成骨细胞胶原蛋白合成 2×104细胞接种于24孔板中,培养24h后,弃掉旧培养液,换上各组相应的培养基,继续培养2天。弃掉旧培养液,换上150μl各组相应的培养基,同时加入3.7×105Bq3H-脯氨酸。24小时后取出上清液于5ml尖底玻璃试管中;用0.9%NaCl调至200μl。在玻璃试管中加入5mol/L乙酸25μl,1mg/ml胃蛋白酶25μl,10mg/ml脯氨酸10μl,4℃保温2h,用细胞自动收集仪将试管内上清及沉淀一起收集到用0.6mol/L高氯酸预先湿润的玻璃纤维膜。0.6mol/L高氯酸2ml抽洗一次,最后用无水乙醇2ml抽洗一次。将玻璃纤膜用0.6mol/L高氯酸2ml抽洗一次,最后用无水乙醇2ml抽洗一次。晾干后,置于闪烁瓶中。加入10ml闪烁液,于液闪仪中计数测定cpm。
, 百拇医药
1.2.3.5 成骨细胞骨钙素合成 将2×104细胞接种于24孔板中,培养基为各组相应的培养基。培养至第12天后,弃掉旧培养液,换上各组相应的培养基1ml,继续培养3天。取上清液按照试剂盒程序进行骨钙素的放免测定。
1.2.3.6 成骨细胞碱性磷酸酶(AKP)活性测定 将2×104细胞接种于24孔培养板中,培养24h后,弃掉旧培养液,换上各组相应的培养基,继续培养3天后,将搜集细胞于Eppendorf管中。用PBS洗涤2次后,加入0.1%TritorX-100,置于4℃过夜。用吸管反复吹打细胞,使其完全裂解。取40μl细胞裂解液按酶动力学方法进行AKP活性测定。AKP活性以每毫克细胞蛋白质每分钟产生对硝基苯酚的毫摩尔数表示[mmol/(min.mg)]。
2 结果
2.1 锌对大鼠成骨细胞DNA合成的影响
, 百拇医药
缺锌组成骨细胞3H-TdR掺入量在各个时点明显低于对照组,而缺锌补锌组与对照组相比无统计学差异(P>0.05,图1)。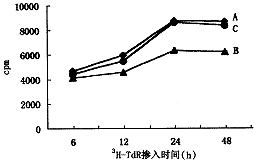
图1 缺锌对体外培养大鼠成骨细胞DNA合成的影响
A:对照组 B:缺锌组 C:缺锌补锌组
2.2 缺锌对成骨细胞细胞周期的影响
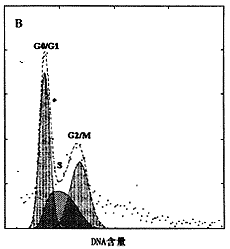
从流式细胞仪测定的DNA直方图可见,缺锌组细胞明显地被阻滞于细胞周期中的G2/M期,使得进入下一细胞周期中G1期、S期的细胞减少,见图2。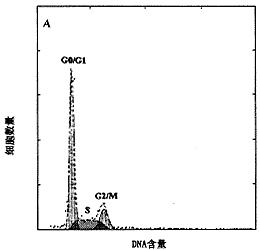
, http://www.100md.com
图2 缺锌对体外培养大鼠成骨细胞细胞周期的影响
A:对照组 B:缺锌组
2.3 缺锌对成骨细胞细胞骨架的影响
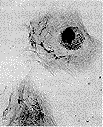
对照组成骨细胞细胞骨架结构丰满、纹理清晰、分布细长均匀,横贯整个细胞,直达细胞膜边缘(图3)。而缺锌组细胞骨架明显杂乱无序,丧失原有清晰均匀的特性(图4)。

图3 正常大鼠成骨细胞细胞骨架(考马氏亮蓝染色,10×20)
, 百拇医药
图4 缺锌大鼠成骨细胞细胞骨架(考马氏亮蓝染色,10×20)
2.4 缺锌对成骨细胞胶原蛋白合成的影响
缺锌组3H-脯氨酸掺入量明显低于对照组(P<0.05),而缺锌补锌组与对照组相比无统计学差异(表1)。
表1 缺锌对大鼠成骨细胞胶原及骨钙素合成的影响(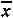 ±s) 组别
±s) 组别
3H-脯氨酸掺入量(cpm)
骨钙素(ng/well)
对照组
11375±1145
, http://www.100md.com
1.01±0.32
缺锌组
7092±887(1)
0.86±0.26(1)
缺锌补锌组
10185±995
0.94±0.11
注:(1)与对照组相比,P<0.05
2.5 缺锌对成骨细胞骨钙素合成的影响
缺锌组骨钙素明显低于对照组(P<0.05);缺锌补锌组与对照组相比无统计学差异(表1)。
, 百拇医药
2.6 锌对成骨细胞碱性磷酸酶活性的影响
缺锌组碱性磷酸酶活性明显低于对照组(P<0.05);缺锌补锌组与对照组相比无统计学差异(表2)
表2 缺锌对大鼠成骨细胞碱性磷酸酶活性的影响(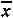 ±s) 组别
±s) 组别
AKP活性[mmol/(min.mg)]
对照组
22.3±3.2
缺锌组
17.5±3.7(1)
, http://www.100md.com
缺锌补锌组
20.8±4.4
注:(1)与对照组相比,P<0.05
3 讨论
3.1 缺锌对成骨细胞增殖的影响
TPEN是锌的特异性络合剂,它与锌的亲合力远远大于钙、镁等金属离子[5]。因此,国外学者常将它用于制造组织培养的体外缺锌模型。结果表明,体外培养的成骨细胞在缺锌条件下,DNA合成受到明显抑制,且呈时间-效应关系。但缺锌补锌组DNA合成不受任何影响。核酸合成的一些关键酶如DNA聚合酶、天冬氨酸转氨甲酰酶都是锌依赖酶,且在缺锌条件下活性降低[6]。因此,缺锌抑制成骨细胞的增殖与核酸合成酶活性降低有关。细胞周期的精确性是正常细胞生长和分化所必需的,它包括G1期、S期、G2期及M期,并受到信号传导系统和反馈环路的精密调控。细胞有丝分裂的顺利进行,最重要的是G1/S和G2/M转换;其中G2/M转换涉及胞质和核DNA的分裂,而该过程又与细胞骨架重建密切相关。细胞骨架是横贯在胞核和质膜内侧的一种纤维状蛋白质基质。它构建细胞形状,参与细胞的运动、变形及增殖调控。缺锌使成骨细胞明显的阻滞于G2/M期,表明细胞不能顺利地进行G2/M的转换;同时缺锌又使得细胞骨架受到破坏。这提示了缺锌导致细胞骨架受损可能是成骨细胞阻滞于G2/M期的重要原因。细胞骨架蛋白的磷酸化对于骨架的正确组装、构架及功能是必须的,如vinculin、肌动蛋白均是蛋白激酶C(PKC)的磷酸化底物[7]。Harrison等研究表明[8],PKC的抑制剂sphingosin可以阻碍佛波酯诱导大鼠星形胶质细胞肌动蛋白的重组。而缺锌使成骨细胞PKC活性降低(另发表)。因此,缺锌很可能抑制了PKC对骨架蛋白的正常磷酸化,干扰微丝、微管及中间丝的正常组装和胞质的正常分裂,从而阻滞细胞于G2/M期,并同时参与抑制细胞增殖。
, 百拇医药
胶原蛋白成骨组织基质的主要组成成分,它在体外的大量合成是成骨细胞增殖活跃的一个显著特征。胶原蛋白中脯氨酸及羟脯氨酸占全部氨基酸残基的22%。因此,可以从3H-脯氨酸掺入量反映细胞胶原合成状况。在缺锌条件下,成骨细胞胶原的修饰合成受到抑制,补锌后合成恢复。缺锌对胶原蛋白合成的抑制可能发生在胶原基因的转录水平。
3.2 缺锌抑制成骨细胞分化
AKP是成骨细胞的标志酶,参与调节钙化过程。它能分解磷酸盐化合物,产生游离磷酸。磷酸与细胞间质中钙结合形成磷酸钙。骨钙素(BGP),是由非增殖期成骨细胞特异性合成和分泌的一种非胶原蛋白。BGP在钙离子存在条件下,与羟磷灰石结合并稳定其构象。因此,AKP、BGP是反映成骨细胞在体外分化为成熟骨细胞及基质钙化的两个重要指标。缺锌条件下,成骨细胞AKP活性、BGP含量明显降低,表明缺锌抑制成骨细胞基质的钙化,抑制向骨细胞的分化。AKP是含锌的锌依赖性酶,缺锌直接降低其活性;BGP基因上游存在锌指蛋白结合位点,因此,缺锌可能在转录及翻译水平影响BGP合成。
, http://www.100md.com
* 国家自然科学基金资助项目(39770647)
作者简介:岑小波,男,医学博士
参考文献
1Beattie J H, Alison A. Trace element nutrition and bone metabolism. Nutr Res Rev, 1992, 5:167—1882Masayuki Hashizume, Masayoshi Yamaguchi. Effect of β-alnany-L-histidinato zinc on differentiation of osteoblast MC3T3-E1 cell: Increase in alkaline phosphatase activity and protein concentration. Mol Cell Biol, 1994,131:19—243Relea P, Recilla M,Ripoll E, et al. Zinc, biochemical markers of nutrition and type I osteoprosis. Age Ageing, 1995,24:303—3074Hiroko S, Hiro-Ari K, Yuji A,et al. In vitro differentiation and calcification in a new clony osteogenic cell line derived from new born mouse calvaria. J Cell Biol, 1983, 96:191—1985Arslan P, Divigilio F, Beltrame M, et al. Ca2+homeostasis in ehrlich and yoshida carcinomas: a new membrane-permeant chelator of heavy metals reveals that these ascites tumor cell lines have normal cytosolic free Ca2+. J Biol Chem, 1985,260:2719—27276Coleman J E. Zinc protein: enzymes, storage protein, transcription factor, and replication protein. Annu Rev Biochem, 1992, 61:897—9467James BM, Wang YL. Reorganization of alpha-actinin and vinculin induced by a phorbol ester in living cells. J Cell Biol, 1996, 102:1430—14358Harrison BC, Staskavage DL, Mobley PL. Effect of siphingosine on phorbol estermediated changes in astrocyte morphology and protein phosphorylation. J Neurosci Res, 1991,29:118—189
1998-06-18收稿, 百拇医药
单位:岑小波 王瑞淑(华西医科大学公共卫生学院,成都 610041);赵瀛兰(贵州省人民医院内科);项鹏 吴兆锋(华西医科大学生物化学教研室)
关键词:锌;成骨细胞;增殖;分化
卫生研究990115 摘要 为了研究缺锌对体外培养大鼠成骨细胞增殖和分化的影响,从大鼠颅骨分离出成骨细胞,并于DMEM培养基中进行传代培养。锌特异性络合剂TPEN络合掉培养基中的锌建立细胞体外培养的缺锌模型。采用3H-TdR掺入法确定成骨细胞在不同时点DNA的合成状况,同时应用流式细胞仪进行细胞周期的分析;采用组织学方法观察细胞骨架的变化、3H-脯氨酸掺入法确定胶原蛋白的合成;采用酶动力学和放免方法分别测定碱性磷酸酶活性和骨钙素含量。结果表明,缺锌组成骨细胞3H-TdR掺入量在各个时点明显低于对照组,细胞被阻滞于细胞周期中G2/M期,这与细胞骨架受损密切相关。缺锌组胶原蛋白合成、骨钙素含量及碱性磷酸酶活性明显低于对照组。但缺锌补锌组的各个指标与对照组相比无统计学差异。因此,缺锌能够抑制体外培养大鼠成骨细胞的增殖和分化。
, 百拇医药
中图分类号 Q581 Q344.5
Zinc deficiency inhibited the proliferation and
differentiation of rat osteoblast in vitro
Cen Xiaobo, Zhao Yinglan, Wang Ruishu, Xiang Peng, et al.
Department of Nutrition & Food Hygiene, Collage of Public Health
West China University of Medical Sciences, Chengdu 610041, China
, 百拇医药
The effect of zinc deficiency on proliferation and differentiation of rat osteoblast was studied in vitro. The osteoblasts were isolated from the rat calvaria, and were subcultured in DMEM medium. Zinc deficiency model in cell culture was made by chelating zinc from the medium with a special chelator TPEN. Incorporation of 3H-thymidine was measured to show the DNA synthesis at different time point, and cell cycle was analyzed by flow cytometry. A histochemistry method was used to detect changes of osteoblast cytoskeleton. Incorporation of 3H-proline was measured to show the synthesis of collagen. Alkaline phosphatase activity (AKP) and osteocalcin content were measured by enzyme dynamics method and radioimunoassay respectively. The results showed that the incorporation of 3H-thymidine in the zinc deficient group was significantly less than that in the control group at different time points. The cells were blocked at G2/M phase of cell cycle, which is related to the impairment of cytoskeleton. Collagen synthesis, osteocalcin content and AKP activity in the zinc deficient group were reduced significantly as compared with those in the control group. But no differences in all the measurements were observed between the control group and the group of zinc deficiency supplemented with zinc. Therefore, it was concluded that zinc deficiency inhibited the proliferation and differentiation of rat osteoblast in vitro.
, 百拇医药
Key words:zinc, osteoblast, proliferation, differentiation
锌是人体所必需的微量元素,它参与了机体新陈代谢的各个方面。近年来的研究表明锌与骨代谢及机能的关系非常密切[1]。锌可以促进动物骨发育以及骨钙化,促进体外培养的MC3T3-E1成骨细胞蛋白质及DNA的合成[2]。流行病学调查资料表明锌缺乏可使动物及人体生长发育迟缓、骨龄延迟,缺乏严重时尚可引起动物骨骼畸形;锌缺乏也与妇女经绝期后骨质减少、骨质疏松密切相关[3]。我国是一个农业大国,尤其在农村,植物性食物在家庭膳食结构中占较大比例;加上影响锌吸收的因素较多,所以很容易造成机体锌缺乏。本次采用体外培养的大鼠成骨细胞研究缺锌对其增殖及分化的影响,为充分发挥锌的营养及药理作用提供实验依据。
1 材料与方法
1.1 主要生化试剂
, 百拇医药
DMEM培养基(GibcoBRL);小牛血清(华西生化制品厂);胰蛋白酶、Ⅳ型胶原酶、ZnSO4.7H2O及N,N,N’,N’-tetrakis-2-pyridyl methl-ethyline diamine(TPEN)均为Sigma产品。3H-胸腺嘧啶核苷酸(3H-TdR),3H-脯氨酸及骨钙素放免测定试剂盒由上海原子能研究所提供。
1.2 方法
1.2.1 大鼠成骨细胞的分离及体外培养 参照Hiroko等的方法进行大鼠颅骨成骨细胞的分离培养[4]。将妊娠第19~21天的SD雌性大鼠用乙醚麻醉后,在无菌条件下迅速剖腹,从子宫中取出胎鼠。分离出胎鼠颅骨,仔细剥除骨膜和结缔组织。用Hank's液清洗三次后,将其剪碎,加入含0.25%胰酶和0.1%胶原酶的消化液。37℃恒温振摇消化5min,收集细胞悬液,弃去。重新加入上述消化液消化60min,收集细胞悬液,经100μm孔径的金属网过滤后,1000r/min离心10min,弃上清。细胞沉淀用无血清DMEM培养基洗涤2次,加入含10%小牛血清的DMEM培养液调整细胞密度为5×105/ml。取细胞悬液1ml加入25ml培养瓶中,加入DMEM培养液,于37℃、5%CO2培养箱中进行培养。原代培养细胞融合后开始进行传代培养。一般取4~8代的细胞进行实验。
, 百拇医药
1.2.2 实验分组 实验分为3个组:(1)对照组,培养基为基础培养基;(2)缺锌组,培养基TPEN浓度为10μmol/L;(3)缺锌补锌组,培养基TPEN及Zn2+的浓度均为10μmol/L。
1.2.3 测定指标及方法
1.2.3.1 成骨细胞DNA合成 采用3H-TdR掺入法。取对数生长期细胞1×104接种于96孔板中。各实验组设立3个复孔。培养36h后,弃掉旧培养液,换上各组相应的培养基,同时各孔加入3.7×104Bq3H-TdR,置于CO2孵箱中培养。分别于6、12、24、48h后弃去上清,加入0.25%胰蛋白酶消化分离细胞,用多头细胞收集器将细胞收集于玻纤滤纸上。60℃烘干滤纸,置于闪烁瓶内,加入闪烁液后于液闪计数仪中测定cpm(count per minute,每分钟计数)。
, http://www.100md.com
1.2.3.2 细胞周期测定 采用流式细胞仪进行检测。各组待测细胞用PBS洗涤2次后,迅速注入预冷的75%乙醇中,振荡混匀,4℃过夜。再用PBS洗涤细胞,以除去乙醇。溴化乙啶在暗处对细胞染色,30min后上机检测。
1.2.3.3 细胞骨架观察 取出载有细胞的小盖片,用0.1mol/L PBS漂洗2次,每次3min后,用1% TritonX-100抽提缓冲液作用5min,0.1mol/L PBS漂洗2次,每次5min后,用2.5%戊二醛中固定20min。取出盖片用蒸馏水漂洗2次。然后用0.2%考马氏亮蓝染色液染色60min,蒸馏水洗3次。然后置于37℃烘箱内20min后,用树胶封片、观察、摄影记录。
1.2.3.4 成骨细胞胶原蛋白合成 2×104细胞接种于24孔板中,培养24h后,弃掉旧培养液,换上各组相应的培养基,继续培养2天。弃掉旧培养液,换上150μl各组相应的培养基,同时加入3.7×105Bq3H-脯氨酸。24小时后取出上清液于5ml尖底玻璃试管中;用0.9%NaCl调至200μl。在玻璃试管中加入5mol/L乙酸25μl,1mg/ml胃蛋白酶25μl,10mg/ml脯氨酸10μl,4℃保温2h,用细胞自动收集仪将试管内上清及沉淀一起收集到用0.6mol/L高氯酸预先湿润的玻璃纤维膜。0.6mol/L高氯酸2ml抽洗一次,最后用无水乙醇2ml抽洗一次。将玻璃纤膜用0.6mol/L高氯酸2ml抽洗一次,最后用无水乙醇2ml抽洗一次。晾干后,置于闪烁瓶中。加入10ml闪烁液,于液闪仪中计数测定cpm。
, 百拇医药
1.2.3.5 成骨细胞骨钙素合成 将2×104细胞接种于24孔板中,培养基为各组相应的培养基。培养至第12天后,弃掉旧培养液,换上各组相应的培养基1ml,继续培养3天。取上清液按照试剂盒程序进行骨钙素的放免测定。
1.2.3.6 成骨细胞碱性磷酸酶(AKP)活性测定 将2×104细胞接种于24孔培养板中,培养24h后,弃掉旧培养液,换上各组相应的培养基,继续培养3天后,将搜集细胞于Eppendorf管中。用PBS洗涤2次后,加入0.1%TritorX-100,置于4℃过夜。用吸管反复吹打细胞,使其完全裂解。取40μl细胞裂解液按酶动力学方法进行AKP活性测定。AKP活性以每毫克细胞蛋白质每分钟产生对硝基苯酚的毫摩尔数表示[mmol/(min.mg)]。
2 结果
2.1 锌对大鼠成骨细胞DNA合成的影响
, 百拇医药
缺锌组成骨细胞3H-TdR掺入量在各个时点明显低于对照组,而缺锌补锌组与对照组相比无统计学差异(P>0.05,图1)。

图1 缺锌对体外培养大鼠成骨细胞DNA合成的影响
A:对照组 B:缺锌组 C:缺锌补锌组
2.2 缺锌对成骨细胞细胞周期的影响
从流式细胞仪测定的DNA直方图可见,缺锌组细胞明显地被阻滞于细胞周期中的G2/M期,使得进入下一细胞周期中G1期、S期的细胞减少,见图2。


, http://www.100md.com
图2 缺锌对体外培养大鼠成骨细胞细胞周期的影响
A:对照组 B:缺锌组
2.3 缺锌对成骨细胞细胞骨架的影响
对照组成骨细胞细胞骨架结构丰满、纹理清晰、分布细长均匀,横贯整个细胞,直达细胞膜边缘(图3)。而缺锌组细胞骨架明显杂乱无序,丧失原有清晰均匀的特性(图4)。


图3 正常大鼠成骨细胞细胞骨架(考马氏亮蓝染色,10×20)


, 百拇医药
图4 缺锌大鼠成骨细胞细胞骨架(考马氏亮蓝染色,10×20)
2.4 缺锌对成骨细胞胶原蛋白合成的影响
缺锌组3H-脯氨酸掺入量明显低于对照组(P<0.05),而缺锌补锌组与对照组相比无统计学差异(表1)。
表1 缺锌对大鼠成骨细胞胶原及骨钙素合成的影响(
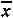 ±s) 组别
±s) 组别3H-脯氨酸掺入量(cpm)
骨钙素(ng/well)
对照组
11375±1145
, http://www.100md.com
1.01±0.32
缺锌组
7092±887(1)
0.86±0.26(1)
缺锌补锌组
10185±995
0.94±0.11
注:(1)与对照组相比,P<0.05
2.5 缺锌对成骨细胞骨钙素合成的影响
缺锌组骨钙素明显低于对照组(P<0.05);缺锌补锌组与对照组相比无统计学差异(表1)。
, 百拇医药
2.6 锌对成骨细胞碱性磷酸酶活性的影响
缺锌组碱性磷酸酶活性明显低于对照组(P<0.05);缺锌补锌组与对照组相比无统计学差异(表2)
表2 缺锌对大鼠成骨细胞碱性磷酸酶活性的影响(
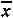 ±s) 组别
±s) 组别AKP活性[mmol/(min.mg)]
对照组
22.3±3.2
缺锌组
17.5±3.7(1)
, http://www.100md.com
缺锌补锌组
20.8±4.4
注:(1)与对照组相比,P<0.05
3 讨论
3.1 缺锌对成骨细胞增殖的影响
TPEN是锌的特异性络合剂,它与锌的亲合力远远大于钙、镁等金属离子[5]。因此,国外学者常将它用于制造组织培养的体外缺锌模型。结果表明,体外培养的成骨细胞在缺锌条件下,DNA合成受到明显抑制,且呈时间-效应关系。但缺锌补锌组DNA合成不受任何影响。核酸合成的一些关键酶如DNA聚合酶、天冬氨酸转氨甲酰酶都是锌依赖酶,且在缺锌条件下活性降低[6]。因此,缺锌抑制成骨细胞的增殖与核酸合成酶活性降低有关。细胞周期的精确性是正常细胞生长和分化所必需的,它包括G1期、S期、G2期及M期,并受到信号传导系统和反馈环路的精密调控。细胞有丝分裂的顺利进行,最重要的是G1/S和G2/M转换;其中G2/M转换涉及胞质和核DNA的分裂,而该过程又与细胞骨架重建密切相关。细胞骨架是横贯在胞核和质膜内侧的一种纤维状蛋白质基质。它构建细胞形状,参与细胞的运动、变形及增殖调控。缺锌使成骨细胞明显的阻滞于G2/M期,表明细胞不能顺利地进行G2/M的转换;同时缺锌又使得细胞骨架受到破坏。这提示了缺锌导致细胞骨架受损可能是成骨细胞阻滞于G2/M期的重要原因。细胞骨架蛋白的磷酸化对于骨架的正确组装、构架及功能是必须的,如vinculin、肌动蛋白均是蛋白激酶C(PKC)的磷酸化底物[7]。Harrison等研究表明[8],PKC的抑制剂sphingosin可以阻碍佛波酯诱导大鼠星形胶质细胞肌动蛋白的重组。而缺锌使成骨细胞PKC活性降低(另发表)。因此,缺锌很可能抑制了PKC对骨架蛋白的正常磷酸化,干扰微丝、微管及中间丝的正常组装和胞质的正常分裂,从而阻滞细胞于G2/M期,并同时参与抑制细胞增殖。
, 百拇医药
胶原蛋白成骨组织基质的主要组成成分,它在体外的大量合成是成骨细胞增殖活跃的一个显著特征。胶原蛋白中脯氨酸及羟脯氨酸占全部氨基酸残基的22%。因此,可以从3H-脯氨酸掺入量反映细胞胶原合成状况。在缺锌条件下,成骨细胞胶原的修饰合成受到抑制,补锌后合成恢复。缺锌对胶原蛋白合成的抑制可能发生在胶原基因的转录水平。
3.2 缺锌抑制成骨细胞分化
AKP是成骨细胞的标志酶,参与调节钙化过程。它能分解磷酸盐化合物,产生游离磷酸。磷酸与细胞间质中钙结合形成磷酸钙。骨钙素(BGP),是由非增殖期成骨细胞特异性合成和分泌的一种非胶原蛋白。BGP在钙离子存在条件下,与羟磷灰石结合并稳定其构象。因此,AKP、BGP是反映成骨细胞在体外分化为成熟骨细胞及基质钙化的两个重要指标。缺锌条件下,成骨细胞AKP活性、BGP含量明显降低,表明缺锌抑制成骨细胞基质的钙化,抑制向骨细胞的分化。AKP是含锌的锌依赖性酶,缺锌直接降低其活性;BGP基因上游存在锌指蛋白结合位点,因此,缺锌可能在转录及翻译水平影响BGP合成。
, http://www.100md.com
* 国家自然科学基金资助项目(39770647)
作者简介:岑小波,男,医学博士
参考文献
1Beattie J H, Alison A. Trace element nutrition and bone metabolism. Nutr Res Rev, 1992, 5:167—1882Masayuki Hashizume, Masayoshi Yamaguchi. Effect of β-alnany-L-histidinato zinc on differentiation of osteoblast MC3T3-E1 cell: Increase in alkaline phosphatase activity and protein concentration. Mol Cell Biol, 1994,131:19—243Relea P, Recilla M,Ripoll E, et al. Zinc, biochemical markers of nutrition and type I osteoprosis. Age Ageing, 1995,24:303—3074Hiroko S, Hiro-Ari K, Yuji A,et al. In vitro differentiation and calcification in a new clony osteogenic cell line derived from new born mouse calvaria. J Cell Biol, 1983, 96:191—1985Arslan P, Divigilio F, Beltrame M, et al. Ca2+homeostasis in ehrlich and yoshida carcinomas: a new membrane-permeant chelator of heavy metals reveals that these ascites tumor cell lines have normal cytosolic free Ca2+. J Biol Chem, 1985,260:2719—27276Coleman J E. Zinc protein: enzymes, storage protein, transcription factor, and replication protein. Annu Rev Biochem, 1992, 61:897—9467James BM, Wang YL. Reorganization of alpha-actinin and vinculin induced by a phorbol ester in living cells. J Cell Biol, 1996, 102:1430—14358Harrison BC, Staskavage DL, Mobley PL. Effect of siphingosine on phorbol estermediated changes in astrocyte morphology and protein phosphorylation. J Neurosci Res, 1991,29:118—189
1998-06-18收稿, 百拇医药