伏马菌素B1免疫检测方法的研究
作者:郭云昌 刘秀梅 刘江
单位:中国预防医学科学院营养与食品卫生研究所,北京 100050
关键词:伏马菌素B1;单克隆抗体;免疫检测
卫生研究\990415 摘要 本研究建立了用于检测粮食、饲料中伏马菌素B1(FB1)的快速、灵敏、简便的免疫检测方法—建立在单克隆抗体基础上的直接竞争性酶联免疫吸附测定方法(DC—ELISA法);其最低检出浓度为10ng/ml,线性范围在10ng~5μg/ml。对新疆、安徽、黑龙江、哈尔滨四省市玉米样品中的FB1含量进行了测定,结果表明156份样品中有34份检出FB1,阳性率为21.79%,含量在0.18~31.32μg/g范围内,平均含量为12.04μg/g。
中图分类号 R155.31 TS207.4
, 百拇医药
Studies on immunoassay for detecting fumonisin B1
Guo Yunchang,Liu Xiumei,Liu Jiang
Institute of Nutrition and Food Hygiene,Chinese Academy of Preventive Medicine,Beijing 100050,China
Direct competitive inhibition enzyme-linked immunosorbent assay for determination of fumonisin B1(FB1) in corns were developed by using anti-FB1 monoclonal antibody.The minimum detectable concentration of FB1 was 10ng/ml,and the standard curve was linear between 10ng/ml and 5μg/ml.The FB1 concentration of some corn samples from Xinjiang,Anhui,Hilongjiang provinces and Haerbin city were detected.The result imply that 34 out of 156 samples were positive for FB1 .The concentrations were in the range of 0.18~31.32μg/g.The average concentration was 12.04μg/g.
, 百拇医药
Key words: fumonisin B1,monoclonal antibody,immunoassay
伏马菌素(Fumonisins)是一类主要由串珠镰刀菌(Fusarium moniliforme)产生的真菌毒素[1],其中伏马菌素B1(Fumonisin B1,FB1)是污染玉米样品或真菌产毒培养物中伏马菌素的主要组分,而且实验证明FB1是产生伏马菌素毒性作用的主要原因,其促癌性和致癌性已在大鼠中得到证实[2]。FB1还可诱发马脑白质软化症(ELEM)、猪的肺水肿症候群(PPE)、羊的肝病样改变和肾病、大鼠的肝坏死和心室内形成血栓等[3]。另外,FB1对实验仓鼠具有妊娠毒性、对鸡胚的致病性和致死性,以及对灵长类动物致动物脉粥样硬化样脂肪改变等[4]。流行病学调查发现,串珠镰刀菌和伏马菌素对玉米及玉米制品的污染可能与人类食管癌的高发率有一定相关
, 百拇医药
性。Yoshizawa等从我国食管癌高发区林县和低发区上丘县共采集玉米样品47份,两县样品中FB1和FB2的含量水平基本相同(FB1 873~890ng/g, FB2 330~448ng/g),但林县玉米样品的污染率约为上丘县的2倍[5]。而Chu等从林县采集31份玉米样品,在16份霉变样品中检出FB1(18~155mg/kg,平均74mg/kg),在15份肉眼未见霉变的样品中检出FB1(20~60mg/kg,平均
35.3mg/kg)[6]。Sydenham等通过跟踪流行病学研究发现,南非Transkei食管癌高发区玉米中伏马菌素的含量明显高于低发区[7],需特别指出的是我国林县和南非Transkei地区均以玉米为主食。
国外已建立了检测食物、种子、玉米中伏马菌素的高效液相色谱法(HPLC)、气/质联用法(GC/MS)、液体二次离子探针质谱法(liquid-SIMS)等检测方法,这些方法具有较高的灵敏度和特异性,但均需复杂的提取净化步骤,单位时间内检测样品数量有限,且需要较贵重的仪器设备,不易推广使用。而ELISA检测方法,则具备简单、快速、高灵敏度、高特异性、可同时检测大量样品的优点,受到各国学者的重视。Azcona-Olivera等制备了抗FB1、FB2的多克隆抗体,并建立了间接竞争ELISA检测方法[8],对FB1的检出限为0.1μg/ml。日本Kikkoman公司也建立了以单克隆抗体为基础的间接竞争ELISA检测方法[9],并制成了试剂盒,检测范围在0.5~5μg/ml,但其价格昂贵。近年来我国开展了对FB1的研究,但尚缺乏适宜的快速检测方法,本研究是在国内首次建立的以单克隆抗体为基础的直接竞争ELISA检测方法。
, 百拇医药
1 材料
抗FB1单克隆抗体(由本室制备),伏马菌素B1(Fumonisin B1)为Sigma公司的产品,辣根过氧化物酶购自华美生物工程公司,新生小牛血清为杭州四季青公司产品,邻苯二胺(OPD)为Merck公司的产品,辣根过氧化物酶标记羊抗鼠抗体由军事医学科学院五所提供。
2 方法
2.1 抗FB1单克隆抗体的制备和纯化
将抗FB1的杂交瘤细胞株4G4复苏,培养在RPMI1640培养基中。以5×105~106个细胞/鼠,注射降植烷处理的BALB/C小鼠腹腔,10天后收集腹水。用辛酸—饱和硫酸铵沉淀法进行纯化,直接非竞争性ELISA法检测抗体效价。
, http://www.100md.com
2.2 单克隆抗体辣根过氧化物酶标记物(McAb-HRP)的制备
采用改良过碘酸钠标记法,以进口的辣根过氧化物酶标记纯化的单克隆抗体。
2.3 样品提取
采用甲醇—水提取法,称取10g粉碎好的粮食样品,放入100ml的三角瓶中,加入75%的甲醇水溶液,振荡提取30分钟,静置后取上清分装,-20℃保存待测。
2.4 样品的酶联免疫吸附试验测定方法
2.4.1 直接竞争抑制性ELISA法(以下简称直接法)
各试验条件的最佳组合用棋盘滴定法确定。
(1)用1μg/ml的BSA—FB1包被酶标板微孔,每孔100μl,4℃过夜;(2)酶标板用PBS—T洗3min×3次后,加入封闭液,每孔200μl,37℃,1h;(3)酶标板用PBS—T洗3min×3次后,加入不同浓度的FB1标准溶液(制作标准曲线)或样品提取液(检测样品)与McAb-HRP的混合液(该液系毒素标准液或样品提取液与McAb-HRP按1∶1的比例混合,在试验前配好,37℃孵育1h备用),每孔100μl,37℃,1h;(4)酶标板用PBS—T洗3min×6次后,加入底物溶液,每孔100μl,37℃,15min;(5)加入终止液,每孔50μl,用酶标仪测A490值。
, 百拇医药
2.4.2 FBI含量计算
FBI含量(ng/g)=C.D.X/W
式中:C为酶标板上测得的FB1浓度(ng),根据标准曲线求得;D为样品提取液的体积(ml);X为样品提取液的稀释倍数;W为样品重量(g)
当样品重为10g,提取液体积为50ml时,上式可写为:
FBI含量(ng/g)=5C.X
2.5 数据处理
所有实验数据,用Microsoft Excel和STATA软件进行运算和统计处理。
3 结果
, 百拇医药
3.1 单克隆抗体纯化和效价检测结果
用辛酸—饱和硫酸铵沉淀纯化腹水中抗体,纯化后的腹水抗体浓度为7.5g/L,效价为1∶1×107。
3.2 单克隆抗体辣根过氧化物酶标记物(McAb-HRP)的制备
将纯化后的FB14G4McAb与HRP进行连接,成功制备了FB1McAb-HRP,用直接非竞争性ELISA法测得其效价为1∶64 000,稀释度曲线见图1。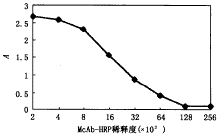
图1 McAb-HRP不同稀释度的光吸收曲线
3.3 伏马菌素B1的直接竞争酶联免疫吸附试验测定方法
, 百拇医药
3.3.1 固相抗原最佳包被浓度和酶标抗体最佳工作浓度的选择
以2.5、1.0、0.5、0.1μg/ml的BSA—FB1包被酶标板,加入1∶1×104~1∶16×104倍比稀释的酶标抗体,测得A值,如表1所示。
表1 固相抗原不同包被浓度和酶标抗体不同稀释度下的A值 固相抗原
包浓度(μg/ml)
酶标抗体稀释度(×104)
1∶1
1∶2
1∶4
, 百拇医药 1∶8
1∶16
2.5
2.201
1.507
0.824
0.731
0.482
1.0
2.155
1.287
0.797
0.495
, 百拇医药
0.284
0.5
0.713
0.532
0.406
0.261
0.186
0.1
0.104
0.066
0.056
0.047
0.032
, 百拇医药
包被抗原为1.0~2.5μg/ml时,随酶标抗体浓度的增加,而其A值无明显改变,结合酶标仪测量A值的敏感范围在1.0左右,确定最佳包被浓度为1μg/ml,最佳酶标抗体稀释度为1∶20 000。
3.3.2 测定FB1方法的灵敏度
把已知浓度的标准液依次加到包被BSA-FB1的酶标板微孔中,FB1的浓度为0.0、0.0001、0.001、0.01、0.1、1.0μg/ml,取4份平行样,用酶标仪测定A值,结果见表2。
表2 测定FB1方法的灵敏度 FB1(μg/ml)
A490
平均值
, 百拇医药
差值
0.0
1.34
1.30
1.31
1.3
1.32
0
0.0001
1.30
1.28
1.28
1.30
, http://www.100md.com
1.29
0.03
0.001
1.28
1.22
1.25
1.25
1.26
0.06
0.01
1.22
1.20
1.21
, http://www.100md.com
1.21
1.21
0.11
0.1
1.03
1.02
1.02
1.04
1.03
0.29
1.0
0.44
0.43
, 百拇医药
0.42
0.44
0.43
0.89
该方法的灵敏度是指浓度在0.0~1.0μg/ml之间的A值与0.0μg/ml的A值之差>0.1的最低浓度。从表2可以看出,直接竞争ELISA法的灵敏度为0.01μg/ml。3.3.3 直接法标准曲线
FB1毒素储备液(1mg/ml)用PBS稀释成不同浓度的标准液(10000、5000、1000、500、100、50、10、5ng/ml),将McAb-HRP稀释至1∶20 000,用直接竞争ELISA法测得的标准曲线如图2所示。从图中可以看出该法线性范围为10ng~5000ng/ml,对FB1的最低检出浓度为10ng/ml。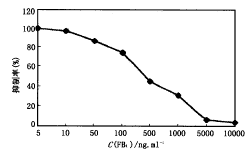
, 百拇医药
图2 FB1标准抑制曲线(直接ELISA)
3.3.4 加标回收
在FB1阴性的玉米样品中加入一定量的FB1标准溶液,提取后用直接竞争ELISA法进行检测,结果见表3。
表3 玉米样品的加标回收试验 FB1加入量
(μg/ml)
实际检出浓度
(μg/ml)
回收率
(%)
CV
, 百拇医药
(%)
0.01
0.0124±0.0002
124.2
1.6
0.1
0.0831±0.0097
83.1
11.7
1.0
0.7313±0.0807
73.1
, 百拇医药 11.0
直接竞争ELISA检测方法的回收率为73.1%~124.2%,平均回收率为93.5%。3.4 四省市玉米样品中的FB1
用直接竞争ELISA法对黑龙江、安徽、新疆、哈尔滨四省市1994~1995年所采集的玉米样品进行了检测,结果见表4。
表4 玉米样品中FB1含量 省市
样品数
阳性样品
数量 r/(%)
FB1含量范围
(μg/g)
, 百拇医药
平均含量
(μg/g)
哈尔滨
24
0
—
—
—
安徽
63
4
6.35
2.07~28.06
, 百拇医药
12.94
黑龙江
30
11
36.67
0.18~20.84
9.10
新疆
39
19
48.72
0.58~31.32
14.07
, 百拇医药
合计
156
34
21.79
0.18~31.32
12.04
4 讨论
4.1 关于ELISA检测方法
ELISA检测方法具有灵敏度高、特异性强、快速简便易于操作、样品不需特殊前处理、对仪器的要求低等优点,更能适应大规模调查中检测的需要,在国际上被广泛采用。国外已建立了比较成熟的用于真菌毒素监测的ELISA检测方法,这些真菌毒素包括:黄曲霉毒素(B1、B2、B3、M1、G1、Q1及B1-DNA加合物)、棕曲霉霉素A(OA)、展青毒素(Pt)、杂色曲霉素(ST)、T-2毒素、脱氧雪腐镰刀菌烯醇(DON)、雪腐镰刀菌烯醇(NIV)、二乙酰EB5E草镰刀菌烯醇(DAS)、四乙酰EB5E草镰刀菌烯醇(TAN)、玉米赤霉烯酮(ZEN)、串珠镰刀菌素(MF)、伏马菌素(FB)、烟曲霉震颤素(FT)等。国内近年来在这方面的研究发展很快,列入国家标准检测方法的就有黄曲霉毒素B1、M1、T-2毒素、脱氧雪腐镰刀菌烯醇等几种真菌毒素。伏马菌素在食品卫生中的意义越来越受到人们的重视,已形成继黄曲霉毒素后的又一个研究热点。国外已建立了TLC、HPLC、ELISA等检测方法,国内这方面的研究刚刚起步,迄今尚未见FB1McAb及其ELISA检测方法的研究报告。我们在获得抗FB1的单克隆抗体的基础上,建立了检测FB1的直接ELISA法,其最低检出浓度为10ng/ml。与国外报道的检测FB1的ELISA法相比,优于同类ELISA检测方法(表5)。
, http://www.100md.com
表5 本文建立的方法与国外ELISA法比较 国家
作者
抗体
方法
检测范围
(μg/ml)
最低检出限
(ng/ml)
美国
Olivera A,et al[8]
PcAb
间接竞争法
, http://www.100md.com
—
100
日本
Fukuda S,et al[9]
MuAb
酶标抗原直接竞争法
0.5~5
500
美国
Chu FS[6]
PcAb
—
, http://www.100md.com
—
10
美国
Chu FS[6]
McAb
—
—
50
中国
本文建立的方法
McAb
酶标抗体直接竞争法
0.01~5
, 百拇医药
10
在实验初期发现方法的重复性和稳定性较差。我们在FB1与酶标抗体或腹水抗体的反应过程中进行孵育预平衡,显著提高了方法的灵敏度和重复性,可能是因为抗体对游离半抗原的亲和性不如固相抗原载体上的半抗原。
4.2 关于样品检测
目前我国有关玉米、玉米制品及其它粮食作物中FB1含量的报道还很少,尚未见到运用单克隆抗体进行ELISA法检测FB1方面的文献。以本研究建立的单克隆抗体为基础的ELISA方法对黑龙江、安徽、新疆、哈尔滨四省市玉米样品中的FB1污染含量的测定结果表明,不同省市玉米样品中FB1的阳性检出率存在差异,较国外报道的玉米样品中的FB1含量要高[6]。用Chu提供的多克隆抗体和采用间接竞争ELISA法与我们的单克隆抗体直接竞争ELISA法进行了初步的比较[6],结果表明运用两种不同的抗体,两种方法测定结果基本相符。本研究未综合考虑影响粮食中霉菌及真菌毒素污染的因素,如气候、水分、储存条件等等,尚有待于在今后的研究中对各地玉米及玉米制品中的含量进行全面细致的研究。
, http://www.100md.com
本研究的目的是在制备抗FB1的单克隆抗体的基础上,建立检测FB1的ELISA检测方法,以便开展大规模的粮食及粮食制品中FB1的检测,为制定我国FB1的允许限量标准及食品安全的监督检测提供科学的方法和技术手段。
* 国家自然科学青年基金资助项目(No.39500121)
作者简介:郭云昌,男,硕士,助理研究员
参考文献
1.Grelderblom WC,Jaskiewicz K,Marasas WF,et al.Fumonisins-novel mycotoxins with cancer promoting activity produced by Fusarium moniliforme.Appl Environ Microbiol,1988,54(7):1806—1811
, 百拇医药
2.Grelderblom WC,Snyman SD,Marass WF, et al.Fumonisin B1 dosimetry in relation to cancer initiation in rat liver.Carcinogenesis,1994,15(2):209—214
3.Colvin BM and Harrison LR.Fumonisin-induced pulmonary edema and hydrothorax in swine.Mycropathologia,1992,117:79—82
4.刘江.伏马菌素—食品卫生及真菌毒素研究中的新热点.国外医学(卫生学分册),1995,22(6):321—326
5.Yoshizawa,T,Yamashita A,Luo Y,Fumonisin occurrence in corn from high and low risk areas for human esophageal cancer in China.Appl Environ Microbiol,1994,60(5):1626—1629
, 百拇医药
6.Chu FS,Li GY,Simultaneous occurrence of fumonisin bland mycotoxins in moldy corn collected from the People's Republic of China in regions with high incidences of esophageal cancer.Appl Environ Microbiol,1994,60(3):847—852
7.Sydenham EW,Thiel PG,Marasas WFO,et al.Natural occurrence of some Fusarium mycotoxins in corn from low and high esophageal cancer prevalence areas of the Transkei,southern Africa.J Agric Food Chem,1990,8:1900—1903
, http://www.100md.com
8.Azcona Olivera JI,Abouzied MM,Norred WP,et al.Generation of antibodies reactive with fumonisin B1,B2,and B3 by using cholera toxin as the carrier-adjuvant.Appl Environ Microbiol,1992,58(1):169—173
9.Fukuda S,Nagahara A,Kikuchi M,et al.Prearation and Characterization of Anti Fumonisin Monoclonal Antibodies.Biosci Biotech Biochem,1994,58(4):765—767
1998-12-31收稿, http://www.100md.com
单位:中国预防医学科学院营养与食品卫生研究所,北京 100050
关键词:伏马菌素B1;单克隆抗体;免疫检测
卫生研究\990415 摘要 本研究建立了用于检测粮食、饲料中伏马菌素B1(FB1)的快速、灵敏、简便的免疫检测方法—建立在单克隆抗体基础上的直接竞争性酶联免疫吸附测定方法(DC—ELISA法);其最低检出浓度为10ng/ml,线性范围在10ng~5μg/ml。对新疆、安徽、黑龙江、哈尔滨四省市玉米样品中的FB1含量进行了测定,结果表明156份样品中有34份检出FB1,阳性率为21.79%,含量在0.18~31.32μg/g范围内,平均含量为12.04μg/g。
中图分类号 R155.31 TS207.4
, 百拇医药
Studies on immunoassay for detecting fumonisin B1
Guo Yunchang,Liu Xiumei,Liu Jiang
Institute of Nutrition and Food Hygiene,Chinese Academy of Preventive Medicine,Beijing 100050,China
Direct competitive inhibition enzyme-linked immunosorbent assay for determination of fumonisin B1(FB1) in corns were developed by using anti-FB1 monoclonal antibody.The minimum detectable concentration of FB1 was 10ng/ml,and the standard curve was linear between 10ng/ml and 5μg/ml.The FB1 concentration of some corn samples from Xinjiang,Anhui,Hilongjiang provinces and Haerbin city were detected.The result imply that 34 out of 156 samples were positive for FB1 .The concentrations were in the range of 0.18~31.32μg/g.The average concentration was 12.04μg/g.
, 百拇医药
Key words: fumonisin B1,monoclonal antibody,immunoassay
伏马菌素(Fumonisins)是一类主要由串珠镰刀菌(Fusarium moniliforme)产生的真菌毒素[1],其中伏马菌素B1(Fumonisin B1,FB1)是污染玉米样品或真菌产毒培养物中伏马菌素的主要组分,而且实验证明FB1是产生伏马菌素毒性作用的主要原因,其促癌性和致癌性已在大鼠中得到证实[2]。FB1还可诱发马脑白质软化症(ELEM)、猪的肺水肿症候群(PPE)、羊的肝病样改变和肾病、大鼠的肝坏死和心室内形成血栓等[3]。另外,FB1对实验仓鼠具有妊娠毒性、对鸡胚的致病性和致死性,以及对灵长类动物致动物脉粥样硬化样脂肪改变等[4]。流行病学调查发现,串珠镰刀菌和伏马菌素对玉米及玉米制品的污染可能与人类食管癌的高发率有一定相关
, 百拇医药
性。Yoshizawa等从我国食管癌高发区林县和低发区上丘县共采集玉米样品47份,两县样品中FB1和FB2的含量水平基本相同(FB1 873~890ng/g, FB2 330~448ng/g),但林县玉米样品的污染率约为上丘县的2倍[5]。而Chu等从林县采集31份玉米样品,在16份霉变样品中检出FB1(18~155mg/kg,平均74mg/kg),在15份肉眼未见霉变的样品中检出FB1(20~60mg/kg,平均
35.3mg/kg)[6]。Sydenham等通过跟踪流行病学研究发现,南非Transkei食管癌高发区玉米中伏马菌素的含量明显高于低发区[7],需特别指出的是我国林县和南非Transkei地区均以玉米为主食。
国外已建立了检测食物、种子、玉米中伏马菌素的高效液相色谱法(HPLC)、气/质联用法(GC/MS)、液体二次离子探针质谱法(liquid-SIMS)等检测方法,这些方法具有较高的灵敏度和特异性,但均需复杂的提取净化步骤,单位时间内检测样品数量有限,且需要较贵重的仪器设备,不易推广使用。而ELISA检测方法,则具备简单、快速、高灵敏度、高特异性、可同时检测大量样品的优点,受到各国学者的重视。Azcona-Olivera等制备了抗FB1、FB2的多克隆抗体,并建立了间接竞争ELISA检测方法[8],对FB1的检出限为0.1μg/ml。日本Kikkoman公司也建立了以单克隆抗体为基础的间接竞争ELISA检测方法[9],并制成了试剂盒,检测范围在0.5~5μg/ml,但其价格昂贵。近年来我国开展了对FB1的研究,但尚缺乏适宜的快速检测方法,本研究是在国内首次建立的以单克隆抗体为基础的直接竞争ELISA检测方法。
, 百拇医药
1 材料
抗FB1单克隆抗体(由本室制备),伏马菌素B1(Fumonisin B1)为Sigma公司的产品,辣根过氧化物酶购自华美生物工程公司,新生小牛血清为杭州四季青公司产品,邻苯二胺(OPD)为Merck公司的产品,辣根过氧化物酶标记羊抗鼠抗体由军事医学科学院五所提供。
2 方法
2.1 抗FB1单克隆抗体的制备和纯化
将抗FB1的杂交瘤细胞株4G4复苏,培养在RPMI1640培养基中。以5×105~106个细胞/鼠,注射降植烷处理的BALB/C小鼠腹腔,10天后收集腹水。用辛酸—饱和硫酸铵沉淀法进行纯化,直接非竞争性ELISA法检测抗体效价。
, http://www.100md.com
2.2 单克隆抗体辣根过氧化物酶标记物(McAb-HRP)的制备
采用改良过碘酸钠标记法,以进口的辣根过氧化物酶标记纯化的单克隆抗体。
2.3 样品提取
采用甲醇—水提取法,称取10g粉碎好的粮食样品,放入100ml的三角瓶中,加入75%的甲醇水溶液,振荡提取30分钟,静置后取上清分装,-20℃保存待测。
2.4 样品的酶联免疫吸附试验测定方法
2.4.1 直接竞争抑制性ELISA法(以下简称直接法)
各试验条件的最佳组合用棋盘滴定法确定。
(1)用1μg/ml的BSA—FB1包被酶标板微孔,每孔100μl,4℃过夜;(2)酶标板用PBS—T洗3min×3次后,加入封闭液,每孔200μl,37℃,1h;(3)酶标板用PBS—T洗3min×3次后,加入不同浓度的FB1标准溶液(制作标准曲线)或样品提取液(检测样品)与McAb-HRP的混合液(该液系毒素标准液或样品提取液与McAb-HRP按1∶1的比例混合,在试验前配好,37℃孵育1h备用),每孔100μl,37℃,1h;(4)酶标板用PBS—T洗3min×6次后,加入底物溶液,每孔100μl,37℃,15min;(5)加入终止液,每孔50μl,用酶标仪测A490值。
, 百拇医药
2.4.2 FBI含量计算
FBI含量(ng/g)=C.D.X/W
式中:C为酶标板上测得的FB1浓度(ng),根据标准曲线求得;D为样品提取液的体积(ml);X为样品提取液的稀释倍数;W为样品重量(g)
当样品重为10g,提取液体积为50ml时,上式可写为:
FBI含量(ng/g)=5C.X
2.5 数据处理
所有实验数据,用Microsoft Excel和STATA软件进行运算和统计处理。
3 结果
, 百拇医药
3.1 单克隆抗体纯化和效价检测结果
用辛酸—饱和硫酸铵沉淀纯化腹水中抗体,纯化后的腹水抗体浓度为7.5g/L,效价为1∶1×107。
3.2 单克隆抗体辣根过氧化物酶标记物(McAb-HRP)的制备
将纯化后的FB14G4McAb与HRP进行连接,成功制备了FB1McAb-HRP,用直接非竞争性ELISA法测得其效价为1∶64 000,稀释度曲线见图1。

图1 McAb-HRP不同稀释度的光吸收曲线
3.3 伏马菌素B1的直接竞争酶联免疫吸附试验测定方法
, 百拇医药
3.3.1 固相抗原最佳包被浓度和酶标抗体最佳工作浓度的选择
以2.5、1.0、0.5、0.1μg/ml的BSA—FB1包被酶标板,加入1∶1×104~1∶16×104倍比稀释的酶标抗体,测得A值,如表1所示。
表1 固相抗原不同包被浓度和酶标抗体不同稀释度下的A值 固相抗原
包浓度(μg/ml)
酶标抗体稀释度(×104)
1∶1
1∶2
1∶4
, 百拇医药 1∶8
1∶16
2.5
2.201
1.507
0.824
0.731
0.482
1.0
2.155
1.287
0.797
0.495
, 百拇医药
0.284
0.5
0.713
0.532
0.406
0.261
0.186
0.1
0.104
0.066
0.056
0.047
0.032
, 百拇医药
包被抗原为1.0~2.5μg/ml时,随酶标抗体浓度的增加,而其A值无明显改变,结合酶标仪测量A值的敏感范围在1.0左右,确定最佳包被浓度为1μg/ml,最佳酶标抗体稀释度为1∶20 000。
3.3.2 测定FB1方法的灵敏度
把已知浓度的标准液依次加到包被BSA-FB1的酶标板微孔中,FB1的浓度为0.0、0.0001、0.001、0.01、0.1、1.0μg/ml,取4份平行样,用酶标仪测定A值,结果见表2。
表2 测定FB1方法的灵敏度 FB1(μg/ml)
A490
平均值
, 百拇医药
差值
0.0
1.34
1.30
1.31
1.3
1.32
0
0.0001
1.30
1.28
1.28
1.30
, http://www.100md.com
1.29
0.03
0.001
1.28
1.22
1.25
1.25
1.26
0.06
0.01
1.22
1.20
1.21
, http://www.100md.com
1.21
1.21
0.11
0.1
1.03
1.02
1.02
1.04
1.03
0.29
1.0
0.44
0.43
, 百拇医药
0.42
0.44
0.43
0.89
该方法的灵敏度是指浓度在0.0~1.0μg/ml之间的A值与0.0μg/ml的A值之差>0.1的最低浓度。从表2可以看出,直接竞争ELISA法的灵敏度为0.01μg/ml。3.3.3 直接法标准曲线
FB1毒素储备液(1mg/ml)用PBS稀释成不同浓度的标准液(10000、5000、1000、500、100、50、10、5ng/ml),将McAb-HRP稀释至1∶20 000,用直接竞争ELISA法测得的标准曲线如图2所示。从图中可以看出该法线性范围为10ng~5000ng/ml,对FB1的最低检出浓度为10ng/ml。

, 百拇医药
图2 FB1标准抑制曲线(直接ELISA)
3.3.4 加标回收
在FB1阴性的玉米样品中加入一定量的FB1标准溶液,提取后用直接竞争ELISA法进行检测,结果见表3。
表3 玉米样品的加标回收试验 FB1加入量
(μg/ml)
实际检出浓度
(μg/ml)
回收率
(%)
CV
, 百拇医药
(%)
0.01
0.0124±0.0002
124.2
1.6
0.1
0.0831±0.0097
83.1
11.7
1.0
0.7313±0.0807
73.1
, 百拇医药 11.0
直接竞争ELISA检测方法的回收率为73.1%~124.2%,平均回收率为93.5%。3.4 四省市玉米样品中的FB1
用直接竞争ELISA法对黑龙江、安徽、新疆、哈尔滨四省市1994~1995年所采集的玉米样品进行了检测,结果见表4。
表4 玉米样品中FB1含量 省市
样品数
阳性样品
数量 r/(%)
FB1含量范围
(μg/g)
, 百拇医药
平均含量
(μg/g)
哈尔滨
24
0
—
—
—
安徽
63
4
6.35
2.07~28.06
, 百拇医药
12.94
黑龙江
30
11
36.67
0.18~20.84
9.10
新疆
39
19
48.72
0.58~31.32
14.07
, 百拇医药
合计
156
34
21.79
0.18~31.32
12.04
4 讨论
4.1 关于ELISA检测方法
ELISA检测方法具有灵敏度高、特异性强、快速简便易于操作、样品不需特殊前处理、对仪器的要求低等优点,更能适应大规模调查中检测的需要,在国际上被广泛采用。国外已建立了比较成熟的用于真菌毒素监测的ELISA检测方法,这些真菌毒素包括:黄曲霉毒素(B1、B2、B3、M1、G1、Q1及B1-DNA加合物)、棕曲霉霉素A(OA)、展青毒素(Pt)、杂色曲霉素(ST)、T-2毒素、脱氧雪腐镰刀菌烯醇(DON)、雪腐镰刀菌烯醇(NIV)、二乙酰EB5E草镰刀菌烯醇(DAS)、四乙酰EB5E草镰刀菌烯醇(TAN)、玉米赤霉烯酮(ZEN)、串珠镰刀菌素(MF)、伏马菌素(FB)、烟曲霉震颤素(FT)等。国内近年来在这方面的研究发展很快,列入国家标准检测方法的就有黄曲霉毒素B1、M1、T-2毒素、脱氧雪腐镰刀菌烯醇等几种真菌毒素。伏马菌素在食品卫生中的意义越来越受到人们的重视,已形成继黄曲霉毒素后的又一个研究热点。国外已建立了TLC、HPLC、ELISA等检测方法,国内这方面的研究刚刚起步,迄今尚未见FB1McAb及其ELISA检测方法的研究报告。我们在获得抗FB1的单克隆抗体的基础上,建立了检测FB1的直接ELISA法,其最低检出浓度为10ng/ml。与国外报道的检测FB1的ELISA法相比,优于同类ELISA检测方法(表5)。
, http://www.100md.com
表5 本文建立的方法与国外ELISA法比较 国家
作者
抗体
方法
检测范围
(μg/ml)
最低检出限
(ng/ml)
美国
Olivera A,et al[8]
PcAb
间接竞争法
, http://www.100md.com
—
100
日本
Fukuda S,et al[9]
MuAb
酶标抗原直接竞争法
0.5~5
500
美国
Chu FS[6]
PcAb
—
, http://www.100md.com
—
10
美国
Chu FS[6]
McAb
—
—
50
中国
本文建立的方法
McAb
酶标抗体直接竞争法
0.01~5
, 百拇医药
10
在实验初期发现方法的重复性和稳定性较差。我们在FB1与酶标抗体或腹水抗体的反应过程中进行孵育预平衡,显著提高了方法的灵敏度和重复性,可能是因为抗体对游离半抗原的亲和性不如固相抗原载体上的半抗原。
4.2 关于样品检测
目前我国有关玉米、玉米制品及其它粮食作物中FB1含量的报道还很少,尚未见到运用单克隆抗体进行ELISA法检测FB1方面的文献。以本研究建立的单克隆抗体为基础的ELISA方法对黑龙江、安徽、新疆、哈尔滨四省市玉米样品中的FB1污染含量的测定结果表明,不同省市玉米样品中FB1的阳性检出率存在差异,较国外报道的玉米样品中的FB1含量要高[6]。用Chu提供的多克隆抗体和采用间接竞争ELISA法与我们的单克隆抗体直接竞争ELISA法进行了初步的比较[6],结果表明运用两种不同的抗体,两种方法测定结果基本相符。本研究未综合考虑影响粮食中霉菌及真菌毒素污染的因素,如气候、水分、储存条件等等,尚有待于在今后的研究中对各地玉米及玉米制品中的含量进行全面细致的研究。
, http://www.100md.com
本研究的目的是在制备抗FB1的单克隆抗体的基础上,建立检测FB1的ELISA检测方法,以便开展大规模的粮食及粮食制品中FB1的检测,为制定我国FB1的允许限量标准及食品安全的监督检测提供科学的方法和技术手段。
* 国家自然科学青年基金资助项目(No.39500121)
作者简介:郭云昌,男,硕士,助理研究员
参考文献
1.Grelderblom WC,Jaskiewicz K,Marasas WF,et al.Fumonisins-novel mycotoxins with cancer promoting activity produced by Fusarium moniliforme.Appl Environ Microbiol,1988,54(7):1806—1811
, 百拇医药
2.Grelderblom WC,Snyman SD,Marass WF, et al.Fumonisin B1 dosimetry in relation to cancer initiation in rat liver.Carcinogenesis,1994,15(2):209—214
3.Colvin BM and Harrison LR.Fumonisin-induced pulmonary edema and hydrothorax in swine.Mycropathologia,1992,117:79—82
4.刘江.伏马菌素—食品卫生及真菌毒素研究中的新热点.国外医学(卫生学分册),1995,22(6):321—326
5.Yoshizawa,T,Yamashita A,Luo Y,Fumonisin occurrence in corn from high and low risk areas for human esophageal cancer in China.Appl Environ Microbiol,1994,60(5):1626—1629
, 百拇医药
6.Chu FS,Li GY,Simultaneous occurrence of fumonisin bland mycotoxins in moldy corn collected from the People's Republic of China in regions with high incidences of esophageal cancer.Appl Environ Microbiol,1994,60(3):847—852
7.Sydenham EW,Thiel PG,Marasas WFO,et al.Natural occurrence of some Fusarium mycotoxins in corn from low and high esophageal cancer prevalence areas of the Transkei,southern Africa.J Agric Food Chem,1990,8:1900—1903
, http://www.100md.com
8.Azcona Olivera JI,Abouzied MM,Norred WP,et al.Generation of antibodies reactive with fumonisin B1,B2,and B3 by using cholera toxin as the carrier-adjuvant.Appl Environ Microbiol,1992,58(1):169—173
9.Fukuda S,Nagahara A,Kikuchi M,et al.Prearation and Characterization of Anti Fumonisin Monoclonal Antibodies.Biosci Biotech Biochem,1994,58(4):765—767
1998-12-31收稿, http://www.100md.com