重组TGFβ1基因转染后细胞上清的检测
作者:封 岩 程振球 王发锁 汤 琰 曹广文 张晓琴 孔宪涛
单位:封 岩 程振球 王发锁 汤 琰:海军医学研究所,上海市 200433;曹广文 张晓琴:第二军医大学微生物学教研室;孔宪涛:长征医院全军临床免疫中心
关键词:转化生长因子β1;基因;逆转录病毒载体;检测
海军医学杂志990117 摘要 目的:观察TGFβ1基因转入能否成功。方法:用pL(TGFβ1)SN经脂质体转染包装细胞,G418筛选,对阳性病毒上清检测TGFβ1表达蛋白及Neo基因,转染后的SMMC7721细胞进行免疫组化染色。结果:阳性上清ELISA检测,TGFβ1含量为16~41ng/ml;套式RT-PCR检测Neo基因,第2轮后全部出现290bp条带;TGFβ1免疫组化染色显示:空白对照±,正义转染++。结论:TGFβ1基因转染效果确实可靠。
, 百拇医药
Testing of Cell Culture Fluid by Recombinant
TGFβ1 Gene Tran sfer
Feng Yan,Cao Guangwen,Zhang Xiaoqin, et al
Naval Medical Research Institute, Shanghai 200433
Abstract Objective: To investiga te whether transforming growth factor β1 gene can transfer successfully or not. Methods: pL( TGF β1) SN was used to transfect packaging cell line by lipofectamine. After G418 screening, the positive serum of retroviral was detected for TGF β1 and Neo gene. Positive SMMC 7721 cell slide for immunohistochemical staini ng was prepared. Results: The TGF β 1 concentra tion of cell culture fluid ranged from 16 to 41 ng/ml by ELISA. 290 bp Neo gene band was discovered by nest primer RT-PCR in all the samples. Immunohistochemical staining showed TGF β1 expression was increased significantly after pL(TGF β1) SN transfection. Conclusion: T he effect of TGF β1 gene transfer is certain.
, 百拇医药
Key words transforming growth fa ctor β1; gene; retroviral vector; detection
转化生长因子β1(TGFβ1)为多功能细胞因子,以前在肝纤维中研究较多,为一重要的细胞因子[1],目前在肿瘤研究中亦有报道,能抑制肿瘤细胞的生长、增殖[2],通过重组TGFβ1逆转录病毒载体[3],转染包装细胞,经鉴定转染成功后可为以后基因治疗打下良好的基础。
1 材料和方法
1.1 主要材料 重组逆转录病毒载体pL(TGFβ1)SN,自己构建[4],含正义连接和反义连接基因;包装细胞PA317、SMMC 7721细胞,第二军医大学微生物教研室提供;RPMI1640、G418及脂质体(LipofectamineTM),为美国Life Technologies公司产品;TGFβ1ELISA检测试剂盒,美国Genzyme公司产品;RNA快速提取试剂(浓缩型)及M-MILV逆转录病毒酶,为新华联集团(湖南)来福生物工程公司产品;PCR仪,美国PerkinElmer公司产品,2400型;外引物由中科院典型培养保藏委员会基因库合成,内引物由法国Eurobio实验室合成,Taq DNA Polymerase,Promega 公司产品。
, 百拇医药
1.2 方 法
1.2.1 包装细胞的复苏、换液和传代 用1640培养液常规操作,传代时用0.1%的胰酶消化后(2~5min),反复吹吸瓶壁,成1:2或1:3。
1.2.2 包装细胞的脂质体转染及筛选 细胞在转染前一天换培养基,一般达60%~70%融合可以进行转染试验。先配制A液,将6μl正、反义pL(TGFβ1)SN加入94μl无血清1640培养基中,B液,Lipofectamine6μl加入94μl无血清1640培养基中,各自混匀,后A、B液混合后放试管架上平板振荡30min;取出PA317及7721培养细胞,用无血清1640培养基洗2次,每次放置约5min,再倒掉;在Lipo-DNA混合液中加入0.8ml的无血清培养基,然后慢慢滴加入包装细胞瓶中;培养5h后,加1ml含20%牛血清的1640,24h后,换无双抗的1640培养基;转染48~72h,视细胞生长情况,消化传代后用G418 400μg/ml进行筛选。如细胞死亡更换G418液,一般3~5d阳性克隆慢慢生长,待阳性克隆长满瓶壁后,消化传代,更换用无双抗的1640培养基,48h后收取第一次上清,用二层滤膜(孔径为0.22μm)抽吸过滤,-40℃保存。
, 百拇医药
1.2.3 病毒上清中TGFβ1的ELISA检测 样品活化,450μl样品稀释液加10μl样品,再加20μl1NHCl,轻轻颠倒混匀,2~8℃放置1h,然后加20μl1N NaOH,轻轻颠倒混匀。采用双抗体夹心法,其余按照试剂盒说明书操作。
1.2.4 病毒上清的Neo检测 首先抽取上清的RNA,再进行RT-PCR,设计的外引物为5'-CGTTGT CAC TGA AGC GGG AAG G-3',5'-CCA TGA TAT TCG GCA AGC AGG C-3'; 内引物5'-TGC TA T TGG GCG AAG TGC CG-3',5'-ACA AGA CCG GCT TCC ATC CG-3'。外引物各1μl,加模板R NA 10μl,70℃, 10min,离心,依次加入:5×buffer 4μl,DTT(0. 2mol/L) 1 μl,dNTP(10mmol)1μl,M-MILV逆转录酶2.5μl(25u),然后37℃反应1h,再依次加入:10×无镁buffer 3μl,Taq酶1μl,50mmol/LMgCl2 1.2μl,DW H2O 24.3μl,设定94℃,5min;94℃、50℃、72℃各30s;72℃,7min,共进行30个循环。取第一轮PCR产物为第二轮PCR的模板,依次加入下列反应物:模板2μl,10×buffer2μl,内引物各0.5μl,25mmol/LMgCl21.2μl,10mmol/L dNTP 1μl,Taq酶1μl,DW H2O 11.8μl,设定94℃5min、94℃ 40s、55℃ 1min、72℃ 1.5min、72℃ 7min, 共进行30个循环。
, 百拇医药
1.2.5 TGFβ1免疫组化染色 转染7721细胞,筛选后加入12mm×50mm的薄玻片,待细胞爬满玻片后,取出玻片用S-P法进行组化染色,阳性切片按阳性细胞数>5%,25%~45%,>45%分为+,++,+++三级。
2 结 果
2.1 病毒上清的ELISA检测结果
随机抽取四份病毒上清,其中反义pL(TGFβ1)SN-PA317上清1份,正义pL(TGFβ1)SN-PA317上清3份,同时检测2份不含DNA的包装细胞上清,测得的A450nm及计算出的TGFβ1含量见表1。
表1 TGFβ1检测结果 上清种类
, http://www.100md.com A值
TGFβ1大约含量(ng/ml)*
正义-PA317
0.218
16
正义-PA317
0.480
41
反义-PA317
0.273
23
正义-PA317
, 百拇医药
0.300
27
阳性对照
0.332
阴性对照
0.085
空白对照
0.016
*计算含量时乘以稀释倍数50,根据标准曲线换算
2.2 RT-PCR检测Neo基因结果
随机抽取4份病毒上清,其中反义1份,3份正义,经过第1轮(外引物)PCR后,电泳能见2条带,位置在411bp左右,第2轮(内引物)PCR后,电泳时均出现条带,位置在290bp处,见图1。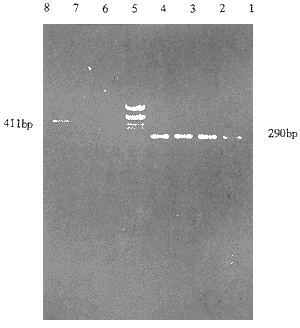
, 百拇医药
图1 Neo基因PCR分析结果
Figl PCR analysis of Neo gene
1、2、4. sense pL(TGFβ1)SN-PA317 cell culture fluid
3. anti-sense pL(TGFβ1)SN-PA317 cell culture fluid
5.pGEM-7Zf(+)/Hae Ⅲ DNA Markers
6、7、8.sense pL(TGFβ1)SN-PA317 cell culture fluid (singleprimer)
2.3 7721细胞TGFβ1免疫组化结果
, http://www.100md.com
用含正义pL(TGFβ1)SN的包装细胞上清(PA317)感染7721细胞,G418筛选后的阳性细胞进行TGFβ1表达蛋白的免疫组化分析,并与7721细胞作对照(空白),结果见图2、3。
图2 SMMC7721细胞空白对照TGFβ1免疫组化染色±(200×)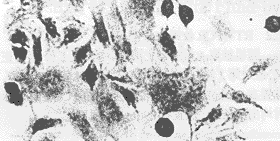
图3 转染正义pL(TGFβ1)SN病毒上清后SMMC 7721
细胞免疫组化TGFβ1染色++(200×)
3 讨 论
, 百拇医药
基因重组在基因治疗中占很重要的地位,目前应用较多的是逆转录病毒载体,本文应用的载体pLXSN含可供筛选的Neo基因,PA317为第2代逆转录病毒包装细胞,是兼性包装细胞,与第一代包装细胞相比,PA317除了能提供逆转录病毒载体颗粒所需的蛋白质和缺失病毒的包装信号Ψ以外,其病毒基因组中的env3'端序列是缺失的,PA317要通过两次独立重组过程才能产生具有复制活性的病毒,是一种较安全的包装细胞,因此它具有不致病性、靶细胞范围广、转染能力强和能够长期稳定表达的特点。
Lipofectamine是GIBCOBRL公司推出的第二代产品,是一种特制的多阳离子脂质试剂,它与靶DNA的磷酸骨架结合而生成的复合物能轻易通过细胞膜,它独特的精胺基团强负电子头部使之具有较强的转染能力,适用于各种类型的贴壁和悬浮培养细胞株[5]。转染时脂质体用量要适当控制,说明书建议用2~25μl,范围稍广,笔者体会用6μl就足以发挥转染效率,过多反而影响细胞生长,并对细胞产生一定的毒性作用,转染时细胞最好70%~80%融合,且用无血清培养液洗二次,DNA与脂质体要有足够的混合时间,因转染时操作步骤较多,更要注意无菌操作,移液器最好专用作细胞转染。
, 百拇医药
为了解病毒上清中是否存在逆转录病毒,对病毒上清进行抽提RNA,用RT-PCR技术进行检测,看是否出现411bp Neo基因条带,而我们则采用更为准确可靠的套叠PCR,用二对引物进行扩增,第一次扩增后半数出现411条带,第二次扩增后全部出现条带,说明收获的上清中肯定存在Neo基因,为判别Neo基因的真伪性,可进行Northern印迹,通过探针杂交以确定是否含目的DNA顺序,但这种方法比较复杂,步骤繁多,笔者找到了更为可靠的方法即测定上清中的TGFβ1[6~8],理论上讲只有正义连接才可产生TGFβ1,但实际工作中,正义、反义上清均可出现TGFβ1,这方面的解释并不能令人满意,以前进行杂交瘤细胞培养时也有类似情况出现,正义、反义IL6的培养细胞上清均可使杂交瘤细胞维持生长(因杂交瘤细胞的生长离不开IL6)。用并不复杂的ELISA试剂盒,检测病毒上清,通过标准曲线既可以定性,也可大约定量,可检测到ng级水平。同时,通过免疫组化染色,检测阳性细胞的TGFβ1,并和空白组比较,结果转染组明显高于对照组,这又从一个侧面证实了重组体转入成功。
, 百拇医药
参考文献
1 Orsatti G, Hytiroglou P, Thung SN et al. Lamellar fi brosis in the fibrolamellar variant of hepatocellular carcinoma: a role for tran sforming growth factor beta. Liver, 1997, 17(3):152
2 Braunl L, Gruppuso P, Mikumok et al. Transforming gr owth factor betal in liver carcinogenesis: messenger RNA expression and growth effects. Cell Growth & Differentiation, 1990, 1:103
3 Miller AD, Miller DG, Garcia JV et al. Use of retrov iral vectors for gene transfer and expression. Methods In Enzymology, 1993, 217:518
, http://www.100md.com
4 封 岩,曹广文,孔宪涛等.正、反义TGF β1逆转录病毒载体的构建及鉴定.上海免疫学杂志,1999,19(4):230
5 Rosenberg RA, Aebersold P, Cornetta K et al.Genet ransfer into human-immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med ,1990,323:570
6 Tsai JF, Jeng JE, Chuang LY et al. Elevated urinary transforming growth factor-beta l level as a tumor marker and predictor of poor suvival in cirrhotic hepatocellular carcinoma. Br J Cancer,1997,76(2):244
, 百拇医药
7 Tsai JF, Chuang LY, Jeng JE et al. Clinical relevance of transforming growth factor-beta l in the urine of patients with hepatocell ular carcinoma. Medicine Baltimore, 1997,76(3):213
8 Factor VM, Kao CY, Santoni RE et al. Constitutive expression of mature transforming growth factor betal in the liver accelerates he patocarcinogenesis in transgenic mice.Cancer Res,1997,57(11):2089
(收稿:1999-03-30), http://www.100md.com
单位:封 岩 程振球 王发锁 汤 琰:海军医学研究所,上海市 200433;曹广文 张晓琴:第二军医大学微生物学教研室;孔宪涛:长征医院全军临床免疫中心
关键词:转化生长因子β1;基因;逆转录病毒载体;检测
海军医学杂志990117 摘要 目的:观察TGFβ1基因转入能否成功。方法:用pL(TGFβ1)SN经脂质体转染包装细胞,G418筛选,对阳性病毒上清检测TGFβ1表达蛋白及Neo基因,转染后的SMMC7721细胞进行免疫组化染色。结果:阳性上清ELISA检测,TGFβ1含量为16~41ng/ml;套式RT-PCR检测Neo基因,第2轮后全部出现290bp条带;TGFβ1免疫组化染色显示:空白对照±,正义转染++。结论:TGFβ1基因转染效果确实可靠。
, 百拇医药
Testing of Cell Culture Fluid by Recombinant
TGFβ1 Gene Tran sfer
Feng Yan,Cao Guangwen,Zhang Xiaoqin, et al
Naval Medical Research Institute, Shanghai 200433
Abstract Objective: To investiga te whether transforming growth factor β1 gene can transfer successfully or not. Methods: pL( TGF β1) SN was used to transfect packaging cell line by lipofectamine. After G418 screening, the positive serum of retroviral was detected for TGF β1 and Neo gene. Positive SMMC 7721 cell slide for immunohistochemical staini ng was prepared. Results: The TGF β 1 concentra tion of cell culture fluid ranged from 16 to 41 ng/ml by ELISA. 290 bp Neo gene band was discovered by nest primer RT-PCR in all the samples. Immunohistochemical staining showed TGF β1 expression was increased significantly after pL(TGF β1) SN transfection. Conclusion: T he effect of TGF β1 gene transfer is certain.
, 百拇医药
Key words transforming growth fa ctor β1; gene; retroviral vector; detection
转化生长因子β1(TGFβ1)为多功能细胞因子,以前在肝纤维中研究较多,为一重要的细胞因子[1],目前在肿瘤研究中亦有报道,能抑制肿瘤细胞的生长、增殖[2],通过重组TGFβ1逆转录病毒载体[3],转染包装细胞,经鉴定转染成功后可为以后基因治疗打下良好的基础。
1 材料和方法
1.1 主要材料 重组逆转录病毒载体pL(TGFβ1)SN,自己构建[4],含正义连接和反义连接基因;包装细胞PA317、SMMC 7721细胞,第二军医大学微生物教研室提供;RPMI1640、G418及脂质体(LipofectamineTM),为美国Life Technologies公司产品;TGFβ1ELISA检测试剂盒,美国Genzyme公司产品;RNA快速提取试剂(浓缩型)及M-MILV逆转录病毒酶,为新华联集团(湖南)来福生物工程公司产品;PCR仪,美国PerkinElmer公司产品,2400型;外引物由中科院典型培养保藏委员会基因库合成,内引物由法国Eurobio实验室合成,Taq DNA Polymerase,Promega 公司产品。
, 百拇医药
1.2 方 法
1.2.1 包装细胞的复苏、换液和传代 用1640培养液常规操作,传代时用0.1%的胰酶消化后(2~5min),反复吹吸瓶壁,成1:2或1:3。
1.2.2 包装细胞的脂质体转染及筛选 细胞在转染前一天换培养基,一般达60%~70%融合可以进行转染试验。先配制A液,将6μl正、反义pL(TGFβ1)SN加入94μl无血清1640培养基中,B液,Lipofectamine6μl加入94μl无血清1640培养基中,各自混匀,后A、B液混合后放试管架上平板振荡30min;取出PA317及7721培养细胞,用无血清1640培养基洗2次,每次放置约5min,再倒掉;在Lipo-DNA混合液中加入0.8ml的无血清培养基,然后慢慢滴加入包装细胞瓶中;培养5h后,加1ml含20%牛血清的1640,24h后,换无双抗的1640培养基;转染48~72h,视细胞生长情况,消化传代后用G418 400μg/ml进行筛选。如细胞死亡更换G418液,一般3~5d阳性克隆慢慢生长,待阳性克隆长满瓶壁后,消化传代,更换用无双抗的1640培养基,48h后收取第一次上清,用二层滤膜(孔径为0.22μm)抽吸过滤,-40℃保存。
, 百拇医药
1.2.3 病毒上清中TGFβ1的ELISA检测 样品活化,450μl样品稀释液加10μl样品,再加20μl1NHCl,轻轻颠倒混匀,2~8℃放置1h,然后加20μl1N NaOH,轻轻颠倒混匀。采用双抗体夹心法,其余按照试剂盒说明书操作。
1.2.4 病毒上清的Neo检测 首先抽取上清的RNA,再进行RT-PCR,设计的外引物为5'-CGTTGT CAC TGA AGC GGG AAG G-3',5'-CCA TGA TAT TCG GCA AGC AGG C-3'; 内引物5'-TGC TA T TGG GCG AAG TGC CG-3',5'-ACA AGA CCG GCT TCC ATC CG-3'。外引物各1μl,加模板R NA 10μl,70℃, 10min,离心,依次加入:5×buffer 4μl,DTT(0. 2mol/L) 1 μl,dNTP(10mmol)1μl,M-MILV逆转录酶2.5μl(25u),然后37℃反应1h,再依次加入:10×无镁buffer 3μl,Taq酶1μl,50mmol/LMgCl2 1.2μl,DW H2O 24.3μl,设定94℃,5min;94℃、50℃、72℃各30s;72℃,7min,共进行30个循环。取第一轮PCR产物为第二轮PCR的模板,依次加入下列反应物:模板2μl,10×buffer2μl,内引物各0.5μl,25mmol/LMgCl21.2μl,10mmol/L dNTP 1μl,Taq酶1μl,DW H2O 11.8μl,设定94℃5min、94℃ 40s、55℃ 1min、72℃ 1.5min、72℃ 7min, 共进行30个循环。
, 百拇医药
1.2.5 TGFβ1免疫组化染色 转染7721细胞,筛选后加入12mm×50mm的薄玻片,待细胞爬满玻片后,取出玻片用S-P法进行组化染色,阳性切片按阳性细胞数>5%,25%~45%,>45%分为+,++,+++三级。
2 结 果
2.1 病毒上清的ELISA检测结果
随机抽取四份病毒上清,其中反义pL(TGFβ1)SN-PA317上清1份,正义pL(TGFβ1)SN-PA317上清3份,同时检测2份不含DNA的包装细胞上清,测得的A450nm及计算出的TGFβ1含量见表1。
表1 TGFβ1检测结果 上清种类
, http://www.100md.com A值
TGFβ1大约含量(ng/ml)*
正义-PA317
0.218
16
正义-PA317
0.480
41
反义-PA317
0.273
23
正义-PA317
, 百拇医药
0.300
27
阳性对照
0.332
阴性对照
0.085
空白对照
0.016
*计算含量时乘以稀释倍数50,根据标准曲线换算
2.2 RT-PCR检测Neo基因结果
随机抽取4份病毒上清,其中反义1份,3份正义,经过第1轮(外引物)PCR后,电泳能见2条带,位置在411bp左右,第2轮(内引物)PCR后,电泳时均出现条带,位置在290bp处,见图1。

, 百拇医药
图1 Neo基因PCR分析结果
Figl PCR analysis of Neo gene
1、2、4. sense pL(TGFβ1)SN-PA317 cell culture fluid
3. anti-sense pL(TGFβ1)SN-PA317 cell culture fluid
5.pGEM-7Zf(+)/Hae Ⅲ DNA Markers
6、7、8.sense pL(TGFβ1)SN-PA317 cell culture fluid (singleprimer)
2.3 7721细胞TGFβ1免疫组化结果
, http://www.100md.com
用含正义pL(TGFβ1)SN的包装细胞上清(PA317)感染7721细胞,G418筛选后的阳性细胞进行TGFβ1表达蛋白的免疫组化分析,并与7721细胞作对照(空白),结果见图2、3。

图2 SMMC7721细胞空白对照TGFβ1免疫组化染色±(200×)

图3 转染正义pL(TGFβ1)SN病毒上清后SMMC 7721
细胞免疫组化TGFβ1染色++(200×)
3 讨 论
, 百拇医药
基因重组在基因治疗中占很重要的地位,目前应用较多的是逆转录病毒载体,本文应用的载体pLXSN含可供筛选的Neo基因,PA317为第2代逆转录病毒包装细胞,是兼性包装细胞,与第一代包装细胞相比,PA317除了能提供逆转录病毒载体颗粒所需的蛋白质和缺失病毒的包装信号Ψ以外,其病毒基因组中的env3'端序列是缺失的,PA317要通过两次独立重组过程才能产生具有复制活性的病毒,是一种较安全的包装细胞,因此它具有不致病性、靶细胞范围广、转染能力强和能够长期稳定表达的特点。
Lipofectamine是GIBCOBRL公司推出的第二代产品,是一种特制的多阳离子脂质试剂,它与靶DNA的磷酸骨架结合而生成的复合物能轻易通过细胞膜,它独特的精胺基团强负电子头部使之具有较强的转染能力,适用于各种类型的贴壁和悬浮培养细胞株[5]。转染时脂质体用量要适当控制,说明书建议用2~25μl,范围稍广,笔者体会用6μl就足以发挥转染效率,过多反而影响细胞生长,并对细胞产生一定的毒性作用,转染时细胞最好70%~80%融合,且用无血清培养液洗二次,DNA与脂质体要有足够的混合时间,因转染时操作步骤较多,更要注意无菌操作,移液器最好专用作细胞转染。
, 百拇医药
为了解病毒上清中是否存在逆转录病毒,对病毒上清进行抽提RNA,用RT-PCR技术进行检测,看是否出现411bp Neo基因条带,而我们则采用更为准确可靠的套叠PCR,用二对引物进行扩增,第一次扩增后半数出现411条带,第二次扩增后全部出现条带,说明收获的上清中肯定存在Neo基因,为判别Neo基因的真伪性,可进行Northern印迹,通过探针杂交以确定是否含目的DNA顺序,但这种方法比较复杂,步骤繁多,笔者找到了更为可靠的方法即测定上清中的TGFβ1[6~8],理论上讲只有正义连接才可产生TGFβ1,但实际工作中,正义、反义上清均可出现TGFβ1,这方面的解释并不能令人满意,以前进行杂交瘤细胞培养时也有类似情况出现,正义、反义IL6的培养细胞上清均可使杂交瘤细胞维持生长(因杂交瘤细胞的生长离不开IL6)。用并不复杂的ELISA试剂盒,检测病毒上清,通过标准曲线既可以定性,也可大约定量,可检测到ng级水平。同时,通过免疫组化染色,检测阳性细胞的TGFβ1,并和空白组比较,结果转染组明显高于对照组,这又从一个侧面证实了重组体转入成功。
, 百拇医药
参考文献
1 Orsatti G, Hytiroglou P, Thung SN et al. Lamellar fi brosis in the fibrolamellar variant of hepatocellular carcinoma: a role for tran sforming growth factor beta. Liver, 1997, 17(3):152
2 Braunl L, Gruppuso P, Mikumok et al. Transforming gr owth factor betal in liver carcinogenesis: messenger RNA expression and growth effects. Cell Growth & Differentiation, 1990, 1:103
3 Miller AD, Miller DG, Garcia JV et al. Use of retrov iral vectors for gene transfer and expression. Methods In Enzymology, 1993, 217:518
, http://www.100md.com
4 封 岩,曹广文,孔宪涛等.正、反义TGF β1逆转录病毒载体的构建及鉴定.上海免疫学杂志,1999,19(4):230
5 Rosenberg RA, Aebersold P, Cornetta K et al.Genet ransfer into human-immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med ,1990,323:570
6 Tsai JF, Jeng JE, Chuang LY et al. Elevated urinary transforming growth factor-beta l level as a tumor marker and predictor of poor suvival in cirrhotic hepatocellular carcinoma. Br J Cancer,1997,76(2):244
, 百拇医药
7 Tsai JF, Chuang LY, Jeng JE et al. Clinical relevance of transforming growth factor-beta l in the urine of patients with hepatocell ular carcinoma. Medicine Baltimore, 1997,76(3):213
8 Factor VM, Kao CY, Santoni RE et al. Constitutive expression of mature transforming growth factor betal in the liver accelerates he patocarcinogenesis in transgenic mice.Cancer Res,1997,57(11):2089
(收稿:1999-03-30), http://www.100md.com