甲苯神经毒性的生物学机制研究进展
作者:颜士勇
单位:海军医学研究所,上海市 200433
关键词:甲苯;神经毒性;生物学机制
海军医学杂志990113 摘要 介绍甲苯对神经系统的毒性,并从形态、生理、生化和 分子等不同的角度和层次阐述甲苯所致神经毒性的生物学机制。
甲苯(toluene)是常用的有机溶剂,在舰艇中广泛存在,有较强的挥发性,是脂溶性物 质,易透过血脑屏障,因而对中枢神经系统的毒性极受关注,流行病学调查也表明接触人群 有神经功能的改变。对其造成神经毒性的机制研究越来越受重视,本文就此作一综述。
1 甲苯的体内代谢过程
甲苯被摄入体内后,约有48%在体内被代谢,其代谢终产物是马尿酸,经过肾 排出体外。其代谢过程见图1,代谢的主要器官是肝脏,其次在脑、肺和肾等部位,甲苯在 代谢过程中产生氧活性物质(ROS),脑区检测可发现海马等部位产生大量自由基,而谷胱甘 肽等还原性物质减少。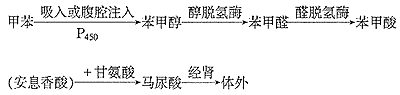
, 百拇医药
图1 甲苯的体内代谢过程
2 甲苯的行为毒理学研究
2.1 对人群行为的影响
甲苯的急性毒性较低,大鼠经口LD50为5 500mg/kg,LC50为 17 020mg/m3,小鼠经口LD50为8 000mg/kg,LC50为25 900mg/m3, 除非事故等 原因,一般不引起人的急性中毒,但是长期低浓度接触甲苯可致人的神经行为功能发生改变 ,这方面已有大量的人群流行病学调查资料。Boey等[1]检查了职业接触低浓度甲 苯工人的神经行为功能(接触工人血中甲苯浓度为1.25±0.37mg/L,对照组为0.16±0.0 6mg/ L),结果发现接触工人的短期记忆能力、注意力持久性以及感觉运动速度均显著地低于对照 组。对自愿者进行甲苯吸入实验[2],甲苯浓度为3 700mg/m3,吸入6h, 神经 行为功能检查发现反应时间延长,活动可增强甲苯的作用。另有对自愿者的测试结果表明, 甲苯只影响受试者的记忆功能。国内郭棣华等[3]对混苯作业的工作进行调查,并 将接触工人根据接触甲苯和二甲苯浓度的不同分为低浓度和中浓度接触组,接触工人的神经 行为功能显著降低, 表现为记忆力下降,影响感知(视觉、听觉)、运动速度,视觉记忆测试与甲苯浓度呈剂量- 效应关系。上述调查中所有改变并没有伴随临床症状和体征,但这些改变是否是可逆的,还 是进一步损害的前兆尚须进一步调查。
, 百拇医药
2.2 对动物行为的影响
甲苯对动物中枢神经系统的作用呈双相反应,低浓度时表现为兴奋,高浓度 时表现为抑制。Evans等发现甲苯浓度为200mg/m3时,小鼠活动增加,浓度增大时小鼠活 动受抑制,终止染毒后则活动度逐渐恢复正常。但活动度不能代表大鼠的反应性,Wada [4]研究发现,甲苯染毒大鼠,无论活动度增加还是降低都显著降低大鼠电击逃避反应 率。
3 形态学研究
Saavedra[5]等观察到猫慢性吸入甲苯,中枢神经元发生变性、坏 死,在不同脑区严重度不一样。极为严重的是海马区CA1和CA3,当脑组织受损后,神经胶质 细胞增生,神经胶质细胞标志蛋白GFAP、S-100及烯醇酶含量增高,临床和流行病学研究都 表明慢性甲苯接触可引起记忆缺失。海马是与学习记忆过程极为相关的脑区,Korb[ 6]研究发现5 550mg/m3甲苯染毒大鼠6个月,病理检查发现海马CA2和CA3区有16 %的 神经元损失;7 400mg/m3吸入染毒大鼠1个月,可出现海马齿状回的GFAP免疫组化增强。 有研究者报道甲苯在抑制突触传递的过程中可不伴有中枢神经系统形态改变,说明在发生器 质性改变之前,可有功能改变或生化改变的预兆。
, 百拇医药
4 电生理研究
神经系统的活动伴随着神经元之间生物电的传递,而神经系统功能活动的变 化可以通过记录脑区电位显示,神经活动功能的异常可表现为神经电活动的变化。Tomas T [7]等用慢性电极植入甲苯染毒大白兔的不同脑区记录兔脑的自发电位和诱发电位 ,结果发现大白兔的大脑皮层和海马无论是诱发电位(视觉刺激和电刺激)还是自发电位都发 生改变。Murata K等[8]检查了甲苯接触者(1~36年,307mg/m3)心电图R-R间 隔变异系数、正中神经最大感觉传导速度和运动神经传导速度,与对照组相比都发生了改变 ,且有时间-效应关系,结合海马和脑干的损伤,作者认为甲苯引起中枢神经系统的电位损 伤特点,主要为副交感神经活动减少。另有报道[9]甲苯引起接触工人脑干区听觉 诱发电位发生改变,表现为P1波潜伏期显著延长,P3~P5波峰间隔期显著增加,认为听觉 传导通路的外髓区和高延髓区受到影响,同时伴有视觉诱发电位P100波潜伏期的显著延长。 上述研究说明甲苯影响信息在大脑的整合过程。
, 百拇医药
5 神经生化研究
甲苯可影响脑内神经递质的合成、神经末梢的释放、重摄取和降解从而导致 一系列神经症状的发生。脑内的神经递质种类较多,其中研究比较多的是γ-氨基丁酸、谷 氨酸、乙酰胆碱、儿茶酚胺、脑肽等。有研究[10]发现甲苯抑制大鼠脑氨基肽酶 的活性,该酶是专司神经活性肽的降解的,受抑制后就会导致神经活性肽释放后在突触部位 的积聚,引起神经毒性。有研究者报道甲苯可引起染毒大鼠脑脊髓核内亮脑啡肽和甲硫脑啡 肽的改变,免疫组化发现脑区染色增加,脑啡肽对调节和维持呼吸中枢的兴奋性十分重要, 神经节苷酯可对抗甲苯的这种作用,确切机制尚不清楚,可能是神经节苷酯与甲苯及其代谢 产物发生作用,从而保护了脑氨基肽酶的活性,维持了神经活性肽的稳态。也可能是神经节 苷酯保护神经鞘膜免于受甲苯及其代谢产物的损害,从而达到维持脑啡肽的稳定。近来研究 [11,12]发现甲苯影响γ-氨基丁酸传递而影响前庭和视听觉运动系统功能, 抑制大脑对视听觉刺激的反应。甲苯7 400mg/m3染毒大鼠2h后,对大鼠小脑皮层进 行微 透析分析发现细胞外γ-氨基丁酸升高,在苍白球和纹状体的传递途径上,影响纹状体中γ- 氨基丁酸向苍白球的输出,还影响神经元中γ-氨基丁酸经过苔藓纤维向小脑皮层的输入, 甲苯的这种作用可被Na+通道特异性阻滞剂TTX(河豚毒素)所阻断。Lizumi等[13] 研究慢性甲苯接触(11 100mg/m3,每天染毒4h,染毒3周)对大鼠酪氨酸羟化酶(TH)的免 疫活性影响,发现甲苯染毒大鼠的大部分脑区(包括小脑、海马、中隔侧核和下丘脑)TH免疫 活性神经纤维末梢的数目和密度比对照组显著增多,TH是儿茶酚胺类神经递质合成的限速酶 ,甲苯对该酶的影响使得儿茶酚胺在这些脑区合成显著增多,生化检测也发现多巴胺和去甲 肾上腺素量增多,影响了儿茶酚胺能神经元系统功能。甲苯还抑制乙酰胆碱从神经末梢的释 放,影响了胆碱能神经的信息传递,而胆碱能神经对大脑众多功能(如学习、记忆、反应性 等)的维持起重要作用,近来有人研究发现急性甲苯暴露引起大鼠纹状体乙酰胆碱释放减少 ,同时多巴胺释放增多,但二者无相互联系,是甲苯引起的独立反应[14]。甲苯 还抑制神经突触体和新型胶质细胞膜的Na+、K+-ATP酶和Mg2+-ATP酶活性,使膜 脂流动性增加[15]。可见甲苯对中枢系统的神经递质影响是多方面的,也可能存 在多种不同的机制,但这些机制有何内在联系尚有待进一步研究。
, http://www.100md.com
6 分子机制研究
对甲苯引起神经毒性的分子机制研究报道的还不多,近年来在分子神经生物 学研究中,立早基因的作用正越来越受到重视,在正常情况下,立早基因参与神经细胞的生 长、分化、信息传递、学习和记忆等生理过程,在受到外界刺激的情况下,可作为第三信使 将刺激激活神经元的第二信使的信息传递到目的基因,c-fos和c-jun作为立早基因的重要成 员、编码DNA结合蛋白,后者形成转录因子AP-1,在中枢神经系统中,c-fos和c-jun的快速 表达使细胞外的短期刺激与细胞的长时程反相关联。但c-fos和c-jun过度表达则是神经细胞 受损伤的标志。Matsuoka M[16]将小鼠吸入1 850~7 400mg/m3甲苯8h后,检 测小鼠大脑的立早基因表达,未发现有表达的改变, 但是由于甲苯在不同脑区中的反应性 不一致,因此尚不能肯定其他脑区如海马中立早基因的表达是否有变化,这方面仍有深入研 究的必要。
参考文献
, 百拇医药
1 Boey KW, Foo SC, Jeyardtnam J. Effects of occupational exposure to tol uene: a neuropsychological study on workers in Singapore. Ann Acad Med Singapore , 1997,26(2):184
2 Rahilla AA, Weiss B, Morrow PE. Human performance during exposure to t oluene. Aviat Space Environ Med, 1996,67(7):640
3 郭棣华,林勇福,童家期.职业接触混苯对神经行为功能的影响.中华劳动卫生职 业病杂志,1994,12(1):42
4 Wada H, Hosokawa T, Saito K. Single toluene exposure and changes of re sponse latency in shock avoidance performance. Neurotoxicology and Teratology, 1989,11(3):265
, 百拇医药
5 Saavedra H, De M, Palestini M. Neuronal changes induced by chronic tol uene exposure in the cat. Archives Italiennes De Biologie, 1996,134(3):217
6 Korbo C, Ladefoged O, Lam HR. Neuronal loss in hippocampus in rats exp osed to toluene. Neurotoxicology, 1996,17(2):359
7 Tomas T, Swiercz R, Wiaaerna D. Changes in bioelectric function of rab bit cerebral after intraperitoneal injection of organic solvents: toluene and m- xylene. Med Pr, 1997,48(2):161
, 百拇医药
8 Murata K, Araki S, Yokoyema K. Cardiac automatic dysjunction in rogagr avure printers exposed to toluene in relation to peripheral nerve condition. Ind Health, 1993,31(3):79
9 Abbate C, Giorgianni C, Munao F. Neurotoxicity induced by exposure to toluene. An electrophysiologic study. Int Arch Occup Environ Health, 1993,64(6) :389
10 De-Gandarian JM, Echevarnia E, Serrano K. Effect of subacute toluene administration on the eukephalinergic neuromodulatory system in rats and protect ive action of ganglioside treatments. Toxicol Ind Health, 1994,10(3):155
, http://www.100md.com
11 Niklasson M, Stengard K, Tham R. Are the effects of toluene on the ve stibulo and opto-occular motao system inhibited by the action of GABAB antagonis t CGP35348? Neurotoxicol Teratol, 1995,17(3):351
12 Stengard K, Tham K. Acute toluene exposure increases extracellular GA BA in the cerebellum of rat: a microdialysis study. Pharmacol Toxicol, 1993,3(6) :315
13 Lizumi H, Fukui K, Utsumi H. Effect of chronic toluene exposure on ty rosine hydroxylase-positive nerve elements in the rat forebrain: an immunohistoc hemical study combined with semiquantitative morphometric analysis. Neuroreport, 1995,7(1):81
, http://www.100md.com
14 Stengard K. Effect of toluene inhalation on extracellular striatal ac etylcholine release studied with microdialysis. Pharmacol Toxicol, 1994,75(2):1 15
15 Vaalavirta L, Tahti H. Effects of selected organic solvents on the as trocyte membrane ATPase in vitro. Chemical and experimental Pharmacology and Phy siology, 1995,22(4):293
16 Matsuoka M, Matsumara H, Igisu H. Effects of single exposure to tolue ne vapour on the expression of immediate early genes and GFAP gene in the mouse brain. Arch Toxicol, 1997,71(11):722
(收稿:1999-06-01), 百拇医药
单位:海军医学研究所,上海市 200433
关键词:甲苯;神经毒性;生物学机制
海军医学杂志990113 摘要 介绍甲苯对神经系统的毒性,并从形态、生理、生化和 分子等不同的角度和层次阐述甲苯所致神经毒性的生物学机制。
甲苯(toluene)是常用的有机溶剂,在舰艇中广泛存在,有较强的挥发性,是脂溶性物 质,易透过血脑屏障,因而对中枢神经系统的毒性极受关注,流行病学调查也表明接触人群 有神经功能的改变。对其造成神经毒性的机制研究越来越受重视,本文就此作一综述。
1 甲苯的体内代谢过程
甲苯被摄入体内后,约有48%在体内被代谢,其代谢终产物是马尿酸,经过肾 排出体外。其代谢过程见图1,代谢的主要器官是肝脏,其次在脑、肺和肾等部位,甲苯在 代谢过程中产生氧活性物质(ROS),脑区检测可发现海马等部位产生大量自由基,而谷胱甘 肽等还原性物质减少。

, 百拇医药
图1 甲苯的体内代谢过程
2 甲苯的行为毒理学研究
2.1 对人群行为的影响
甲苯的急性毒性较低,大鼠经口LD50为5 500mg/kg,LC50为 17 020mg/m3,小鼠经口LD50为8 000mg/kg,LC50为25 900mg/m3, 除非事故等 原因,一般不引起人的急性中毒,但是长期低浓度接触甲苯可致人的神经行为功能发生改变 ,这方面已有大量的人群流行病学调查资料。Boey等[1]检查了职业接触低浓度甲 苯工人的神经行为功能(接触工人血中甲苯浓度为1.25±0.37mg/L,对照组为0.16±0.0 6mg/ L),结果发现接触工人的短期记忆能力、注意力持久性以及感觉运动速度均显著地低于对照 组。对自愿者进行甲苯吸入实验[2],甲苯浓度为3 700mg/m3,吸入6h, 神经 行为功能检查发现反应时间延长,活动可增强甲苯的作用。另有对自愿者的测试结果表明, 甲苯只影响受试者的记忆功能。国内郭棣华等[3]对混苯作业的工作进行调查,并 将接触工人根据接触甲苯和二甲苯浓度的不同分为低浓度和中浓度接触组,接触工人的神经 行为功能显著降低, 表现为记忆力下降,影响感知(视觉、听觉)、运动速度,视觉记忆测试与甲苯浓度呈剂量- 效应关系。上述调查中所有改变并没有伴随临床症状和体征,但这些改变是否是可逆的,还 是进一步损害的前兆尚须进一步调查。
, 百拇医药
2.2 对动物行为的影响
甲苯对动物中枢神经系统的作用呈双相反应,低浓度时表现为兴奋,高浓度 时表现为抑制。Evans等发现甲苯浓度为200mg/m3时,小鼠活动增加,浓度增大时小鼠活 动受抑制,终止染毒后则活动度逐渐恢复正常。但活动度不能代表大鼠的反应性,Wada [4]研究发现,甲苯染毒大鼠,无论活动度增加还是降低都显著降低大鼠电击逃避反应 率。
3 形态学研究
Saavedra[5]等观察到猫慢性吸入甲苯,中枢神经元发生变性、坏 死,在不同脑区严重度不一样。极为严重的是海马区CA1和CA3,当脑组织受损后,神经胶质 细胞增生,神经胶质细胞标志蛋白GFAP、S-100及烯醇酶含量增高,临床和流行病学研究都 表明慢性甲苯接触可引起记忆缺失。海马是与学习记忆过程极为相关的脑区,Korb[ 6]研究发现5 550mg/m3甲苯染毒大鼠6个月,病理检查发现海马CA2和CA3区有16 %的 神经元损失;7 400mg/m3吸入染毒大鼠1个月,可出现海马齿状回的GFAP免疫组化增强。 有研究者报道甲苯在抑制突触传递的过程中可不伴有中枢神经系统形态改变,说明在发生器 质性改变之前,可有功能改变或生化改变的预兆。
, 百拇医药
4 电生理研究
神经系统的活动伴随着神经元之间生物电的传递,而神经系统功能活动的变 化可以通过记录脑区电位显示,神经活动功能的异常可表现为神经电活动的变化。Tomas T [7]等用慢性电极植入甲苯染毒大白兔的不同脑区记录兔脑的自发电位和诱发电位 ,结果发现大白兔的大脑皮层和海马无论是诱发电位(视觉刺激和电刺激)还是自发电位都发 生改变。Murata K等[8]检查了甲苯接触者(1~36年,307mg/m3)心电图R-R间 隔变异系数、正中神经最大感觉传导速度和运动神经传导速度,与对照组相比都发生了改变 ,且有时间-效应关系,结合海马和脑干的损伤,作者认为甲苯引起中枢神经系统的电位损 伤特点,主要为副交感神经活动减少。另有报道[9]甲苯引起接触工人脑干区听觉 诱发电位发生改变,表现为P1波潜伏期显著延长,P3~P5波峰间隔期显著增加,认为听觉 传导通路的外髓区和高延髓区受到影响,同时伴有视觉诱发电位P100波潜伏期的显著延长。 上述研究说明甲苯影响信息在大脑的整合过程。
, 百拇医药
5 神经生化研究
甲苯可影响脑内神经递质的合成、神经末梢的释放、重摄取和降解从而导致 一系列神经症状的发生。脑内的神经递质种类较多,其中研究比较多的是γ-氨基丁酸、谷 氨酸、乙酰胆碱、儿茶酚胺、脑肽等。有研究[10]发现甲苯抑制大鼠脑氨基肽酶 的活性,该酶是专司神经活性肽的降解的,受抑制后就会导致神经活性肽释放后在突触部位 的积聚,引起神经毒性。有研究者报道甲苯可引起染毒大鼠脑脊髓核内亮脑啡肽和甲硫脑啡 肽的改变,免疫组化发现脑区染色增加,脑啡肽对调节和维持呼吸中枢的兴奋性十分重要, 神经节苷酯可对抗甲苯的这种作用,确切机制尚不清楚,可能是神经节苷酯与甲苯及其代谢 产物发生作用,从而保护了脑氨基肽酶的活性,维持了神经活性肽的稳态。也可能是神经节 苷酯保护神经鞘膜免于受甲苯及其代谢产物的损害,从而达到维持脑啡肽的稳定。近来研究 [11,12]发现甲苯影响γ-氨基丁酸传递而影响前庭和视听觉运动系统功能, 抑制大脑对视听觉刺激的反应。甲苯7 400mg/m3染毒大鼠2h后,对大鼠小脑皮层进 行微 透析分析发现细胞外γ-氨基丁酸升高,在苍白球和纹状体的传递途径上,影响纹状体中γ- 氨基丁酸向苍白球的输出,还影响神经元中γ-氨基丁酸经过苔藓纤维向小脑皮层的输入, 甲苯的这种作用可被Na+通道特异性阻滞剂TTX(河豚毒素)所阻断。Lizumi等[13] 研究慢性甲苯接触(11 100mg/m3,每天染毒4h,染毒3周)对大鼠酪氨酸羟化酶(TH)的免 疫活性影响,发现甲苯染毒大鼠的大部分脑区(包括小脑、海马、中隔侧核和下丘脑)TH免疫 活性神经纤维末梢的数目和密度比对照组显著增多,TH是儿茶酚胺类神经递质合成的限速酶 ,甲苯对该酶的影响使得儿茶酚胺在这些脑区合成显著增多,生化检测也发现多巴胺和去甲 肾上腺素量增多,影响了儿茶酚胺能神经元系统功能。甲苯还抑制乙酰胆碱从神经末梢的释 放,影响了胆碱能神经的信息传递,而胆碱能神经对大脑众多功能(如学习、记忆、反应性 等)的维持起重要作用,近来有人研究发现急性甲苯暴露引起大鼠纹状体乙酰胆碱释放减少 ,同时多巴胺释放增多,但二者无相互联系,是甲苯引起的独立反应[14]。甲苯 还抑制神经突触体和新型胶质细胞膜的Na+、K+-ATP酶和Mg2+-ATP酶活性,使膜 脂流动性增加[15]。可见甲苯对中枢系统的神经递质影响是多方面的,也可能存 在多种不同的机制,但这些机制有何内在联系尚有待进一步研究。
, http://www.100md.com
6 分子机制研究
对甲苯引起神经毒性的分子机制研究报道的还不多,近年来在分子神经生物 学研究中,立早基因的作用正越来越受到重视,在正常情况下,立早基因参与神经细胞的生 长、分化、信息传递、学习和记忆等生理过程,在受到外界刺激的情况下,可作为第三信使 将刺激激活神经元的第二信使的信息传递到目的基因,c-fos和c-jun作为立早基因的重要成 员、编码DNA结合蛋白,后者形成转录因子AP-1,在中枢神经系统中,c-fos和c-jun的快速 表达使细胞外的短期刺激与细胞的长时程反相关联。但c-fos和c-jun过度表达则是神经细胞 受损伤的标志。Matsuoka M[16]将小鼠吸入1 850~7 400mg/m3甲苯8h后,检 测小鼠大脑的立早基因表达,未发现有表达的改变, 但是由于甲苯在不同脑区中的反应性 不一致,因此尚不能肯定其他脑区如海马中立早基因的表达是否有变化,这方面仍有深入研 究的必要。
参考文献
, 百拇医药
1 Boey KW, Foo SC, Jeyardtnam J. Effects of occupational exposure to tol uene: a neuropsychological study on workers in Singapore. Ann Acad Med Singapore , 1997,26(2):184
2 Rahilla AA, Weiss B, Morrow PE. Human performance during exposure to t oluene. Aviat Space Environ Med, 1996,67(7):640
3 郭棣华,林勇福,童家期.职业接触混苯对神经行为功能的影响.中华劳动卫生职 业病杂志,1994,12(1):42
4 Wada H, Hosokawa T, Saito K. Single toluene exposure and changes of re sponse latency in shock avoidance performance. Neurotoxicology and Teratology, 1989,11(3):265
, 百拇医药
5 Saavedra H, De M, Palestini M. Neuronal changes induced by chronic tol uene exposure in the cat. Archives Italiennes De Biologie, 1996,134(3):217
6 Korbo C, Ladefoged O, Lam HR. Neuronal loss in hippocampus in rats exp osed to toluene. Neurotoxicology, 1996,17(2):359
7 Tomas T, Swiercz R, Wiaaerna D. Changes in bioelectric function of rab bit cerebral after intraperitoneal injection of organic solvents: toluene and m- xylene. Med Pr, 1997,48(2):161
, 百拇医药
8 Murata K, Araki S, Yokoyema K. Cardiac automatic dysjunction in rogagr avure printers exposed to toluene in relation to peripheral nerve condition. Ind Health, 1993,31(3):79
9 Abbate C, Giorgianni C, Munao F. Neurotoxicity induced by exposure to toluene. An electrophysiologic study. Int Arch Occup Environ Health, 1993,64(6) :389
10 De-Gandarian JM, Echevarnia E, Serrano K. Effect of subacute toluene administration on the eukephalinergic neuromodulatory system in rats and protect ive action of ganglioside treatments. Toxicol Ind Health, 1994,10(3):155
, http://www.100md.com
11 Niklasson M, Stengard K, Tham R. Are the effects of toluene on the ve stibulo and opto-occular motao system inhibited by the action of GABAB antagonis t CGP35348? Neurotoxicol Teratol, 1995,17(3):351
12 Stengard K, Tham K. Acute toluene exposure increases extracellular GA BA in the cerebellum of rat: a microdialysis study. Pharmacol Toxicol, 1993,3(6) :315
13 Lizumi H, Fukui K, Utsumi H. Effect of chronic toluene exposure on ty rosine hydroxylase-positive nerve elements in the rat forebrain: an immunohistoc hemical study combined with semiquantitative morphometric analysis. Neuroreport, 1995,7(1):81
, http://www.100md.com
14 Stengard K. Effect of toluene inhalation on extracellular striatal ac etylcholine release studied with microdialysis. Pharmacol Toxicol, 1994,75(2):1 15
15 Vaalavirta L, Tahti H. Effects of selected organic solvents on the as trocyte membrane ATPase in vitro. Chemical and experimental Pharmacology and Phy siology, 1995,22(4):293
16 Matsuoka M, Matsumara H, Igisu H. Effects of single exposure to tolue ne vapour on the expression of immediate early genes and GFAP gene in the mouse brain. Arch Toxicol, 1997,71(11):722
(收稿:1999-06-01), 百拇医药