缺氧处理小白鼠乳酸脱氢酶同工酶的辅酶化和去辅酶化调控作用
作者:袁明秀 邵宏兵 耿 震 刘 建 邓爱平 金浩方*
单位:北京大学生命科学学院,北京 100871
关键词:乳酸脱氢酶同工酶;辅酶化;去辅酶化;缺氧
摘要 目的 研究生物缺氧应激反应调控模式 摘要 目的 研究生物缺氧应激反应调控模式——小白鼠轻度缺氧心肌乳酸脱氢酶谱变化特点。方法 以小白鼠心肌为材料,人工缺氧,乳酸脱氢酶酶活性特异染色。CS-910型双波长薄层层析扫描仪定量测定LDH(1~5)相对百分含量。 结果 轻度缺氧处理后小白鼠各组织的LDH同工酶相对百分酶活性向以H基为主的同工酶(LDH1、LDH2)方向移动,LDH1(H4)、LDH\-2(H\-3M)的相对百分酶活性升高,而除心肌外组织的LDH\-5(M\-4)相对百分酶活性显著降低,LDH4(HM3)与LDH5的相对百分酶活性也有所下降。人工轻度缺氧处理的心肌样品PAGE电泳后,在LDH同工酶酶谱上有规律的产生活性亚带,其规律是LDH1(0条),LDH2(0~1条),LDH3(0~2条),LDH4(1~3条),LDH5(2~4条),缺氧处理后的小白鼠心肌样品中加入适量的NAD+再走PAGE电泳,LDH2~LDH5 4种同工酶的活性酶谱上的活性亚带数减少或完全消失。结论 乳酸脱氢酶辅酶化与去辅酶化负反馈调控模式是小白鼠轻度缺氧应激反应机制之一。
, http://www.100md.com
中图号 Q554.1
乳酸脱氢酶同工酶(lactate dehydrogenase,EC1.1.1.27,LDH)是Markert等[1]于1959年发现的第一个同工酶,此后国内外学者对其结构、功能、调控在发育过程中及病理条件下的酶谱变化进行了大量的研究,取得了不少有意义的结果。1963年Fritz和Jacobson[2]用β-巯基乙醇还原辅酶化(LDH与NAD+结合)的LDH,在不同的还原程度下得到不同的亚带数,用3种方法证明了活性亚带的产生是去辅酶化(NAD+从LDH上解离下来)的结果。为此,本文对活性亚带的产生机制和生理意义进行深一步的研究。
1 材料和方法
材料 昆明种健康小白鼠10周龄,体重约27~28 g。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+,美国Sigma公司),丙烯酰胺(中国医药公司北京采购供应站),A.R.甲叉双丙烯酰胺(瑞士Fluka公司),甲硫吩嗪(Phenazine methosulfate,PMS,瑞士Fluka公司),氯化硝基四氮唑蓝(nitroblue tertrazolium chloride,NBT,上海前进农药试剂厂),国产A.R.垂直板电泳仪,直流稳压电源(300~600 V,50~100 mA),岛津CS-910型双波长薄层层析扫描仪(日本)。
, 百拇医药
方法
样品制备:每批挑选24只小白鼠,每只体重27~28 g左右,随机分成3组,每组8只,作如下处理:(1) 正常组,直接活体取新鲜组织;(2) 轻度缓慢缺氧组,缺氧处理不致死2.5 h(按文献[3]方法);(3) 轻度快速缺氧组,将小白鼠分3次置入2 000 ml的密闭的抽滤瓶中用水源减压泵去空气,内部气压42.67~50.70 kPa(320~380 mmHg,起始氧分压约9.8 kPa。随时间延长,氧分压不断降低)快速缺氧15~30 min(此时间系该实验条件下小鼠的平均抗缺氧时间)。小鼠不窒息死亡后,取血、腿肌、心脏、肝脏(各0.2 g),在10~15℃时用pH6.5的0.001 mol/L磷酸缓冲液洗净血污,将除血以外的组织剪成碎片,加入5倍于组织量的0.001 mol/L的磷酸缓冲液,用玻璃匀浆器匀浆5~10 min,再将各匀浆液及血清在高速离心机中离心15 min(104 r/min),分别取上清液备用。
样品处理:将上述样品进行聚丙烯酰胺凝胶电泳(polyacyl gel electrophoresis,PAGE)和LDH酶活性特异性染色(胶板等用量均按文献[4]方法)固定后,制成凝胶干板。自然风干,给胶板照相和扫描(用岛津CS-910薄层层析扫描仪在595 nm波长下对LDH1~LDH5区带进行扫描测定)。
, 百拇医药
2 结果
正常各组织LDH同工酶的相对百分酶活性分布有组织特异性,正常心肌以LDH3的相对百分酶活性最高,血、肝脏及腿肌中LDH5的相对百分酶活性最高。
轻度缓慢缺氧与轻度快速缺氧处理后,小白鼠各组织LDH同工酶相对百分酶活性发生显著变化(附表)。心肌LDH2相对百分酶活性最高,腿肌LDH4相对百分酶活性最高,各组织
附表 正常,轻度缓慢缺氧及轻度快速缺氧条件下LDH同工酶相对百分酶活性
Table Percentage activity patterns of LDH isozymes observed in normal condition,slight
, 百拇医药 slow hypoxia,and quick hypoxia
Specimen
Number
of sample
Condition
Relative percent activity of enzyme
LDH1
LDH2
LDH3
LDH4
, 百拇医药
LDH5
Heart
3×8
N
16.40±1.65
26.10±3.52
32.50±4.60
17.10±4.92
6.95±2.15
3×8
Ssh
20.30±2.80
, 百拇医药
36.20±6.26
20.70±5.20
15.60±4.52
7.16±2.48
3×8
Sqh
18.20±5.31
33.20±6.22
29.90±6.31
13.10±4.21
5.39±1.92
Blood
, 百拇医药
3×8
N
2.18±1.12
5.57±2.14
7.42±3.21
4.82±1.50
78.00±8.48
Ssh
2.19±0.23
23.50±5.75*
17.20±4.82*
, http://www.100md.com 5.06±2.52
51.30±7.18*
Sqh
2.42±1.20
26.40±4.72*
17.80±2.21*
5.53±0.85
47.7±5.23*
Liver
3×8
N
, 百拇医药
0
0
0
0
98.20±12.10
Sqh
1.32±0.754*
2.02±0.264*
3.48±1.20
14.40±0.58*
69.80±8.21*
, http://www.100md.com
Leg
3×8
N
2.76
±
0.164
5.54
±
3.99
8.64
±
4.86
15.40
, 百拇医药
±
7.97
67.70
±
16.90
Muscle
Ssh
14.40
±
1.22\+*
20.50
±
2.17
, 百拇医药
24.10
±
0.37\+*
26.60
±
1.89\+*
14.10
±
2.31\+*
N:normal condition;Ssh:slight slow hypoxia;Sqh:slight quick hypoxia; * P<0.05 compared with normal conditions
, 百拇医药
在缺氧情况下均有LDH1和LDH2相对百分酶活性升高,其中LDH2的相对百分酶活性显著升高(P<0.05)。除心肌以外,LDH5相对百分酶活性显著降低(P<0.05),LDH4相对百分酶活性也有所降低。即缺氧处理后小白鼠各组织的LDH同工酶相对百分酶活性向以H亚基为主的同工酶(LDH1,LDH2)方向偏移。
正常心肌匀浆液电泳并活性染色后出现5条LDH同工酶区带,从正极到负极依次为LDH1(H4)、LDH2(H3M)、LDH\-3(H\-2M\-2)、LDH4(H0M3)和LDH5(M4);而在缺氧处理组,LDH2~LDH5在原区带处产生不同数目的活性亚带(图1)。
, 百拇医药
在正常情况下只有部分LDH与NAD+结合。当活性染色时,不加入NAD+,则染色条带变浅(图2)。
在缺氧样品中加入NAD+,再活性染色,结果LDH活性亚带数减少或消失(图3)。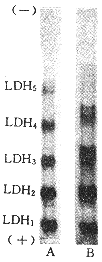
图 1 在正常和缺氧条件下小白鼠心肌样品的PAGE的LDH活性染色图谱
Fig 1 LDH activity specific staining map of mouse heart sample after PAGE A:under normal condition;B:under slight slow hypoxia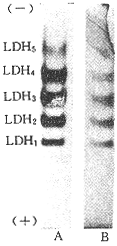
, 百拇医药
图 2 正常小白鼠心肌LDH活性染色图谱
Fig 2 LDH activity staining map of mouse heart under normal condition A:added NAD+(0.05 mol/L 10 μl); B:without NAD+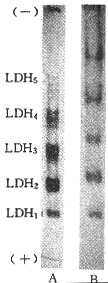
图 3 缺氧小白鼠心肌中加入NAD+和不加NAD+后的LDH活性染色图谱
Fig 3 LDH activity staining map of mouse heart under hypoxia A:added NAD+ (0.05 mol/L 10 μl);B:without NAD+
, 百拇医药
3 讨论
Fritz和Jacobson早在1963年就发现在LDH中加入β-巯基乙醇(β-mercaptoethanol),前者会产生活性亚带,并提出亚带的产生是NAD+从LDH同工酶的M亚基上解离下来的假说。本实验在人工缺氧处理小白鼠心肌LDH同工酶活性酶谱上发现了与Fritz和Jacobson实验中类似的现象。如果Fritz和Jacobson的假说正确,则在缺氧样品中加入适当浓度的NAD+,LDH同工酶活性谱上的亚带数应减少或消失。实验初步证实了这一想法,证明亚带的产生确为LDH去辅酶化的结果。
LDH在体内催化的反应如下式,并通过乳酸的代谢与能量代谢相联系。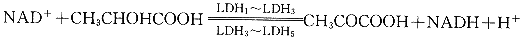 (1)
(1)
, 百拇医药
李云兰[3]曾对缺氧条件下小白鼠脑组织中乳酸、丙酮酸含量变化进行定量测定,在20~25 min内缺氧不致死条件下,脑组织中乳酸、丙酮酸含量升高,并且乳酸升高大于丙酮酸。本实验结果也证明了这一点。在缺氧条件下,上述反应向右移动,同工酶谱中催化乳酸氧化的LDH1和LDH2的相对百分酶活性升高,随着反应右移,细胞内的NAD+浓度降低,这时结合在LDH同工酶M亚基上的NAD+就会解离下来补充到细胞质中,维持细胞内NAD+与NADH的比值恒定[5],而保证细胞行使正常的生理功能。这一过程的可能生物学动态平衡方程式表示为: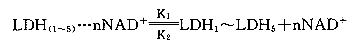 (n=0~4) (2)
(n=0~4) (2)
K1为LDH(1~5)与NAD+结合的复合体解离动态平衡常数,K2为LDH(1~5)与NAD+结合的动态平衡常数。K1》K2,K1和K2是只与温度、LDH(1~5)和NAD+结构有关的平衡常数。机体的这一调控机制是与NAD+和LDH(1~5)浓度直接有关的负反馈调控模型。可以说,机体细胞这一辅酶化与去辅酶化作用 是生命活动的红绿灯。
, 百拇医药
另外,平衡式(1)LDH(1~5)5种同工酶对反应式中四种底物的亲和力不同,亲和力最大的酶底物分别为LDH1-乳酸[6]、LDH2-NAD+、LDH4-NADH、LDH5-丙酮酸[6]、LDH3-四种底物。这一结果与文献[7]吻合。可见LDH1~LDH3催化乳酸氧化为丙酮酸,LDH3~LDH5催化丙酮酸还原为乳酸,5种同工酶催化作用有特异性,可部分解释LDH存在5种同工酶之[6]。
*北京大学技物系
参 考 文 献
1 Market CL,Moller F.Forms of enzymes:tissue,ontogenetic and species specific patterns.Proc Natl Acad Sci USA,1959,28:753~764
, 百拇医药
2 Fritz PJ,Jacobson KB.Lactic dehydrogeneses:subfraction of isozymes.Science,1963,140:64~65
3 李云兰.缺氧条件下小白鼠脑组织中乳酸、丙酮酸含量的变化.北京大学学报(自然科学版),1987,(4):56~62
4 李建武,袁明秀,余瑞元,等.生物化学实验原理和方法.北京:北京大学出版社,1994.355~358
5 陈惠黎,李文杰.分子酶学.北京:人民卫生出版社,1983.382,412
6 Strryer L著.生物化学.唐有琪,张惠珠,吴相玉,等译.北京:北京大学出版社,1995.270~271
7 Wang XC,Jiang L,Zhou HM.Minimal functional unit of lactate dehydrogenases.J Prot Chem,1997,16(3):227~230
, http://www.100md.com
Regulating Function of Enzymization and Deenzymization of the Lactate Dehydrogenase Isozymes in the Mouse Tissues during Hypoxia
Yuan Mingxiu Shao Hongbing Geng Zhen Liu Jian Deng Aiping,et al
(College of Life Sciences,Peking University,Beijing 100871)
Objective Study the characterestics of changes of LDH enzyme map of mouse under slight hypoxia. Methods Treated mouse with artificial hypoxia,various tissue biopsies were made for the test of LDH enzymatic activity by specific staining technical LDH(1-5)relative percent enzymatic activity were measured with CS-910 dual-wavelength thin-layer chromatography scanner. Results The relative percent enzymatic activity of LDH isozymes of various tissues after slight hypoxia shift to the isozymes LDH1 and LDH2,whose principal subunits are H subunits,and the relative percent enzymatic activity of LDH1 (H4),LDH2-(H3M) increased(the relative percent enzymatic activity of LDH2 increased markedly,P<0.05),while LDH (M4) in various tissues decreased prominently except the cardiac muscle,and that of LDH4(HM3) decreased as well.After the PAGE of the hypoxia treated cardiac muscle specimen was made,activity subbands originated regularly in the isozyme pattern of LDH,with the regularity of LDH1(0 subband),LDH2(0~1 subbands),LDH3(0~2 subbands),LDH4(1~3 subbands),LDH5(2~4 subbands).After adding appropriate amount of NAD+ to mouse cardiac muscle specimen with hypoxia,PAGE showed the numbers of subbands of four kinds of isozymes (LDH2~LDH5)decreased even totally disappeared in the isozyme pattern. Conclusions The negative feedback regulation of enzymization and deenzymization of LDH isozymes is one of mouse stress responses to slight hypoxia.
Key words lactate dehydrogenase isozymes;enzymization; deenzymization;hypoxia
(1997-11-20 收稿), 百拇医药(袁明秀 邵宏兵 耿 震 刘 建 邓爱平 金浩方*)
单位:北京大学生命科学学院,北京 100871
关键词:乳酸脱氢酶同工酶;辅酶化;去辅酶化;缺氧
摘要 目的 研究生物缺氧应激反应调控模式 摘要 目的 研究生物缺氧应激反应调控模式——小白鼠轻度缺氧心肌乳酸脱氢酶谱变化特点。方法 以小白鼠心肌为材料,人工缺氧,乳酸脱氢酶酶活性特异染色。CS-910型双波长薄层层析扫描仪定量测定LDH(1~5)相对百分含量。 结果 轻度缺氧处理后小白鼠各组织的LDH同工酶相对百分酶活性向以H基为主的同工酶(LDH1、LDH2)方向移动,LDH1(H4)、LDH\-2(H\-3M)的相对百分酶活性升高,而除心肌外组织的LDH\-5(M\-4)相对百分酶活性显著降低,LDH4(HM3)与LDH5的相对百分酶活性也有所下降。人工轻度缺氧处理的心肌样品PAGE电泳后,在LDH同工酶酶谱上有规律的产生活性亚带,其规律是LDH1(0条),LDH2(0~1条),LDH3(0~2条),LDH4(1~3条),LDH5(2~4条),缺氧处理后的小白鼠心肌样品中加入适量的NAD+再走PAGE电泳,LDH2~LDH5 4种同工酶的活性酶谱上的活性亚带数减少或完全消失。结论 乳酸脱氢酶辅酶化与去辅酶化负反馈调控模式是小白鼠轻度缺氧应激反应机制之一。
, http://www.100md.com
中图号 Q554.1
乳酸脱氢酶同工酶(lactate dehydrogenase,EC1.1.1.27,LDH)是Markert等[1]于1959年发现的第一个同工酶,此后国内外学者对其结构、功能、调控在发育过程中及病理条件下的酶谱变化进行了大量的研究,取得了不少有意义的结果。1963年Fritz和Jacobson[2]用β-巯基乙醇还原辅酶化(LDH与NAD+结合)的LDH,在不同的还原程度下得到不同的亚带数,用3种方法证明了活性亚带的产生是去辅酶化(NAD+从LDH上解离下来)的结果。为此,本文对活性亚带的产生机制和生理意义进行深一步的研究。
1 材料和方法
材料 昆明种健康小白鼠10周龄,体重约27~28 g。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+,美国Sigma公司),丙烯酰胺(中国医药公司北京采购供应站),A.R.甲叉双丙烯酰胺(瑞士Fluka公司),甲硫吩嗪(Phenazine methosulfate,PMS,瑞士Fluka公司),氯化硝基四氮唑蓝(nitroblue tertrazolium chloride,NBT,上海前进农药试剂厂),国产A.R.垂直板电泳仪,直流稳压电源(300~600 V,50~100 mA),岛津CS-910型双波长薄层层析扫描仪(日本)。
, 百拇医药
方法
样品制备:每批挑选24只小白鼠,每只体重27~28 g左右,随机分成3组,每组8只,作如下处理:(1) 正常组,直接活体取新鲜组织;(2) 轻度缓慢缺氧组,缺氧处理不致死2.5 h(按文献[3]方法);(3) 轻度快速缺氧组,将小白鼠分3次置入2 000 ml的密闭的抽滤瓶中用水源减压泵去空气,内部气压42.67~50.70 kPa(320~380 mmHg,起始氧分压约9.8 kPa。随时间延长,氧分压不断降低)快速缺氧15~30 min(此时间系该实验条件下小鼠的平均抗缺氧时间)。小鼠不窒息死亡后,取血、腿肌、心脏、肝脏(各0.2 g),在10~15℃时用pH6.5的0.001 mol/L磷酸缓冲液洗净血污,将除血以外的组织剪成碎片,加入5倍于组织量的0.001 mol/L的磷酸缓冲液,用玻璃匀浆器匀浆5~10 min,再将各匀浆液及血清在高速离心机中离心15 min(104 r/min),分别取上清液备用。
样品处理:将上述样品进行聚丙烯酰胺凝胶电泳(polyacyl gel electrophoresis,PAGE)和LDH酶活性特异性染色(胶板等用量均按文献[4]方法)固定后,制成凝胶干板。自然风干,给胶板照相和扫描(用岛津CS-910薄层层析扫描仪在595 nm波长下对LDH1~LDH5区带进行扫描测定)。
, 百拇医药
2 结果
正常各组织LDH同工酶的相对百分酶活性分布有组织特异性,正常心肌以LDH3的相对百分酶活性最高,血、肝脏及腿肌中LDH5的相对百分酶活性最高。
轻度缓慢缺氧与轻度快速缺氧处理后,小白鼠各组织LDH同工酶相对百分酶活性发生显著变化(附表)。心肌LDH2相对百分酶活性最高,腿肌LDH4相对百分酶活性最高,各组织
附表 正常,轻度缓慢缺氧及轻度快速缺氧条件下LDH同工酶相对百分酶活性
Table Percentage activity patterns of LDH isozymes observed in normal condition,slight
, 百拇医药 slow hypoxia,and quick hypoxia
Specimen
Number
of sample
Condition
Relative percent activity of enzyme
LDH1
LDH2
LDH3
LDH4
, 百拇医药
LDH5
Heart
3×8
N
16.40±1.65
26.10±3.52
32.50±4.60
17.10±4.92
6.95±2.15
3×8
Ssh
20.30±2.80
, 百拇医药
36.20±6.26
20.70±5.20
15.60±4.52
7.16±2.48
3×8
Sqh
18.20±5.31
33.20±6.22
29.90±6.31
13.10±4.21
5.39±1.92
Blood
, 百拇医药
3×8
N
2.18±1.12
5.57±2.14
7.42±3.21
4.82±1.50
78.00±8.48
Ssh
2.19±0.23
23.50±5.75*
17.20±4.82*
, http://www.100md.com 5.06±2.52
51.30±7.18*
Sqh
2.42±1.20
26.40±4.72*
17.80±2.21*
5.53±0.85
47.7±5.23*
Liver
3×8
N
, 百拇医药
0
0
0
0
98.20±12.10
Sqh
1.32±0.754*
2.02±0.264*
3.48±1.20
14.40±0.58*
69.80±8.21*
, http://www.100md.com
Leg
3×8
N
2.76
±
0.164
5.54
±
3.99
8.64
±
4.86
15.40
, 百拇医药
±
7.97
67.70
±
16.90
Muscle
Ssh
14.40
±
1.22\+*
20.50
±
2.17
, 百拇医药
24.10
±
0.37\+*
26.60
±
1.89\+*
14.10
±
2.31\+*
N:normal condition;Ssh:slight slow hypoxia;Sqh:slight quick hypoxia; * P<0.05 compared with normal conditions
, 百拇医药
在缺氧情况下均有LDH1和LDH2相对百分酶活性升高,其中LDH2的相对百分酶活性显著升高(P<0.05)。除心肌以外,LDH5相对百分酶活性显著降低(P<0.05),LDH4相对百分酶活性也有所降低。即缺氧处理后小白鼠各组织的LDH同工酶相对百分酶活性向以H亚基为主的同工酶(LDH1,LDH2)方向偏移。
正常心肌匀浆液电泳并活性染色后出现5条LDH同工酶区带,从正极到负极依次为LDH1(H4)、LDH2(H3M)、LDH\-3(H\-2M\-2)、LDH4(H0M3)和LDH5(M4);而在缺氧处理组,LDH2~LDH5在原区带处产生不同数目的活性亚带(图1)。
, 百拇医药
在正常情况下只有部分LDH与NAD+结合。当活性染色时,不加入NAD+,则染色条带变浅(图2)。
在缺氧样品中加入NAD+,再活性染色,结果LDH活性亚带数减少或消失(图3)。

图 1 在正常和缺氧条件下小白鼠心肌样品的PAGE的LDH活性染色图谱
Fig 1 LDH activity specific staining map of mouse heart sample after PAGE A:under normal condition;B:under slight slow hypoxia

, 百拇医药
图 2 正常小白鼠心肌LDH活性染色图谱
Fig 2 LDH activity staining map of mouse heart under normal condition A:added NAD+(0.05 mol/L 10 μl); B:without NAD+

图 3 缺氧小白鼠心肌中加入NAD+和不加NAD+后的LDH活性染色图谱
Fig 3 LDH activity staining map of mouse heart under hypoxia A:added NAD+ (0.05 mol/L 10 μl);B:without NAD+
, 百拇医药
3 讨论
Fritz和Jacobson早在1963年就发现在LDH中加入β-巯基乙醇(β-mercaptoethanol),前者会产生活性亚带,并提出亚带的产生是NAD+从LDH同工酶的M亚基上解离下来的假说。本实验在人工缺氧处理小白鼠心肌LDH同工酶活性酶谱上发现了与Fritz和Jacobson实验中类似的现象。如果Fritz和Jacobson的假说正确,则在缺氧样品中加入适当浓度的NAD+,LDH同工酶活性谱上的亚带数应减少或消失。实验初步证实了这一想法,证明亚带的产生确为LDH去辅酶化的结果。
LDH在体内催化的反应如下式,并通过乳酸的代谢与能量代谢相联系。
, 百拇医药
李云兰[3]曾对缺氧条件下小白鼠脑组织中乳酸、丙酮酸含量变化进行定量测定,在20~25 min内缺氧不致死条件下,脑组织中乳酸、丙酮酸含量升高,并且乳酸升高大于丙酮酸。本实验结果也证明了这一点。在缺氧条件下,上述反应向右移动,同工酶谱中催化乳酸氧化的LDH1和LDH2的相对百分酶活性升高,随着反应右移,细胞内的NAD+浓度降低,这时结合在LDH同工酶M亚基上的NAD+就会解离下来补充到细胞质中,维持细胞内NAD+与NADH的比值恒定[5],而保证细胞行使正常的生理功能。这一过程的可能生物学动态平衡方程式表示为:
K1为LDH(1~5)与NAD+结合的复合体解离动态平衡常数,K2为LDH(1~5)与NAD+结合的动态平衡常数。K1》K2,K1和K2是只与温度、LDH(1~5)和NAD+结构有关的平衡常数。机体的这一调控机制是与NAD+和LDH(1~5)浓度直接有关的负反馈调控模型。可以说,机体细胞这一辅酶化与去辅酶化作用 是生命活动的红绿灯。
, 百拇医药
另外,平衡式(1)LDH(1~5)5种同工酶对反应式中四种底物的亲和力不同,亲和力最大的酶底物分别为LDH1-乳酸[6]、LDH2-NAD+、LDH4-NADH、LDH5-丙酮酸[6]、LDH3-四种底物。这一结果与文献[7]吻合。可见LDH1~LDH3催化乳酸氧化为丙酮酸,LDH3~LDH5催化丙酮酸还原为乳酸,5种同工酶催化作用有特异性,可部分解释LDH存在5种同工酶之[6]。
*北京大学技物系
参 考 文 献
1 Market CL,Moller F.Forms of enzymes:tissue,ontogenetic and species specific patterns.Proc Natl Acad Sci USA,1959,28:753~764
, 百拇医药
2 Fritz PJ,Jacobson KB.Lactic dehydrogeneses:subfraction of isozymes.Science,1963,140:64~65
3 李云兰.缺氧条件下小白鼠脑组织中乳酸、丙酮酸含量的变化.北京大学学报(自然科学版),1987,(4):56~62
4 李建武,袁明秀,余瑞元,等.生物化学实验原理和方法.北京:北京大学出版社,1994.355~358
5 陈惠黎,李文杰.分子酶学.北京:人民卫生出版社,1983.382,412
6 Strryer L著.生物化学.唐有琪,张惠珠,吴相玉,等译.北京:北京大学出版社,1995.270~271
7 Wang XC,Jiang L,Zhou HM.Minimal functional unit of lactate dehydrogenases.J Prot Chem,1997,16(3):227~230
, http://www.100md.com
Regulating Function of Enzymization and Deenzymization of the Lactate Dehydrogenase Isozymes in the Mouse Tissues during Hypoxia
Yuan Mingxiu Shao Hongbing Geng Zhen Liu Jian Deng Aiping,et al
(College of Life Sciences,Peking University,Beijing 100871)
Objective Study the characterestics of changes of LDH enzyme map of mouse under slight hypoxia. Methods Treated mouse with artificial hypoxia,various tissue biopsies were made for the test of LDH enzymatic activity by specific staining technical LDH(1-5)relative percent enzymatic activity were measured with CS-910 dual-wavelength thin-layer chromatography scanner. Results The relative percent enzymatic activity of LDH isozymes of various tissues after slight hypoxia shift to the isozymes LDH1 and LDH2,whose principal subunits are H subunits,and the relative percent enzymatic activity of LDH1 (H4),LDH2-(H3M) increased(the relative percent enzymatic activity of LDH2 increased markedly,P<0.05),while LDH (M4) in various tissues decreased prominently except the cardiac muscle,and that of LDH4(HM3) decreased as well.After the PAGE of the hypoxia treated cardiac muscle specimen was made,activity subbands originated regularly in the isozyme pattern of LDH,with the regularity of LDH1(0 subband),LDH2(0~1 subbands),LDH3(0~2 subbands),LDH4(1~3 subbands),LDH5(2~4 subbands).After adding appropriate amount of NAD+ to mouse cardiac muscle specimen with hypoxia,PAGE showed the numbers of subbands of four kinds of isozymes (LDH2~LDH5)decreased even totally disappeared in the isozyme pattern. Conclusions The negative feedback regulation of enzymization and deenzymization of LDH isozymes is one of mouse stress responses to slight hypoxia.
Key words lactate dehydrogenase isozymes;enzymization; deenzymization;hypoxia
(1997-11-20 收稿), 百拇医药(袁明秀 邵宏兵 耿 震 刘 建 邓爱平 金浩方*)