异体深冷冻牙移植的免疫原性实验研究
作者:杨成 张汉东 郭远龙 韩俊 曾久荷 李水平
单位:同济医科大学附属协和医院口腔科,武汉 430022
关键词:牙移植,异体;免疫原性;深冷冻
同济医科大学学报990525 摘要 采用C57BL/6和Balb/c两种主要组织相容性复合体(MHC)完全不相同的近交系小鼠作为动物模型,对异体深冷冻(-196℃)牙的免疫原性进行研究。通过检测宿主抗体-补体介导的细胞杀伤(ACMC)、细胞介导的细胞杀伤(CMC)水平,发现异体深冷冻牙移植后,其ACMC和CMC反应水平与同基因型牙无显著性差异(P>0.05);这说明异体深冷冻牙的免疫原性很低,具有良好的组织相容性。
中图法分类号 R617, R392.1
Experimental Study on the Immunogenicity of Frozen Tooth Allografts in Mice
, 百拇医药
Yang Cheng, Zhang Handong, Guo Yuanlong et al
Department of Stomatology, Xiehe Hospital, Tongji Medical
University, Wuhan 430022
Abstract In-bred strains C57BL/6 and Balb/c mice with different major histocompatibility complex (MHC) served as experimental animal model. The immunogenicity of frozen (-196℃) tooth allografts was studied in vitro by detecting the response of antibody-complement mediated cytotoxity (ACMC) and cell mediated cytotoxity (CMC) of the host. It was found that there was no significant difference in both ACMC and CMC activities between the frozen (-196℃) tooth allotransplantation and isogenic tooth transplantation (P>0.05). The results indicate that the frozen (-196℃) tooth allografts are of weak immunogenicity and good histocompatibility.
, 百拇医药
Key words allograft, tooth; immunogenicity; frozen
牙移植是修复失牙、恢复咀嚼功能的有效方法之一。异体牙移植比自体牙移植供牙来源丰富;然而,异体牙具有免疫原性,它所引起的移植免疫反应是导致牙根吸收、影响移植牙长期存活的重要因素。为了设法消除或降低异体牙的免疫原性,国内、外学者曾采用不同方法处理异体供牙。但是,采用深冷冻(-196 ℃)方法处理异体牙,以及有关异体深冷冻牙的免疫原性研究报道较少。本实验旨在应用现代免疫学检测方法观察异体深冷冻牙移植的免疫原性[1~3]。
1 材料和方法
1.1 材料
①动物:采用8~10周龄的近交系小鼠,由中国科学院上海实验动物研究所提供。Balb/c小鼠作为异体供牙者,体重(16±2) g,雄性。C57BL/6小鼠作为异体牙接受者,体重(20±2) g,雄性。②靶细胞:采用SP-20骨髓瘤细胞;SP-20是Balb/c小鼠的骨髓瘤细胞。③生物和化学试剂:淋巴细胞分离液(600 ml/L Pecoll)、溴化二苯四偶氮盐(MTT)、二甲基亚砜(DMSO)、兔补体、蛋白水解酶。④RPMI-1640(GIBCO公司产),内含150 ml/L胎牛血清。
, http://www.100md.com
1.2 方法
1.2.1植牙材料的制备:断颈法处死Balb/c小鼠和C57BL/6小鼠。将小鼠头部置于700 ml/L酒精中浸泡数min后,用眼科剪剥离小鼠的上颌、下颌切牙(4颗/只);除尽牙齿周围的硬、软组织,并用3-0拨髓针将牙髓组织除去。尔后,用生理盐水漂洗10次。再用蛋白水解酶溶液浸泡20~30 min。然后将牙齿用生理盐水漂洗;再用2.5 g/L氯霉素生理盐水浸泡2~3 h。将上述处理的牙齿作为异体新鲜牙和同基因型牙进行移植。
将异体新鲜牙进行以下处理,制备成异体深冷冻牙:先置于液氮(-196℃)中冷冻4周,尔后放入-80℃冰箱中储存1个月。
1.2.2 移植技术:将C57BL/6小鼠随机分为3组,无菌条件下分别将异体新鲜牙、异体深冷冻牙和同基因型牙植入C57BL/6小鼠右颈部皮下。
, 百拇医药
1.2.3 效应细胞制备:无菌条件下取C57BL/6小鼠的脾脏,将脾脏在不锈钢网上磨碎,使淋巴细胞充分溢出,收集细胞悬液,用600 ml/L Pecoll分离淋巴细胞。
1.2.4 免疫学观察:(1)抗体-补体介导的细胞杀伤(ACMC)反应:①观察期为6周,每2周为一观察点。②每个观察点取8只C57BL/6小鼠,分离血清,制备抗体。③在96孔平底细胞培养板中,每孔加入50 μl(4×104)靶细胞悬液。④抗体稀释度1∶32,兔补体稀释度为1∶20,每个稀释度设3个平行孔。⑤每孔加入50 μl抗体,置37℃、50 ml/L CO2培养箱中孵育45 min。⑥然后加入50 μl兔补体,在相同条件下孵育1 h。⑦最后每孔加入MTT 20 μl,孵育4 h。⑧用RPMI-1640洗3遍,离心去上清后。加入DMSO 150 μl。⑨用酶联检测仪测定每孔光密度,取3孔平均计算细胞杀伤率(%)=(1-实验组光密度/对照组光密度)×100%。(2)细胞介导的细胞杀伤(CMC)反应:①观察期为6周,每2周为一观察点。②每个观察点取8只C57BL/6小鼠检测。③在96孔“U”型细胞培养板中,每孔先加入50 μl(4×104)靶细胞。④然后加入效应细胞100 μl,效∶靶比分别为100∶1。⑤每个效∶靶比设3个平行孔。⑥将培养板置于37 ℃、50 ml/L CO2培养箱内孵育18 h。⑦反应完毕,每孔加入MTT 20 μl,孵育4 h。⑧用RPMI-1640洗3遍,离心去上清后,加入DMSO 150 μl。⑨用酶联检测仪测定每孔光密度,取3孔平均,计算细胞杀伤率(%)=(1-实验组光密度/对照组光密度)×100%。
, 百拇医药
2 结果
2.1 抗体-补体介导的细胞杀伤作用比较
异体深冷冻牙的ACMC在移植术后各时间点上均与同基因型牙无显著性差异(P>0.05)。然而,异体新鲜牙则表现出较高的细胞杀伤水平;除术后第2周外,在术后第4、6周两个时间点上与异体深冷牙和同基因型牙均有显著性差异(P<0.01),见图1。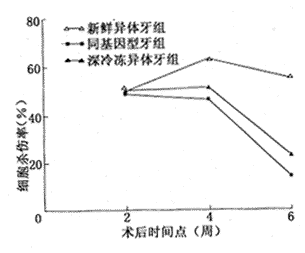
图1 抗体-补体介导的细胞杀伤作用之比较
2.2 细胞介导的细胞杀伤作用比较
在术后各时间点上,异体深冷冻牙的CMC与同基因型牙无显著性差异(P>0.05);然而,异体新鲜牙与异体深冷冻牙和同基因型牙则有显著性差异(P<0.01),见图2。
, http://www.100md.com
图2 细胞介导的细胞杀伤作用之比较
3 讨论
3.1 异体牙移植的免疫原性与免疫排斥反应
异体牙移植的免疫原性问题一直是有关医学专家研究的热点。在早期研究阶段,国外学者大多采用非特异性检测方法,主要有①宿主对来自同一供体的“二次皮肤移植”的加速排斥试验;②受植区域内淋巴结中免疫淋巴母细胞的产生。但是,以往的实验研究中有许多不一致的结果[4]。随着免疫学检测技术的发展,多种特异性免疫检测方法已用于研究异体器官和组织移植的免疫原性,具有代表性的方法主要有:ACMC和CMC[5]。
本实验采用C57BL/6和Balb/c两种主要组织相容性复合体(MHC)完全不相同的近交系小鼠作为动物模型,应用MTT法(四唑盐显色法)体外细胞毒性试验检测宿主的体液免疫反应(ACMC)和细胞免疫反应(CMC),以观察经深冷冻处理的异体牙硬组织的免疫原性。若移植牙具有抗原性,当Balb/c小鼠牙植入C57BL/6小鼠体内时, 则因Balb/c与C57BL/6的MHC不相同,故会产生免疫排斥反应;而C57BL/6小鼠间进行的同基因型牙移植则不会产生免疫排斥反应。同时SP-20作为靶细胞与Balb/c具有相同的MHC抗原,假如C57BL/6对Balb/c小鼠的牙齿产生了免疫排斥,其产生的特异性抗体和细胞毒性T细胞也同样会对SP-20产生特异性杀伤。
, 百拇医药
本实验采用的MTT比色法,有快速、定量、重复性好、适用面广等特点,受到国内外学者公认[6]。实验结果表明,异体牙硬组织具有免疫原性,能够引起宿主体内产生免疫排斥反应。
3.2 异体深冷冻牙移植的免疫原性与免疫排斥反应
异体牙移植的免疫排斥反应可划分为两个阶段:①与牙体软组织有关的急性移植免疫;②与牙体硬组织有关的慢性移植免疫[3]。牙根吸收是牙移植术后最常见的并发症,它关系到牙移植的成功和长期存留。Schwartz认为[7],移植免疫排斥反应是导致牙根吸收、影响异体牙移植远期存留时间的重要因素。
为了消除或降低异体供牙的免疫原性,延长其临床行使功能时间,国内、外学者曾采用不同方法处理异体牙,如氟化液浸泡、放射线照射等[4]。但是,应用深冷冻(-196℃)方法处理异体供牙的报道较少 。杨维东等关于异体深冷冻骨移植的实验表明,深冷冻处理可降低异体骨的免疫原性[5];然而,有关深冷冻异体牙移植免疫原性的研究尚未见报道。
, 百拇医药
本实验对不含牙髓和牙周膜的异体牙采用深冷冻方法处理,附加-80℃储存。经检测其ACMC和CMC反应,发现异体深冷冻牙与同基因型牙无显著性差异(P>0.05);而与异体新鲜牙有显著性差异(P<0.01)。实验证明,异体深冷冻牙免疫原性很低,具有良好的组织相容性。
作者简介:杨 成,男,1965年生,主治医师。
参考文献
1 东耀峻.骨和牙移植.见:戌诚兴编.生物科学基础——口腔医学基础理论.长沙:湖南教育出版社,1993.503~540
2 杨晓梅,黄培吉.异体牙移植牙根吸收的临床与动物实验研究.上海口腔医学,1995,4(2):82
3 Emmings F G. Transplantation Immunobiology. In: Jorgen S eds. Contemporary oral microbiolgoy and immunology. London: Mosby Year Book, 1992.570~618
, http://www.100md.com
4 Atkinson M E. Histopathological and immunological aspects of tooth transplantation. J Oral Pathol, 1978,7:43
5 杨维东,丁鸿才,金伯泉.异体深冷冻骨移植的免疫原性研究.中华口腔医学杂志,1993,28(2):97
6 吴军正,司徒镇强,刘 斌等.MTT试验及其在抗癌中药筛选中的应用.中华口腔医学杂志,1992,27(6):373
7 Schwarts O, Andreasen J O. Allotransplantation and autotransplantation of mature teeth in monkeys: The influence of endodontic treatment. J Oral Maxillofac Surg, 1988,46:672
收稿日期:1998-12-29, 百拇医药
单位:同济医科大学附属协和医院口腔科,武汉 430022
关键词:牙移植,异体;免疫原性;深冷冻
同济医科大学学报990525 摘要 采用C57BL/6和Balb/c两种主要组织相容性复合体(MHC)完全不相同的近交系小鼠作为动物模型,对异体深冷冻(-196℃)牙的免疫原性进行研究。通过检测宿主抗体-补体介导的细胞杀伤(ACMC)、细胞介导的细胞杀伤(CMC)水平,发现异体深冷冻牙移植后,其ACMC和CMC反应水平与同基因型牙无显著性差异(P>0.05);这说明异体深冷冻牙的免疫原性很低,具有良好的组织相容性。
中图法分类号 R617, R392.1
Experimental Study on the Immunogenicity of Frozen Tooth Allografts in Mice
, 百拇医药
Yang Cheng, Zhang Handong, Guo Yuanlong et al
Department of Stomatology, Xiehe Hospital, Tongji Medical
University, Wuhan 430022
Abstract In-bred strains C57BL/6 and Balb/c mice with different major histocompatibility complex (MHC) served as experimental animal model. The immunogenicity of frozen (-196℃) tooth allografts was studied in vitro by detecting the response of antibody-complement mediated cytotoxity (ACMC) and cell mediated cytotoxity (CMC) of the host. It was found that there was no significant difference in both ACMC and CMC activities between the frozen (-196℃) tooth allotransplantation and isogenic tooth transplantation (P>0.05). The results indicate that the frozen (-196℃) tooth allografts are of weak immunogenicity and good histocompatibility.
, 百拇医药
Key words allograft, tooth; immunogenicity; frozen
牙移植是修复失牙、恢复咀嚼功能的有效方法之一。异体牙移植比自体牙移植供牙来源丰富;然而,异体牙具有免疫原性,它所引起的移植免疫反应是导致牙根吸收、影响移植牙长期存活的重要因素。为了设法消除或降低异体牙的免疫原性,国内、外学者曾采用不同方法处理异体供牙。但是,采用深冷冻(-196 ℃)方法处理异体牙,以及有关异体深冷冻牙的免疫原性研究报道较少。本实验旨在应用现代免疫学检测方法观察异体深冷冻牙移植的免疫原性[1~3]。
1 材料和方法
1.1 材料
①动物:采用8~10周龄的近交系小鼠,由中国科学院上海实验动物研究所提供。Balb/c小鼠作为异体供牙者,体重(16±2) g,雄性。C57BL/6小鼠作为异体牙接受者,体重(20±2) g,雄性。②靶细胞:采用SP-20骨髓瘤细胞;SP-20是Balb/c小鼠的骨髓瘤细胞。③生物和化学试剂:淋巴细胞分离液(600 ml/L Pecoll)、溴化二苯四偶氮盐(MTT)、二甲基亚砜(DMSO)、兔补体、蛋白水解酶。④RPMI-1640(GIBCO公司产),内含150 ml/L胎牛血清。
, http://www.100md.com
1.2 方法
1.2.1植牙材料的制备:断颈法处死Balb/c小鼠和C57BL/6小鼠。将小鼠头部置于700 ml/L酒精中浸泡数min后,用眼科剪剥离小鼠的上颌、下颌切牙(4颗/只);除尽牙齿周围的硬、软组织,并用3-0拨髓针将牙髓组织除去。尔后,用生理盐水漂洗10次。再用蛋白水解酶溶液浸泡20~30 min。然后将牙齿用生理盐水漂洗;再用2.5 g/L氯霉素生理盐水浸泡2~3 h。将上述处理的牙齿作为异体新鲜牙和同基因型牙进行移植。
将异体新鲜牙进行以下处理,制备成异体深冷冻牙:先置于液氮(-196℃)中冷冻4周,尔后放入-80℃冰箱中储存1个月。
1.2.2 移植技术:将C57BL/6小鼠随机分为3组,无菌条件下分别将异体新鲜牙、异体深冷冻牙和同基因型牙植入C57BL/6小鼠右颈部皮下。
, 百拇医药
1.2.3 效应细胞制备:无菌条件下取C57BL/6小鼠的脾脏,将脾脏在不锈钢网上磨碎,使淋巴细胞充分溢出,收集细胞悬液,用600 ml/L Pecoll分离淋巴细胞。
1.2.4 免疫学观察:(1)抗体-补体介导的细胞杀伤(ACMC)反应:①观察期为6周,每2周为一观察点。②每个观察点取8只C57BL/6小鼠,分离血清,制备抗体。③在96孔平底细胞培养板中,每孔加入50 μl(4×104)靶细胞悬液。④抗体稀释度1∶32,兔补体稀释度为1∶20,每个稀释度设3个平行孔。⑤每孔加入50 μl抗体,置37℃、50 ml/L CO2培养箱中孵育45 min。⑥然后加入50 μl兔补体,在相同条件下孵育1 h。⑦最后每孔加入MTT 20 μl,孵育4 h。⑧用RPMI-1640洗3遍,离心去上清后。加入DMSO 150 μl。⑨用酶联检测仪测定每孔光密度,取3孔平均计算细胞杀伤率(%)=(1-实验组光密度/对照组光密度)×100%。(2)细胞介导的细胞杀伤(CMC)反应:①观察期为6周,每2周为一观察点。②每个观察点取8只C57BL/6小鼠检测。③在96孔“U”型细胞培养板中,每孔先加入50 μl(4×104)靶细胞。④然后加入效应细胞100 μl,效∶靶比分别为100∶1。⑤每个效∶靶比设3个平行孔。⑥将培养板置于37 ℃、50 ml/L CO2培养箱内孵育18 h。⑦反应完毕,每孔加入MTT 20 μl,孵育4 h。⑧用RPMI-1640洗3遍,离心去上清后,加入DMSO 150 μl。⑨用酶联检测仪测定每孔光密度,取3孔平均,计算细胞杀伤率(%)=(1-实验组光密度/对照组光密度)×100%。
, 百拇医药
2 结果
2.1 抗体-补体介导的细胞杀伤作用比较
异体深冷冻牙的ACMC在移植术后各时间点上均与同基因型牙无显著性差异(P>0.05)。然而,异体新鲜牙则表现出较高的细胞杀伤水平;除术后第2周外,在术后第4、6周两个时间点上与异体深冷牙和同基因型牙均有显著性差异(P<0.01),见图1。

图1 抗体-补体介导的细胞杀伤作用之比较
2.2 细胞介导的细胞杀伤作用比较
在术后各时间点上,异体深冷冻牙的CMC与同基因型牙无显著性差异(P>0.05);然而,异体新鲜牙与异体深冷冻牙和同基因型牙则有显著性差异(P<0.01),见图2。

, http://www.100md.com
图2 细胞介导的细胞杀伤作用之比较
3 讨论
3.1 异体牙移植的免疫原性与免疫排斥反应
异体牙移植的免疫原性问题一直是有关医学专家研究的热点。在早期研究阶段,国外学者大多采用非特异性检测方法,主要有①宿主对来自同一供体的“二次皮肤移植”的加速排斥试验;②受植区域内淋巴结中免疫淋巴母细胞的产生。但是,以往的实验研究中有许多不一致的结果[4]。随着免疫学检测技术的发展,多种特异性免疫检测方法已用于研究异体器官和组织移植的免疫原性,具有代表性的方法主要有:ACMC和CMC[5]。
本实验采用C57BL/6和Balb/c两种主要组织相容性复合体(MHC)完全不相同的近交系小鼠作为动物模型,应用MTT法(四唑盐显色法)体外细胞毒性试验检测宿主的体液免疫反应(ACMC)和细胞免疫反应(CMC),以观察经深冷冻处理的异体牙硬组织的免疫原性。若移植牙具有抗原性,当Balb/c小鼠牙植入C57BL/6小鼠体内时, 则因Balb/c与C57BL/6的MHC不相同,故会产生免疫排斥反应;而C57BL/6小鼠间进行的同基因型牙移植则不会产生免疫排斥反应。同时SP-20作为靶细胞与Balb/c具有相同的MHC抗原,假如C57BL/6对Balb/c小鼠的牙齿产生了免疫排斥,其产生的特异性抗体和细胞毒性T细胞也同样会对SP-20产生特异性杀伤。
, 百拇医药
本实验采用的MTT比色法,有快速、定量、重复性好、适用面广等特点,受到国内外学者公认[6]。实验结果表明,异体牙硬组织具有免疫原性,能够引起宿主体内产生免疫排斥反应。
3.2 异体深冷冻牙移植的免疫原性与免疫排斥反应
异体牙移植的免疫排斥反应可划分为两个阶段:①与牙体软组织有关的急性移植免疫;②与牙体硬组织有关的慢性移植免疫[3]。牙根吸收是牙移植术后最常见的并发症,它关系到牙移植的成功和长期存留。Schwartz认为[7],移植免疫排斥反应是导致牙根吸收、影响异体牙移植远期存留时间的重要因素。
为了消除或降低异体供牙的免疫原性,延长其临床行使功能时间,国内、外学者曾采用不同方法处理异体牙,如氟化液浸泡、放射线照射等[4]。但是,应用深冷冻(-196℃)方法处理异体供牙的报道较少 。杨维东等关于异体深冷冻骨移植的实验表明,深冷冻处理可降低异体骨的免疫原性[5];然而,有关深冷冻异体牙移植免疫原性的研究尚未见报道。
, 百拇医药
本实验对不含牙髓和牙周膜的异体牙采用深冷冻方法处理,附加-80℃储存。经检测其ACMC和CMC反应,发现异体深冷冻牙与同基因型牙无显著性差异(P>0.05);而与异体新鲜牙有显著性差异(P<0.01)。实验证明,异体深冷冻牙免疫原性很低,具有良好的组织相容性。
作者简介:杨 成,男,1965年生,主治医师。
参考文献
1 东耀峻.骨和牙移植.见:戌诚兴编.生物科学基础——口腔医学基础理论.长沙:湖南教育出版社,1993.503~540
2 杨晓梅,黄培吉.异体牙移植牙根吸收的临床与动物实验研究.上海口腔医学,1995,4(2):82
3 Emmings F G. Transplantation Immunobiology. In: Jorgen S eds. Contemporary oral microbiolgoy and immunology. London: Mosby Year Book, 1992.570~618
, http://www.100md.com
4 Atkinson M E. Histopathological and immunological aspects of tooth transplantation. J Oral Pathol, 1978,7:43
5 杨维东,丁鸿才,金伯泉.异体深冷冻骨移植的免疫原性研究.中华口腔医学杂志,1993,28(2):97
6 吴军正,司徒镇强,刘 斌等.MTT试验及其在抗癌中药筛选中的应用.中华口腔医学杂志,1992,27(6):373
7 Schwarts O, Andreasen J O. Allotransplantation and autotransplantation of mature teeth in monkeys: The influence of endodontic treatment. J Oral Maxillofac Surg, 1988,46:672
收稿日期:1998-12-29, 百拇医药