自制脂肪乳剂灌胃在家兔高脂血症模型制作中的应用
作者:马建林 毛焕元
单位:同济医科大学附属协和医院心血管疾病研究所,武汉 430022
关键词:高脂血症模型;脂肪乳;灌胃
同济医科大学学报990514 摘要 采用脂肪乳剂给予家兔连续灌胃2周,灌胃前后测定血清总胆固醇(TC)、甘油三酯(TG)、载脂蛋白A1(APOA1)、APOB、血浆血栓素B2(TXB2)、6-酮-前列腺素F1α(6-Keto-PGF1α)、内皮素(ET)、红细胞膜总胆固醇(M-TC)、膜流动性(M-Flu)、红细胞丙二醛(E-MDA)、红细胞超氧化物歧化酶(E-SOD)水平,实验结束时取主动脉作光镜观察。结果发现:灌胃后血清TC、TG、APOB、血浆TXB2、ET、红细胞M-Flu、E-MDA水平明显升高;血清APOA1、血浆6-Keto-PGF1α、E-SOD水平明显降低;而红细胞M-TC水平无明显变化;光镜观察主动脉胆固醇颗粒沉积。以上结果符合实验用动物高脂血症模型的特点,提示采用脂肪乳剂灌胃建立动物高脂血症模型的方法是可行的。
, 百拇医药
中图法分类号 R944.1
Application of Gastric Perfusion Intralipid in Developing
Models of Rabbit’s Hyperlipidemia
Ma Jianlin, Mao Huanyuan
Institute of Cardiovascular Diseases, Tongji Medical University, Wuhan 430022
Abstract The rabbits were subjected to gastric intralipid perfusion for consecutive 2 weeks. The levels of blood serum total cholesterol (TC), triglyceride (TG), apolipoprotein A1 (APOA1), APOB, blood plasma thromboxane B2(TXB2), 6-Keto-prostaglandin F1α(6-Keto-PGF1α), endotheline (ET), erythrocyte membrane cholesterol (M-Flu), erythrocyte malondialdehyde (E-MDA), erythrocyte superoxide dismutase (E-SOD) before and after gastric perfusion were determined. In the end of the experiment the aorta was removed to undergo the light microscopic examination. The results showed that after gastric infusion the levels of blood serum TC, TG, APOB, blood plasma TXB2, ET, erythrocyte M-Flu and E-MDA were significantly increased , those of blood serum APOA1, blood plasma 6-Keto-PGF1α, E-SOD were significantly decreased, but that of erythrocyte M-TC had no significantly changed. Light microscopic examination showed that there was depositing of granular cholesterol in the aorta. The findings were in accordance with the characteristics of experimental animal hyperlipidemia, suggesting that the development of hyperlipidemia models by gastric perfusion intralipid was available in rabbits.
, 百拇医药
Key words models of hyperlipidemia; intralipid; gastric perfusion
高脂血症被公认为是动脉粥样硬化(AS)的危险因子,但其致病机理非常复杂,有些方面还不十分清楚,为了阐明其致病机理,高脂血症动物模型的制作尤为重要,对此,人们作了大量的尝试,目前实验中通常应用的方法是采用高胆固醇饲料喂养动物制造高脂血症模型,但由于受到动物食性、剂量、周期等因素的影响,造成高脂血症模型质量不稳定,且复制时间较长(达3~4个月),本文采用一种新方法——脂肪乳剂灌胃复制家兔高脂血症模型,探讨该方法在制造高脂血症模型中的准确性。
1 材料与方法
1.1 材料
1.1.1 实验动物:普通日本雄性大耳白兔20只,体重2.38~2.96 kg,由同济医科大学实验动物学部提供。
, http://www.100md.com
1.1.2 主要试剂:胆固醇(上海市食品公司生产);胆酸钠(美国Serua公司产品);丙基硫氧嘧啶(德国Handberg公司产品);1,2-丙二醇(北京医药采购站产品);吐温-80(北京医药采购站产品);猪油(自制);酶法测定血清TC、TG及免疫浊度法测定血清APOA1、APOB药盒(宁波市慈城生化试剂厂);SOD采用邻苯三酚自氧化法测试药盒(海军工程学院抗衰老中心);TXB2、6-Keto-PGF1α及ET放免药盒(苏州医学院血栓室及解放军总医院血栓室)。
1.1.3 主要仪器:721分光光度计(上海第三分析仪器厂);DYY-Ⅲ 2型稳压稳流电泳仪(北京六一仪器厂);γ计数器。
1.2 方法
根据刘明等[1]方法略加修改,配制脂肪乳剂:将80 g猪油置于500 ml烧杯中并在电炉上加热融化,加入40 g胆固醇并使之溶化,再加入8 g胆酸钠和4 g丙基硫氧嘧啶片,充分搅匀,然后放入适量的蒸馏水及吐温-80、2-丙二醇各80 ml,不断搅匀,再加双蒸水至400 ml并充分混匀,即成100 g/L胆固醇、200 g/L猪油、20 g/L胆酸钠和10 g/L丙基硫氧嘧啶的脂肪乳剂,放入冰箱保存,用时需加热融化。
, http://www.100md.com
取上述脂肪乳剂按2 ml/(kg . d)。连续灌胃2周,灌胃前后从心脏采血6 ml(采血前禁饮食12 h),取其中3 ml用20 g/L EDTA-Na2抗凝(抗凝剂∶标本=1∶9),2500 r/min离心5 min,取血浆低温冰箱保存(先取少量血液测定Hb含量)。取部分红细胞测定:膜流动性(M-Flu),用PBS洗涤红血球2次配成4×107细胞/ml浓度的红细胞悬液,按1∶1与DPH(荧光探针)标记液混匀,于25 ℃保温30 min,离心弃去标记残液,用PBS洗涤细胞2次,再用PBS稀释成2 ml悬液,在25 ℃下采用荧光光度计分别测定与激发偏振光振动方向平行、垂直时荧光偏振强度,根据公式计算出M-Flu;E-MDA,参考Uchlyma等[2]方法提取MDA前质,再按钟福孙等[3]提供的硫代巴比妥酸比色法测定E-MDA含量;E-SOD采用邻苯三酚自氧化法测定。
将剩下的红细胞用生理盐水洗涤后,溶于0.025 nmol/L的CaCl2溶液中(体积比1∶1),于4 ℃置30 min至完全溶血,然后以1400 r/min离心10 min,去掉溶血液,沉淀物用pH值为7.4的0.01 mmol/L磷酸盐缓冲液反复洗涤,再按所取的细胞体积加入50 g/L氯化钠,先在超声波绞碎仪上超声匀浆,再用500 r/min的速度离心5 min,以上清液10 μl测定红细胞M-TC含量。取血浆放免法测定TXB2、6-Keto-PGF1α、ET含量。
, 百拇医药
另3 ml血直接离心测定血清TC、TG、APOA1、APOB,所有测定方法均根据药盒说明书进行。
灌胃2周后处死动物作肉眼及光镜观察。
1.3 统计处理
文中所有数据均采用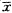 ±s表示,采用自身配对t检验方法进行统计。
±s表示,采用自身配对t检验方法进行统计。
2 结果
灌胃前后测定的血清TC、TG、APOA1、APOB、血浆TXB2、6-Keto-PGF1α、ET、红细胞M-Flu、M-TC、E-MDA、E-SOD水平的比较。结果见附表。
灌胃2周后取主动脉作肉眼及光镜检查,肉眼观察未见明显动脉脂肪样硬化斑块,而光镜下发现有胆固醇颗粒沉积。
, http://www.100md.com
附表 灌胃前后测定的家兔各项指标比较
(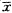 ±s,n=20)
±s,n=20)
指 标
灌胃前
灌胃后
血清TC(g/L)
0.675±0.143
10.196±1.806**
血清TG(g/L)
1.018±0.286
, http://www.100md.com
3.867±0.794**
血清APOA1(g/L)
0.364±0.086
0.219±0.068*
血清APOB(g/L)
0.199±0.038
0.369±0.072**
血清TXB2(ng/L)
158.7±76.3
460.9±128.9**
, http://www.100md.com
血浆6-Keto-PGF1α
(ng/L)
58.2±22.3
36.8±19.3**
血浆ET(ng/L)
102.4±23.5
149.7±38.8**
M-Flu
2.70±0.49
2.36±0.42**
, 百拇医药 M-TC
(μmol/g.Hb)
8.10±2.46
9.31±3.30**
E-MDA
(nmol/g.Hb)
14.3±1.9
17.6±2.6**
E-SOD(U/g.Hb)
1712.3±189.4
1560.8±136.8*
, http://www.100md.com
与灌胃前比较 *P<0.05,**P<0.01
3 讨论
目前动物实验中常采用高脂饲料喂养制备高脂血症动物模型,该方法对于大、小鼠杂食性动物的制备效果尚可,但由于鼠类采血量极少,不能同时检测数个相关的指标,因而限制了其在制备高脂血症模型中的应用 ;采用高脂饲料喂养制备家兔高脂血症模型可以避免这方面缺陷,可以从心脏一次采血达10 ml,能够同时测定数个相关指标,但由于动物食性等因素造成剂量不易准确投喂,并且喂养周期较长等,给实验带来一定的困难。本实验采用脂肪乳剂给家兔灌胃,避免了上述方法的一系列并发症,所需的剂量可以准确无误地灌入,并且造模周期较短,能够在2周内迅速地制造出高脂血症动物模型,从本文实验结果可以看出,采用该方法给家兔灌胃2周,其中血清TC、TG、APOB及血浆TXB2、ET水平明显升高,而血清APOA1及血浆6-Keto-PGF1α水平明显降低,完全符合实验所需的动物高脂血症模型特点,但其变化的具体机理尚未完全阐明,Goldstein[4]研究发现,家兔肝脏APOB受体可以清除血浆中2/3的低密度脂蛋白,饲喂高脂或高胆固醇饲料后血中胆固醇在肝细胞内堆积,反馈性地抑制APOB受体合成,导致低密度脂蛋白清除发生障碍,从而致血中TC及APOB水平升高,胆固醇在动脉壁沉积。
, 百拇医药
目前多数实验研究表明高脂饲料喂养家兔所致的体内脂质过氧化损伤是导致血管内皮细胞(VEC)损伤,促进中性粒细胞粘附于VEC,加强氧化修饰低密度脂蛋白[5],最终形成AS的重要病因[6],本文结果也充分说明,采用高脂肪乳灌胃可使家兔红细胞SOD活性明显降低,脂质过氧化代谢产物-丙二醛水平明显升高,表明家兔体内存在明显的脂质过氧化损伤,并且造成VEC及血小板功能异常,表现为浆ET、TXB2水平升高而6-Keto-PGF1α水平明显降低。此外,本文结果还发现,采用脂肪乳剂灌胃可以诱导家兔红细胞膜流动性降低,其原因也可能与脂质过氧化损伤有关:动物体内自由基产生增加,同时又得不到及时清除[7],造成其蓄积并氧化了红细胞膜中的不饱和脂肪酸,导致膜中的不饱和脂肪酸与饱和脂肪酸比例失调,但目前无充足的证据说明红细胞膜流动性降低是由于胆固醇在红细胞膜中沉积所造成的。
本实验结果还证实,尽管采用脂肪乳灌胃2周后肉眼未发现明显的脂肪样硬化斑块,但光镜下已显示出胆固醇颗粒在主动脉壁中沉积,从而说明采用该方法制造高脂血症动物模型简单可行,至于动脉粥样硬化斑块形成所需的具体时间有待进一步研究证实。
, 百拇医药
作者简介:马建林,男,1959年生,副主任医师,医学博士。现址:海南省人民医院心内科,海口 570311
参考文献
1 刘明,王强,李家明等.一种简便实用的大鼠高脂血症模型.中国药理学报,1989,5(2):119
2 Uchlyma M, Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbiture acid test. Anal Biochem, 1978,86:271
3 钟福孙,胡文尧,冯 驰等.硫代巴比士酸色法测定血清过氧化脂质的方法探讨.临床检验杂志,1986,4(3):129
4 Goldstein M. Progress in understanding the LDL receptor and HMG-CoA reductase, two memberane proteins that regulate the plasma cholesterol. J Lipid Res, 1984,25:1450
, http://www.100md.com
5 Bui M N, SacR M N, Moutsatsos G et al. Autoantibody titers to oxidized low density lipoprotein in patients with coronary atherosclerosis. Am Heart J, 1996,131:663
6 Gadipathi N R, BerR B C. Active oxygen species stimulate vascular smooth muscle cell growth and proto-oncogene expression. Circ Res, 1992,70:593
7 Peng S K, Phillip G A, Xia G I et al. Transport of cholesterol autoxidation products in rabbit lipoproteins. Atherosclerosis, 1987,64:1
收稿日期:1997-11-10, 百拇医药
单位:同济医科大学附属协和医院心血管疾病研究所,武汉 430022
关键词:高脂血症模型;脂肪乳;灌胃
同济医科大学学报990514 摘要 采用脂肪乳剂给予家兔连续灌胃2周,灌胃前后测定血清总胆固醇(TC)、甘油三酯(TG)、载脂蛋白A1(APOA1)、APOB、血浆血栓素B2(TXB2)、6-酮-前列腺素F1α(6-Keto-PGF1α)、内皮素(ET)、红细胞膜总胆固醇(M-TC)、膜流动性(M-Flu)、红细胞丙二醛(E-MDA)、红细胞超氧化物歧化酶(E-SOD)水平,实验结束时取主动脉作光镜观察。结果发现:灌胃后血清TC、TG、APOB、血浆TXB2、ET、红细胞M-Flu、E-MDA水平明显升高;血清APOA1、血浆6-Keto-PGF1α、E-SOD水平明显降低;而红细胞M-TC水平无明显变化;光镜观察主动脉胆固醇颗粒沉积。以上结果符合实验用动物高脂血症模型的特点,提示采用脂肪乳剂灌胃建立动物高脂血症模型的方法是可行的。
, 百拇医药
中图法分类号 R944.1
Application of Gastric Perfusion Intralipid in Developing
Models of Rabbit’s Hyperlipidemia
Ma Jianlin, Mao Huanyuan
Institute of Cardiovascular Diseases, Tongji Medical University, Wuhan 430022
Abstract The rabbits were subjected to gastric intralipid perfusion for consecutive 2 weeks. The levels of blood serum total cholesterol (TC), triglyceride (TG), apolipoprotein A1 (APOA1), APOB, blood plasma thromboxane B2(TXB2), 6-Keto-prostaglandin F1α(6-Keto-PGF1α), endotheline (ET), erythrocyte membrane cholesterol (M-Flu), erythrocyte malondialdehyde (E-MDA), erythrocyte superoxide dismutase (E-SOD) before and after gastric perfusion were determined. In the end of the experiment the aorta was removed to undergo the light microscopic examination. The results showed that after gastric infusion the levels of blood serum TC, TG, APOB, blood plasma TXB2, ET, erythrocyte M-Flu and E-MDA were significantly increased , those of blood serum APOA1, blood plasma 6-Keto-PGF1α, E-SOD were significantly decreased, but that of erythrocyte M-TC had no significantly changed. Light microscopic examination showed that there was depositing of granular cholesterol in the aorta. The findings were in accordance with the characteristics of experimental animal hyperlipidemia, suggesting that the development of hyperlipidemia models by gastric perfusion intralipid was available in rabbits.
, 百拇医药
Key words models of hyperlipidemia; intralipid; gastric perfusion
高脂血症被公认为是动脉粥样硬化(AS)的危险因子,但其致病机理非常复杂,有些方面还不十分清楚,为了阐明其致病机理,高脂血症动物模型的制作尤为重要,对此,人们作了大量的尝试,目前实验中通常应用的方法是采用高胆固醇饲料喂养动物制造高脂血症模型,但由于受到动物食性、剂量、周期等因素的影响,造成高脂血症模型质量不稳定,且复制时间较长(达3~4个月),本文采用一种新方法——脂肪乳剂灌胃复制家兔高脂血症模型,探讨该方法在制造高脂血症模型中的准确性。
1 材料与方法
1.1 材料
1.1.1 实验动物:普通日本雄性大耳白兔20只,体重2.38~2.96 kg,由同济医科大学实验动物学部提供。
, http://www.100md.com
1.1.2 主要试剂:胆固醇(上海市食品公司生产);胆酸钠(美国Serua公司产品);丙基硫氧嘧啶(德国Handberg公司产品);1,2-丙二醇(北京医药采购站产品);吐温-80(北京医药采购站产品);猪油(自制);酶法测定血清TC、TG及免疫浊度法测定血清APOA1、APOB药盒(宁波市慈城生化试剂厂);SOD采用邻苯三酚自氧化法测试药盒(海军工程学院抗衰老中心);TXB2、6-Keto-PGF1α及ET放免药盒(苏州医学院血栓室及解放军总医院血栓室)。
1.1.3 主要仪器:721分光光度计(上海第三分析仪器厂);DYY-Ⅲ 2型稳压稳流电泳仪(北京六一仪器厂);γ计数器。
1.2 方法
根据刘明等[1]方法略加修改,配制脂肪乳剂:将80 g猪油置于500 ml烧杯中并在电炉上加热融化,加入40 g胆固醇并使之溶化,再加入8 g胆酸钠和4 g丙基硫氧嘧啶片,充分搅匀,然后放入适量的蒸馏水及吐温-80、2-丙二醇各80 ml,不断搅匀,再加双蒸水至400 ml并充分混匀,即成100 g/L胆固醇、200 g/L猪油、20 g/L胆酸钠和10 g/L丙基硫氧嘧啶的脂肪乳剂,放入冰箱保存,用时需加热融化。
, http://www.100md.com
取上述脂肪乳剂按2 ml/(kg . d)。连续灌胃2周,灌胃前后从心脏采血6 ml(采血前禁饮食12 h),取其中3 ml用20 g/L EDTA-Na2抗凝(抗凝剂∶标本=1∶9),2500 r/min离心5 min,取血浆低温冰箱保存(先取少量血液测定Hb含量)。取部分红细胞测定:膜流动性(M-Flu),用PBS洗涤红血球2次配成4×107细胞/ml浓度的红细胞悬液,按1∶1与DPH(荧光探针)标记液混匀,于25 ℃保温30 min,离心弃去标记残液,用PBS洗涤细胞2次,再用PBS稀释成2 ml悬液,在25 ℃下采用荧光光度计分别测定与激发偏振光振动方向平行、垂直时荧光偏振强度,根据公式计算出M-Flu;E-MDA,参考Uchlyma等[2]方法提取MDA前质,再按钟福孙等[3]提供的硫代巴比妥酸比色法测定E-MDA含量;E-SOD采用邻苯三酚自氧化法测定。
将剩下的红细胞用生理盐水洗涤后,溶于0.025 nmol/L的CaCl2溶液中(体积比1∶1),于4 ℃置30 min至完全溶血,然后以1400 r/min离心10 min,去掉溶血液,沉淀物用pH值为7.4的0.01 mmol/L磷酸盐缓冲液反复洗涤,再按所取的细胞体积加入50 g/L氯化钠,先在超声波绞碎仪上超声匀浆,再用500 r/min的速度离心5 min,以上清液10 μl测定红细胞M-TC含量。取血浆放免法测定TXB2、6-Keto-PGF1α、ET含量。
, 百拇医药
另3 ml血直接离心测定血清TC、TG、APOA1、APOB,所有测定方法均根据药盒说明书进行。
灌胃2周后处死动物作肉眼及光镜观察。
1.3 统计处理
文中所有数据均采用
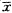 ±s表示,采用自身配对t检验方法进行统计。
±s表示,采用自身配对t检验方法进行统计。2 结果
灌胃前后测定的血清TC、TG、APOA1、APOB、血浆TXB2、6-Keto-PGF1α、ET、红细胞M-Flu、M-TC、E-MDA、E-SOD水平的比较。结果见附表。
灌胃2周后取主动脉作肉眼及光镜检查,肉眼观察未见明显动脉脂肪样硬化斑块,而光镜下发现有胆固醇颗粒沉积。
, http://www.100md.com
附表 灌胃前后测定的家兔各项指标比较
(
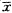 ±s,n=20)
±s,n=20)指 标
灌胃前
灌胃后
血清TC(g/L)
0.675±0.143
10.196±1.806**
血清TG(g/L)
1.018±0.286
, http://www.100md.com
3.867±0.794**
血清APOA1(g/L)
0.364±0.086
0.219±0.068*
血清APOB(g/L)
0.199±0.038
0.369±0.072**
血清TXB2(ng/L)
158.7±76.3
460.9±128.9**
, http://www.100md.com
血浆6-Keto-PGF1α
(ng/L)
58.2±22.3
36.8±19.3**
血浆ET(ng/L)
102.4±23.5
149.7±38.8**
M-Flu
2.70±0.49
2.36±0.42**
, 百拇医药 M-TC
(μmol/g.Hb)
8.10±2.46
9.31±3.30**
E-MDA
(nmol/g.Hb)
14.3±1.9
17.6±2.6**
E-SOD(U/g.Hb)
1712.3±189.4
1560.8±136.8*
, http://www.100md.com
与灌胃前比较 *P<0.05,**P<0.01
3 讨论
目前动物实验中常采用高脂饲料喂养制备高脂血症动物模型,该方法对于大、小鼠杂食性动物的制备效果尚可,但由于鼠类采血量极少,不能同时检测数个相关的指标,因而限制了其在制备高脂血症模型中的应用 ;采用高脂饲料喂养制备家兔高脂血症模型可以避免这方面缺陷,可以从心脏一次采血达10 ml,能够同时测定数个相关指标,但由于动物食性等因素造成剂量不易准确投喂,并且喂养周期较长等,给实验带来一定的困难。本实验采用脂肪乳剂给家兔灌胃,避免了上述方法的一系列并发症,所需的剂量可以准确无误地灌入,并且造模周期较短,能够在2周内迅速地制造出高脂血症动物模型,从本文实验结果可以看出,采用该方法给家兔灌胃2周,其中血清TC、TG、APOB及血浆TXB2、ET水平明显升高,而血清APOA1及血浆6-Keto-PGF1α水平明显降低,完全符合实验所需的动物高脂血症模型特点,但其变化的具体机理尚未完全阐明,Goldstein[4]研究发现,家兔肝脏APOB受体可以清除血浆中2/3的低密度脂蛋白,饲喂高脂或高胆固醇饲料后血中胆固醇在肝细胞内堆积,反馈性地抑制APOB受体合成,导致低密度脂蛋白清除发生障碍,从而致血中TC及APOB水平升高,胆固醇在动脉壁沉积。
, 百拇医药
目前多数实验研究表明高脂饲料喂养家兔所致的体内脂质过氧化损伤是导致血管内皮细胞(VEC)损伤,促进中性粒细胞粘附于VEC,加强氧化修饰低密度脂蛋白[5],最终形成AS的重要病因[6],本文结果也充分说明,采用高脂肪乳灌胃可使家兔红细胞SOD活性明显降低,脂质过氧化代谢产物-丙二醛水平明显升高,表明家兔体内存在明显的脂质过氧化损伤,并且造成VEC及血小板功能异常,表现为浆ET、TXB2水平升高而6-Keto-PGF1α水平明显降低。此外,本文结果还发现,采用脂肪乳剂灌胃可以诱导家兔红细胞膜流动性降低,其原因也可能与脂质过氧化损伤有关:动物体内自由基产生增加,同时又得不到及时清除[7],造成其蓄积并氧化了红细胞膜中的不饱和脂肪酸,导致膜中的不饱和脂肪酸与饱和脂肪酸比例失调,但目前无充足的证据说明红细胞膜流动性降低是由于胆固醇在红细胞膜中沉积所造成的。
本实验结果还证实,尽管采用脂肪乳灌胃2周后肉眼未发现明显的脂肪样硬化斑块,但光镜下已显示出胆固醇颗粒在主动脉壁中沉积,从而说明采用该方法制造高脂血症动物模型简单可行,至于动脉粥样硬化斑块形成所需的具体时间有待进一步研究证实。
, 百拇医药
作者简介:马建林,男,1959年生,副主任医师,医学博士。现址:海南省人民医院心内科,海口 570311
参考文献
1 刘明,王强,李家明等.一种简便实用的大鼠高脂血症模型.中国药理学报,1989,5(2):119
2 Uchlyma M, Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbiture acid test. Anal Biochem, 1978,86:271
3 钟福孙,胡文尧,冯 驰等.硫代巴比士酸色法测定血清过氧化脂质的方法探讨.临床检验杂志,1986,4(3):129
4 Goldstein M. Progress in understanding the LDL receptor and HMG-CoA reductase, two memberane proteins that regulate the plasma cholesterol. J Lipid Res, 1984,25:1450
, http://www.100md.com
5 Bui M N, SacR M N, Moutsatsos G et al. Autoantibody titers to oxidized low density lipoprotein in patients with coronary atherosclerosis. Am Heart J, 1996,131:663
6 Gadipathi N R, BerR B C. Active oxygen species stimulate vascular smooth muscle cell growth and proto-oncogene expression. Circ Res, 1992,70:593
7 Peng S K, Phillip G A, Xia G I et al. Transport of cholesterol autoxidation products in rabbit lipoproteins. Atherosclerosis, 1987,64:1
收稿日期:1997-11-10, 百拇医药