肺血管周细胞增生分化与慢性肺动脉高压发生的关系*
作者:熊密 张燕 车东媛 袁永辉 刘绍春
单位:同济医科大学基础医学院病理学教研室,武汉 430030
关键词:低氧;周细胞;肺动脉高压
同济医科大学学报990502 摘要 为证实周细胞增生和分化与慢性肺动脉高压的关系,用MTT法、流式细胞术及免疫组化分别检测低氧对培养的大鼠肺血管周细胞的增生及活性、细胞周期和增殖细胞核抗原(PCNA)表达的影响。同时复制慢性低氧性肺动脉高压大鼠模型,定量分析腺泡内肺动脉(IAPA)三种类型血管的构成比及其结构改变。结果表明,低氧组周细胞的MTT和PCNA吸光度均较常氧组高。细胞周期中,处于G0、G1期的细胞百分值,低氧组较常氧组低,但S期细胞百分值升高。低氧组大鼠IAPA内环肌型动脉构成比和α-SM-actin抗原表达的吸光度较常氧组者高。结论:低氧促进肺血管周细胞的增生、分化可能是无肌型肺动脉肌化的重要细胞来源和慢性肺动脉高压发生的重要结构基础。
, 百拇医药
中图法分类号 R845.2, R329.2, R322.1
The Relationship between Proliferation and Differentiation of Lung
Vascular Pericytes and the Development of Chronic Pulmonary
Hypertension
Xiong Mi, Zhang Yan, Che Dongyuan et al
Department of Pathology, School of Basic Medical Sciences,Tongji Medical University, Wuhan 430030
, 百拇医药
Abstract To identify the relationship between proliferation and differentiation of pericytes and the development of chronic pulmonary hypertension, the MTT colorimetric assay, flow cytometry and immunohistochemistry were used to detect the effect of hypoxia on proliferation, activity, cell cycle and proliferating cell nuclear antigen (PCNA) expression of the rat lung vascular pericytes respectively. The animal model of chronic hypoxic pulmonary hypertension was replicated and the changes of component ratio of three kinds of vessels in intraacinar pulmonary arteries (IAPA) and their structures were quantitatively analyzed. The absorbance of MTT and PCNA in hypoxia group were higher than in normal group. For the cell cycle, the percentage of G0 and G1 phase cells in hypoxia group were lower than in normal group, whereas the percentage of S phase cells higher. The component ratio of circular muscular arterioles of IAPA and the absorbance of α-SM-actin antigen expression in hypoxia group were higher than in normal group. In conclusion, proliferation and differentiation of the lung vascular pericytes due to hypoxia may be an important cell source for the muscularization of non-muscular pulmonary arterioles and structural basis for the development of chronic pulmonary hypertension.
, http://www.100md.com
Key words hypoxia; pericytes; hypertension, pulmonary
无肌型肺动脉的肌化可能是肺循环阻力增大、肺动脉压升高的关键[1,2]。而无肌型肺动脉肌化的细胞来源是研究防治肺动脉高压的重要课题之一。本文旨在通过大鼠肺血管周细胞培养和复制慢性低氧性肺动脉高压大鼠动物模型,观察低氧对肺血管周细胞生物学特性的影响及周细胞在慢性低氧性肺动脉高压,特别是无肌型肺动脉肌化发生中的作用。
1 材料与方法
1.1 肺动脉内皮细胞条件培养液的制备和肺血管周细胞的培养及检测
1.1.1 牛肺动脉内皮细胞条件培养液的制备:无菌条件下分离牛心包内肺动脉干,参照本室建立的猪肺动脉内皮细胞胰蛋白酶消化法[3], 收集肺动脉内皮细胞(PAECs)进行培养,根据细胞呈单层铺路石状排列,Ⅷ因子内皮细胞相关抗原阳性表达鉴定为内皮细胞。取第2~4代融合的PAECs,换用无血清的培养液(SFM)后,分别在常氧(21% O2)或低氧(3%~5% O2)环境下继续培养24 h,收集上清液,离心,微孔滤膜过滤后即为常氧的内皮细胞条件培养液(NECCM)和低氧的内皮细胞条件培养液(HECCM)。
, 百拇医药
1.1.2 大鼠肺血管周细胞的培养及实验分组:成年清洁级SD大鼠(同济医科大学实验动物学部提供),颈椎拉脱法处死,依照我们建立的大鼠肺血管周细胞的培养方法[4]进行培养。传到第四、五代。根据培养的细胞体积较大,伸出大量突起,可长成多层,免疫组化染色α-SM-actin及CD34、S-100(Dako公司)蛋白表达阳性鉴定为周细胞。实验分组:取第5~7代肺血管周细胞,待细胞生长达70%~80%融合时,换用无血清培养液(SFM),常氧37℃,培养24 h,分为对照(N)、低氧(H)、常氧内皮细胞条件培养液(NECCM)和低氧内皮细胞条件培养液(HECCM)组(表1),各组细胞分别换以相应培养液,继续培养24 h,按检测指标的不同需要分别进行样本的固定及保存。
表1 肺血管周细胞的实验分组
组别
培养液
, 百拇医药
培养环境(含氧量,%)
N
SFM
21
H
SFM
3~5
NECCM
NECCM
21
HECCM
HECCM
21
, http://www.100md.com
1.1.3 MTT比色分析法:实验组周细胞以密度为105/ml接种于96孔培养板内,每孔200 μl,每组6个样本,培养24 h,弃去原培养液,平衡盐溶液洗涤,每孔加110 μl MTT反应液[100 μl无血清培养液+10 μl MTT(5 mg/ml)溶液],37 ℃孵育4 h,每孔加100 μl二甲基亚砜,混匀,静置数分钟,待细胞代谢MTT形成的甲臢产物充分溶解后,用HL-290酶标自动分析仪,选择检测波长570 nm,测定每组6个孔的吸光度[5]。
1.1.4 细胞周期的测定:实验组周细胞培养24 h后收样。调细胞悬液浓度为2×106/ml,用700 ml/L冷酒精固定30 min(4 ℃),50 μg/ml的RNAse 37 ℃消化1 h,将处理后细胞离心,碘化丙啶染色,FACS440型流式细胞仪分析细胞周期中各期的细胞数目占总细胞数的百分值,并利用单耦合聚类分析法对数据进行统计学分析。
, http://www.100md.com
1.1.5 增殖细胞核抗原(PCNA)表达的检测:将分组培养的附有周细胞的盖玻片取出,经平衡盐溶液洗涤2次后,放入10 g/L多聚甲醛室温固定5 min,然后用-20 ℃预冷的甲醇液置4 ℃固定15 min,滴加PCNA单克隆抗体(Dako公司),4 ℃过夜,再用SABC法进行免疫组化反应,DAB/H2O2显色,每组随机选取20个细胞,用TJTY-300型全自动图像分析仪测定细胞内阳性反应产物的平均吸光度,数据经单因素方差分析处理。
1.2 慢性低氧性肺动脉高压大鼠模型的复制及检测
1.2.1慢性低氧性肺动脉高压动物模型的复制:雌性成年SD大鼠47只(同济医科大学实验动物学部提供),体重(180±20) g,随机将动物分为对照组(N组,21% O2,20只)和低氧组(H组,10%O2, 27只)。H组动物分别饲养4、7、14、21、28 d(4、28 d各为6只,余各为5只)后处死,对照组动物于相应时间点处死。
, http://www.100md.com
1.2.2 右心室收缩压(RVSP)的测量:各时间点动物在处死前,经腹腔注射200 g/L乌拉坦(5.0 ml/kg)全身麻醉。仰卧固定,切开颈前右侧皮肤,游离右侧颈外静脉,将内径1 mm的聚乙烯塑料导管充盈肝素生理盐水,经右颈外静脉插入,缓慢将其推至右心室,导管的外端连接YH-3型压力换能器和SJ-42型生理多导仪。依据示波器上显示的压力曲线,监测右心室压力,稳定后描记右心室收缩压,以此代表肺动脉压。
1.2.3 肺组织的取材:将心肺自胸腔内完整取出,分离心脏,100 ml/L中性福尔马林液灌注固定。1周后于右肺下叶额状面取肺组织一片。常规脱水,透明,石蜡包埋切片,部分 切片做HE染色,光镜观察。部分切片备做其它染色。
1.2.4 右心室肥大指数(RVHI)的计算:将分离后的心脏除去心房和心外膜上的脂肪组织,沿室间隔右缘剪下右心室(RV),留下左心室加室间隔(LV+S)。分别称重后,计算RVHI=(RV/LV+S),当比值大于0.33时,作为判断右心室肥大的指标。
, http://www.100md.com
1.2.5 计算IAPA三种类型血管的构成比:对照组、不同时间点实验组各取3只鼠肺组织石蜡切片做维多利亚蓝染色,光镜下观察。选择截面为圆形和类圆形的小动脉,计数单位面积(25 mm2)内IAPA的总数,并分别计算环肌型动脉(CMA)、部分肌型动脉(PMA)、无肌型动脉(NMA)三种类型血管数目及其所占血管总数的百分值。
1.2.6 免疫组织化学染色:石蜡切片脱蜡至水。0.5 g/L胰蛋白酶37 ℃消化,3 ml/L H2O2-甲醇液阻断内源性酶,用 10 g/L BSA封闭20 min,加兔抗鼠α-SM-actin单克隆抗体(Dako公司),4 ℃过夜。SABC法反应,DAB/H2O2显色。用PBS替代第一抗体或第二抗体,作为阴性对照组。
观察腺泡内肺动脉壁免疫组织化学染色阳性部位,在相同的倍数下,每组随意选取10条伴行呼吸性细支气管(RB),10条伴行肺泡管(AD)的肺小动脉,经TJTY-300型全自动图像分析仪测定肺小动脉壁阳性染色物质的平均吸光度,以表示IAPA管壁骨架蛋白α-SM-actin表达的相对量。
, 百拇医药
1.2.7 统计分析:用SAS软件,对获得的各项数据分别进行F检验,t检验,χ2检验及相关与回归分析等统计学处理。
2 结果
2.1 低氧对肺血管周细胞生长及存活的影响
MTT比色分析法测得的各组吸光度(表2)反映了各组肺周细胞能量代谢水平。H组和HECCM组周细胞的吸光度较N组高0.096、0.106,较NECCM组高0.029、0.039,差异均有显著意义,均为P<0.05,说明H组、HECCM组细胞代谢旺盛。
表2 各组肺血管周细胞MTT比色分析法测得吸光度及细胞周期分析
组别
MTT法比色吸光度
, http://www.100md.com
(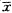 ±s,n=6)
±s,n=6)
细胞周期(%)
G0/G1
S
G2+M
N
0.4452±0.0489
93.55
4.44
2.01
NECCM
, 百拇医药
0.5122±0.0179*
84.64
9.96
5.41
H
0.5416±0.0453*△
81.84
10.76
7.29
HECCM
0.5512±0.0770*△
, 百拇医药
76.25
12.62
11.13
与同项中N组相比*P<0.05;与同项NECCM组相比
△P<0.05
2.2 低氧对肺血管周细胞细胞周期的影响
G0、G1期细胞百分值,H组、HECCM组分别较N组低11.61%、17.30%,较NECCM组低2.7%、8.3%。S期细胞百分值,H组和HECCM组分别较N组高6.32%、8.18%;较NECCM组高0.8%、2.66%。G2+M期细胞的百分值,分别较N组高5.28%、9.12%,较NECCM组高1.88%、3.84%(表2)。
, 百拇医药
2.3 低氧对肺血管周细胞PCNA表达的影响
HECCM组和H组细胞核内的棕黄色阳性颗粒较多,核致密浓染。图像分析及统计处理结果,HECCM组和H组表达量明显增多,分别是NECCM组的1.16倍、1.22倍,是N组的1.41倍、1.49倍。HECCM组和H组表达量相比P>0.05,差异无显著意义。NECCM组和N组相比,差异有显著性意义(图1,2)。

图1 N组肺血管周细胞核内PCNA表达 ×100
图2 H组肺血管周细胞核内PCNA表达 ×100
2.4 各组大鼠右心室收缩压(RVSP)的动态变化
, http://www.100md.com
从H4d组开始,H组大鼠的RVSP升高,与相应时间点的N组相比,为1.46~2.18倍。
2.5 右心室肥大情况观察
H4d、H7d组动物的右心室肥大指数(RVHI)均小于0.33,和相应时间点的N组相比,差异无显著性意义,说明没有发生右心室肥大。H14d组的RVHI为0.334,随着低氧的延续,右心室的肥大更明显,H28d组的RVHI为0.4,和其它各组相比,差异均有显著性意义。
2.6 腺泡内肺动脉三种类型血管构成比的改变
随着低氧时间的延长,肺组织内IAPA数目增多,无肌型动脉减少(图3,4)。从H14d开始,IAPA三种血管的构成比与N组相比,差异有显著意义。随着实验天数的增加,IAPA中的CMA、PMA构成比逐渐升高,以PMA升高幅度明显,NMA占位明显减低。CMA/NMA值,N组为3.8%,H14 d组为14.6%,H28 d组为27.2%。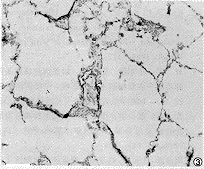
, 百拇医药
图3 H7d组大鼠末梢肺组织弹力纤维染色 ×200
图4 H14d组大鼠末梢肺组织弹力纤维染色 ×200
2.7 IAPA管壁骨架蛋白α-SM-actin表达量的动态分析
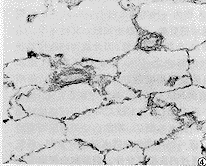
对伴行呼吸性细支气管(RB)和肺泡管(AD)的IAPA管壁的表达产物分别进行图像分析,结果有显著性意义,随着低氧时间的延长,IAPA管壁的α-SM-actin表达量逐渐增多,尤以伴行AD的小动脉管壁表达量升高幅度较明显(图5,6)。
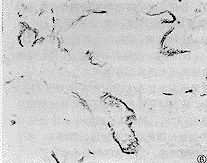
图5 H14d组大鼠末梢肺组织α-SM-actin免疫组化染色 ×200
, 百拇医药
图6 H21d组大鼠末梢肺组织α-SM-actin免疫组化染色 ×200
2.8 RVSP与实验时间、RVHI和IAPA三种类型血管的构成比的相关与回归分析
利用多元线性回归分析(REG过程),建立H组RVSP(R)与实验时间(T)、RVHI和IAPA内CMA、PMA、NMA的构成比的回归方程:R=30.6531+0.2654T-18.5688RVHI+0.6893CMA+0.0490PMA,对该方程进行显著性检验,有极显著意义,P<0.001。
3 讨论
已有文献报道,在腺泡内肺动脉的无肌型动脉壁存在周细胞[6],紧邻于内皮细胞的基底面,与内皮细胞共同由基底膜包绕。两种细胞的细胞膜在局部形成“闭锁”状连接,在相邻的两细胞之间的裂隙中充满细胞外基质。周细胞发出许多胞浆突起,与内皮细胞的基底面有较广泛的连接,两者通过细胞连接和旁分泌途径,相互作用,共同维持微循环的稳定性和微血管的正常构型。
, 百拇医药
活细胞特别是处于肥大或增殖状态的细胞,需要大量的能量来供应各种生物大分子的合成和完成分裂过程。MTT为一淡黄色的唑氮盐,细胞通过线粒体能量代谢过程,可以将MTT代谢形成的紫蓝色甲月 赞沉积于细胞内或细胞周围,而且形成的甲月 赞量与细胞肥大或增殖的程度成正相关[7]。本实验结果表明,低氧和HECCM都能提高周细胞能量代谢水平,即能诱导周细胞处于肥大或增殖状态。PCNA是聚合酶δ的附属蛋白,它协调DNA的前导链和后随链的合成,有促进DNA聚合酶延伸DNA的能力[8],PCNA作为一种周期蛋白(cyclin),它的出现明显与细胞增殖有关,在静止细胞,其量很少,G1晚期开始增加,S期达到高峰,因此成为细胞增殖状态的最有效的标志之一[9]。本实验可见:H组和HECCM组肺血管周细胞PCNA蛋白的表达量明显高于N组和NECCM组,差异有显著意义。流式细胞术结果表明:H组和HECCM组不仅能推动细胞经G0、G1期进入S期(G1期的启动是细胞周期的关键),而且还可以推动细胞进入细胞分裂期。低氧还能直接或通过内皮细胞介导,刺激肺血管周细胞肥大、增殖、分化。我们将动物连续饲养于常压低氧箱内,给予低氧分压气(氧分压保持10%±0.5%)28 d。从H4d起,实验组大鼠肺动脉压显著持续升高,从H14d起,出现右心室肥大,说明慢性低氧性肺动脉高压大鼠模型复制成功。
, 百拇医药
正常时无肌型动脉在IAPA中占位75%左右,在本实验中,从H14 d开始,无肌型动脉比例明显减少,占位60.47%,伴行RB的肺小动脉管壁α-SM-actin表达量也随低氧时间的延长而增多,提示中膜平滑肌细胞增多。伴行AD的肺小动脉管壁骨架蛋白α-SM-actin表达量也随低氧时间的延长而增多,提示有两种可能:①管壁原有的平滑肌细胞、周细胞增生;②原有的周细胞或中间型细胞向平滑肌细胞转化(平滑肌细胞中α-SM-actin的表达量比周细胞高)。相关回归分析表明,RVSP与低氧实验时间、RVHI和IAPA三种类型血管的构成比之间有密切相关性。实验结果再次证明了无肌型动脉肌化,容量型血管转变为阻力性血管,是慢性低氧性肺动脉高压中的重要血管构形重建现象。
本实验结果表明,低氧可直接或通过内皮细胞的介导促进肺血管周细胞增殖和发生表型转化,无肌型肺动脉的肌化是慢性肺动脉高压发展过程中重要的肺血管构形重建之一,而周细胞可能是无肌型动脉肌化的重要细胞来源。
*国家自然科学基金资助项目(No.39570289)
, 百拇医药
作者简介:熊密,女,1935年生,教授。
参考文献
1 Emery C J. Vascular remodeling in the lung. Eur Respir J, 1994,7:217
2 King A P, Smith P, Heath D. Ultrastructure of rat pulmonary arterioles after neonatal exposure to hypoxia and subsequent relief and treatment with monocrotaline. J Pathol, 1995,177:71
3 肖芳,车东媛,张婉蓉. 缺氧内皮细胞条件培养液对肺动脉平滑肌细胞生长的影响.中华病理学杂志,1998,22(2):166
, 百拇医药
4 张燕,熊密,车东媛等. 大鼠肺血管周细胞培养方法的建立及鉴定. 中国学术期刊文献(科技快报). 1998,17(4):209
5 周通洪,沈元珊,赵蔓瑞.测定淋巴细胞转化和鼠白细胞介素-2活性的新方法——MTT比色分析法. 中国免疫学杂志, 1986,2(1):39
6 吴永平,车东媛.周细胞在肺腺泡内动脉构型重建中的意义. 国外医学生理、病理科学与临床分册,1994,14(2):73
7 Francois D, Rita L. Rapid colorimetric assay for cell growth and survival modifications to the tetrazdium dye procedure giving improved sensitivity and reliability. J Immunol Methods, 1986,89:271
, 百拇医药
8 Prelich G, Tan C K, Kostura M et al. Functional identity of proliferating cell nuclear antigen and a DNA polymerasedelta auxiliary protein. Nature, 1978,326:517
9 Celis J E, Bravo R, Larsen P M et al. Cyclin:a nuclear protein whose level correlates directly with the proliferative state of normal as well as transformed cells. Leuk Res, 1984,8:143
收稿日期:1999-01-28, 百拇医药
单位:同济医科大学基础医学院病理学教研室,武汉 430030
关键词:低氧;周细胞;肺动脉高压
同济医科大学学报990502 摘要 为证实周细胞增生和分化与慢性肺动脉高压的关系,用MTT法、流式细胞术及免疫组化分别检测低氧对培养的大鼠肺血管周细胞的增生及活性、细胞周期和增殖细胞核抗原(PCNA)表达的影响。同时复制慢性低氧性肺动脉高压大鼠模型,定量分析腺泡内肺动脉(IAPA)三种类型血管的构成比及其结构改变。结果表明,低氧组周细胞的MTT和PCNA吸光度均较常氧组高。细胞周期中,处于G0、G1期的细胞百分值,低氧组较常氧组低,但S期细胞百分值升高。低氧组大鼠IAPA内环肌型动脉构成比和α-SM-actin抗原表达的吸光度较常氧组者高。结论:低氧促进肺血管周细胞的增生、分化可能是无肌型肺动脉肌化的重要细胞来源和慢性肺动脉高压发生的重要结构基础。
, 百拇医药
中图法分类号 R845.2, R329.2, R322.1
The Relationship between Proliferation and Differentiation of Lung
Vascular Pericytes and the Development of Chronic Pulmonary
Hypertension
Xiong Mi, Zhang Yan, Che Dongyuan et al
Department of Pathology, School of Basic Medical Sciences,Tongji Medical University, Wuhan 430030
, 百拇医药
Abstract To identify the relationship between proliferation and differentiation of pericytes and the development of chronic pulmonary hypertension, the MTT colorimetric assay, flow cytometry and immunohistochemistry were used to detect the effect of hypoxia on proliferation, activity, cell cycle and proliferating cell nuclear antigen (PCNA) expression of the rat lung vascular pericytes respectively. The animal model of chronic hypoxic pulmonary hypertension was replicated and the changes of component ratio of three kinds of vessels in intraacinar pulmonary arteries (IAPA) and their structures were quantitatively analyzed. The absorbance of MTT and PCNA in hypoxia group were higher than in normal group. For the cell cycle, the percentage of G0 and G1 phase cells in hypoxia group were lower than in normal group, whereas the percentage of S phase cells higher. The component ratio of circular muscular arterioles of IAPA and the absorbance of α-SM-actin antigen expression in hypoxia group were higher than in normal group. In conclusion, proliferation and differentiation of the lung vascular pericytes due to hypoxia may be an important cell source for the muscularization of non-muscular pulmonary arterioles and structural basis for the development of chronic pulmonary hypertension.
, http://www.100md.com
Key words hypoxia; pericytes; hypertension, pulmonary
无肌型肺动脉的肌化可能是肺循环阻力增大、肺动脉压升高的关键[1,2]。而无肌型肺动脉肌化的细胞来源是研究防治肺动脉高压的重要课题之一。本文旨在通过大鼠肺血管周细胞培养和复制慢性低氧性肺动脉高压大鼠动物模型,观察低氧对肺血管周细胞生物学特性的影响及周细胞在慢性低氧性肺动脉高压,特别是无肌型肺动脉肌化发生中的作用。
1 材料与方法
1.1 肺动脉内皮细胞条件培养液的制备和肺血管周细胞的培养及检测
1.1.1 牛肺动脉内皮细胞条件培养液的制备:无菌条件下分离牛心包内肺动脉干,参照本室建立的猪肺动脉内皮细胞胰蛋白酶消化法[3], 收集肺动脉内皮细胞(PAECs)进行培养,根据细胞呈单层铺路石状排列,Ⅷ因子内皮细胞相关抗原阳性表达鉴定为内皮细胞。取第2~4代融合的PAECs,换用无血清的培养液(SFM)后,分别在常氧(21% O2)或低氧(3%~5% O2)环境下继续培养24 h,收集上清液,离心,微孔滤膜过滤后即为常氧的内皮细胞条件培养液(NECCM)和低氧的内皮细胞条件培养液(HECCM)。
, 百拇医药
1.1.2 大鼠肺血管周细胞的培养及实验分组:成年清洁级SD大鼠(同济医科大学实验动物学部提供),颈椎拉脱法处死,依照我们建立的大鼠肺血管周细胞的培养方法[4]进行培养。传到第四、五代。根据培养的细胞体积较大,伸出大量突起,可长成多层,免疫组化染色α-SM-actin及CD34、S-100(Dako公司)蛋白表达阳性鉴定为周细胞。实验分组:取第5~7代肺血管周细胞,待细胞生长达70%~80%融合时,换用无血清培养液(SFM),常氧37℃,培养24 h,分为对照(N)、低氧(H)、常氧内皮细胞条件培养液(NECCM)和低氧内皮细胞条件培养液(HECCM)组(表1),各组细胞分别换以相应培养液,继续培养24 h,按检测指标的不同需要分别进行样本的固定及保存。
表1 肺血管周细胞的实验分组
组别
培养液
, 百拇医药
培养环境(含氧量,%)
N
SFM
21
H
SFM
3~5
NECCM
NECCM
21
HECCM
HECCM
21
, http://www.100md.com
1.1.3 MTT比色分析法:实验组周细胞以密度为105/ml接种于96孔培养板内,每孔200 μl,每组6个样本,培养24 h,弃去原培养液,平衡盐溶液洗涤,每孔加110 μl MTT反应液[100 μl无血清培养液+10 μl MTT(5 mg/ml)溶液],37 ℃孵育4 h,每孔加100 μl二甲基亚砜,混匀,静置数分钟,待细胞代谢MTT形成的甲臢产物充分溶解后,用HL-290酶标自动分析仪,选择检测波长570 nm,测定每组6个孔的吸光度[5]。
1.1.4 细胞周期的测定:实验组周细胞培养24 h后收样。调细胞悬液浓度为2×106/ml,用700 ml/L冷酒精固定30 min(4 ℃),50 μg/ml的RNAse 37 ℃消化1 h,将处理后细胞离心,碘化丙啶染色,FACS440型流式细胞仪分析细胞周期中各期的细胞数目占总细胞数的百分值,并利用单耦合聚类分析法对数据进行统计学分析。
, http://www.100md.com
1.1.5 增殖细胞核抗原(PCNA)表达的检测:将分组培养的附有周细胞的盖玻片取出,经平衡盐溶液洗涤2次后,放入10 g/L多聚甲醛室温固定5 min,然后用-20 ℃预冷的甲醇液置4 ℃固定15 min,滴加PCNA单克隆抗体(Dako公司),4 ℃过夜,再用SABC法进行免疫组化反应,DAB/H2O2显色,每组随机选取20个细胞,用TJTY-300型全自动图像分析仪测定细胞内阳性反应产物的平均吸光度,数据经单因素方差分析处理。
1.2 慢性低氧性肺动脉高压大鼠模型的复制及检测
1.2.1慢性低氧性肺动脉高压动物模型的复制:雌性成年SD大鼠47只(同济医科大学实验动物学部提供),体重(180±20) g,随机将动物分为对照组(N组,21% O2,20只)和低氧组(H组,10%O2, 27只)。H组动物分别饲养4、7、14、21、28 d(4、28 d各为6只,余各为5只)后处死,对照组动物于相应时间点处死。
, http://www.100md.com
1.2.2 右心室收缩压(RVSP)的测量:各时间点动物在处死前,经腹腔注射200 g/L乌拉坦(5.0 ml/kg)全身麻醉。仰卧固定,切开颈前右侧皮肤,游离右侧颈外静脉,将内径1 mm的聚乙烯塑料导管充盈肝素生理盐水,经右颈外静脉插入,缓慢将其推至右心室,导管的外端连接YH-3型压力换能器和SJ-42型生理多导仪。依据示波器上显示的压力曲线,监测右心室压力,稳定后描记右心室收缩压,以此代表肺动脉压。
1.2.3 肺组织的取材:将心肺自胸腔内完整取出,分离心脏,100 ml/L中性福尔马林液灌注固定。1周后于右肺下叶额状面取肺组织一片。常规脱水,透明,石蜡包埋切片,部分 切片做HE染色,光镜观察。部分切片备做其它染色。
1.2.4 右心室肥大指数(RVHI)的计算:将分离后的心脏除去心房和心外膜上的脂肪组织,沿室间隔右缘剪下右心室(RV),留下左心室加室间隔(LV+S)。分别称重后,计算RVHI=(RV/LV+S),当比值大于0.33时,作为判断右心室肥大的指标。
, http://www.100md.com
1.2.5 计算IAPA三种类型血管的构成比:对照组、不同时间点实验组各取3只鼠肺组织石蜡切片做维多利亚蓝染色,光镜下观察。选择截面为圆形和类圆形的小动脉,计数单位面积(25 mm2)内IAPA的总数,并分别计算环肌型动脉(CMA)、部分肌型动脉(PMA)、无肌型动脉(NMA)三种类型血管数目及其所占血管总数的百分值。
1.2.6 免疫组织化学染色:石蜡切片脱蜡至水。0.5 g/L胰蛋白酶37 ℃消化,3 ml/L H2O2-甲醇液阻断内源性酶,用 10 g/L BSA封闭20 min,加兔抗鼠α-SM-actin单克隆抗体(Dako公司),4 ℃过夜。SABC法反应,DAB/H2O2显色。用PBS替代第一抗体或第二抗体,作为阴性对照组。
观察腺泡内肺动脉壁免疫组织化学染色阳性部位,在相同的倍数下,每组随意选取10条伴行呼吸性细支气管(RB),10条伴行肺泡管(AD)的肺小动脉,经TJTY-300型全自动图像分析仪测定肺小动脉壁阳性染色物质的平均吸光度,以表示IAPA管壁骨架蛋白α-SM-actin表达的相对量。
, 百拇医药
1.2.7 统计分析:用SAS软件,对获得的各项数据分别进行F检验,t检验,χ2检验及相关与回归分析等统计学处理。
2 结果
2.1 低氧对肺血管周细胞生长及存活的影响
MTT比色分析法测得的各组吸光度(表2)反映了各组肺周细胞能量代谢水平。H组和HECCM组周细胞的吸光度较N组高0.096、0.106,较NECCM组高0.029、0.039,差异均有显著意义,均为P<0.05,说明H组、HECCM组细胞代谢旺盛。
表2 各组肺血管周细胞MTT比色分析法测得吸光度及细胞周期分析
组别
MTT法比色吸光度
, http://www.100md.com
(
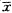 ±s,n=6)
±s,n=6)细胞周期(%)
G0/G1
S
G2+M
N
0.4452±0.0489
93.55
4.44
2.01
NECCM
, 百拇医药
0.5122±0.0179*
84.64
9.96
5.41
H
0.5416±0.0453*△
81.84
10.76
7.29
HECCM
0.5512±0.0770*△
, 百拇医药
76.25
12.62
11.13
与同项中N组相比*P<0.05;与同项NECCM组相比
△P<0.05
2.2 低氧对肺血管周细胞细胞周期的影响
G0、G1期细胞百分值,H组、HECCM组分别较N组低11.61%、17.30%,较NECCM组低2.7%、8.3%。S期细胞百分值,H组和HECCM组分别较N组高6.32%、8.18%;较NECCM组高0.8%、2.66%。G2+M期细胞的百分值,分别较N组高5.28%、9.12%,较NECCM组高1.88%、3.84%(表2)。
, 百拇医药
2.3 低氧对肺血管周细胞PCNA表达的影响
HECCM组和H组细胞核内的棕黄色阳性颗粒较多,核致密浓染。图像分析及统计处理结果,HECCM组和H组表达量明显增多,分别是NECCM组的1.16倍、1.22倍,是N组的1.41倍、1.49倍。HECCM组和H组表达量相比P>0.05,差异无显著意义。NECCM组和N组相比,差异有显著性意义(图1,2)。


图1 N组肺血管周细胞核内PCNA表达 ×100
图2 H组肺血管周细胞核内PCNA表达 ×100
2.4 各组大鼠右心室收缩压(RVSP)的动态变化
, http://www.100md.com
从H4d组开始,H组大鼠的RVSP升高,与相应时间点的N组相比,为1.46~2.18倍。
2.5 右心室肥大情况观察
H4d、H7d组动物的右心室肥大指数(RVHI)均小于0.33,和相应时间点的N组相比,差异无显著性意义,说明没有发生右心室肥大。H14d组的RVHI为0.334,随着低氧的延续,右心室的肥大更明显,H28d组的RVHI为0.4,和其它各组相比,差异均有显著性意义。
2.6 腺泡内肺动脉三种类型血管构成比的改变
随着低氧时间的延长,肺组织内IAPA数目增多,无肌型动脉减少(图3,4)。从H14d开始,IAPA三种血管的构成比与N组相比,差异有显著意义。随着实验天数的增加,IAPA中的CMA、PMA构成比逐渐升高,以PMA升高幅度明显,NMA占位明显减低。CMA/NMA值,N组为3.8%,H14 d组为14.6%,H28 d组为27.2%。


, 百拇医药
图3 H7d组大鼠末梢肺组织弹力纤维染色 ×200
图4 H14d组大鼠末梢肺组织弹力纤维染色 ×200
2.7 IAPA管壁骨架蛋白α-SM-actin表达量的动态分析
对伴行呼吸性细支气管(RB)和肺泡管(AD)的IAPA管壁的表达产物分别进行图像分析,结果有显著性意义,随着低氧时间的延长,IAPA管壁的α-SM-actin表达量逐渐增多,尤以伴行AD的小动脉管壁表达量升高幅度较明显(图5,6)。


图5 H14d组大鼠末梢肺组织α-SM-actin免疫组化染色 ×200
, 百拇医药
图6 H21d组大鼠末梢肺组织α-SM-actin免疫组化染色 ×200
2.8 RVSP与实验时间、RVHI和IAPA三种类型血管的构成比的相关与回归分析
利用多元线性回归分析(REG过程),建立H组RVSP(R)与实验时间(T)、RVHI和IAPA内CMA、PMA、NMA的构成比的回归方程:R=30.6531+0.2654T-18.5688RVHI+0.6893CMA+0.0490PMA,对该方程进行显著性检验,有极显著意义,P<0.001。
3 讨论
已有文献报道,在腺泡内肺动脉的无肌型动脉壁存在周细胞[6],紧邻于内皮细胞的基底面,与内皮细胞共同由基底膜包绕。两种细胞的细胞膜在局部形成“闭锁”状连接,在相邻的两细胞之间的裂隙中充满细胞外基质。周细胞发出许多胞浆突起,与内皮细胞的基底面有较广泛的连接,两者通过细胞连接和旁分泌途径,相互作用,共同维持微循环的稳定性和微血管的正常构型。
, 百拇医药
活细胞特别是处于肥大或增殖状态的细胞,需要大量的能量来供应各种生物大分子的合成和完成分裂过程。MTT为一淡黄色的唑氮盐,细胞通过线粒体能量代谢过程,可以将MTT代谢形成的紫蓝色甲月 赞沉积于细胞内或细胞周围,而且形成的甲月 赞量与细胞肥大或增殖的程度成正相关[7]。本实验结果表明,低氧和HECCM都能提高周细胞能量代谢水平,即能诱导周细胞处于肥大或增殖状态。PCNA是聚合酶δ的附属蛋白,它协调DNA的前导链和后随链的合成,有促进DNA聚合酶延伸DNA的能力[8],PCNA作为一种周期蛋白(cyclin),它的出现明显与细胞增殖有关,在静止细胞,其量很少,G1晚期开始增加,S期达到高峰,因此成为细胞增殖状态的最有效的标志之一[9]。本实验可见:H组和HECCM组肺血管周细胞PCNA蛋白的表达量明显高于N组和NECCM组,差异有显著意义。流式细胞术结果表明:H组和HECCM组不仅能推动细胞经G0、G1期进入S期(G1期的启动是细胞周期的关键),而且还可以推动细胞进入细胞分裂期。低氧还能直接或通过内皮细胞介导,刺激肺血管周细胞肥大、增殖、分化。我们将动物连续饲养于常压低氧箱内,给予低氧分压气(氧分压保持10%±0.5%)28 d。从H4d起,实验组大鼠肺动脉压显著持续升高,从H14d起,出现右心室肥大,说明慢性低氧性肺动脉高压大鼠模型复制成功。
, 百拇医药
正常时无肌型动脉在IAPA中占位75%左右,在本实验中,从H14 d开始,无肌型动脉比例明显减少,占位60.47%,伴行RB的肺小动脉管壁α-SM-actin表达量也随低氧时间的延长而增多,提示中膜平滑肌细胞增多。伴行AD的肺小动脉管壁骨架蛋白α-SM-actin表达量也随低氧时间的延长而增多,提示有两种可能:①管壁原有的平滑肌细胞、周细胞增生;②原有的周细胞或中间型细胞向平滑肌细胞转化(平滑肌细胞中α-SM-actin的表达量比周细胞高)。相关回归分析表明,RVSP与低氧实验时间、RVHI和IAPA三种类型血管的构成比之间有密切相关性。实验结果再次证明了无肌型动脉肌化,容量型血管转变为阻力性血管,是慢性低氧性肺动脉高压中的重要血管构形重建现象。
本实验结果表明,低氧可直接或通过内皮细胞的介导促进肺血管周细胞增殖和发生表型转化,无肌型肺动脉的肌化是慢性肺动脉高压发展过程中重要的肺血管构形重建之一,而周细胞可能是无肌型动脉肌化的重要细胞来源。
*国家自然科学基金资助项目(No.39570289)
, 百拇医药
作者简介:熊密,女,1935年生,教授。
参考文献
1 Emery C J. Vascular remodeling in the lung. Eur Respir J, 1994,7:217
2 King A P, Smith P, Heath D. Ultrastructure of rat pulmonary arterioles after neonatal exposure to hypoxia and subsequent relief and treatment with monocrotaline. J Pathol, 1995,177:71
3 肖芳,车东媛,张婉蓉. 缺氧内皮细胞条件培养液对肺动脉平滑肌细胞生长的影响.中华病理学杂志,1998,22(2):166
, 百拇医药
4 张燕,熊密,车东媛等. 大鼠肺血管周细胞培养方法的建立及鉴定. 中国学术期刊文献(科技快报). 1998,17(4):209
5 周通洪,沈元珊,赵蔓瑞.测定淋巴细胞转化和鼠白细胞介素-2活性的新方法——MTT比色分析法. 中国免疫学杂志, 1986,2(1):39
6 吴永平,车东媛.周细胞在肺腺泡内动脉构型重建中的意义. 国外医学生理、病理科学与临床分册,1994,14(2):73
7 Francois D, Rita L. Rapid colorimetric assay for cell growth and survival modifications to the tetrazdium dye procedure giving improved sensitivity and reliability. J Immunol Methods, 1986,89:271
, 百拇医药
8 Prelich G, Tan C K, Kostura M et al. Functional identity of proliferating cell nuclear antigen and a DNA polymerasedelta auxiliary protein. Nature, 1978,326:517
9 Celis J E, Bravo R, Larsen P M et al. Cyclin:a nuclear protein whose level correlates directly with the proliferative state of normal as well as transformed cells. Leuk Res, 1984,8:143
收稿日期:1999-01-28, 百拇医药