转染p53抑癌基因体外抑制K562细胞克隆的形成
作者:黄仁魏 夏忠军 林桂真 林东军 唐加明 李铭权
单位:中山医科大学附属第三医院血液科; 广州, 510630
关键词:K562细胞;基因,p53;基因转染;白血病
中山医科大学学报990116
摘 要 目的:构建p53表达质粒,研究p53基因对白血病细胞K562细胞生长的抑制作用。方法:以T4连接酶把2160bp的p53cDNA片段插入pRc/CMV质粒,重组构建pRc/p53表达质粒,以Lipofectin介导pRc/p53质粒转染K562细胞,以甲基纤维素半固体培养方法作K562细胞体外克隆培养,观察转染p53基因后K562细胞克隆形成改变。结果:p53cDNA质粒转染的K562细胞,体外培养克隆形成能力明显减低。在接种1×104细胞时,未转染的空白对照组及空质粒对照组白血病细胞集落数分别是2797±264和2725±261;而p53质粒转染组细胞集落数是1061±160;与空质粒转染组及未转染的K562细胞组比较有非常显著性差异(P<0.001,n=10)。结论:转染p53基因能抑制K562细胞的生长。
, http://www.100md.com
中图号 R 375.35
The Inhibition of Colony-Forming Activity in K562 Cells by
Transfection of p53 cDNA Plasmid in Vitro
Huang Renwei Xia Zhongjun Lin Guizheng Lin Dongjun Tang Jiaming Li Mingquan
(Department of Hematology of the 3rd Affiliated Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou, 510630)
Abstract Objective: To recombine a p53 gene expression vector and investigate the supression activity of p53 gene on the colony forming activity of K562 cells. Methods: The p53 cDNA expression vector pRc/p53 was constructed by inserting a 2 160bp p53 cDNA fragment into digested pRc/CMV vector with T4 ligase by blunt ligation manner. The pRc/p53 plasmid was transfected into K562 cells using lipofectin as mediator. Then, the suppression activity of p53 gene on the colony forming activity in K562 cells was measured with colony culture method in vitro. Results: The colony-forming ability of the K562 cells that were transfected with pRc/p53 cDNA plasmid in the colony culture in vitro was much lower than that of control. When the cells were cultured in the number of 104, the number of formed colony in not-transfected control and pRc/CMV transfected group were 2797±264 and 2725±261 respectively. While in pRc/p53 transfected group that was only 1061±160, which show a significant difference compared with not-transfected control and pRc/CMV transfected group (P<0.001, n=10). Conclusion: The result suggest that transfection of p53 gene into K562 cells can inhibit the tumorigenic growth of K562 cells.
, 百拇医药
Subject headingsK562 cells; gene, p53; gene transfer; leukemia
肿瘤抑制基因p53功能的丧失,与人类的肿瘤发生过程存在密切的关系,p53基因的功能丧失还与肿瘤的恶性程度有关。为研究p53基因与白血病的发生和发展的关系,我们构建pRc/p53质粒,用该质粒转染K562细胞,观察p53基因对K562细胞克隆形成的影响。
1 材料与方法
1.1 试 剂
pPro p53 cDNA质粒和pRc/CMV质粒由日本熊本大学医学院Matsuoka博士惠赠。核酸内切酶BamHⅠ,EcoRⅠ,XbaⅠ等购于华美公司;Lipofectin、G18购于GIBCO公司。RPMI1640购于Sigma公司。
, 百拇医药 1.2 pRc/p53质粒的构建
以BamH I和EcoR I核酸内切酶从pProp53 cDNA质粒中切出p53cDNA片段(2 160bp),然后用Klenow酶把p53cDNA片段末端酶切口平端化,经低熔点琼脂糖电泳(TAE缓冲液)分离出目的p53cDNA片段。以HindⅢ核酸内切酶处理pRc/CMV表达质粒,用Klenow酶处理补平末端,再以BAP(牛碱性磷酸酶)处理,使酶切口5′端碱基脱磷酸。以T4连接酶把以上经处理的p53cDNA片段和酶处理后的pRc/CMV质粒以平端连接的方式连接,构成重组pRc/p53质粒。重组质粒转染大肠杆菌,经酶切法挑选正向连接的质粒(如图1),再转染大肠杆菌大量扩增,并纯化。
1.3 K562细胞培养
含φ=10%小牛血清的RPMI1640培养液,37 ℃,φ=5%CO2,饱和湿度下常规培养,每周常规换培养液2次。
, 百拇医药
1.4 pRc/p53质粒转染K562细胞
收集培养第3天(对数生长期)的K562细胞,以RPMI1640培养液洗2次,待用。Lipofectin作为介质,以pRc/p53质粒转染K562细胞[1]。10μg质粒DNA和10μL Lipofectin混合于3mLRPMI1640培养液中,即刻加于已准备好的1×107细胞中,边加边轻柔地混和,常规孵育5h。然后加含φ=10%小牛血清的RPMI1640培养液至10mL,培养过夜。第2天收集细胞,以1×106/mL的细胞培养于含φ=10%小牛血清的RPMI1640培养液中,48h后加G18 l g/L培养2周。选择转染了pRc/p53质粒的细胞,进行常规培养。
1.5K562细胞克隆培养
取常规培养第3天的K562细胞,RPMI1640培养液洗2次,调整细胞浓度为1×108/L。以甲基纤维素半固体培养体系进行克隆培养。实验分组:实验组为pRc/p53质粒转染的K562细胞,对照组分别设空白对照组(未转染的K562细胞)及空质粒对照组(转染pRc/CMV质粒的K562细胞)。培养体系含φ=10%小牛血清RPMI1640 g/L甲基纤维素、细胞107/L,35mm培养皿接种1mL,37 ℃、φ=5%CO2、饱和湿度下常规培养7d。光镜下观察计数>40个细胞的细胞群为一个集落单位[每体系(每次实验)取2个培养皿数的平均值]。
, http://www.100md.com
2 结 果
2.1 pRc/p53质粒的鉴定
限制性内切酶酶切法鉴定重组质粒:p53cDNA3′端有XbaⅠ酶切点,DNA片段为217bp,pRc/CMV载体第891位是p53cDNA插入部位,其后的第985位有Xba I酶切点,因此,正向连接的重组质粒以Xba I酶切后,有一个311bp的Xba I片段。XbaI处理重组的pRc/p53质粒,电泳可见约311bp的DNA片段(图1)。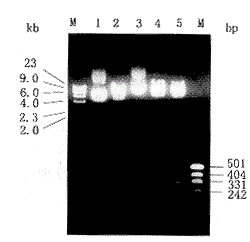
图1 核酸内切酶法鉴定pRc/p53质粒
Fig.1 Identification of recombined pRc/p53 plasmid
with endonuclerase
, http://www.100md.com
M: DNA marker (λDNA/HindⅢ);1:pRc/CMV plasmid without digestion; 2: pRc/CMV plasmid digested with Xba I; 3: pRc/p53 plasmid without digestion; 4: pRc/p53 plasmid digested with Sca I; 5: pRc/p53 plasmid digested with Xba I
2.2 pRc/p53质粒转染细胞的鉴定
G18杀伤未转染的细胞:转染的细胞有耐G18的基因。在转染及未转染的K562细胞培养中,加1g/L的G18培养1周,未转染的细胞100%死亡,而转染的细胞生长良好,死亡数仅为12%。
2.3转染p53基因对K562细胞克隆形成的抑制作用
, 百拇医药 1×104K562细胞经体外克隆培养7d,未转染的空白对照组细胞集落数是2797±264(n=10),空质粒对照组细胞集落数是2725±261(n=7);两组比较差异无显著性(P>0.05)。p53质粒转染组细胞集落数是1061±160(n=10);与空白对照组及空质粒对照组比较有非常显著性差异(P<0.001)。
接种细胞浓度分别为1×106/L,5×106/L及1×107/L,经培养1周时,未转染的K562细胞集落数分别是296±52,1562±136和2775±333;p53基因转染的K562细胞集落数分别是108±10,578±65和1068±136。两者在接种不同细胞浓度时集落产率的比较有非常显著性差异(P<0.01,n=5)。
3 讨 论
肿瘤抑制基因p53功能的丧失与肿瘤的发生和发展有密切的关系,并与肿瘤的恶性程度有关。有报道在慢性粒细胞白血病(慢粒)的急变期比慢性期较常出现p53基因的异常[2]。由慢粒急变来源的K562细胞存在p53基因的异常[3,4],可能与慢粒的病情进展有关[3]。急性非淋巴细胞白血病存在p53基因的异常,可能与白血病的发生与发展有关[5]。本研究以p53cDNA质粒转染存在p53基因异常的白血病细胞株K562细胞,发现p53基因对K562细胞体外克隆形成有明显的抑制作用。提示p53基因的异常与K562细胞肿瘤性生长有密切的关系。有报道转染p53基因对多种肿瘤细胞的生长有抑制作用。刘氏把p53cDNA质粒转染到人肝癌细胞株,结果转染的细胞株集落形成明显减少[6]。Blagosklonny把表达p53基因的腺病毒转染乳腺癌细胞,结果显示转染p53基因可使原有p53基因异常的肿瘤细胞发生凋亡,同时转染后的肿瘤细胞对化疗药物敏感,易于被抗肿瘤药物杀灭[7]。在我们的研究中,把p53基因转染到K562细胞后,转染细胞体外克隆形成能力明显降低,克隆形成率仅为未转染细胞的三分之一,并与接种细胞数负相关。提示正常的p53基因有抑制肿瘤细胞的增殖作用,在p53基因异常的情况下,肿瘤细胞失去了p53蛋白的监控而出现无限制的增长,致使病情进展。
, http://www.100md.com
国家教委留学回国人员基金及中山医科大学留学回国人员启动基金资助课题;自由词
参考文献
1 Tsuda H, Huang R W, Konishi M, et al. A new system that analyzes erythropoietin-mediated early signal transduction of the c-fos enhancer promoter-luciferase gene into a murine erythroid cell line. Eur J Heamatol, 1994, 52(2):73.
2 Guinn B A, Smith M, Padua R A, et al. Changing p53 mutations with the evolution of chronic myeloid leukemia from the chronic phase to blast crises. Leuk Res, 1995, 19(8):519
, http://www.100md.com
3 Sen S, Takahashi R, Rani S, et al. Expression of differentially phosphorylated Rb and mutant p53 proteins in myeloid leukemia cell lines. Leuk Res, 1993, 17(8):639
4 Law J C, Ritke M K, Yalowich J C, et al. Mutational inactivation of the p53 gene in the human erythroid leukemic K562 cell line. Leuk Res, 1993, 17(12):1045
5 Slingerland J M, Minder M D, Benchimol S. Mutation of the p53 gene in human acute myelogenous leukemia. Blood, 1991, 77(7):1500
6 刘超亭,曹宇清,范育虹,等. p53基因抑制人肝癌细胞的生长. 肿瘤,1991,11(5):197
7 Blagosklonny M V, el-Deiry W S. In vitro evaluation of a p53-expressing adenovirus as an anti-cancer drug. Int J Cancer, 1996, 67(3):386
(1998 - 09 - 14收稿 1998 - 11 - 16修回), 百拇医药
单位:中山医科大学附属第三医院血液科; 广州, 510630
关键词:K562细胞;基因,p53;基因转染;白血病
中山医科大学学报990116
摘 要 目的:构建p53表达质粒,研究p53基因对白血病细胞K562细胞生长的抑制作用。方法:以T4连接酶把2160bp的p53cDNA片段插入pRc/CMV质粒,重组构建pRc/p53表达质粒,以Lipofectin介导pRc/p53质粒转染K562细胞,以甲基纤维素半固体培养方法作K562细胞体外克隆培养,观察转染p53基因后K562细胞克隆形成改变。结果:p53cDNA质粒转染的K562细胞,体外培养克隆形成能力明显减低。在接种1×104细胞时,未转染的空白对照组及空质粒对照组白血病细胞集落数分别是2797±264和2725±261;而p53质粒转染组细胞集落数是1061±160;与空质粒转染组及未转染的K562细胞组比较有非常显著性差异(P<0.001,n=10)。结论:转染p53基因能抑制K562细胞的生长。
, http://www.100md.com
中图号 R 375.35
The Inhibition of Colony-Forming Activity in K562 Cells by
Transfection of p53 cDNA Plasmid in Vitro
Huang Renwei Xia Zhongjun Lin Guizheng Lin Dongjun Tang Jiaming Li Mingquan
(Department of Hematology of the 3rd Affiliated Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou, 510630)
Abstract Objective: To recombine a p53 gene expression vector and investigate the supression activity of p53 gene on the colony forming activity of K562 cells. Methods: The p53 cDNA expression vector pRc/p53 was constructed by inserting a 2 160bp p53 cDNA fragment into digested pRc/CMV vector with T4 ligase by blunt ligation manner. The pRc/p53 plasmid was transfected into K562 cells using lipofectin as mediator. Then, the suppression activity of p53 gene on the colony forming activity in K562 cells was measured with colony culture method in vitro. Results: The colony-forming ability of the K562 cells that were transfected with pRc/p53 cDNA plasmid in the colony culture in vitro was much lower than that of control. When the cells were cultured in the number of 104, the number of formed colony in not-transfected control and pRc/CMV transfected group were 2797±264 and 2725±261 respectively. While in pRc/p53 transfected group that was only 1061±160, which show a significant difference compared with not-transfected control and pRc/CMV transfected group (P<0.001, n=10). Conclusion: The result suggest that transfection of p53 gene into K562 cells can inhibit the tumorigenic growth of K562 cells.
, 百拇医药
Subject headingsK562 cells; gene, p53; gene transfer; leukemia
肿瘤抑制基因p53功能的丧失,与人类的肿瘤发生过程存在密切的关系,p53基因的功能丧失还与肿瘤的恶性程度有关。为研究p53基因与白血病的发生和发展的关系,我们构建pRc/p53质粒,用该质粒转染K562细胞,观察p53基因对K562细胞克隆形成的影响。
1 材料与方法
1.1 试 剂
pPro p53 cDNA质粒和pRc/CMV质粒由日本熊本大学医学院Matsuoka博士惠赠。核酸内切酶BamHⅠ,EcoRⅠ,XbaⅠ等购于华美公司;Lipofectin、G18购于GIBCO公司。RPMI1640购于Sigma公司。
, 百拇医药 1.2 pRc/p53质粒的构建
以BamH I和EcoR I核酸内切酶从pProp53 cDNA质粒中切出p53cDNA片段(2 160bp),然后用Klenow酶把p53cDNA片段末端酶切口平端化,经低熔点琼脂糖电泳(TAE缓冲液)分离出目的p53cDNA片段。以HindⅢ核酸内切酶处理pRc/CMV表达质粒,用Klenow酶处理补平末端,再以BAP(牛碱性磷酸酶)处理,使酶切口5′端碱基脱磷酸。以T4连接酶把以上经处理的p53cDNA片段和酶处理后的pRc/CMV质粒以平端连接的方式连接,构成重组pRc/p53质粒。重组质粒转染大肠杆菌,经酶切法挑选正向连接的质粒(如图1),再转染大肠杆菌大量扩增,并纯化。
1.3 K562细胞培养
含φ=10%小牛血清的RPMI1640培养液,37 ℃,φ=5%CO2,饱和湿度下常规培养,每周常规换培养液2次。
, 百拇医药
1.4 pRc/p53质粒转染K562细胞
收集培养第3天(对数生长期)的K562细胞,以RPMI1640培养液洗2次,待用。Lipofectin作为介质,以pRc/p53质粒转染K562细胞[1]。10μg质粒DNA和10μL Lipofectin混合于3mLRPMI1640培养液中,即刻加于已准备好的1×107细胞中,边加边轻柔地混和,常规孵育5h。然后加含φ=10%小牛血清的RPMI1640培养液至10mL,培养过夜。第2天收集细胞,以1×106/mL的细胞培养于含φ=10%小牛血清的RPMI1640培养液中,48h后加G18 l g/L培养2周。选择转染了pRc/p53质粒的细胞,进行常规培养。
1.5K562细胞克隆培养
取常规培养第3天的K562细胞,RPMI1640培养液洗2次,调整细胞浓度为1×108/L。以甲基纤维素半固体培养体系进行克隆培养。实验分组:实验组为pRc/p53质粒转染的K562细胞,对照组分别设空白对照组(未转染的K562细胞)及空质粒对照组(转染pRc/CMV质粒的K562细胞)。培养体系含φ=10%小牛血清RPMI1640 g/L甲基纤维素、细胞107/L,35mm培养皿接种1mL,37 ℃、φ=5%CO2、饱和湿度下常规培养7d。光镜下观察计数>40个细胞的细胞群为一个集落单位[每体系(每次实验)取2个培养皿数的平均值]。
, http://www.100md.com
2 结 果
2.1 pRc/p53质粒的鉴定
限制性内切酶酶切法鉴定重组质粒:p53cDNA3′端有XbaⅠ酶切点,DNA片段为217bp,pRc/CMV载体第891位是p53cDNA插入部位,其后的第985位有Xba I酶切点,因此,正向连接的重组质粒以Xba I酶切后,有一个311bp的Xba I片段。XbaI处理重组的pRc/p53质粒,电泳可见约311bp的DNA片段(图1)。

图1 核酸内切酶法鉴定pRc/p53质粒
Fig.1 Identification of recombined pRc/p53 plasmid
with endonuclerase
, http://www.100md.com
M: DNA marker (λDNA/HindⅢ);1:pRc/CMV plasmid without digestion; 2: pRc/CMV plasmid digested with Xba I; 3: pRc/p53 plasmid without digestion; 4: pRc/p53 plasmid digested with Sca I; 5: pRc/p53 plasmid digested with Xba I
2.2 pRc/p53质粒转染细胞的鉴定
G18杀伤未转染的细胞:转染的细胞有耐G18的基因。在转染及未转染的K562细胞培养中,加1g/L的G18培养1周,未转染的细胞100%死亡,而转染的细胞生长良好,死亡数仅为12%。
2.3转染p53基因对K562细胞克隆形成的抑制作用
, 百拇医药 1×104K562细胞经体外克隆培养7d,未转染的空白对照组细胞集落数是2797±264(n=10),空质粒对照组细胞集落数是2725±261(n=7);两组比较差异无显著性(P>0.05)。p53质粒转染组细胞集落数是1061±160(n=10);与空白对照组及空质粒对照组比较有非常显著性差异(P<0.001)。
接种细胞浓度分别为1×106/L,5×106/L及1×107/L,经培养1周时,未转染的K562细胞集落数分别是296±52,1562±136和2775±333;p53基因转染的K562细胞集落数分别是108±10,578±65和1068±136。两者在接种不同细胞浓度时集落产率的比较有非常显著性差异(P<0.01,n=5)。
3 讨 论
肿瘤抑制基因p53功能的丧失与肿瘤的发生和发展有密切的关系,并与肿瘤的恶性程度有关。有报道在慢性粒细胞白血病(慢粒)的急变期比慢性期较常出现p53基因的异常[2]。由慢粒急变来源的K562细胞存在p53基因的异常[3,4],可能与慢粒的病情进展有关[3]。急性非淋巴细胞白血病存在p53基因的异常,可能与白血病的发生与发展有关[5]。本研究以p53cDNA质粒转染存在p53基因异常的白血病细胞株K562细胞,发现p53基因对K562细胞体外克隆形成有明显的抑制作用。提示p53基因的异常与K562细胞肿瘤性生长有密切的关系。有报道转染p53基因对多种肿瘤细胞的生长有抑制作用。刘氏把p53cDNA质粒转染到人肝癌细胞株,结果转染的细胞株集落形成明显减少[6]。Blagosklonny把表达p53基因的腺病毒转染乳腺癌细胞,结果显示转染p53基因可使原有p53基因异常的肿瘤细胞发生凋亡,同时转染后的肿瘤细胞对化疗药物敏感,易于被抗肿瘤药物杀灭[7]。在我们的研究中,把p53基因转染到K562细胞后,转染细胞体外克隆形成能力明显降低,克隆形成率仅为未转染细胞的三分之一,并与接种细胞数负相关。提示正常的p53基因有抑制肿瘤细胞的增殖作用,在p53基因异常的情况下,肿瘤细胞失去了p53蛋白的监控而出现无限制的增长,致使病情进展。
, http://www.100md.com
国家教委留学回国人员基金及中山医科大学留学回国人员启动基金资助课题;自由词
参考文献
1 Tsuda H, Huang R W, Konishi M, et al. A new system that analyzes erythropoietin-mediated early signal transduction of the c-fos enhancer promoter-luciferase gene into a murine erythroid cell line. Eur J Heamatol, 1994, 52(2):73.
2 Guinn B A, Smith M, Padua R A, et al. Changing p53 mutations with the evolution of chronic myeloid leukemia from the chronic phase to blast crises. Leuk Res, 1995, 19(8):519
, http://www.100md.com
3 Sen S, Takahashi R, Rani S, et al. Expression of differentially phosphorylated Rb and mutant p53 proteins in myeloid leukemia cell lines. Leuk Res, 1993, 17(8):639
4 Law J C, Ritke M K, Yalowich J C, et al. Mutational inactivation of the p53 gene in the human erythroid leukemic K562 cell line. Leuk Res, 1993, 17(12):1045
5 Slingerland J M, Minder M D, Benchimol S. Mutation of the p53 gene in human acute myelogenous leukemia. Blood, 1991, 77(7):1500
6 刘超亭,曹宇清,范育虹,等. p53基因抑制人肝癌细胞的生长. 肿瘤,1991,11(5):197
7 Blagosklonny M V, el-Deiry W S. In vitro evaluation of a p53-expressing adenovirus as an anti-cancer drug. Int J Cancer, 1996, 67(3):386
(1998 - 09 - 14收稿 1998 - 11 - 16修回), 百拇医药