兔关节软骨细胞在几丁糖中培养的生物学特性
作者:郑卫平 张志光 郑有华 杨国平
单位:中山医科大学口腔医学院口腔颌面外科, 广东 广州 510055
关键词:关节;软骨;细胞学;几丁糖凝胶;细胞培养;软骨细胞;超微结构
中山医科大学学报000413
摘 要:【目的】 观察关节软骨细胞在几丁糖凝胶中培养的生物学行为,以探讨几丁糖凝胶作为组织工程细胞支架的可行性。【方法】 从幼龄兔关节表面削取薄层软骨,经酶消化获得大量的软骨细胞。原代培养后,按106/mL细胞浓度接种于几丁糖凝胶,通过绘制生长曲线,组织化学检测,透射电镜观察,了解软骨细胞在几丁糖中生长特征。【结果】 软骨细胞在几丁糖中保持圆形,甲苯胺蓝异染及Ⅱ型胶原免疫组化染色呈强阳性;细胞内富含高尔基体、粗面型内质网及大量的分泌泡。【结论】 软骨细胞在几丁糖中保持圆形生长状态,几丁糖能促进软骨细胞分裂、增殖,提高其分泌基质的能力。几丁糖可作为可注射性软骨组织工程的载体材料。
, 百拇医药
中图分类号:R782 文献标识码: A
文章编号:1000-257X(2000)04-0277-03
Biological Behavior of Rabbit Articular Chondrocyte in Chitosan Gels
ZHENG Wei-ping, ZHANG Zhi-guang, ZHENG You-hua, YANG Guo-ping
(Department of Oral and Maxillofacial Surgery, College of Stomatology,Sun Yat-sen University of Medical Sciences, Guangzhou 510055, China)
Abstract: 【Objective】 To observe the biological behavior of chondrocyte in chitosan gels in vitro and the possibility of chitosan using as scaffolds in tissue engineering. 【Methods】 Chondrocytes isolated by enzymic digestion from the condylar cartilages of the young rabbits were cultured in monolayer system. After primary culture, the cells were seeded in chitosan gels in concentration of 106/mL in vitro. Characteristics of chondrocyte growth were observed with growth curve, toluidine blues staining, type Ⅱ collagen immunohistochemistry reaction and also observed by electronic microscope. 【Result】 Chondrocytes retained their surrounded morphology, multiplited, and produced matrix in chitosan gels. The results of histochemistry examination were strong postive. Most cells appeared to contain several golgi zones and large areas of rough endoplasmic reticulum, partly filled with dense secretory material. 【Conclusion】 Cell-culture system, using chitosan gels, provided chondrocytes a suitable environment in which synthesized matrix macromolecules and preserved their surrouned morophology in vitro. Chitosan gels may be a vehicle for injectable tissue-engineered cartilage.
, 百拇医药
Key words:cartilage, articular/cytology; chitosan gel; cell culture; chondrocyte/ultrastructure
关节软骨自身修复能力很低,各种原因导致的软骨缺损很难自愈,在临床治疗中一直是个难题。组织工程技术的应用,为该疾病的治疗提供了新的方法。其基本思路是在体外将一定数量的关节软骨细胞接种到载体支架中,培养形成具有活性和功能的软骨组织,然后移植到缺损部位,以达到修复重建的目的[1]。目前组织工程的研究重点在于寻找最适的细胞载体材料。几丁糖凝胶是一种高分子多糖类物质,有良好的生物相容性、可降解性、生物活性[2]。本研究将软骨细胞接种于几丁糖凝胶中,观察细胞生长、增殖、分化等情况,为进行可注射性软骨移植实验打下基础。
1 材料和方法
1.1 软骨细胞的分离
, 百拇医药
2周龄新西兰白兔2只(中山医科大学实验动物中心提供), 参照文献[3]方法,无菌条件下削取颞下颌关节(TMJ)及四肢关节表面软骨,切成1.0 mm3大小,置于2.5 mg/L胰蛋白酶(Advanced)5 mL中消化40 min, 弃去消化液;再加入 1 mg/LⅡ型胶原酶(Sigma)5 mL, 消化4~6 h。细胞大部分游离后,200目筛网过滤,收集并离心(1 000 r/min, 5 min)。血细胞计数板计数,台盼蓝拒染检测软骨细胞活性。获得软骨细胞5×106,活性率为95%。
1.2 软骨细胞的原代培养
将细胞按1.0×106/孔接种于6孔培养板 , 加入2 mL DMEM培养液(Gibco),培养液中添加150 mL/L小牛血清(中山医科大学微生物教研室)、青霉素10 万U/L、庆大霉素1 g/L,于37 ℃、饱和湿度、体积分数为5% CO2的细胞培养孵箱中培养, 每3 d换液1次, 倒置显微镜下观察并照相,细胞长满后用2.5 mg/L胰蛋白酶消化并收集、计数。
, 百拇医药
1.3 软骨细胞在几丁糖中培养
取初代软骨细胞, 分成2组。一组接种于几丁糖凝胶(上海其胜生物制剂实业公司)中, 使细胞终浓度为109/L,再加入DMEM培养液;另组按相同的细胞浓度直接种于DMEM培养液。每3 d换1次液,观察并比较2种条件下细胞的生长情况。
1.4 绘制生长曲线
分别于接种后1、2、3、4、5、6、7、8 d各取3孔细胞进行计数,两组间进行t检验,绘制生长曲线。
1.5 组织化学检查
培养细胞用10 g/L甲苯胺蓝(pH 2.5)进行基质异染,能特异地反映软骨细胞分泌的硫酸糖胺聚糖的含量[4]。取生长良好的软骨细胞,PBS(pH 7.4)冲洗,体积分数为95%酒精固定,ABC法进行Ⅱ型胶原免疫组化染色。
, http://www.100md.com
1.6 透射电镜观察
取生长良好的软骨细胞,经2.5 g/L胰蛋白酶消化后移入离心管,3 000 r/min离心10 min,取出细胞团块用30 mL/L戊二醛固定,锇酸后固定,丙酮系列脱水,环氧树脂包埋,切片进行观察。
2 结 果
2.1 软骨细胞的原代培养
接种培养24 h后,细胞开始贴壁、伸展,出现增殖、分化。8 d左右,细胞逐渐融合长满瓶底。
2.2 软骨细胞在几丁糖凝胶中的生长
几丁糖凝胶为白色半透明。软骨细胞接种后8~12 h,在相差显微镜下可见大部分细胞保持圆形形态,定植在凝胶中,少数在凝胶表面附着者,呈椭圆形。对照组,细胞定植于孔底,呈多角形。培养后3 d,细胞不断分化、增殖。甲苯胺蓝染色示细胞内及胞周有异染物质出现,Ⅱ型胶原染色也显示细胞浆染成棕黄色。5~7 d,几丁糖逐渐收缩、降解。甲苯胺蓝染色及Ⅱ型胶原染色呈强阳性,胞内外着色连成一片。9~10 d,仍可见几丁糖存在。镜下可见类软骨物质出现,呈结节状。甲苯胺蓝染色及Ⅱ型胶原染色分别呈强阳性,显示含有较多的氨基多糖和Ⅱ型胶原成分(图1、2)。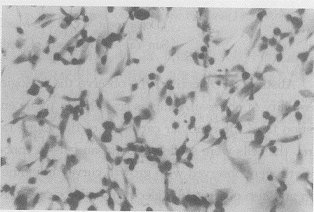
, 百拇医药
图1 软骨细胞甲苯胺蓝染色呈强阳性
Fig.1 Toluidine blue staining is strong postive in Chondrocytes(×100)
图2 软骨细胞Ⅱ型胶原单克隆抗体免疫组化染色呈强阳性
Fig.2 Immunohistochemistical stain with anti-type Ⅱantibody is strong postive in Chondrocytes(×100)
几丁糖组及单层组软骨细胞生长曲线见图3。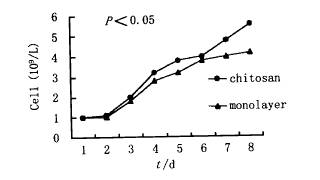
, 百拇医药
图3 几丁糖组、单层培养组软骨细胞生长曲线
Fig.3 Growth curve of chondrocytes with in chitosangels and in monolayer cultures
透射电镜观察见:细胞核较大,多为圆形,形态不规则,核仁边聚,常染色质明显。细胞质胞浆丰富,核糖体、线粒体较多,在线粒体上可见深电子密度的圆形颗粒,有丰富的粗面内质网及分泌小泡,泡内为合成的基质成份,胞浆中还可见大量成团的糖原颗粒。说明细胞分泌状态旺盛。有的细胞表面可见微绒毛突起。
3 讨 论
3.1 细胞培养方式与组织工程的关系
软骨组织工程研究中一个重要的问题是细胞单层培养时出现反分化现象,随着传代次数增加或培养时间增长,软骨细胞由圆形变扁,mRNA表达改变;软骨的主要成分Ⅱ、Ⅺ型胶原合成减少,而Ⅰ型、Ⅲ型胶原增加;逐渐产生金属蛋白酶抑制因子、细胞自溶素B,氨基乙糖苷酶活力增强。这些物质抑制软骨细胞生长,传至第16代时完全失去合成胶原和氨基多糖的能力[5]。因此,需要一种培养方式,使软骨细胞在体外保持稳定的表型表达,以维持其正常功能[6]。三维立体培养,能维持细胞正常表型,为细胞提供生长代谢空间,从而保持其正常功能[7]。在组织工程研究中,已有多种生物材料用于细胞的三维载体。一些凝胶态的生物材料,如琼脂糖、透明质酸、纤维蛋白、藻酸盐和聚乙烯醇氧化物等,还能促进细胞增殖、分化、分泌基质[8]。
, 百拇医药
3.2 几丁糖对软骨细胞的作用
几丁糖是由虾、蟹等动物甲壳的高分子化合物几丁质脱N-乙酰基后,加工而成的一种氨基多糖,它和关节软骨基质中氨基多糖很相似,其降解中间产物对细胞无害,最终物为水和二氧化碳。实验证明,几丁糖是一种组织相容性好、生物可降解、高度活性的聚合物,已经广泛应用于医药各领域。本实验将软骨细胞接种于几丁糖凝胶中,见软骨细胞在几丁糖中维持圆形, 增殖、分化活跃;透射电镜下见细胞内有丰富的粗面内质网、线粒体及分泌泡,有大量的基质合成。甲苯胺蓝及Ⅱ型胶原免疫组化染色呈强阳性,提示软骨细胞能分泌较多氨基多糖和Ⅱ型胶原成分,与单层培养相比较,有明显差异(P<0.05)。故此我们可认为,几丁糖能稳定地维持软骨细胞的表型表达,适合作为软骨组织工程研究的细胞载体材料。几丁糖如何促进软骨细胞的增殖分化,目前还不太清楚。有研究表明,几丁质寡聚糖合成酶与南非有爪蟾蜍发育基因DG42相似,它也可在斑马鱼甚至小鼠的胚胎早期表达,促进透明质酸的合成,推测几丁质-几丁质寡聚糖-透明质酸-软骨之间的某种代谢关系,使它具有特殊生物活性[9]。
, http://www.100md.com
基金项目:香港杨震基金资助课题
作者简介:郑卫平(1970-),男,江西新干人,硕士,医师.
参考文献:
[1] Martin I, Quarto R, Dozin B, et al. Producing prefabricated tissues and organs via tissue engineering[J]. IEEE Eng Med Biol Mag, 1997, 16(2): 73.
[2] 侯春林,卢建熙,包聚良,等.几丁质生物学特性研究[J]. 中国修复重建外科杂志, 1993, 79(1): 115.
[3] 姚向前, 马绪臣, 张震康. 兔下颌骨髁状突软骨细胞的分离、培养和鉴定[J]. 北京医科大学学报, 1996, 28(6): 436.
, http://www.100md.com
[4] Lillich J, Bertone A, Malemud C. Biochemical, histochemical, and immunohistochemical characterization of distal tibial osteochondrosis in horses [J]. Am J Vet Res, 1997,58(1):89.
[5] Wakitani S, Kimura T, Hirooka A, et al. Repair of rabbit articular surfaces with allograft chondrocytes embedded in collagen gel[J]. J Bone Joint Surg(Br), 1989, 71(1): 74.
[6] Glowacki J, Trepman E, Folkman J. Cell shaped and phenotype expression in chondrocytes. Proc Soc Exp Biol Med, 1983, 172(1): 93.
, 百拇医药
[7] Minuth W W, Stittiner M, Kloth S. Tissue engineering: generation of differentiated artificial tissues for biomedical applications [J]. Cell Tissue Res, 1998, 291(1): 1
[8] 陶 凯, 杨维东. 可注射性软骨[J]. 国外医学生物医学工程分册, 1999, 26(4): 207.
[9] Semino C E, Specht C A, Raimond A, et al. Homologs of the xenopus developmental gene DG42 are present in zebrafish and mouse and are involved in the synthesis of nod like chitin oligosaccharides during early embryogenesis[J]. Proc Natl Acad Sci USA, 1996, 93(10): 4548.
收稿日期:2000-03-16, 百拇医药
单位:中山医科大学口腔医学院口腔颌面外科, 广东 广州 510055
关键词:关节;软骨;细胞学;几丁糖凝胶;细胞培养;软骨细胞;超微结构
中山医科大学学报000413
摘 要:【目的】 观察关节软骨细胞在几丁糖凝胶中培养的生物学行为,以探讨几丁糖凝胶作为组织工程细胞支架的可行性。【方法】 从幼龄兔关节表面削取薄层软骨,经酶消化获得大量的软骨细胞。原代培养后,按106/mL细胞浓度接种于几丁糖凝胶,通过绘制生长曲线,组织化学检测,透射电镜观察,了解软骨细胞在几丁糖中生长特征。【结果】 软骨细胞在几丁糖中保持圆形,甲苯胺蓝异染及Ⅱ型胶原免疫组化染色呈强阳性;细胞内富含高尔基体、粗面型内质网及大量的分泌泡。【结论】 软骨细胞在几丁糖中保持圆形生长状态,几丁糖能促进软骨细胞分裂、增殖,提高其分泌基质的能力。几丁糖可作为可注射性软骨组织工程的载体材料。
, 百拇医药
中图分类号:R782 文献标识码: A
文章编号:1000-257X(2000)04-0277-03
Biological Behavior of Rabbit Articular Chondrocyte in Chitosan Gels
ZHENG Wei-ping, ZHANG Zhi-guang, ZHENG You-hua, YANG Guo-ping
(Department of Oral and Maxillofacial Surgery, College of Stomatology,Sun Yat-sen University of Medical Sciences, Guangzhou 510055, China)
Abstract: 【Objective】 To observe the biological behavior of chondrocyte in chitosan gels in vitro and the possibility of chitosan using as scaffolds in tissue engineering. 【Methods】 Chondrocytes isolated by enzymic digestion from the condylar cartilages of the young rabbits were cultured in monolayer system. After primary culture, the cells were seeded in chitosan gels in concentration of 106/mL in vitro. Characteristics of chondrocyte growth were observed with growth curve, toluidine blues staining, type Ⅱ collagen immunohistochemistry reaction and also observed by electronic microscope. 【Result】 Chondrocytes retained their surrounded morphology, multiplited, and produced matrix in chitosan gels. The results of histochemistry examination were strong postive. Most cells appeared to contain several golgi zones and large areas of rough endoplasmic reticulum, partly filled with dense secretory material. 【Conclusion】 Cell-culture system, using chitosan gels, provided chondrocytes a suitable environment in which synthesized matrix macromolecules and preserved their surrouned morophology in vitro. Chitosan gels may be a vehicle for injectable tissue-engineered cartilage.
, 百拇医药
Key words:cartilage, articular/cytology; chitosan gel; cell culture; chondrocyte/ultrastructure
关节软骨自身修复能力很低,各种原因导致的软骨缺损很难自愈,在临床治疗中一直是个难题。组织工程技术的应用,为该疾病的治疗提供了新的方法。其基本思路是在体外将一定数量的关节软骨细胞接种到载体支架中,培养形成具有活性和功能的软骨组织,然后移植到缺损部位,以达到修复重建的目的[1]。目前组织工程的研究重点在于寻找最适的细胞载体材料。几丁糖凝胶是一种高分子多糖类物质,有良好的生物相容性、可降解性、生物活性[2]。本研究将软骨细胞接种于几丁糖凝胶中,观察细胞生长、增殖、分化等情况,为进行可注射性软骨移植实验打下基础。
1 材料和方法
1.1 软骨细胞的分离
, 百拇医药
2周龄新西兰白兔2只(中山医科大学实验动物中心提供), 参照文献[3]方法,无菌条件下削取颞下颌关节(TMJ)及四肢关节表面软骨,切成1.0 mm3大小,置于2.5 mg/L胰蛋白酶(Advanced)5 mL中消化40 min, 弃去消化液;再加入 1 mg/LⅡ型胶原酶(Sigma)5 mL, 消化4~6 h。细胞大部分游离后,200目筛网过滤,收集并离心(1 000 r/min, 5 min)。血细胞计数板计数,台盼蓝拒染检测软骨细胞活性。获得软骨细胞5×106,活性率为95%。
1.2 软骨细胞的原代培养
将细胞按1.0×106/孔接种于6孔培养板 , 加入2 mL DMEM培养液(Gibco),培养液中添加150 mL/L小牛血清(中山医科大学微生物教研室)、青霉素10 万U/L、庆大霉素1 g/L,于37 ℃、饱和湿度、体积分数为5% CO2的细胞培养孵箱中培养, 每3 d换液1次, 倒置显微镜下观察并照相,细胞长满后用2.5 mg/L胰蛋白酶消化并收集、计数。
, 百拇医药
1.3 软骨细胞在几丁糖中培养
取初代软骨细胞, 分成2组。一组接种于几丁糖凝胶(上海其胜生物制剂实业公司)中, 使细胞终浓度为109/L,再加入DMEM培养液;另组按相同的细胞浓度直接种于DMEM培养液。每3 d换1次液,观察并比较2种条件下细胞的生长情况。
1.4 绘制生长曲线
分别于接种后1、2、3、4、5、6、7、8 d各取3孔细胞进行计数,两组间进行t检验,绘制生长曲线。
1.5 组织化学检查
培养细胞用10 g/L甲苯胺蓝(pH 2.5)进行基质异染,能特异地反映软骨细胞分泌的硫酸糖胺聚糖的含量[4]。取生长良好的软骨细胞,PBS(pH 7.4)冲洗,体积分数为95%酒精固定,ABC法进行Ⅱ型胶原免疫组化染色。
, http://www.100md.com
1.6 透射电镜观察
取生长良好的软骨细胞,经2.5 g/L胰蛋白酶消化后移入离心管,3 000 r/min离心10 min,取出细胞团块用30 mL/L戊二醛固定,锇酸后固定,丙酮系列脱水,环氧树脂包埋,切片进行观察。
2 结 果
2.1 软骨细胞的原代培养
接种培养24 h后,细胞开始贴壁、伸展,出现增殖、分化。8 d左右,细胞逐渐融合长满瓶底。
2.2 软骨细胞在几丁糖凝胶中的生长
几丁糖凝胶为白色半透明。软骨细胞接种后8~12 h,在相差显微镜下可见大部分细胞保持圆形形态,定植在凝胶中,少数在凝胶表面附着者,呈椭圆形。对照组,细胞定植于孔底,呈多角形。培养后3 d,细胞不断分化、增殖。甲苯胺蓝染色示细胞内及胞周有异染物质出现,Ⅱ型胶原染色也显示细胞浆染成棕黄色。5~7 d,几丁糖逐渐收缩、降解。甲苯胺蓝染色及Ⅱ型胶原染色呈强阳性,胞内外着色连成一片。9~10 d,仍可见几丁糖存在。镜下可见类软骨物质出现,呈结节状。甲苯胺蓝染色及Ⅱ型胶原染色分别呈强阳性,显示含有较多的氨基多糖和Ⅱ型胶原成分(图1、2)。

, 百拇医药
图1 软骨细胞甲苯胺蓝染色呈强阳性
Fig.1 Toluidine blue staining is strong postive in Chondrocytes(×100)

图2 软骨细胞Ⅱ型胶原单克隆抗体免疫组化染色呈强阳性
Fig.2 Immunohistochemistical stain with anti-type Ⅱantibody is strong postive in Chondrocytes(×100)
几丁糖组及单层组软骨细胞生长曲线见图3。

, 百拇医药
图3 几丁糖组、单层培养组软骨细胞生长曲线
Fig.3 Growth curve of chondrocytes with in chitosangels and in monolayer cultures
透射电镜观察见:细胞核较大,多为圆形,形态不规则,核仁边聚,常染色质明显。细胞质胞浆丰富,核糖体、线粒体较多,在线粒体上可见深电子密度的圆形颗粒,有丰富的粗面内质网及分泌小泡,泡内为合成的基质成份,胞浆中还可见大量成团的糖原颗粒。说明细胞分泌状态旺盛。有的细胞表面可见微绒毛突起。
3 讨 论
3.1 细胞培养方式与组织工程的关系
软骨组织工程研究中一个重要的问题是细胞单层培养时出现反分化现象,随着传代次数增加或培养时间增长,软骨细胞由圆形变扁,mRNA表达改变;软骨的主要成分Ⅱ、Ⅺ型胶原合成减少,而Ⅰ型、Ⅲ型胶原增加;逐渐产生金属蛋白酶抑制因子、细胞自溶素B,氨基乙糖苷酶活力增强。这些物质抑制软骨细胞生长,传至第16代时完全失去合成胶原和氨基多糖的能力[5]。因此,需要一种培养方式,使软骨细胞在体外保持稳定的表型表达,以维持其正常功能[6]。三维立体培养,能维持细胞正常表型,为细胞提供生长代谢空间,从而保持其正常功能[7]。在组织工程研究中,已有多种生物材料用于细胞的三维载体。一些凝胶态的生物材料,如琼脂糖、透明质酸、纤维蛋白、藻酸盐和聚乙烯醇氧化物等,还能促进细胞增殖、分化、分泌基质[8]。
, 百拇医药
3.2 几丁糖对软骨细胞的作用
几丁糖是由虾、蟹等动物甲壳的高分子化合物几丁质脱N-乙酰基后,加工而成的一种氨基多糖,它和关节软骨基质中氨基多糖很相似,其降解中间产物对细胞无害,最终物为水和二氧化碳。实验证明,几丁糖是一种组织相容性好、生物可降解、高度活性的聚合物,已经广泛应用于医药各领域。本实验将软骨细胞接种于几丁糖凝胶中,见软骨细胞在几丁糖中维持圆形, 增殖、分化活跃;透射电镜下见细胞内有丰富的粗面内质网、线粒体及分泌泡,有大量的基质合成。甲苯胺蓝及Ⅱ型胶原免疫组化染色呈强阳性,提示软骨细胞能分泌较多氨基多糖和Ⅱ型胶原成分,与单层培养相比较,有明显差异(P<0.05)。故此我们可认为,几丁糖能稳定地维持软骨细胞的表型表达,适合作为软骨组织工程研究的细胞载体材料。几丁糖如何促进软骨细胞的增殖分化,目前还不太清楚。有研究表明,几丁质寡聚糖合成酶与南非有爪蟾蜍发育基因DG42相似,它也可在斑马鱼甚至小鼠的胚胎早期表达,促进透明质酸的合成,推测几丁质-几丁质寡聚糖-透明质酸-软骨之间的某种代谢关系,使它具有特殊生物活性[9]。
, http://www.100md.com
基金项目:香港杨震基金资助课题
作者简介:郑卫平(1970-),男,江西新干人,硕士,医师.
参考文献:
[1] Martin I, Quarto R, Dozin B, et al. Producing prefabricated tissues and organs via tissue engineering[J]. IEEE Eng Med Biol Mag, 1997, 16(2): 73.
[2] 侯春林,卢建熙,包聚良,等.几丁质生物学特性研究[J]. 中国修复重建外科杂志, 1993, 79(1): 115.
[3] 姚向前, 马绪臣, 张震康. 兔下颌骨髁状突软骨细胞的分离、培养和鉴定[J]. 北京医科大学学报, 1996, 28(6): 436.
, http://www.100md.com
[4] Lillich J, Bertone A, Malemud C. Biochemical, histochemical, and immunohistochemical characterization of distal tibial osteochondrosis in horses [J]. Am J Vet Res, 1997,58(1):89.
[5] Wakitani S, Kimura T, Hirooka A, et al. Repair of rabbit articular surfaces with allograft chondrocytes embedded in collagen gel[J]. J Bone Joint Surg(Br), 1989, 71(1): 74.
[6] Glowacki J, Trepman E, Folkman J. Cell shaped and phenotype expression in chondrocytes. Proc Soc Exp Biol Med, 1983, 172(1): 93.
, 百拇医药
[7] Minuth W W, Stittiner M, Kloth S. Tissue engineering: generation of differentiated artificial tissues for biomedical applications [J]. Cell Tissue Res, 1998, 291(1): 1
[8] 陶 凯, 杨维东. 可注射性软骨[J]. 国外医学生物医学工程分册, 1999, 26(4): 207.
[9] Semino C E, Specht C A, Raimond A, et al. Homologs of the xenopus developmental gene DG42 are present in zebrafish and mouse and are involved in the synthesis of nod like chitin oligosaccharides during early embryogenesis[J]. Proc Natl Acad Sci USA, 1996, 93(10): 4548.
收稿日期:2000-03-16, 百拇医药