重建型蓖麻蛋白脂质体的制备、性质及对肝癌细胞的毒性
作者:王新建 杨建国
单位:王新建(河南省药品检验所生化室 郑州 450003);杨建国(郑州一中生物组 郑州 450007)
关键词:重建型脂质体;蓖麻蛋白;肝癌
河南医科大学学报000333 摘要 目的:制备重建型蓖麻蛋白脂质体(RRL),并探讨其毒性作用。方法:通过正交法实验选择配方,并采用冷冻干燥脱水-再水化-囊泡化方法(DRV法)制备RRL;用体外细胞毒性试验和小鼠半数致死量(LD50)试验测定RRL毒性。结果:RRL的包封率可达59.63%(含50 g/L的甘露醇),粒径为0.50~0.79 μm(占90%以上),经4 ℃ 0.5 a贮存,其粒径和粒度分布无明显变化。RRL对7 721人肝癌细胞的半数细胞抑制浓度(IC50)与游离蓖麻蛋白的IC50之比为1∶2.47;RRL的LD50为(55.61±19.71) μg/kg,毒性下降27.66%。结论:本法所得RRL性质稳定,药物包封率较高,并提高了对肝癌细胞的毒性,降低了对小鼠的毒性,为临床研制蓖麻蛋白的新剂型提供了理论依据。
, http://www.100md.com
分类号 R94;TQ460.7;TQ460.7+2
Study on preparation, characteristics and toxicity to hepatoma cells of reconstituted ricin liposomes
WANG Xinjian
(Department of Biochemistry,Henan Provincial Institute for Drug Control,Zhengzhou 450003)
YANG Jianguo
(Department of Biology,the No.1 Middle School of Zhengzhou,Zhengzhou 450007)
, 百拇医药
Abstract Aim:Prepare reconstituted liposome entraprment of Ricin(RRL)and study its toxicity.Methods:Screen the optimum preparation condition of RRL by orthogonal design and prepare RRL by dehydration—rehydration vesicles(DRV)methods;Assay toxicity of RRL by IC50 and LD50. Results:The encapsulation efficiency of RRL with 5% mannitol is 59.63%. The distribution of particle size of RRL is mainly in the range of 0.50~0.79 μm and change very little in half a year at 4 ℃.The ratios of IC50 of RRL and free ricin to human hepatoma cells line 7721 is 1:2.47;The mouse LD50 of RRL is (55.61±19.71) μg/kg , reduce its toxicity by 27.66%.Conclusion:RRL prepared by this method is stable and have high encapsulation efficiency.Ricin entrapped in liposomes promote its cytotoxicity to hepatoma and reduce its toxic side-effect.This study may be significant in clinical use of RRL.
, http://www.100md.com
Key words reconstituted liposomes;ricin;hepatoma cells
在临床上已有用蓖麻蛋白(Ricin,简称R)对小鼠艾氏腹水瘤、乳腺癌、Lewis肺癌进行治疗的报道[1],但是由于蓖麻蛋白对细胞杀伤是非特异性的,因此有严重的毒副作用。在临床上常会出现呼吸困难,白蛋白减少,浮肿,体重增加等症状[2],限制了其在肿瘤治疗中的应用。能否利用脂质体包封R,以降低毒性并提高对癌细胞的杀伤作用?张今等[3]曾用半乳糖神经酰胺脂质体包封R。结果表明,R经脂质体包封后,提高了对体外培养细胞(7721人肝癌细胞)的杀伤力,而且降低了对正常小鼠的毒性。但是用磷脂脂质体包封R作为抗癌药物新剂型的研究尚未见报道。作者就重建型蓖麻蛋白磷脂脂质体的配方、理化性质以及对肝癌细胞的体外杀伤力和小鼠毒性(LD50)等作了研究。
1 材料与方法
, 百拇医药
1.1 材料 蓖麻蛋白(上海市第二肺科医院免疫室提供),噻唑兰(MTT)(美国Sigma公司)。7721人肝癌细胞株(购自中科院上海细胞研究所),昆明纯种小白鼠(购自中科院上海市实验动物中心),大豆磷脂、胆固醇(上海油脂一厂),甘露醇(上海试剂二厂,AR),1,1,3,3-四乙氧基丙烷[TEP](Sigma产品)。真空冷冻干燥机(美国LABCONCO公司),SCR20BA型超速离心机(日本HITACHI公司),WCl/005-2型微粒分析仪(上海第二光学仪器厂),DG-3022A型酶联免疫检测仪(南京市国营华东电子管厂)。
1.2 实验方法
1.2.1 包裹有蓖麻蛋白的重建型脂质体(Reconstitued Ricin liposome,RRL)的制备:参考冻干脱水-水化-再囊泡化(Dehydration-Rehydration Vesicles,简称DRV)法[4]进行。将一定量的大豆磷脂和胆固醇溶于乙醇中,然后注入pH 7.5,0.01 mol/L Tris.HCl缓冲液中,得到空白脂质体。将一定量的蓖麻蛋白及赋形剂(甘露醇)与空白脂质体混匀,以每瓶0.6 ml分装,经真空冻冷干燥成白色的冻干粉,密封后经60Co辐射灭菌, 4 ℃保存备用。临用前加无菌水0.6 ml ,短时振荡,将冻干粉水化成蓖麻蛋白的重建型脂质体(RRL)。
, http://www.100md.com
1.2.2 包封率的测定:水化后的RRL经过超速离心(48 000 r/min,2 h),收集上清液,用考马斯亮兰染色法分别测定R总含量和上清液中游离R含量,按下式计算包封率:
包封率(%)=[(Ricin总量-游离Ricin含量)/Ricin总量]×100
1.2.3 蓖麻蛋白脂质体的配方优化选择:张今等[3]研究结果表明,蓖麻蛋白脂质体的包封率与制备时缓冲液的pH和离子强度有关,并认为获得最高包封率的条件是pH7.5,离子强度0.01 mol/L (Tris.HCl缓冲液)。作者在此基础上,用正交优化法按表1设计3个因素、4个水平,进行筛选试验。表1中A:蓖麻蛋白(mg/L),B:磷脂(g/L),C:胆固醇(g/L)
表1 各种因素和水平正交优化表 水平
因 素
, 百拇医药
A
B
C
1
8
0.5
0.0
2
16
1.0
0.2
3
40
2.0
, 百拇医药
0.4
4
64
4.0
1.0
按正交表L16(45)设计16个配方制备蓖麻蛋白脂质体,并以包封率为指标进行最佳配方的选择。
1.2.4 粒径及粒度分布测定:按文献[5]方法在微粒分析仪上测定脂质体的粒径及粒度分布。测定条件: 速度为20 ml/min, 时间为90 s,测定范围为0.50~16.02 μm。
1.2.5 MTT比色分析细胞存活率:在96孔培养板的每一孔内加入100 μl 7721人肝癌细胞悬液(浓度为105~106个/ml),贴壁培养24 h。吸去每一孔内的培养液后,加入不同浓度的药物 (R 或 RRL)100 μl继续培养48 h,每一孔内吸去培养液后加入50 μl MTT溶液(1 g/L),在37 ℃温育4 h,吸去上清液,加入100 μl/孔二甲基亚砜(DMSO),振荡2 min,在DG3022-A型酶联免疫检测仪上读出每孔的A570,以不加药的细胞存活率为100%,计算各条件下的细胞存活率,同时用游离药物,不载药物空白脂质体作为对照,每个样品作10个平行孔。
, 百拇医药
细胞存活率按下式计算:
细胞存活率(%)=(实验组A570/空白对照组A570)×100
1.2.6 小鼠毒性试验(LD50 ):取体重18~22 g的昆明种小鼠,雌雄兼取,随机分为5组,每组4只,腹腔注射不同剂量的R或RRL后,观察并记录给药72 h各组动物的反应和死亡率,由简化机率单位法计算LD50 ,并与对照组比较。
2 结果
2.1 蓖麻蛋白脂质体的配方优化选择 结果见表2。由极差值可以看出,R浓度对蓖麻毒蛋白脂质体包封率影响最大,胆固醇和磷脂用量的影响较小。为获得最大包封率(48.67%),制备RL时的配方应为,蓖麻蛋白40 mg/L,磷脂0.5 g/L,胆固醇0.4 g/L。
, 百拇医药
表2 不同因素水平对RRL包封率的影响 样品
处理号
因 素
包封率/%
A
B
C
1
1
1
1
16.35
2
, 百拇医药
1
2
2
24.72
3
1
3
3
38.67
4
1
4
4
33.09
, 百拇医药
5
2
1
2
34.46
6
2
2
3
44.22
7
2
3
4
, 百拇医药
47.01
8
2
4
1
31.81
9
3
1
3
48.67
10
3
2
, 百拇医药
4
46.44
11
3
3
1
37.51
12
3
4
2
33.05
13
4
, http://www.100md.com
1
4
29.32
14
4
2
1
14.44
15
4
3
2
26.07
16
, http://www.100md.com
4
4
3
12.05
I/4
28.21
32.20
25.03
II/4
39.38
32.46
29.58
III/4
, 百拇医药
41.42
37.32
35.90
IV/4
20.47
27.50
38.97
极差
20.95
9.82
13.94
2.2 赋形剂对包封率的影响 甘露醇是脂质体冻干时添加的赋形剂,见表3。表3 蓖麻蛋白脂质体的包封率 ρ(甘露醇)
, 百拇医药
/g.L-1
m(R总量)
/μg
m(游离R测
定量)/μg
m(脂质体
中R量)
/μg
包封率
/%
0
40
, 百拇医药 20.53
19.47
48.67
25
40
17.82
22.18
55.45
50
40
16.15
23.85
59.63
, 百拇医药
由表3可见,甘露醇可以提高重建型脂质体的包封率,其中含有50 g/L甘露醇脂质体的包封率可高达59.63%。
2.3 脂质体粒径及粒度分布 见图1。
图1 RRL的粒径及粒度分布
16个通道直径(μm)依次为:0.5,0.63,0.79,1.00,1.26,1.5,2.0,2.52,3.18,4.00,5.04,6.35,8.01,10.09,12.71,16.02
由图1可见,RRL的粒度分布较集中,90.08%分布在0.50~0.79 μm的范围内,分布在5.04 μm 以内的颗粒占99.71% 。4 ℃贮存6个月后,粒径为0.5~0.79 μm的脂质体仍占85.33%,5.04 μm以内的颗粒占99%。可见,在本实验条件下制备的RRL比较稳定,贮存6个月后脂质体的粒径仍符合静脉注射液的粒径标准。
, 百拇医药
2.4 细胞毒性 见图2。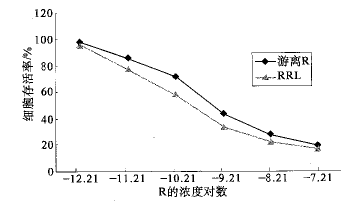
图2 RRL和游离R对7 721人肝癌细胞毒性(n=10)
由图2可知,游离R和RRL对7 721人肝癌细胞抑制作用均随浓度增大而增强。值得注意的是,在一定浓度范围内,与以杀伤50%肝癌细胞所需要的药物浓度(IC50)相比,RRL的IC50约为1.95×10-10mol/L,而游离Ricin的IC50约为4.89×10-10 mol/L,结果表明,RRL对人肝癌细胞的杀伤力比游离的Ricin高2.47倍。
2.5 小鼠毒性实验 其95%平均可信限为R的LD50=43.560±12.316 μg/kg,RRL的LD50=(55.61±19.71) μg/kg,RRL毒性比游离R降低了27.66%。
, 百拇医药
3 讨 论
脂质体的制备方法很多[6],考虑到蛋白质易变性的特性,在制备脂质体过程中必须避免加热过程。因此作者采用DRV法[4],制备包有蓖麻蛋白的重建型脂质体。结果表明,这种冻干态的脂质体,不仅使蓖麻蛋白不受热变性,而且便于长期保存,避免脂质体水混悬态时易聚集,粒径变大,从而破坏混悬液的均态。
包封率是研制载药脂质体的一个关键问题。脂质体的包封率,除了与制备条件(pH,离子强度)有关外,与脂质体配方也密切相关。由表2可见,脂质体中药物含量能明显影响包封率,而脂质量的影响相对较小。此外,赋形剂对包封率也有影响,在重建的RL中,由于含有50 g/L的甘露醇,其包封率可提高到59.63%,其原因与赋形剂对载药脂质体有保护作用有关。童桥等[7]人认为含多羟基的糖类赋形剂能防护冷冻干燥对脂质体膜结构的损伤作用。
实验结果表明,蓖麻蛋白经脂质体包裹后可提高药效降低毒性。这和张今等[3]的报道一致。实验中对脂质体试样均未分离纯化,可能尚存未包封的Ricin,如果用纯化的脂质体试样作实验,其提高药效、降低毒性的效果将更加明显。
, 百拇医药
研究方向:膜的生物化学
作者简介:王新建,女,30岁,华东师范大学99届生化专业研究生,参考文献
[1]Marks A, Ettenson D, Bjorn MJ. Inhibition of human tumor growth by intraperitoneal immunotoxins in nude mice. Cancer Research, 1990,50(1):288
[2]王文香.重组蓖麻毒素的研究及应用.免疫杂志,1994,10(3):198
[3]张今,秦德安.包裹蓖麻蛋白的脂质体的制备、性质及毒性研究.生物化学与生物物理学报,1999,31(4):472
[4]Kirby C, Gregoriadis, G. Dehydration-rehydration Vesicles:a simple method for high yield drug entrapment in liposomes. Biotechnology, 1984,2:979
[5]马淑贤,王海波,丁玉玲.橄香烯脂质体(EL)的凝聚动力学研究.生物化学与生物物理学报,1993,25(2): 127
[6]刘文龙,张志鸿.生物膜与脂质体技术.长沙:湖南科技出版社,1989
[7]童桥,聂松青.糖和膜脂的相互作用-脂质体稳定性研究.生理科学进展,1996,27(2):123
2000-01-12收稿, 百拇医药
单位:王新建(河南省药品检验所生化室 郑州 450003);杨建国(郑州一中生物组 郑州 450007)
关键词:重建型脂质体;蓖麻蛋白;肝癌
河南医科大学学报000333 摘要 目的:制备重建型蓖麻蛋白脂质体(RRL),并探讨其毒性作用。方法:通过正交法实验选择配方,并采用冷冻干燥脱水-再水化-囊泡化方法(DRV法)制备RRL;用体外细胞毒性试验和小鼠半数致死量(LD50)试验测定RRL毒性。结果:RRL的包封率可达59.63%(含50 g/L的甘露醇),粒径为0.50~0.79 μm(占90%以上),经4 ℃ 0.5 a贮存,其粒径和粒度分布无明显变化。RRL对7 721人肝癌细胞的半数细胞抑制浓度(IC50)与游离蓖麻蛋白的IC50之比为1∶2.47;RRL的LD50为(55.61±19.71) μg/kg,毒性下降27.66%。结论:本法所得RRL性质稳定,药物包封率较高,并提高了对肝癌细胞的毒性,降低了对小鼠的毒性,为临床研制蓖麻蛋白的新剂型提供了理论依据。
, http://www.100md.com
分类号 R94;TQ460.7;TQ460.7+2
Study on preparation, characteristics and toxicity to hepatoma cells of reconstituted ricin liposomes
WANG Xinjian
(Department of Biochemistry,Henan Provincial Institute for Drug Control,Zhengzhou 450003)
YANG Jianguo
(Department of Biology,the No.1 Middle School of Zhengzhou,Zhengzhou 450007)
, 百拇医药
Abstract Aim:Prepare reconstituted liposome entraprment of Ricin(RRL)and study its toxicity.Methods:Screen the optimum preparation condition of RRL by orthogonal design and prepare RRL by dehydration—rehydration vesicles(DRV)methods;Assay toxicity of RRL by IC50 and LD50. Results:The encapsulation efficiency of RRL with 5% mannitol is 59.63%. The distribution of particle size of RRL is mainly in the range of 0.50~0.79 μm and change very little in half a year at 4 ℃.The ratios of IC50 of RRL and free ricin to human hepatoma cells line 7721 is 1:2.47;The mouse LD50 of RRL is (55.61±19.71) μg/kg , reduce its toxicity by 27.66%.Conclusion:RRL prepared by this method is stable and have high encapsulation efficiency.Ricin entrapped in liposomes promote its cytotoxicity to hepatoma and reduce its toxic side-effect.This study may be significant in clinical use of RRL.
, http://www.100md.com
Key words reconstituted liposomes;ricin;hepatoma cells
在临床上已有用蓖麻蛋白(Ricin,简称R)对小鼠艾氏腹水瘤、乳腺癌、Lewis肺癌进行治疗的报道[1],但是由于蓖麻蛋白对细胞杀伤是非特异性的,因此有严重的毒副作用。在临床上常会出现呼吸困难,白蛋白减少,浮肿,体重增加等症状[2],限制了其在肿瘤治疗中的应用。能否利用脂质体包封R,以降低毒性并提高对癌细胞的杀伤作用?张今等[3]曾用半乳糖神经酰胺脂质体包封R。结果表明,R经脂质体包封后,提高了对体外培养细胞(7721人肝癌细胞)的杀伤力,而且降低了对正常小鼠的毒性。但是用磷脂脂质体包封R作为抗癌药物新剂型的研究尚未见报道。作者就重建型蓖麻蛋白磷脂脂质体的配方、理化性质以及对肝癌细胞的体外杀伤力和小鼠毒性(LD50)等作了研究。
1 材料与方法
, 百拇医药
1.1 材料 蓖麻蛋白(上海市第二肺科医院免疫室提供),噻唑兰(MTT)(美国Sigma公司)。7721人肝癌细胞株(购自中科院上海细胞研究所),昆明纯种小白鼠(购自中科院上海市实验动物中心),大豆磷脂、胆固醇(上海油脂一厂),甘露醇(上海试剂二厂,AR),1,1,3,3-四乙氧基丙烷[TEP](Sigma产品)。真空冷冻干燥机(美国LABCONCO公司),SCR20BA型超速离心机(日本HITACHI公司),WCl/005-2型微粒分析仪(上海第二光学仪器厂),DG-3022A型酶联免疫检测仪(南京市国营华东电子管厂)。
1.2 实验方法
1.2.1 包裹有蓖麻蛋白的重建型脂质体(Reconstitued Ricin liposome,RRL)的制备:参考冻干脱水-水化-再囊泡化(Dehydration-Rehydration Vesicles,简称DRV)法[4]进行。将一定量的大豆磷脂和胆固醇溶于乙醇中,然后注入pH 7.5,0.01 mol/L Tris.HCl缓冲液中,得到空白脂质体。将一定量的蓖麻蛋白及赋形剂(甘露醇)与空白脂质体混匀,以每瓶0.6 ml分装,经真空冻冷干燥成白色的冻干粉,密封后经60Co辐射灭菌, 4 ℃保存备用。临用前加无菌水0.6 ml ,短时振荡,将冻干粉水化成蓖麻蛋白的重建型脂质体(RRL)。
, http://www.100md.com
1.2.2 包封率的测定:水化后的RRL经过超速离心(48 000 r/min,2 h),收集上清液,用考马斯亮兰染色法分别测定R总含量和上清液中游离R含量,按下式计算包封率:
包封率(%)=[(Ricin总量-游离Ricin含量)/Ricin总量]×100
1.2.3 蓖麻蛋白脂质体的配方优化选择:张今等[3]研究结果表明,蓖麻蛋白脂质体的包封率与制备时缓冲液的pH和离子强度有关,并认为获得最高包封率的条件是pH7.5,离子强度0.01 mol/L (Tris.HCl缓冲液)。作者在此基础上,用正交优化法按表1设计3个因素、4个水平,进行筛选试验。表1中A:蓖麻蛋白(mg/L),B:磷脂(g/L),C:胆固醇(g/L)
表1 各种因素和水平正交优化表 水平
因 素
, 百拇医药
A
B
C
1
8
0.5
0.0
2
16
1.0
0.2
3
40
2.0
, 百拇医药
0.4
4
64
4.0
1.0
按正交表L16(45)设计16个配方制备蓖麻蛋白脂质体,并以包封率为指标进行最佳配方的选择。
1.2.4 粒径及粒度分布测定:按文献[5]方法在微粒分析仪上测定脂质体的粒径及粒度分布。测定条件: 速度为20 ml/min, 时间为90 s,测定范围为0.50~16.02 μm。
1.2.5 MTT比色分析细胞存活率:在96孔培养板的每一孔内加入100 μl 7721人肝癌细胞悬液(浓度为105~106个/ml),贴壁培养24 h。吸去每一孔内的培养液后,加入不同浓度的药物 (R 或 RRL)100 μl继续培养48 h,每一孔内吸去培养液后加入50 μl MTT溶液(1 g/L),在37 ℃温育4 h,吸去上清液,加入100 μl/孔二甲基亚砜(DMSO),振荡2 min,在DG3022-A型酶联免疫检测仪上读出每孔的A570,以不加药的细胞存活率为100%,计算各条件下的细胞存活率,同时用游离药物,不载药物空白脂质体作为对照,每个样品作10个平行孔。
, 百拇医药
细胞存活率按下式计算:
细胞存活率(%)=(实验组A570/空白对照组A570)×100
1.2.6 小鼠毒性试验(LD50 ):取体重18~22 g的昆明种小鼠,雌雄兼取,随机分为5组,每组4只,腹腔注射不同剂量的R或RRL后,观察并记录给药72 h各组动物的反应和死亡率,由简化机率单位法计算LD50 ,并与对照组比较。
2 结果
2.1 蓖麻蛋白脂质体的配方优化选择 结果见表2。由极差值可以看出,R浓度对蓖麻毒蛋白脂质体包封率影响最大,胆固醇和磷脂用量的影响较小。为获得最大包封率(48.67%),制备RL时的配方应为,蓖麻蛋白40 mg/L,磷脂0.5 g/L,胆固醇0.4 g/L。
, 百拇医药
表2 不同因素水平对RRL包封率的影响 样品
处理号
因 素
包封率/%
A
B
C
1
1
1
1
16.35
2
, 百拇医药
1
2
2
24.72
3
1
3
3
38.67
4
1
4
4
33.09
, 百拇医药
5
2
1
2
34.46
6
2
2
3
44.22
7
2
3
4
, 百拇医药
47.01
8
2
4
1
31.81
9
3
1
3
48.67
10
3
2
, 百拇医药
4
46.44
11
3
3
1
37.51
12
3
4
2
33.05
13
4
, http://www.100md.com
1
4
29.32
14
4
2
1
14.44
15
4
3
2
26.07
16
, http://www.100md.com
4
4
3
12.05
I/4
28.21
32.20
25.03
II/4
39.38
32.46
29.58
III/4
, 百拇医药
41.42
37.32
35.90
IV/4
20.47
27.50
38.97
极差
20.95
9.82
13.94
2.2 赋形剂对包封率的影响 甘露醇是脂质体冻干时添加的赋形剂,见表3。表3 蓖麻蛋白脂质体的包封率 ρ(甘露醇)
, 百拇医药
/g.L-1
m(R总量)
/μg
m(游离R测
定量)/μg
m(脂质体
中R量)
/μg
包封率
/%
0
40
, 百拇医药 20.53
19.47
48.67
25
40
17.82
22.18
55.45
50
40
16.15
23.85
59.63
, 百拇医药
由表3可见,甘露醇可以提高重建型脂质体的包封率,其中含有50 g/L甘露醇脂质体的包封率可高达59.63%。
2.3 脂质体粒径及粒度分布 见图1。

图1 RRL的粒径及粒度分布
16个通道直径(μm)依次为:0.5,0.63,0.79,1.00,1.26,1.5,2.0,2.52,3.18,4.00,5.04,6.35,8.01,10.09,12.71,16.02
由图1可见,RRL的粒度分布较集中,90.08%分布在0.50~0.79 μm的范围内,分布在5.04 μm 以内的颗粒占99.71% 。4 ℃贮存6个月后,粒径为0.5~0.79 μm的脂质体仍占85.33%,5.04 μm以内的颗粒占99%。可见,在本实验条件下制备的RRL比较稳定,贮存6个月后脂质体的粒径仍符合静脉注射液的粒径标准。
, 百拇医药
2.4 细胞毒性 见图2。

图2 RRL和游离R对7 721人肝癌细胞毒性(n=10)
由图2可知,游离R和RRL对7 721人肝癌细胞抑制作用均随浓度增大而增强。值得注意的是,在一定浓度范围内,与以杀伤50%肝癌细胞所需要的药物浓度(IC50)相比,RRL的IC50约为1.95×10-10mol/L,而游离Ricin的IC50约为4.89×10-10 mol/L,结果表明,RRL对人肝癌细胞的杀伤力比游离的Ricin高2.47倍。
2.5 小鼠毒性实验 其95%平均可信限为R的LD50=43.560±12.316 μg/kg,RRL的LD50=(55.61±19.71) μg/kg,RRL毒性比游离R降低了27.66%。
, 百拇医药
3 讨 论
脂质体的制备方法很多[6],考虑到蛋白质易变性的特性,在制备脂质体过程中必须避免加热过程。因此作者采用DRV法[4],制备包有蓖麻蛋白的重建型脂质体。结果表明,这种冻干态的脂质体,不仅使蓖麻蛋白不受热变性,而且便于长期保存,避免脂质体水混悬态时易聚集,粒径变大,从而破坏混悬液的均态。
包封率是研制载药脂质体的一个关键问题。脂质体的包封率,除了与制备条件(pH,离子强度)有关外,与脂质体配方也密切相关。由表2可见,脂质体中药物含量能明显影响包封率,而脂质量的影响相对较小。此外,赋形剂对包封率也有影响,在重建的RL中,由于含有50 g/L的甘露醇,其包封率可提高到59.63%,其原因与赋形剂对载药脂质体有保护作用有关。童桥等[7]人认为含多羟基的糖类赋形剂能防护冷冻干燥对脂质体膜结构的损伤作用。
实验结果表明,蓖麻蛋白经脂质体包裹后可提高药效降低毒性。这和张今等[3]的报道一致。实验中对脂质体试样均未分离纯化,可能尚存未包封的Ricin,如果用纯化的脂质体试样作实验,其提高药效、降低毒性的效果将更加明显。
, 百拇医药
研究方向:膜的生物化学
作者简介:王新建,女,30岁,华东师范大学99届生化专业研究生,参考文献
[1]Marks A, Ettenson D, Bjorn MJ. Inhibition of human tumor growth by intraperitoneal immunotoxins in nude mice. Cancer Research, 1990,50(1):288
[2]王文香.重组蓖麻毒素的研究及应用.免疫杂志,1994,10(3):198
[3]张今,秦德安.包裹蓖麻蛋白的脂质体的制备、性质及毒性研究.生物化学与生物物理学报,1999,31(4):472
[4]Kirby C, Gregoriadis, G. Dehydration-rehydration Vesicles:a simple method for high yield drug entrapment in liposomes. Biotechnology, 1984,2:979
[5]马淑贤,王海波,丁玉玲.橄香烯脂质体(EL)的凝聚动力学研究.生物化学与生物物理学报,1993,25(2): 127
[6]刘文龙,张志鸿.生物膜与脂质体技术.长沙:湖南科技出版社,1989
[7]童桥,聂松青.糖和膜脂的相互作用-脂质体稳定性研究.生理科学进展,1996,27(2):123
2000-01-12收稿, 百拇医药