Th1和Th2细胞因子对人T细胞趋化作用的调节
作者:谭锦泉 黄保军 李群 何金生 沙泉 张林杰 张学军
单位:谭锦泉 黄保军 李群 何金生 沙泉 张林杰(安徽医科大学免疫学教研室,合肥 230032);张学军(安徽医科大学皮肤性病学教研室,合肥 230032)
关键词:细胞活素类;趋化性
安徽医科大学学报000103摘要 目的 研究IL-2、IFN-γ、IL-4、IL-10、IL-13等Th细胞因子在体外对人T细胞趋化作用的调节。方法 采用48微孔趋化板法观察不同预处理的T细胞趋化作用及Th细胞因子对T细胞趋化作用的调节效应。结果 IL-1能诱导过夜培养T细胞和抗CD3单克隆抗体活化的T细胞的趋化作用,并且其趋化作用可被tyrphosin 23所抑制,IL-8则选择性吸引新鲜分离T细胞并可被staurosporine所抑制。IL-2和IL-13同时抑制CD4+和CD8+T细胞对IL-8和RANTES(regulated on activation normal T expressed and secreted)的反应,IL-4抑制CD8+T细胞对IL-8和RANTES的反应,IL-10只抑制CD4+T细胞对IL-8和RANTES的趋化作用,IFN-γ增加人T细胞对趋化因子刺激的敏感性。结论 不同的细胞因子如IL-1和IL-8,通过作用于不同的信号途径来诱导不同环境下的T细胞趋化移动。而Th1和Th2细胞因子、IL-2、IL-4、IL-10和IL-13能阻断T细胞的趋化作用。
, 百拇医药
中图分类号 R329.2;R392.12
文献标识码 A 文章编号 1000-1492(2000)01-0009-05
Regulation of human T lymphocyte chemotaxis
by Th1 and Th2 cytokines
Tan Jinquan, Huang Baojun, Li Qun et al
(Dept of Immunology, Anhui Medical University, Hefei 230032)
Abstract Objective To study the regulation of T lymphocyte chemotaxis in vitro by Th cytokines IL-2, IFN-γ,IL-4, IL-10 and IL-13. Methods Different pretreated T lymphocyte chemotaxis and the effect of regulation by Th cytokines using 48-well micro-chamber technique. Results IL-1 could induce chemotaxis both on overnight cultured and anti-CD3 mAb-activated T lymphocytes, which can be inhibited by tyrphosin 23. IL-8 selectively attracted freshly isolated T lymphocyte chemotaxis toward IL-8, which can be inhibited by staurosporine. IL-2 and IL-13 inhibited the chemotaxis migration of both CD4+ and CD8+ lymphocyte toward IL-8 and RANTES. IL-10 inhibited only CD4+ T lymphocytes in their chemotaxis response toward RANTES and IL-8. IFN-γ augments the sensitivity of human T lymphocytes to chemotaxis stimuli. Conclusion Different cytokines will induce chemotaxis migration of T lymphocytes under different circumstances acting through different signaling pathways. The Th1 and Th2 cytokines IL-2, IL-4, IL-10 and IL-13 are able to regulate T lymphocyte chemotaxis.
, http://www.100md.com
MeSH cytokines; chemotaxis
现已证明至少存在两个主要趋化因子家族分别称为α家系和β家系。IL-8是α家系的代表成员,β家系主要包括巨噬细胞炎性蛋白(MIP)和RANTES(CC趋化性细胞因子,英文全名为regulated on activation normal T expressed and secreted)。关于某些细胞因子的趋化活性,有许多有争议的报道,一些学者发现IL-1对T细胞有趋化活性,但有些学者用改良Boyden小室法未能发现〔1,2〕。T细胞对IL-8的趋化反应最近也有学者提出疑问〔3〕。为了解释这些争论,我们比较了不同预处理的T细胞对一些趋化性细胞因子的趋化反应,并检验了这些T细胞表面的IL-1受体的数量和亲和力的改变,通过应用特异的信号途径抑制物验证T细胞趋化作用的一些信号途径。T辅助细胞分泌许多细胞因子,其中IL-2和IFN-γ由活化Th1细胞分泌,IL-4、IL-10和IL-13主要由Th2细胞分泌。进一步了解Th细胞分泌的细胞因子对T细胞向IL-8和RANTES的趋化反应的调节,对阐明T细胞趋化作用的复杂性将有一定意义。
, http://www.100md.com
1 材料与方法
1.1 细胞因子和主要试剂 IL-1和IL-8(日本Dainippon公司);IL-2和IFN-γ(瑞士Roche公司);IL-4、IL-10和IL-13(美国J Abrams博士和G Zurawsky博士惠赠);FACS分析所用单抗:鼠抗人IL-1R抗体(美国Steve博士惠赠);FITC-兔抗鼠Ab(丹麦DAKO公司);PE-抗CD 3 mAb(美国BD公司)。
1.2 T细胞亚群的分离纯化 血液标本采集于健康自愿受试者(大部分为实验室工作人员,男女比例相同)T细胞亚群通过加入Dynabeads M-450(挪威Dynal公司)进行分离,Dynabeads与T细胞的比例为20∶1,混合物在4℃轻转30 min,在磁场下分离出与磁珠结合的细胞,并悬浮在HBSS/FCS缓冲溶液中,洗5次,再通过磁场移去磁珠,得到的细胞悬液保存于4℃条件下。CD4+T细胞和CD8+T细胞亚群通过FACS测得纯度大于99%。
, 百拇医药
1.3 PKC和PTK抑制剂对T细胞趋化作用的抑制 PKC抑制剂staurosporine (Sigma公司产品)和PTK抑制剂tyrphostin 23 (Sigma公司产品)配制成浓度范围从0.1 μg.L-1到10 μg.L-1,与T细胞一起在37℃下孵育45 min,细胞用10% FCS-HBSS洗3次并悬浮于10% FCS-RPMI 1640中4℃ 1 h,检查成活细胞大于97%,用于趋化作用试验。
1.4 Th1和Th2细胞因子对T细胞趋化作用的调节 IL-2和IFN-γ配制成浓度范围从0.1 μg.L-1到1000 μg.L-1,IL-4和IL-13浓度范围从0.01 μg.L-1到100 μg.L-1,IL-10浓度范围从0.001 μg.L-1到10 μg.L-1,分别与T细胞一起,37℃培养30 min,然后做趋化实验。IL-4、IL-10、IL-13对T细胞趋化移动调节效应的阻断分别用其相关抗体(10 mg.L-1),37℃培养30 min。
, http://www.100md.com
1.5 T细胞趋化作用试验 采用48微孔趋化板法,趋化因子用0.5% BSA-RPMI 1640稀释放置25μl于下室内;上室加入T细胞或其亚群,浓度为5×109.L-1, 50 μl,中间隔以5 μm孔径的多碳膜。在37℃ 5% CO2中培养120 min后,取出膜,用70%甲醇固定,考马斯亮蓝染色5 min。通过显微镜上的照像机连接到记算机系统计数膜下表面的细胞数,记算趋化指数(CI, Chemtactic Index),CI=测试区平均细胞数/对照区平均细胞数。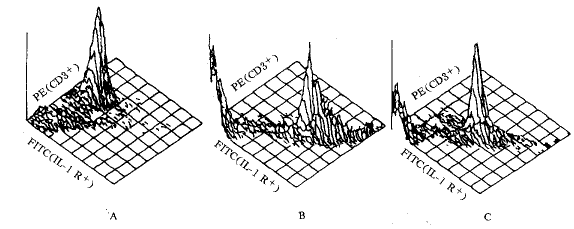
图1 各种状态T淋巴细胞表面白介素-1受体流式细胞术分析
A:新鲜分离的T细胞,表面IL-1受体阳性的细胞只为0.12%;B:过夜培养的T细胞,表面IL-1受体阳性的细胞为62.21%;C:抗CD3单抗活化的T细胞,表面IL-1受体阳性的细胞为70.21%
, 百拇医药
1.6 T细胞IL-1受体检测 新鲜分离、过夜培养抗CD3 mAb活化的T细胞分别与鼠抗人Ⅰ型IL-1受体的抗体一起孵育30 min,然后与FITC兔抗鼠抗体孵育,10%鼠血清封闭,最后细胞与PE鼠抗人CD3单克隆抗体孵育,标记的细胞用1%多聚甲醛固定,用流式细胞仪FACStar plus(美国BD公司)进行测定。
1.7 数据统计分析 结果应用t检验分析。
2 结果
2.1 IL-1和IL-8的不同预处理T细胞的趋化活性分析
2.1.1 IL-1对T细胞的趋化活性 我们观察到过夜培养的T细胞和抗CD3单克隆抗体活化的T细胞对IL-1的刺激有反应,IL-1的浓度达到100 μg.L-1时,过夜培养的T细胞趋化指数(CI)=2.68±0.91,抗CD3单克隆抗体活化的T细胞CI=2.91±0.97,新鲜分离的T细胞CI=1.38±0.41,统计结果差异有显著性,P值分别小于0.01和0.001。
, 百拇医药
2.1.2 IL-8对T细胞的趋化活性 新鲜分离的T细胞对IL-8的刺激有反应(CI=2.86±0.90, P<0.01),过夜培养的T细胞和抗CD3单克隆抗体活化的T细胞未显示对IL-8的趋化移动(CI分别为1.44±0.31,1.34±0.70,P>0.05)。Checkerboard分析证明IL-8和IL-1可引起T细胞趋化移动,而不是化学促活移动(结果未列出)。
2.2 过夜培养和抗CD3单克隆抗体活化对T细胞表面IL-1受体的调节 我们通过FACS分析检查了T细胞表面Ⅰ型IL-1受体的表达,结果表明新鲜分离的T细胞表面很少表达IL-1受体(受体阳性的细胞仅为0.12%),过夜培养和抗CD3单抗活化,IL-1受体在T细胞表面的表达显著增加,其IL-1受体阳性细胞分别为62.21%和70.21%,这也是T细胞经过夜培养和抗CD3单抗活化后,表现出对IL-1的趋化作用的原因之一。见图1。
2.3 PKC抑制剂和PTK抑制剂对T细胞向IL-1和IL-8趋化作用的抑制效应 结果显示staurosporine(PKC抑制剂)能抑制新鲜分离的T细胞对IL-8的趋化作用,tyrphosin23(PTK抑制剂)能显著抑制过夜培养的T细胞向IL-1的趋化作用(图2)和抗CD3单抗活化T细胞向IL-1的趋化作用(图2)。结果表明IL-1诱导T细胞趋化作用受PTK信号途径调控,IL-8则可能激活PKC信号途径。
, 百拇医药
2.4 Th细胞因子对T细胞向IL-8和RANTES趋化作用的调节
2.4.1 IL-13对T细胞向IL-8和RANTES趋化作用的调节 结果表明IL-13是T细胞向IL-8和RANTES趋化作用的强抑制剂。当IL-13(1 μg.L-1)与T细胞一起孵育30 min,能显著地抑制CD8+T细胞向IL-8和RANTES的趋化活性,CD4+T细胞的趋化作用对IL-13的抑制效应更敏感,当浓度为0.1 μg.L-1时,IL-13可明显抑制IL-8诱导的CD4+ T细胞的趋化作用(表1a)。加入抗IL-13单抗完全阻断IL-13在CD4+和CD8+ T细胞趋化作用中的调节效应(表2)。
表1a IL-13对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI, ±s) 细胞类型
±s) 细胞类型
, http://www.100md.com
趋化因子
IL-13的浓度(μg.L-1)
0
0.01
0.1
1
10
100
CD4+
RANTES
2.71±0.35
2.48±0.61
, http://www.100md.com
2.14±0.45
1.61±0.47
1.35±0.36
1.01±0.31
IL-8
3.41±0.33
2.48±0.49
1.56±0.38
1.04±0.70
1.01±0.34
0.89±0.15
CD8+
, 百拇医药
RANTES
3.00±0.47
2.71±0.35
2.10±0.34
1.64±0.30
1.40±0.22
1.03±0.18
IL-8
2.16±0.71
2.83±0.44
2.14±0.36
1.75±0.51
, 百拇医药
1.07±0.41
1.15±0.30
表1b IL-4对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI, ±s) 细胞类型
±s) 细胞类型
趋化因子
IL-4的浓度(μg.L-1)
0
0.01
0.1
1
10
, 百拇医药
100
CD4+
RANTES
2.68±0.51
2.31±0.71
2.54±0.44
2.16±0.65
2.27±0.35
1.99±0.44
IL-8
2.45±0.66
2.67±0.71
, 百拇医药
2.35±0.56
2.41±0.70
2.15±0.48
2.10±0.30
CD8+
RANTES
2.57±0.48
2.61±0.53
2.00±0.44
1.54±0.68
1.31±0.23
1.14±0.20
, http://www.100md.com
IL-8
2.79±0.31
2.14±0.81
1.90±0.35
1.31±0.61
1.18±0.49
1.04±0.25
表1c IL-10对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI, ±s) 细胞类型
±s) 细胞类型
趋化因子
IL-4的浓度(μg.L-1)
, http://www.100md.com
0
0.01
0.1
1
10
100
CD4+
RANTES
2.19±0.43
2.09±0.23
1.73±0.42
1.34±0.24
, http://www.100md.com 1.35±0.14
1.04±0.15
IL-8
2.41±0.49
2.11±0.43
1.45±0.61
1.43±0.41
1.04±0.27
1.01±0.34
CD8+
RANTES
2.37±0.59
, 百拇医药
2.20±0.84
2.34±0.27
2.38±0.37
2.33±0.48
1.90±0.25
IL-8
3.21±0.45
2.58±0.68
2.45±0.41
2.58±0.46
2.44±0.70
1.89±0.91
, 百拇医药
表2 IL-3、IL-4和IL-10的单克隆抗体对IL-3,IL-4和IL-10趋化作用的影响( ±s) 细胞类型
±s) 细胞类型
趋化因子
细胞因子
CI
细胞因子+单抗
CI
CD4+
RANTES
IL-13
1.43±0.27
, 百拇医药
IL-13+抗IL-13
2.80±0.74
CD8+
IL-8
IL-13
1.54±0.21
IL-13+抗IL-13
2.91±0.48
CD4+
RANTES
IL-4
2.41±0.61
, http://www.100md.com
IL-4+抗IL-4
2.55±0.65
CD8+
IL-8
IL-4
1.31±0.30
IL-4+抗IL-4
2.71±0.71
CD4+
RANTES
IL-10
1.18±0.25
, 百拇医药
IL-10+抗IL-10
2.91±0.61
CD8+
IL-8
IL-10
3.00±0.49
IL-10+抗IL-10
2.55±0.49
2.4.2 IL-4对T细胞向IL-8和RANTES趋化作用的调节 结果如表1 b所示,IL-4在其浓度达到1 μg.L-1时能显著降低CD8+ T细胞向IL-8和RANTES的趋化移动。中和抗IL-4单抗能阻断IL-4对CD8+细胞向IL-8和RANTES趋化作用的调节效应(表2)。
, 百拇医药
2.4.3 IL-10对T细胞向IL-8和RANTES趋化作用的调节 实验结果表明IL-10可抑制CD4+ T细胞向RANTES和IL-8的趋化效应,甚至浓度为0.01 μg.L-1(表1c)。但IL-10浓度达到10 μg.L-1时,它对CD8+ T细胞向IL-8和RANTES的趋化性能都无影响。中和抗IL-10单抗能阻断IL-10对CD4+ T细胞趋化作用的调节效应(表2)。
2.4.4 IL-2和IFN-γ对T细胞向IL-8和RANTES趋化作用调节 结果显示IL-2是T细胞趋化作用抑制剂,而IFN-γ可促进T细胞趋化移动,当IL-2浓度为10 μg.L-1时,能显著降低CD4+和CD8+ T细胞向RANTES的趋化作用(资料未列出)。相反,IFN-γ则明显增加CD4+和CD8+ T细胞向RANTES的趋化作用,同样的结果在T细胞向IL-8的趋化作用中也可观察到(资料未列出)。抗IL-2单抗和抗IFN-γ单抗能分别阻断IL-2和IFN-γ对T细胞趋化作用的效应(资料未列出)。
, http://www.100md.com
3 讨论
趋化作用是一个复杂的生物过程,它是细胞向着趋化剂的直接移动。至少包括3个主要步骤:识别趋化剂,传导正确的细胞内信号,运动的产生。在这些过程中,许多细胞结构和相关运动被涉及。白细胞向趋化剂移动的能力对增加它们在损伤或炎症部位的含量是至关重要的。我们在研究T细胞趋化作用时发现一个重要的现象是与所应用T细胞的来源有关。通过我们的实验表明新鲜分离的人的T细胞对IL-8有趋化作用,而过夜培养和抗CD3单抗活化的T细胞对IL-8无趋化作用。IL-1则相反,过夜培养和抗CD3单抗活化的T细胞对IL-1的反应的能力发生显著性改变,而新鲜分离的T细胞对IL-1的刺激发生微弱的反应。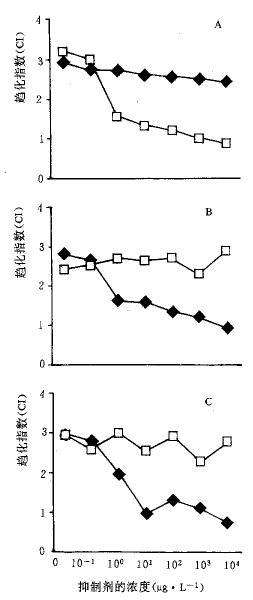
图2 PKC抑制剂和PTK抑制剂对IL-8
或IL-1诱导的T淋巴细胞趋化的影响
, 百拇医药
A:新鲜分离的T细胞向IL-8趋化;B和C:过夜培养(B)和抗CD3单抗活化(C)的T细胞向IL-1的趋化
有报道,T细胞表面表达IL-1受体,它们能被IL-1和IL-4调节〔4〕,我们的资料显示新鲜分离的T细胞有较少的IL-1受体,但经过过夜培养和抗CD3单抗活化的T细胞具有向IL-1趋化的活性,而新鲜分离的T细胞对IL-1的刺激反应微弱。PKC和PTK是白细胞的能动性和趋化作用一个重要的信号途径〔5~7〕,我们的实验结果表明PTK抑制剂(typhosin23)抑制过夜培养和抗CD3单抗活化的T细胞向IL-1的趋化作用,但不抑制新鲜分离的T细胞向IL-8的趋化作用。提示PTK是IL-1诱导的T细胞的趋化作用的途径之一,在培养和活化过程中,PTK信号途径活化或上调。PKC抑制剂(staurosporin)抑制新鲜分离的T细胞向IL-8的趋化作用,但不抑制过夜培养和抗CD3单抗活化T细胞向IL-1的趋化作用。结果表明IL-8通过PKC信号途径诱导T细胞的趋化性迁移,经过培养和活化过程PKC途径发生改变导致T细胞向IL-8趋化作用调节。这些发现还需要进一步深入研究。
, http://www.100md.com
许多细胞因子,特别是活化T细胞亚群来源的细胞因子对T细胞不具趋化性。IL-2、IL-4和IL-13无任何趋化活性,IL-2和IFN-γ是活化Th1细胞的产物,而IL-4、IL-10和IL-13主要从活化Th2细胞产生,但其它细胞也可分泌。Th1细胞分泌的细胞因子,比如IFN-γ是巨噬细胞活化强刺激剂,而Th2细胞产生的细胞因子在某种条件下抑制巨噬细胞活化,近来发现IL-13可降低活化巨噬细胞产生NO的能力,NO在呼吸爆发中起非常重要的作用,在趋化移动方面似也具有作用〔8,9〕。另外虽然IL-4和IL-13对T细胞不具趋化性,但它们对人成骨细胞有趋化作用〔10〕。本文研究结果表明IL-4和IL-10在降低T细胞趋化移动方面显示不同的能力。可能的机制是IL-4和IL-10影响不同的信号途径,也可能IL-4和IL-10作用不同的细胞结构,例如受体引发的一系列相关事件。需要更深入的研究以证实正确信号途径或受体在T细胞趋化作用所涉及的调节效应。
我们已经报道了IL-10对人CD8+ T细胞有趋化性,同时也可抑制CD4+ T细胞向IL-8和RANTES的趋化移动,但不影响CD8+ T细胞向IL-8和RANTES的趋化反应〔11,12〕。本文则研究了无趋化活性的T细胞来源的细胞因子在体外对人T细胞趋化作用的复杂影响。IL-2和IL-13阻断CD4+和CD8+ T细胞向IL-8和RANTES的趋化移动,IL-4阻断CD8+ T细胞向IL-8、RANTES或IL-10的趋化反应。有趣的是,IFN-γ增加CD4+和CD8+ T细胞向IL-8和RANTES的敏感性。我们的发现表明人T细胞趋化作用是一个微妙的控制过程,当在炎症或其他一些应激状态下,免疫炎性细胞由于内环境的改变,其表面粘附分子和趋化性细胞因子受体表达发生改变,这些细胞将趋向血管内皮细胞,继而发生粘附和游走,穿越血管内皮屏障。免疫炎性细胞特别是T细胞继续向趋化性细胞因子(如IL-1、IL-8和RANTES)高浓度处趋化移动。当它们达到一个区域遇到活化T细胞分泌的细胞因子,T细胞可失去对另外趋化因子的反应能力,导致T细胞在炎症部位的集中。
, http://www.100md.com
(本文部分内容曾发表在Journal of Immunology, 1995;154:3472。本试验主要是作者在丹麦Aarhus大学工作期间完成。)
作者简介:谭锦泉,男,44岁,博士,教授,博士生导师
参考文献
1,Miossee P, Yu CL, Ziff M. Lymphocyte chemotasctic activity of human interleukin-1. J Immunol, 1984;133(4):2007~2011
2,Larsen CG, Anderson AO, Apella E et al. The neutrophil-activating peptide(NAP-1) is also chemotatic for T lymphocytes. Science, 1989;243(4897):1464~1466
, http://www.100md.com
3,Taub DD, Conlon K, Lloyd AR et al. Preferential migration of activated CD4+ and CD8+ T cells in response to MIP-1α and MIP-1β. Science, 1993;260(5106):355~358
4,Lacey DL, Erdmann JM. IL-1 and IL-4 modulate IL-1 receptor expression in a murine T cell line. J Immunol, 1990;145(12):4145~4153
5,Bacon KB, Camp RD. IL-8 induced in vitro human lymphocyte migration is inhibited by cholera and pertussis toxins and inhibitors of protein kinase C. Biochem Biophys Res Commun, 1990;169(3):1099~1104
, 百拇医药
6,Giotfano S, Zhen Z, Medico E et al. Transfer/hepatocyte growth factor by transfectin of human MET protooncogene. Proc Natl Acad Sci USA, 1993;90(2):649~653
7,Gaudry M, Caon AC, Gilbert C et al. Evidence for the involvement of tyrossine binases in the locomotory responses of human neutrophils. J Leukocyte Biol, 1992;51(2):103~108
8,Eren J, Seifert R. Molsidomine inhibit the chemoattactant-induced respiratory burst in human neutrophils via a no-independent mechanism. Biochem Pharmacol, 1992;44(4):637~644
, 百拇医药
9,Snyderman R, Uhing RJ. Chemoattractant stimulus-response coupling. in: Gallin JI, Goldstein IM and Snyderman R. eds. Inflammation: Basic Principles and Clinical correlates. New York: Raven press, 1992:421~428
10,Lind M, Deleuran B, Yssel H et al. IL-4 and IL-13, but not IL-10, are chemotactic factor for human osteoblasts. Cytokine, 1995;7(1):78~82
11,Tan JQ, Larsen CG, Gesser B et al. Human IL-10 is a chemoattractant for CD8+ T lymphocytes and an inhibitor of IL-8-induced CD4+ T lymphocyte migration. J Immuol, 1993;151(9):4545~4551
12,Tan JQ, Frydenberg J, Mukaida N et al. Recombinant human growth regulated oncogene-α induces T lymphocyte chemotaxis; a process regulated via interleukin-8 receptor by IFN-γ, TNF-α, IL-4, IL-10 and IL-13. J Immunol, 1995;155(11):5359~5368
1999-05-11收稿,1999-12-29修回, http://www.100md.com
单位:谭锦泉 黄保军 李群 何金生 沙泉 张林杰(安徽医科大学免疫学教研室,合肥 230032);张学军(安徽医科大学皮肤性病学教研室,合肥 230032)
关键词:细胞活素类;趋化性
安徽医科大学学报000103摘要 目的 研究IL-2、IFN-γ、IL-4、IL-10、IL-13等Th细胞因子在体外对人T细胞趋化作用的调节。方法 采用48微孔趋化板法观察不同预处理的T细胞趋化作用及Th细胞因子对T细胞趋化作用的调节效应。结果 IL-1能诱导过夜培养T细胞和抗CD3单克隆抗体活化的T细胞的趋化作用,并且其趋化作用可被tyrphosin 23所抑制,IL-8则选择性吸引新鲜分离T细胞并可被staurosporine所抑制。IL-2和IL-13同时抑制CD4+和CD8+T细胞对IL-8和RANTES(regulated on activation normal T expressed and secreted)的反应,IL-4抑制CD8+T细胞对IL-8和RANTES的反应,IL-10只抑制CD4+T细胞对IL-8和RANTES的趋化作用,IFN-γ增加人T细胞对趋化因子刺激的敏感性。结论 不同的细胞因子如IL-1和IL-8,通过作用于不同的信号途径来诱导不同环境下的T细胞趋化移动。而Th1和Th2细胞因子、IL-2、IL-4、IL-10和IL-13能阻断T细胞的趋化作用。
, 百拇医药
中图分类号 R329.2;R392.12
文献标识码 A 文章编号 1000-1492(2000)01-0009-05
Regulation of human T lymphocyte chemotaxis
by Th1 and Th2 cytokines
Tan Jinquan, Huang Baojun, Li Qun et al
(Dept of Immunology, Anhui Medical University, Hefei 230032)
Abstract Objective To study the regulation of T lymphocyte chemotaxis in vitro by Th cytokines IL-2, IFN-γ,IL-4, IL-10 and IL-13. Methods Different pretreated T lymphocyte chemotaxis and the effect of regulation by Th cytokines using 48-well micro-chamber technique. Results IL-1 could induce chemotaxis both on overnight cultured and anti-CD3 mAb-activated T lymphocytes, which can be inhibited by tyrphosin 23. IL-8 selectively attracted freshly isolated T lymphocyte chemotaxis toward IL-8, which can be inhibited by staurosporine. IL-2 and IL-13 inhibited the chemotaxis migration of both CD4+ and CD8+ lymphocyte toward IL-8 and RANTES. IL-10 inhibited only CD4+ T lymphocytes in their chemotaxis response toward RANTES and IL-8. IFN-γ augments the sensitivity of human T lymphocytes to chemotaxis stimuli. Conclusion Different cytokines will induce chemotaxis migration of T lymphocytes under different circumstances acting through different signaling pathways. The Th1 and Th2 cytokines IL-2, IL-4, IL-10 and IL-13 are able to regulate T lymphocyte chemotaxis.
, http://www.100md.com
MeSH cytokines; chemotaxis
现已证明至少存在两个主要趋化因子家族分别称为α家系和β家系。IL-8是α家系的代表成员,β家系主要包括巨噬细胞炎性蛋白(MIP)和RANTES(CC趋化性细胞因子,英文全名为regulated on activation normal T expressed and secreted)。关于某些细胞因子的趋化活性,有许多有争议的报道,一些学者发现IL-1对T细胞有趋化活性,但有些学者用改良Boyden小室法未能发现〔1,2〕。T细胞对IL-8的趋化反应最近也有学者提出疑问〔3〕。为了解释这些争论,我们比较了不同预处理的T细胞对一些趋化性细胞因子的趋化反应,并检验了这些T细胞表面的IL-1受体的数量和亲和力的改变,通过应用特异的信号途径抑制物验证T细胞趋化作用的一些信号途径。T辅助细胞分泌许多细胞因子,其中IL-2和IFN-γ由活化Th1细胞分泌,IL-4、IL-10和IL-13主要由Th2细胞分泌。进一步了解Th细胞分泌的细胞因子对T细胞向IL-8和RANTES的趋化反应的调节,对阐明T细胞趋化作用的复杂性将有一定意义。
, http://www.100md.com
1 材料与方法
1.1 细胞因子和主要试剂 IL-1和IL-8(日本Dainippon公司);IL-2和IFN-γ(瑞士Roche公司);IL-4、IL-10和IL-13(美国J Abrams博士和G Zurawsky博士惠赠);FACS分析所用单抗:鼠抗人IL-1R抗体(美国Steve博士惠赠);FITC-兔抗鼠Ab(丹麦DAKO公司);PE-抗CD 3 mAb(美国BD公司)。
1.2 T细胞亚群的分离纯化 血液标本采集于健康自愿受试者(大部分为实验室工作人员,男女比例相同)T细胞亚群通过加入Dynabeads M-450(挪威Dynal公司)进行分离,Dynabeads与T细胞的比例为20∶1,混合物在4℃轻转30 min,在磁场下分离出与磁珠结合的细胞,并悬浮在HBSS/FCS缓冲溶液中,洗5次,再通过磁场移去磁珠,得到的细胞悬液保存于4℃条件下。CD4+T细胞和CD8+T细胞亚群通过FACS测得纯度大于99%。
, 百拇医药
1.3 PKC和PTK抑制剂对T细胞趋化作用的抑制 PKC抑制剂staurosporine (Sigma公司产品)和PTK抑制剂tyrphostin 23 (Sigma公司产品)配制成浓度范围从0.1 μg.L-1到10 μg.L-1,与T细胞一起在37℃下孵育45 min,细胞用10% FCS-HBSS洗3次并悬浮于10% FCS-RPMI 1640中4℃ 1 h,检查成活细胞大于97%,用于趋化作用试验。
1.4 Th1和Th2细胞因子对T细胞趋化作用的调节 IL-2和IFN-γ配制成浓度范围从0.1 μg.L-1到1000 μg.L-1,IL-4和IL-13浓度范围从0.01 μg.L-1到100 μg.L-1,IL-10浓度范围从0.001 μg.L-1到10 μg.L-1,分别与T细胞一起,37℃培养30 min,然后做趋化实验。IL-4、IL-10、IL-13对T细胞趋化移动调节效应的阻断分别用其相关抗体(10 mg.L-1),37℃培养30 min。
, http://www.100md.com
1.5 T细胞趋化作用试验 采用48微孔趋化板法,趋化因子用0.5% BSA-RPMI 1640稀释放置25μl于下室内;上室加入T细胞或其亚群,浓度为5×109.L-1, 50 μl,中间隔以5 μm孔径的多碳膜。在37℃ 5% CO2中培养120 min后,取出膜,用70%甲醇固定,考马斯亮蓝染色5 min。通过显微镜上的照像机连接到记算机系统计数膜下表面的细胞数,记算趋化指数(CI, Chemtactic Index),CI=测试区平均细胞数/对照区平均细胞数。

图1 各种状态T淋巴细胞表面白介素-1受体流式细胞术分析
A:新鲜分离的T细胞,表面IL-1受体阳性的细胞只为0.12%;B:过夜培养的T细胞,表面IL-1受体阳性的细胞为62.21%;C:抗CD3单抗活化的T细胞,表面IL-1受体阳性的细胞为70.21%
, 百拇医药
1.6 T细胞IL-1受体检测 新鲜分离、过夜培养抗CD3 mAb活化的T细胞分别与鼠抗人Ⅰ型IL-1受体的抗体一起孵育30 min,然后与FITC兔抗鼠抗体孵育,10%鼠血清封闭,最后细胞与PE鼠抗人CD3单克隆抗体孵育,标记的细胞用1%多聚甲醛固定,用流式细胞仪FACStar plus(美国BD公司)进行测定。
1.7 数据统计分析 结果应用t检验分析。
2 结果
2.1 IL-1和IL-8的不同预处理T细胞的趋化活性分析
2.1.1 IL-1对T细胞的趋化活性 我们观察到过夜培养的T细胞和抗CD3单克隆抗体活化的T细胞对IL-1的刺激有反应,IL-1的浓度达到100 μg.L-1时,过夜培养的T细胞趋化指数(CI)=2.68±0.91,抗CD3单克隆抗体活化的T细胞CI=2.91±0.97,新鲜分离的T细胞CI=1.38±0.41,统计结果差异有显著性,P值分别小于0.01和0.001。
, 百拇医药
2.1.2 IL-8对T细胞的趋化活性 新鲜分离的T细胞对IL-8的刺激有反应(CI=2.86±0.90, P<0.01),过夜培养的T细胞和抗CD3单克隆抗体活化的T细胞未显示对IL-8的趋化移动(CI分别为1.44±0.31,1.34±0.70,P>0.05)。Checkerboard分析证明IL-8和IL-1可引起T细胞趋化移动,而不是化学促活移动(结果未列出)。
2.2 过夜培养和抗CD3单克隆抗体活化对T细胞表面IL-1受体的调节 我们通过FACS分析检查了T细胞表面Ⅰ型IL-1受体的表达,结果表明新鲜分离的T细胞表面很少表达IL-1受体(受体阳性的细胞仅为0.12%),过夜培养和抗CD3单抗活化,IL-1受体在T细胞表面的表达显著增加,其IL-1受体阳性细胞分别为62.21%和70.21%,这也是T细胞经过夜培养和抗CD3单抗活化后,表现出对IL-1的趋化作用的原因之一。见图1。
2.3 PKC抑制剂和PTK抑制剂对T细胞向IL-1和IL-8趋化作用的抑制效应 结果显示staurosporine(PKC抑制剂)能抑制新鲜分离的T细胞对IL-8的趋化作用,tyrphosin23(PTK抑制剂)能显著抑制过夜培养的T细胞向IL-1的趋化作用(图2)和抗CD3单抗活化T细胞向IL-1的趋化作用(图2)。结果表明IL-1诱导T细胞趋化作用受PTK信号途径调控,IL-8则可能激活PKC信号途径。
, 百拇医药
2.4 Th细胞因子对T细胞向IL-8和RANTES趋化作用的调节
2.4.1 IL-13对T细胞向IL-8和RANTES趋化作用的调节 结果表明IL-13是T细胞向IL-8和RANTES趋化作用的强抑制剂。当IL-13(1 μg.L-1)与T细胞一起孵育30 min,能显著地抑制CD8+T细胞向IL-8和RANTES的趋化活性,CD4+T细胞的趋化作用对IL-13的抑制效应更敏感,当浓度为0.1 μg.L-1时,IL-13可明显抑制IL-8诱导的CD4+ T细胞的趋化作用(表1a)。加入抗IL-13单抗完全阻断IL-13在CD4+和CD8+ T细胞趋化作用中的调节效应(表2)。
表1a IL-13对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI,
 ±s) 细胞类型
±s) 细胞类型, http://www.100md.com
趋化因子
IL-13的浓度(μg.L-1)
0
0.01
0.1
1
10
100
CD4+
RANTES
2.71±0.35
2.48±0.61
, http://www.100md.com
2.14±0.45
1.61±0.47
1.35±0.36
1.01±0.31
IL-8
3.41±0.33
2.48±0.49
1.56±0.38
1.04±0.70
1.01±0.34
0.89±0.15
CD8+
, 百拇医药
RANTES
3.00±0.47
2.71±0.35
2.10±0.34
1.64±0.30
1.40±0.22
1.03±0.18
IL-8
2.16±0.71
2.83±0.44
2.14±0.36
1.75±0.51
, 百拇医药
1.07±0.41
1.15±0.30
表1b IL-4对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI,
 ±s) 细胞类型
±s) 细胞类型趋化因子
IL-4的浓度(μg.L-1)
0
0.01
0.1
1
10
, 百拇医药
100
CD4+
RANTES
2.68±0.51
2.31±0.71
2.54±0.44
2.16±0.65
2.27±0.35
1.99±0.44
IL-8
2.45±0.66
2.67±0.71
, 百拇医药
2.35±0.56
2.41±0.70
2.15±0.48
2.10±0.30
CD8+
RANTES
2.57±0.48
2.61±0.53
2.00±0.44
1.54±0.68
1.31±0.23
1.14±0.20
, http://www.100md.com
IL-8
2.79±0.31
2.14±0.81
1.90±0.35
1.31±0.61
1.18±0.49
1.04±0.25
表1c IL-10对IL-8和RANTES诱导的T细胞亚群趋化作用的影响(CI,
 ±s) 细胞类型
±s) 细胞类型趋化因子
IL-4的浓度(μg.L-1)
, http://www.100md.com
0
0.01
0.1
1
10
100
CD4+
RANTES
2.19±0.43
2.09±0.23
1.73±0.42
1.34±0.24
, http://www.100md.com 1.35±0.14
1.04±0.15
IL-8
2.41±0.49
2.11±0.43
1.45±0.61
1.43±0.41
1.04±0.27
1.01±0.34
CD8+
RANTES
2.37±0.59
, 百拇医药
2.20±0.84
2.34±0.27
2.38±0.37
2.33±0.48
1.90±0.25
IL-8
3.21±0.45
2.58±0.68
2.45±0.41
2.58±0.46
2.44±0.70
1.89±0.91
, 百拇医药
表2 IL-3、IL-4和IL-10的单克隆抗体对IL-3,IL-4和IL-10趋化作用的影响(
 ±s) 细胞类型
±s) 细胞类型趋化因子
细胞因子
CI
细胞因子+单抗
CI
CD4+
RANTES
IL-13
1.43±0.27
, 百拇医药
IL-13+抗IL-13
2.80±0.74
CD8+
IL-8
IL-13
1.54±0.21
IL-13+抗IL-13
2.91±0.48
CD4+
RANTES
IL-4
2.41±0.61
, http://www.100md.com
IL-4+抗IL-4
2.55±0.65
CD8+
IL-8
IL-4
1.31±0.30
IL-4+抗IL-4
2.71±0.71
CD4+
RANTES
IL-10
1.18±0.25
, 百拇医药
IL-10+抗IL-10
2.91±0.61
CD8+
IL-8
IL-10
3.00±0.49
IL-10+抗IL-10
2.55±0.49
2.4.2 IL-4对T细胞向IL-8和RANTES趋化作用的调节 结果如表1 b所示,IL-4在其浓度达到1 μg.L-1时能显著降低CD8+ T细胞向IL-8和RANTES的趋化移动。中和抗IL-4单抗能阻断IL-4对CD8+细胞向IL-8和RANTES趋化作用的调节效应(表2)。
, 百拇医药
2.4.3 IL-10对T细胞向IL-8和RANTES趋化作用的调节 实验结果表明IL-10可抑制CD4+ T细胞向RANTES和IL-8的趋化效应,甚至浓度为0.01 μg.L-1(表1c)。但IL-10浓度达到10 μg.L-1时,它对CD8+ T细胞向IL-8和RANTES的趋化性能都无影响。中和抗IL-10单抗能阻断IL-10对CD4+ T细胞趋化作用的调节效应(表2)。
2.4.4 IL-2和IFN-γ对T细胞向IL-8和RANTES趋化作用调节 结果显示IL-2是T细胞趋化作用抑制剂,而IFN-γ可促进T细胞趋化移动,当IL-2浓度为10 μg.L-1时,能显著降低CD4+和CD8+ T细胞向RANTES的趋化作用(资料未列出)。相反,IFN-γ则明显增加CD4+和CD8+ T细胞向RANTES的趋化作用,同样的结果在T细胞向IL-8的趋化作用中也可观察到(资料未列出)。抗IL-2单抗和抗IFN-γ单抗能分别阻断IL-2和IFN-γ对T细胞趋化作用的效应(资料未列出)。
, http://www.100md.com
3 讨论
趋化作用是一个复杂的生物过程,它是细胞向着趋化剂的直接移动。至少包括3个主要步骤:识别趋化剂,传导正确的细胞内信号,运动的产生。在这些过程中,许多细胞结构和相关运动被涉及。白细胞向趋化剂移动的能力对增加它们在损伤或炎症部位的含量是至关重要的。我们在研究T细胞趋化作用时发现一个重要的现象是与所应用T细胞的来源有关。通过我们的实验表明新鲜分离的人的T细胞对IL-8有趋化作用,而过夜培养和抗CD3单抗活化的T细胞对IL-8无趋化作用。IL-1则相反,过夜培养和抗CD3单抗活化的T细胞对IL-1的反应的能力发生显著性改变,而新鲜分离的T细胞对IL-1的刺激发生微弱的反应。

图2 PKC抑制剂和PTK抑制剂对IL-8
或IL-1诱导的T淋巴细胞趋化的影响
, 百拇医药
A:新鲜分离的T细胞向IL-8趋化;B和C:过夜培养(B)和抗CD3单抗活化(C)的T细胞向IL-1的趋化
有报道,T细胞表面表达IL-1受体,它们能被IL-1和IL-4调节〔4〕,我们的资料显示新鲜分离的T细胞有较少的IL-1受体,但经过过夜培养和抗CD3单抗活化的T细胞具有向IL-1趋化的活性,而新鲜分离的T细胞对IL-1的刺激反应微弱。PKC和PTK是白细胞的能动性和趋化作用一个重要的信号途径〔5~7〕,我们的实验结果表明PTK抑制剂(typhosin23)抑制过夜培养和抗CD3单抗活化的T细胞向IL-1的趋化作用,但不抑制新鲜分离的T细胞向IL-8的趋化作用。提示PTK是IL-1诱导的T细胞的趋化作用的途径之一,在培养和活化过程中,PTK信号途径活化或上调。PKC抑制剂(staurosporin)抑制新鲜分离的T细胞向IL-8的趋化作用,但不抑制过夜培养和抗CD3单抗活化T细胞向IL-1的趋化作用。结果表明IL-8通过PKC信号途径诱导T细胞的趋化性迁移,经过培养和活化过程PKC途径发生改变导致T细胞向IL-8趋化作用调节。这些发现还需要进一步深入研究。
, http://www.100md.com
许多细胞因子,特别是活化T细胞亚群来源的细胞因子对T细胞不具趋化性。IL-2、IL-4和IL-13无任何趋化活性,IL-2和IFN-γ是活化Th1细胞的产物,而IL-4、IL-10和IL-13主要从活化Th2细胞产生,但其它细胞也可分泌。Th1细胞分泌的细胞因子,比如IFN-γ是巨噬细胞活化强刺激剂,而Th2细胞产生的细胞因子在某种条件下抑制巨噬细胞活化,近来发现IL-13可降低活化巨噬细胞产生NO的能力,NO在呼吸爆发中起非常重要的作用,在趋化移动方面似也具有作用〔8,9〕。另外虽然IL-4和IL-13对T细胞不具趋化性,但它们对人成骨细胞有趋化作用〔10〕。本文研究结果表明IL-4和IL-10在降低T细胞趋化移动方面显示不同的能力。可能的机制是IL-4和IL-10影响不同的信号途径,也可能IL-4和IL-10作用不同的细胞结构,例如受体引发的一系列相关事件。需要更深入的研究以证实正确信号途径或受体在T细胞趋化作用所涉及的调节效应。
我们已经报道了IL-10对人CD8+ T细胞有趋化性,同时也可抑制CD4+ T细胞向IL-8和RANTES的趋化移动,但不影响CD8+ T细胞向IL-8和RANTES的趋化反应〔11,12〕。本文则研究了无趋化活性的T细胞来源的细胞因子在体外对人T细胞趋化作用的复杂影响。IL-2和IL-13阻断CD4+和CD8+ T细胞向IL-8和RANTES的趋化移动,IL-4阻断CD8+ T细胞向IL-8、RANTES或IL-10的趋化反应。有趣的是,IFN-γ增加CD4+和CD8+ T细胞向IL-8和RANTES的敏感性。我们的发现表明人T细胞趋化作用是一个微妙的控制过程,当在炎症或其他一些应激状态下,免疫炎性细胞由于内环境的改变,其表面粘附分子和趋化性细胞因子受体表达发生改变,这些细胞将趋向血管内皮细胞,继而发生粘附和游走,穿越血管内皮屏障。免疫炎性细胞特别是T细胞继续向趋化性细胞因子(如IL-1、IL-8和RANTES)高浓度处趋化移动。当它们达到一个区域遇到活化T细胞分泌的细胞因子,T细胞可失去对另外趋化因子的反应能力,导致T细胞在炎症部位的集中。
, http://www.100md.com
(本文部分内容曾发表在Journal of Immunology, 1995;154:3472。本试验主要是作者在丹麦Aarhus大学工作期间完成。)
作者简介:谭锦泉,男,44岁,博士,教授,博士生导师
参考文献
1,Miossee P, Yu CL, Ziff M. Lymphocyte chemotasctic activity of human interleukin-1. J Immunol, 1984;133(4):2007~2011
2,Larsen CG, Anderson AO, Apella E et al. The neutrophil-activating peptide(NAP-1) is also chemotatic for T lymphocytes. Science, 1989;243(4897):1464~1466
, http://www.100md.com
3,Taub DD, Conlon K, Lloyd AR et al. Preferential migration of activated CD4+ and CD8+ T cells in response to MIP-1α and MIP-1β. Science, 1993;260(5106):355~358
4,Lacey DL, Erdmann JM. IL-1 and IL-4 modulate IL-1 receptor expression in a murine T cell line. J Immunol, 1990;145(12):4145~4153
5,Bacon KB, Camp RD. IL-8 induced in vitro human lymphocyte migration is inhibited by cholera and pertussis toxins and inhibitors of protein kinase C. Biochem Biophys Res Commun, 1990;169(3):1099~1104
, 百拇医药
6,Giotfano S, Zhen Z, Medico E et al. Transfer/hepatocyte growth factor by transfectin of human MET protooncogene. Proc Natl Acad Sci USA, 1993;90(2):649~653
7,Gaudry M, Caon AC, Gilbert C et al. Evidence for the involvement of tyrossine binases in the locomotory responses of human neutrophils. J Leukocyte Biol, 1992;51(2):103~108
8,Eren J, Seifert R. Molsidomine inhibit the chemoattactant-induced respiratory burst in human neutrophils via a no-independent mechanism. Biochem Pharmacol, 1992;44(4):637~644
, 百拇医药
9,Snyderman R, Uhing RJ. Chemoattractant stimulus-response coupling. in: Gallin JI, Goldstein IM and Snyderman R. eds. Inflammation: Basic Principles and Clinical correlates. New York: Raven press, 1992:421~428
10,Lind M, Deleuran B, Yssel H et al. IL-4 and IL-13, but not IL-10, are chemotactic factor for human osteoblasts. Cytokine, 1995;7(1):78~82
11,Tan JQ, Larsen CG, Gesser B et al. Human IL-10 is a chemoattractant for CD8+ T lymphocytes and an inhibitor of IL-8-induced CD4+ T lymphocyte migration. J Immuol, 1993;151(9):4545~4551
12,Tan JQ, Frydenberg J, Mukaida N et al. Recombinant human growth regulated oncogene-α induces T lymphocyte chemotaxis; a process regulated via interleukin-8 receptor by IFN-γ, TNF-α, IL-4, IL-10 and IL-13. J Immunol, 1995;155(11):5359~5368
1999-05-11收稿,1999-12-29修回, http://www.100md.com