食管支架术后局部组织中相关炎性细胞的变化分析
作者:宛新建 李兆申 许国铭 孙振兴 吴仁培 满晓华
单位:第二军医大学长海医院消化内科,上海 200433
关键词:食管狭窄;支架
安徽医科大学学报000404
摘要 目的 研究食管支架术后不同时间局部食管组织中炎性细胞浸润及分布的变化,以及与再狭窄形成的关系。方法 采用免疫组化(ABC法)检测支架术后1、2、4、8周组织中CD3、CD19、CD68的表达状况,从而反映出巨噬细胞(MΦ)、T-淋巴细胞(T-LC)、B-淋巴细胞(B-LC)的浸润及分布状况。制备再狭窄组织的细胞悬液,采用流式细胞分析法检测组织中3种细胞的含量变化。采用特殊染色法分析组织中肥大细胞(MC)的分布状况。结果 支架术后1、2周组织中有明显的T-淋巴细胞、巨噬细胞、肥大细胞浸润,其细胞含量较正常食管显著升高,而B-淋巴细胞含量极少,术后4、8周各种细胞的含量及分布与正常食管相似。结论 巨噬细胞、肥大细胞及T-淋巴细胞与支架术后再狭窄的形成存在密切关系,可能是局部纤维化的重要调控细胞。
, http://www.100md.com
中图分类号 R571.1;R619;R655.4
文献标识码 A 文章编号 1000-1492(2000)04-0256-04
Changes of related inflammatory cells in esophageal tissue after stenting
Wan Xinjian,Li Zhaoshen,Xu Guoming et al
(Dept of Gastroenterology,Changhai Hospital,The Second Military Medical University,Shanghai 200433)
Abstract Objective To study the infiltration and distribution of inflammatory cells,and the relation with re-stenosis,at several times after stenting. Methods The number and distribution of macrophage,T-lymphocyte,B-lymphocyte in esophageal tissue at week 1,2,4,8 after stenting had been measured by flowcytometry and immunohistochemical methods(ABC). Special staining was used to analyse the distribution of mast cells. Results The T-cell,MΦ,mast cell infiltrated greatly in esophageal tissue 1,2 weeks after stenting,and the number of these cells was much more than that in normal esophagus. But B-cell was very little,the number and distribution was similar to normal esophagus at 4,8 weeks after stenting. Conclusion MΦ,mast cell and T-cell are closely related with restenosis after esophageal stenting,and may be the key regulatory cells in local fibrosis.
, 百拇医药
MeSH esphagus stenosis; stent
巨噬细胞(MΦ)、T-淋巴细胞(T-cell)、肥大细胞(MC)作为免疫系统的主要成员,在组织创伤愈合及器官纤维化过程中发挥重要的作用,是主要的调控因素。目前的研究发现,在组织损伤愈合过程中,局部有大量的MΦ、T-cell、MC浸润,并表达出相关的致纤维化细胞因子,如IL-1、IL-6、TNF-α、TGFβ1、PDGF等。正是由于这些细胞因子的作用,促使了局部肉芽组织的形成及纤维结缔组织产生,进而表现为瘢痕形成及纤维化。在不同类型的创伤中,起调控作用的炎性细胞存在一定的差异。再狭窄是食管支架术后最常见的远期并发症,主要表现为支架放置部位大量肉芽组织形成及纤维化,最终导致食管腔再次狭窄。作为组织创伤愈合的一种形式,其病理过程的调控机制与一般的创伤可能存在一定的相似性,有关这方面的研究国内外尚未见有文献报道。本实验采用免疫组织化学的基本方法探讨再狭窄过程中相关炎性细胞的调控机制。
, 百拇医药
1 材料与方法
1.1 试剂及仪器 0.05%胶原酶,0.1%胰蛋白酶(华美公司),70%乙醇,ABC免疫组化试剂盒(Vector公司),CD3、CD68单克隆抗体(华美公司),CD19单克隆抗体(武汉博士德公司),0.01 mol.L-1 PBS(pH 7.4),DAB溶解液(pH 5.0)(上海华顺公司),抗体稀释液(10%小牛血清-PBS液),封闭剂(10%绵羊血清-PBS液),0.3% H2O2-甲醇液,3% H2O2,FITC标记的二抗IgG(上海华美公司),0.5%硫堇溶液(上海生化试剂公司),0.2%醋酸溶液(上海生化试剂公司),流式细胞分析仪(Becton Dickinson公司),150目、250目铜网,倒置显微镜(Olympus公司)。
1.2 动物实验标本采集、处理 选择16只实验犬,经“自体阔筋膜移植固定法”置入并固定食管支架。具体操作如下:无菌手术下切开颈部皮肤,游离出颈部食管,内镜引导下置入食管支架,使其上端定位于颈部游离段食管。将阔筋膜附着于置架部位的食管外壁,用医用不锈钢细丝两处缝合固定。术中局部注射少量青霉素,术后予半流质饮食。所有术后实验犬均分为4组,分别观察1、2、4、8周。届时分批处死动物,取出置架部位的食管组织分别制成石蜡、冷冻切片及细胞悬液。另取4例正常犬食管组织为对照。
, 百拇医药
1.3 细胞悬液制备及流式细胞分析CD3、CD19、CD68表达 将留取的新鲜组织用眼科剪剪为1.0 mm大小的小块,并用冰冷生理盐水漂洗4次。0.05%胶原酶37℃消化20 min(1.0 g组织加入消化液10 ml),同时间断地振荡。将250目铜网扎在小烧杯上,把消化后组织细胞悬液倒于网上,以试管底端轻搓组织块,直到组织搓完。离心沉淀500转*min-1,2 min,用PBS液将细胞浓度调至109个*L-1,取20 μl分别与10 μl CD3、CD19、CD68单抗原液混匀,室温下孵育30 min。PBS洗3次后与FIT-C标记的二抗IgG(1∶40)混匀,4℃静置30 min。PBS洗2次后,调细胞浓度为109个*L-1上机,每次计数2万个细胞,根据光强度确定CD3、CD19、CD68表达量。对照组不加一抗,其余步骤相同。流式细胞结果采用方差分析进行统计。
表1 流式细胞法检测支架术后组织中CD3、CD19、CD68的表达( ±s,n=4)
±s,n=4)
, http://www.100md.com
1周(%)
2周(%)
4周(%)
8周(%)
正常(%)
CD3
19.45±1.40**
28.17±2.76**
9.05±1.82
7.27±1.32
8.24±0.24
CD19
, http://www.100md.com
6.11±0.17
5.96±0.14
8.76±1.84
5.32±1.96
6.99±1.09
CD68
18.16±0.51**
23.47±2.09**
9.27±2.05
6.76±2.47
8.57±2.16
, 百拇医药
与对照组比较:**P<0.01表2 免疫组化检测食管支架术后组织CD3、CD19、CD68表达 组别
n
CD3
CD68
CD19
-
+

-
+

, http://www.100md.com
-
+

术后1周
4
0
1
3
0
0
2
2
, http://www.100md.com
0
3
1
0
0
术后2周
4
0
0
2
2
0
1
3
, 百拇医药
0
4
0
0
0
术后4周
4
2
2
0
0
3
1
0
, 百拇医药
0
4
0
0
0
术后8周
4
3
1
0
0
3
1
0
, 百拇医药
0
4
0
0
0
正常
4
3
1
0
0
4
0
0
, http://www.100md.com
0
4
0
0
0
+:阳性细胞数<10%, :10%~50%,
:10%~50%, :>50%,-:无表达1.4 免疫组化ABC法检测CD3、CD19、CD68表达 切片脱蜡至水→0.01 mol.L-1PBS洗5 min→0.3% H2O2室温孵育10 min→PBS洗3×5 min→封闭剂37℃ 20 min后甩去,勿洗→一抗37℃ 60 min→PBS洗3×5 min→生物素化二抗37℃ 30 min→PBS洗3×5 min→加ABC混合液,37℃ 30 min→PBS洗3×5 min→DAB显色→苏木精衬染封片→显微镜观察。注:CD19须用冰冻切片。
:>50%,-:无表达1.4 免疫组化ABC法检测CD3、CD19、CD68表达 切片脱蜡至水→0.01 mol.L-1PBS洗5 min→0.3% H2O2室温孵育10 min→PBS洗3×5 min→封闭剂37℃ 20 min后甩去,勿洗→一抗37℃ 60 min→PBS洗3×5 min→生物素化二抗37℃ 30 min→PBS洗3×5 min→加ABC混合液,37℃ 30 min→PBS洗3×5 min→DAB显色→苏木精衬染封片→显微镜观察。注:CD19须用冰冻切片。
, 百拇医药
1.5 硫堇法肥大细胞染色 切片脱蜡至水→硫堇溶液染色45 min→ddH2O稍洗→醋酸溶液分化5 min→自来水洗2 min→用吸水纸将切片吸干→二甲苯透明,中性树胶封固。
1.6 免疫组化及特殊染色结果分析 在光镜下观察切片,每张切片由3人分别观察分析,至少以2人观察结果为最终阳性程度。在高倍镜下观察每张切片粘膜下层的5个视野,且要求均匀分布于组织结构中。平均估算着色细胞所占的百分率,按下列标准进行分级:阳性细胞数>50% ;10%~50% ;<10%+;无着色-。
2 结果
2.1 流式细胞分析结果 CD3、CD19、CD68分别是T-淋巴细胞、B-淋巴细胞和巨噬细胞的特征性表面粘附分子,可做为这3种细胞的标志。结果提示:术后1、2周组织中CD3、CD68表达量明显增强,与正常食管组差异有显著性(P<0.01);术后4、8周组织CD3、CD68表达量明显减少,与正常食管差异无显著性。说明支架术后1、2周食管局部有大量T-淋巴细胞及巨噬细胞浸润,术后4、8周组织细胞浸润明显减少。食管支架术后组织中CD19的表达量与正常食管组织及对照组比较差异无显著性,说明很少有B-淋巴细胞浸润(表1)。
, 百拇医药
2.2 免疫组化检测CD3、CD19、CD68 术后1周组织中出现CD3、CD68表达,阳性细胞散在分布于粘膜下层;术后2周表达量明显增强,阳性细胞的密度升高,分布均匀;术后4、8周表达明显减弱,仍可见少量CD3阳性细胞,极少见CD68阳性细胞。术后1周组织偶可见CD19阳性细胞,术后2、4、8周组织均未见CD19阳性细胞。由此说明,术后1、2周组织中有明显的T-C、MΦ浸润,术后4、8周两种细胞含量明显减少,乃至消失。支架术后食管组织中极少有B-淋巴细胞浸润。阳性细胞的着色部位以胞膜为主,不同取材部位的表达结果基本一致(图1、2,表2)。
2.3 硫堇染色检测肥大细胞 肥大细胞(MC)经染色后,胞浆充满紫红色颗粒,胞核呈蓝色。术后1周食管组织中即可见散在分布的MC;术后2周MC略有减少;术后4周明显减少,仅2只样本可见极少数MC;术后8周MC基本消失。着色的MC主要分布于粘膜下层,无明确的分布规律。正常食管极少有MC存在。不同取材部位的组织检测结果基本一致(图3,表3)。
, 百拇医药
表3 食管支架术后组织MC分布状况(n=4) 组织
阴性
偶见
<10%
10%~50%
术后1周
0
1
3
0
术后2周
0
0
, 百拇医药
3
1
术后4周
0
4
0
0
术后8周
0
4
0
0
正常食管
4
, 百拇医药
0
0
0
图1 支架术后食管组织CD3的表达状况 A 术后1周 B 术后2周
图2 支架术后食管组织CD68的表达状况 A 术后1周 B 术后2周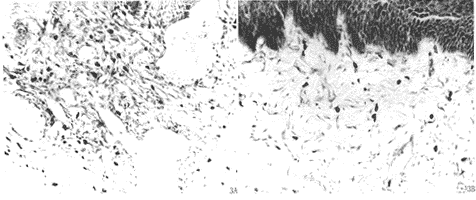
图3 支架术后食管组织中肥大细胞的分布状况 A 术后1周 B 术后2周
3 讨论
, 百拇医药
组织损伤修复及局部纤维化是个复杂的病理过程,其基础是免疫细胞和修复细胞的一系列活动。主要的免疫细胞包括巨噬细胞、T-淋巴细胞、肥大细胞;主要的修复细胞包括;成纤维细胞、血管内皮细胞、上皮细胞。目前已知,免疫细胞在组织修复过程中的作用除了参与炎症反应外,更重要是通过释放多种细胞介质直接和间接、单独或协同影响着修复细胞的增殖功能,从而促进组织的血管化、纤维化〔1〕。国内外学者研究发现,不同形式的组织损伤修复在免疫细胞及细胞介质调控上存在很大差异,如外伤、肝炎后肝硬化、肺纤维化等均有不同的调控机制。食管支架术后再狭窄作为组织损伤修复的一种形式必然包含有特殊发病机制,目前国内外尚未见文献报道。
T-淋巴细胞在组织修复及纤维化的病理过程中,一方面通过某些细胞介质的释放调节巨噬细胞的功能;另外可直接产生一系列细胞因子以促进纤维化的产生〔2〕。MΦ除具有吞噬异物、提呈抗原外,还可分泌大量细胞因子参与组织修复及纤维化过程〔3〕。Peterson于1992年发现,肝脏受损后,肝内浸润的MΦ产生大量的TNF-α、PDGF等细胞因子,进而促进纤维化形成〔4〕。MC在器官纤维化过程中起着重要的作用。Levi于1995年发现激活的肥大细胞能增强3T3细胞的增殖分泌功能,从而不断产生并分泌胶原纤维〔5〕。Me T-Calfe于1998年报道,活化的肥大细胞可产生一系列致纤维化的细胞因子如:TNF-α、TGFβ1、IL-1、IL-2等〔6〕。本实验结果提示,支架术后1、2周的组织即有明显的T-淋巴细胞、MΦ浸润,与正常食管相比差异有显著性,术后4、8周细胞数显著减少。作者的前期研究表明,支架术后1周内,食管局部开始出现新生的肉芽组织,并产生纤维结缔组织;术后2周纤维组织明显增多,食管腔逐渐狭窄,仍有肉芽组织形成;术后4、8周管腔明显狭窄,局部有大量纤维组织肉芽组织逐渐消失,纤维化过程渐趋稳定。由此可见,T-细胞、MΦ局部浸润的动态变化与再狭窄的病理过程基本吻合。随着大量T-细胞、MΦ的浸润,局部表现为活跃的纤维化状态,术后4、8周T-细胞、MΦ显著减少,纤维化过程逐渐稳定。说明T-细胞、MΦ的变化与纤维化的产生具有一定的关系,对再狭窄形成具有重要的调控作用。食管支架术后1、2周组织粘膜下层可见广泛分布的MC,较正常食管组织明显增多,有相当比例的肥大细胞呈长梭形和不规则形状,说明此时MC呈旺盛的脱颗粒状态。术后4、8周组织内肥大细胞明显减少,术后8周组织中很少出现MC,而此时纤维化过程基本稳定,说明肥大细胞的活性状态与再狭窄过程密切相关。
, 百拇医药
从生物力学角度来看,再狭窄的产生是支架与食管壁之间张力关系的必然结果。随着细胞的增殖修复和纤维化,支架的张力作用逐渐得到缓解,也就意味着再狭窄的外源性启动因素逐渐减弱。最终结果必然会导致局部炎性细胞的浸润减少、相关细胞因子的表达降低,这完全符合术后4、8周组织的实验结果。总之,从实验结果我们可以发现,食管支架术后再狭窄的病理过程与巨噬细胞、T-淋巴细胞、肥大细胞的浸润密切相关。从而为再狭窄临床防治的探索提供理论依据。
基金项目:国家自然科学基金(项目编号:39670341)
作者简介:宛新建,男,32岁,博士,主治医师,讲师;
许国铭,男,59岁,主任医师,现任中华内科学会委员,中华消化病学会常委,上海消化病学会副主任委员
参考文献
1,Kovacs E,Dipietro LA. Fitrogenic cytokines and connective tissue production. The FASEB Journal,1994;8(3):854~861
, http://www.100md.com
2,Postlethwaite AE. Role of T cells and cytokines in effecting fibrosis.Int Rev Immunol,1995;12(2~4):247~258
3,Yamate J, Tatsumi M, Nakatsuji S et al. Immunohistochemical observations on the kinetics of macrophages and myofibroblasts in rat renal interstitial fibrosis induced by cis-diamminedichloroplatinum. J Com Pathol,1995;112(1):27~39
4,Peterson TC, Isbrucker RA. Fibroproliferation in liver disease:role of monocyte factors. Hepatology,1992;15(2):191
5,Levi Schaffer F, Rubinchik E. Activated mast cells are fibrogenic for 3T3 fibroblasts. J Invest Dermatol,1995;104(6):999~1 003
6,Me T-Calfe DD,Baram D, Mekori YA et al. Mast cell. Physiol Rev,1997;77(4):1 033~1 079
1999-10-18收稿,2000-01-04修回, 百拇医药
单位:第二军医大学长海医院消化内科,上海 200433
关键词:食管狭窄;支架
安徽医科大学学报000404
摘要 目的 研究食管支架术后不同时间局部食管组织中炎性细胞浸润及分布的变化,以及与再狭窄形成的关系。方法 采用免疫组化(ABC法)检测支架术后1、2、4、8周组织中CD3、CD19、CD68的表达状况,从而反映出巨噬细胞(MΦ)、T-淋巴细胞(T-LC)、B-淋巴细胞(B-LC)的浸润及分布状况。制备再狭窄组织的细胞悬液,采用流式细胞分析法检测组织中3种细胞的含量变化。采用特殊染色法分析组织中肥大细胞(MC)的分布状况。结果 支架术后1、2周组织中有明显的T-淋巴细胞、巨噬细胞、肥大细胞浸润,其细胞含量较正常食管显著升高,而B-淋巴细胞含量极少,术后4、8周各种细胞的含量及分布与正常食管相似。结论 巨噬细胞、肥大细胞及T-淋巴细胞与支架术后再狭窄的形成存在密切关系,可能是局部纤维化的重要调控细胞。
, http://www.100md.com
中图分类号 R571.1;R619;R655.4
文献标识码 A 文章编号 1000-1492(2000)04-0256-04
Changes of related inflammatory cells in esophageal tissue after stenting
Wan Xinjian,Li Zhaoshen,Xu Guoming et al
(Dept of Gastroenterology,Changhai Hospital,The Second Military Medical University,Shanghai 200433)
Abstract Objective To study the infiltration and distribution of inflammatory cells,and the relation with re-stenosis,at several times after stenting. Methods The number and distribution of macrophage,T-lymphocyte,B-lymphocyte in esophageal tissue at week 1,2,4,8 after stenting had been measured by flowcytometry and immunohistochemical methods(ABC). Special staining was used to analyse the distribution of mast cells. Results The T-cell,MΦ,mast cell infiltrated greatly in esophageal tissue 1,2 weeks after stenting,and the number of these cells was much more than that in normal esophagus. But B-cell was very little,the number and distribution was similar to normal esophagus at 4,8 weeks after stenting. Conclusion MΦ,mast cell and T-cell are closely related with restenosis after esophageal stenting,and may be the key regulatory cells in local fibrosis.
, 百拇医药
MeSH esphagus stenosis; stent
巨噬细胞(MΦ)、T-淋巴细胞(T-cell)、肥大细胞(MC)作为免疫系统的主要成员,在组织创伤愈合及器官纤维化过程中发挥重要的作用,是主要的调控因素。目前的研究发现,在组织损伤愈合过程中,局部有大量的MΦ、T-cell、MC浸润,并表达出相关的致纤维化细胞因子,如IL-1、IL-6、TNF-α、TGFβ1、PDGF等。正是由于这些细胞因子的作用,促使了局部肉芽组织的形成及纤维结缔组织产生,进而表现为瘢痕形成及纤维化。在不同类型的创伤中,起调控作用的炎性细胞存在一定的差异。再狭窄是食管支架术后最常见的远期并发症,主要表现为支架放置部位大量肉芽组织形成及纤维化,最终导致食管腔再次狭窄。作为组织创伤愈合的一种形式,其病理过程的调控机制与一般的创伤可能存在一定的相似性,有关这方面的研究国内外尚未见有文献报道。本实验采用免疫组织化学的基本方法探讨再狭窄过程中相关炎性细胞的调控机制。
, 百拇医药
1 材料与方法
1.1 试剂及仪器 0.05%胶原酶,0.1%胰蛋白酶(华美公司),70%乙醇,ABC免疫组化试剂盒(Vector公司),CD3、CD68单克隆抗体(华美公司),CD19单克隆抗体(武汉博士德公司),0.01 mol.L-1 PBS(pH 7.4),DAB溶解液(pH 5.0)(上海华顺公司),抗体稀释液(10%小牛血清-PBS液),封闭剂(10%绵羊血清-PBS液),0.3% H2O2-甲醇液,3% H2O2,FITC标记的二抗IgG(上海华美公司),0.5%硫堇溶液(上海生化试剂公司),0.2%醋酸溶液(上海生化试剂公司),流式细胞分析仪(Becton Dickinson公司),150目、250目铜网,倒置显微镜(Olympus公司)。
1.2 动物实验标本采集、处理 选择16只实验犬,经“自体阔筋膜移植固定法”置入并固定食管支架。具体操作如下:无菌手术下切开颈部皮肤,游离出颈部食管,内镜引导下置入食管支架,使其上端定位于颈部游离段食管。将阔筋膜附着于置架部位的食管外壁,用医用不锈钢细丝两处缝合固定。术中局部注射少量青霉素,术后予半流质饮食。所有术后实验犬均分为4组,分别观察1、2、4、8周。届时分批处死动物,取出置架部位的食管组织分别制成石蜡、冷冻切片及细胞悬液。另取4例正常犬食管组织为对照。
, 百拇医药
1.3 细胞悬液制备及流式细胞分析CD3、CD19、CD68表达 将留取的新鲜组织用眼科剪剪为1.0 mm大小的小块,并用冰冷生理盐水漂洗4次。0.05%胶原酶37℃消化20 min(1.0 g组织加入消化液10 ml),同时间断地振荡。将250目铜网扎在小烧杯上,把消化后组织细胞悬液倒于网上,以试管底端轻搓组织块,直到组织搓完。离心沉淀500转*min-1,2 min,用PBS液将细胞浓度调至109个*L-1,取20 μl分别与10 μl CD3、CD19、CD68单抗原液混匀,室温下孵育30 min。PBS洗3次后与FIT-C标记的二抗IgG(1∶40)混匀,4℃静置30 min。PBS洗2次后,调细胞浓度为109个*L-1上机,每次计数2万个细胞,根据光强度确定CD3、CD19、CD68表达量。对照组不加一抗,其余步骤相同。流式细胞结果采用方差分析进行统计。
表1 流式细胞法检测支架术后组织中CD3、CD19、CD68的表达(
 ±s,n=4)
±s,n=4), http://www.100md.com
1周(%)
2周(%)
4周(%)
8周(%)
正常(%)
CD3
19.45±1.40**
28.17±2.76**
9.05±1.82
7.27±1.32
8.24±0.24
CD19
, http://www.100md.com
6.11±0.17
5.96±0.14
8.76±1.84
5.32±1.96
6.99±1.09
CD68
18.16±0.51**
23.47±2.09**
9.27±2.05
6.76±2.47
8.57±2.16
, 百拇医药
与对照组比较:**P<0.01表2 免疫组化检测食管支架术后组织CD3、CD19、CD68表达 组别
n
CD3
CD68
CD19
-
+


-
+


, http://www.100md.com
-
+


术后1周
4
0
1
3
0
0
2
2
, http://www.100md.com
0
3
1
0
0
术后2周
4
0
0
2
2
0
1
3
, 百拇医药
0
4
0
0
0
术后4周
4
2
2
0
0
3
1
0
, 百拇医药
0
4
0
0
0
术后8周
4
3
1
0
0
3
1
0
, 百拇医药
0
4
0
0
0
正常
4
3
1
0
0
4
0
0
, http://www.100md.com
0
4
0
0
0
+:阳性细胞数<10%,
 :10%~50%,
:10%~50%, :>50%,-:无表达1.4 免疫组化ABC法检测CD3、CD19、CD68表达 切片脱蜡至水→0.01 mol.L-1PBS洗5 min→0.3% H2O2室温孵育10 min→PBS洗3×5 min→封闭剂37℃ 20 min后甩去,勿洗→一抗37℃ 60 min→PBS洗3×5 min→生物素化二抗37℃ 30 min→PBS洗3×5 min→加ABC混合液,37℃ 30 min→PBS洗3×5 min→DAB显色→苏木精衬染封片→显微镜观察。注:CD19须用冰冻切片。
:>50%,-:无表达1.4 免疫组化ABC法检测CD3、CD19、CD68表达 切片脱蜡至水→0.01 mol.L-1PBS洗5 min→0.3% H2O2室温孵育10 min→PBS洗3×5 min→封闭剂37℃ 20 min后甩去,勿洗→一抗37℃ 60 min→PBS洗3×5 min→生物素化二抗37℃ 30 min→PBS洗3×5 min→加ABC混合液,37℃ 30 min→PBS洗3×5 min→DAB显色→苏木精衬染封片→显微镜观察。注:CD19须用冰冻切片。, 百拇医药
1.5 硫堇法肥大细胞染色 切片脱蜡至水→硫堇溶液染色45 min→ddH2O稍洗→醋酸溶液分化5 min→自来水洗2 min→用吸水纸将切片吸干→二甲苯透明,中性树胶封固。
1.6 免疫组化及特殊染色结果分析 在光镜下观察切片,每张切片由3人分别观察分析,至少以2人观察结果为最终阳性程度。在高倍镜下观察每张切片粘膜下层的5个视野,且要求均匀分布于组织结构中。平均估算着色细胞所占的百分率,按下列标准进行分级:阳性细胞数>50% ;10%~50% ;<10%+;无着色-。
2 结果
2.1 流式细胞分析结果 CD3、CD19、CD68分别是T-淋巴细胞、B-淋巴细胞和巨噬细胞的特征性表面粘附分子,可做为这3种细胞的标志。结果提示:术后1、2周组织中CD3、CD68表达量明显增强,与正常食管组差异有显著性(P<0.01);术后4、8周组织CD3、CD68表达量明显减少,与正常食管差异无显著性。说明支架术后1、2周食管局部有大量T-淋巴细胞及巨噬细胞浸润,术后4、8周组织细胞浸润明显减少。食管支架术后组织中CD19的表达量与正常食管组织及对照组比较差异无显著性,说明很少有B-淋巴细胞浸润(表1)。
, 百拇医药
2.2 免疫组化检测CD3、CD19、CD68 术后1周组织中出现CD3、CD68表达,阳性细胞散在分布于粘膜下层;术后2周表达量明显增强,阳性细胞的密度升高,分布均匀;术后4、8周表达明显减弱,仍可见少量CD3阳性细胞,极少见CD68阳性细胞。术后1周组织偶可见CD19阳性细胞,术后2、4、8周组织均未见CD19阳性细胞。由此说明,术后1、2周组织中有明显的T-C、MΦ浸润,术后4、8周两种细胞含量明显减少,乃至消失。支架术后食管组织中极少有B-淋巴细胞浸润。阳性细胞的着色部位以胞膜为主,不同取材部位的表达结果基本一致(图1、2,表2)。
2.3 硫堇染色检测肥大细胞 肥大细胞(MC)经染色后,胞浆充满紫红色颗粒,胞核呈蓝色。术后1周食管组织中即可见散在分布的MC;术后2周MC略有减少;术后4周明显减少,仅2只样本可见极少数MC;术后8周MC基本消失。着色的MC主要分布于粘膜下层,无明确的分布规律。正常食管极少有MC存在。不同取材部位的组织检测结果基本一致(图3,表3)。
, 百拇医药
表3 食管支架术后组织MC分布状况(n=4) 组织
阴性
偶见
<10%
10%~50%
术后1周
0
1
3
0
术后2周
0
0
, 百拇医药
3
1
术后4周
0
4
0
0
术后8周
0
4
0
0
正常食管
4
, 百拇医药
0
0
0

图1 支架术后食管组织CD3的表达状况 A 术后1周 B 术后2周

图2 支架术后食管组织CD68的表达状况 A 术后1周 B 术后2周

图3 支架术后食管组织中肥大细胞的分布状况 A 术后1周 B 术后2周
3 讨论
, 百拇医药
组织损伤修复及局部纤维化是个复杂的病理过程,其基础是免疫细胞和修复细胞的一系列活动。主要的免疫细胞包括巨噬细胞、T-淋巴细胞、肥大细胞;主要的修复细胞包括;成纤维细胞、血管内皮细胞、上皮细胞。目前已知,免疫细胞在组织修复过程中的作用除了参与炎症反应外,更重要是通过释放多种细胞介质直接和间接、单独或协同影响着修复细胞的增殖功能,从而促进组织的血管化、纤维化〔1〕。国内外学者研究发现,不同形式的组织损伤修复在免疫细胞及细胞介质调控上存在很大差异,如外伤、肝炎后肝硬化、肺纤维化等均有不同的调控机制。食管支架术后再狭窄作为组织损伤修复的一种形式必然包含有特殊发病机制,目前国内外尚未见文献报道。
T-淋巴细胞在组织修复及纤维化的病理过程中,一方面通过某些细胞介质的释放调节巨噬细胞的功能;另外可直接产生一系列细胞因子以促进纤维化的产生〔2〕。MΦ除具有吞噬异物、提呈抗原外,还可分泌大量细胞因子参与组织修复及纤维化过程〔3〕。Peterson于1992年发现,肝脏受损后,肝内浸润的MΦ产生大量的TNF-α、PDGF等细胞因子,进而促进纤维化形成〔4〕。MC在器官纤维化过程中起着重要的作用。Levi于1995年发现激活的肥大细胞能增强3T3细胞的增殖分泌功能,从而不断产生并分泌胶原纤维〔5〕。Me T-Calfe于1998年报道,活化的肥大细胞可产生一系列致纤维化的细胞因子如:TNF-α、TGFβ1、IL-1、IL-2等〔6〕。本实验结果提示,支架术后1、2周的组织即有明显的T-淋巴细胞、MΦ浸润,与正常食管相比差异有显著性,术后4、8周细胞数显著减少。作者的前期研究表明,支架术后1周内,食管局部开始出现新生的肉芽组织,并产生纤维结缔组织;术后2周纤维组织明显增多,食管腔逐渐狭窄,仍有肉芽组织形成;术后4、8周管腔明显狭窄,局部有大量纤维组织肉芽组织逐渐消失,纤维化过程渐趋稳定。由此可见,T-细胞、MΦ局部浸润的动态变化与再狭窄的病理过程基本吻合。随着大量T-细胞、MΦ的浸润,局部表现为活跃的纤维化状态,术后4、8周T-细胞、MΦ显著减少,纤维化过程逐渐稳定。说明T-细胞、MΦ的变化与纤维化的产生具有一定的关系,对再狭窄形成具有重要的调控作用。食管支架术后1、2周组织粘膜下层可见广泛分布的MC,较正常食管组织明显增多,有相当比例的肥大细胞呈长梭形和不规则形状,说明此时MC呈旺盛的脱颗粒状态。术后4、8周组织内肥大细胞明显减少,术后8周组织中很少出现MC,而此时纤维化过程基本稳定,说明肥大细胞的活性状态与再狭窄过程密切相关。
, 百拇医药
从生物力学角度来看,再狭窄的产生是支架与食管壁之间张力关系的必然结果。随着细胞的增殖修复和纤维化,支架的张力作用逐渐得到缓解,也就意味着再狭窄的外源性启动因素逐渐减弱。最终结果必然会导致局部炎性细胞的浸润减少、相关细胞因子的表达降低,这完全符合术后4、8周组织的实验结果。总之,从实验结果我们可以发现,食管支架术后再狭窄的病理过程与巨噬细胞、T-淋巴细胞、肥大细胞的浸润密切相关。从而为再狭窄临床防治的探索提供理论依据。
基金项目:国家自然科学基金(项目编号:39670341)
作者简介:宛新建,男,32岁,博士,主治医师,讲师;
许国铭,男,59岁,主任医师,现任中华内科学会委员,中华消化病学会常委,上海消化病学会副主任委员
参考文献
1,Kovacs E,Dipietro LA. Fitrogenic cytokines and connective tissue production. The FASEB Journal,1994;8(3):854~861
, http://www.100md.com
2,Postlethwaite AE. Role of T cells and cytokines in effecting fibrosis.Int Rev Immunol,1995;12(2~4):247~258
3,Yamate J, Tatsumi M, Nakatsuji S et al. Immunohistochemical observations on the kinetics of macrophages and myofibroblasts in rat renal interstitial fibrosis induced by cis-diamminedichloroplatinum. J Com Pathol,1995;112(1):27~39
4,Peterson TC, Isbrucker RA. Fibroproliferation in liver disease:role of monocyte factors. Hepatology,1992;15(2):191
5,Levi Schaffer F, Rubinchik E. Activated mast cells are fibrogenic for 3T3 fibroblasts. J Invest Dermatol,1995;104(6):999~1 003
6,Me T-Calfe DD,Baram D, Mekori YA et al. Mast cell. Physiol Rev,1997;77(4):1 033~1 079
1999-10-18收稿,2000-01-04修回, 百拇医药