改良二温式PCR法SM7微小卫星标记快速多态分析对多囊肾病家系的基因诊断*
作者:陈怡 俞康 徐玉兰
单位:陈怡 俞康 温州医学院附属第一医院血液科(325000);徐玉兰 温州医学院附属第一医院肾内科
关键词:
温州医学院学报/990435 常染色体显性遗传多囊肾病(ADPKD)是终末期肾衰的主要原因,发病率高达1/1000[1]。其基因突变定位在第16号染色体短臂1区3带的PKD1位点[2],后来发现ADPKD存在遗传异质性,定位了PKD2、PKD3位点[3]。国际上常用的PKD1位点相邻的微小卫星体DNA SM7为遗传标记[4]。本研究采用改良二温式PCR扩增法结合聚丙烯酰胺凝胶电泳与银染色对10个ADPKD家系成员进行基因连锁分析,结果表明这是一种快速、简便、有效的ADPKDI基因诊断方法。介绍如下。
, 百拇医药
1 材料和方法
1.1 染色体DNA分离纯化 取静脉血10ml,EDTA(1mg/ml)抗凝,分离白细胞,蛋白酶E水解后,高盐沉淀法提取DNA,用紫光分光光度计测定DNA浓度及纯度,DNA溶于TE溶液100μl(-20℃)保存备用,DNA的纯度A260/A280≥1.7。
1.2 PCR扩增
1.2.1 引物序列:
SM7:(TG)5’-ACATATGTAGTCTTCTGCAGG-3’
(CA)5’-ACAAGAGTGAATCTCTGACAG-3’
引物由上海复旦大学遗传研究所合成。
, 百拇医药 1.2.2 试剂:dATP,dGTP,dCTP,dTTP及TaqDNA多聚酶(附有缓冲液及MgCl2)均购自Promega公司。
1.2.3 PCR反应条件:取模板DNA(80~100ng),加入引物6pmol,dNTP(每种200μmol/L),TaqDNA多聚酶(一个单位),MgCl2(1~4mmol/L),扩增缓冲液加至总体积25μl,反应液上覆盖液状石蜡2滴,于美国PE公司生产DNA扩增仪上扩增,扩增温度98℃,10分钟预变性后,94℃ 1.5分钟,56℃ 2分钟,72℃ 1.5分钟,循环30次,最后72℃ 10分钟,扩增产物约100~150bp,4℃储藏待鉴定。
1.3 PCR产物鉴定及分析 取8μl扩增产物加载体缓冲液2μl,10%聚丙烯酰胺凝胶电泳,电压250V,电泳4~5小时(4℃)电泳结束后,按Budowle等方法凝胶Ag+染色,真空干燥后观察结果。
, http://www.100md.com
1.4 研究对象 来自我院ADPKD专家门诊共10个家系,共103个家庭成员,其中包括29个B超确诊的ADPKD患者。选用家系符合以下条件:①20岁以后发病的经B超确诊的双肾多囊的临床先证者;②每个家系至少有两个经B超确诊的患者(两代中每代至少1个或同代有两个以上);③至少有1个正常成员;④发病符合常染色体显性遗传规律。
2 结果
利用上法对10个ADPKD家系成员进行了基因连锁分析。在103个家庭成员中除29个先证者外,又有9个成员通过ADPKD家系分析得以确诊为ADPKD症前患者。图1显示家系1的遗传关系,图2示家系1的ADPKD凝胶电泳图谱,附家系1基因连锁分析表:此家系的SM7等位片段共5个,从小到大为A1~A5,A5与病变基因连锁关系确切。此谱系中Ⅲ3(R17)携带A5等位片段,故其为PKD1基因携带者,应是症前患者。
, 百拇医药
附表 家系1基因连锁分析表 个体
Ⅱ1(R18)
Ⅱ2(R19)
Ⅱ3(R14)
Ⅲ1(R15)
Ⅲ2(R16)
Ⅲ3(R17)
基因型
A2A5
A1A3
, 百拇医药
A2A4
A2A5
A2A3
A2A5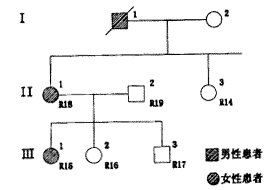
图1 家系1遗传关系图
图2 家系1ADPKD凝胶电泳结果图
3 讨论
ADPKD是终末期肾衰的主要原因之一,迄今仍缺乏有效的治疗方法,及早对ADPKD家系中有发病风险的成员做出症前基因诊断,有利于尽早对携带致病基因而尚未出现症状的成员定期随访,实施医疗监护。
, http://www.100md.com
1990年Sarris[5]等采用PCR技术及变性梯度凝胶电泳方法,成功对一个ADPKD家系进行基因诊断,取代了RFLP方法,但仍较繁琐。1991年Harris等[6]分离到两个与ADPKDⅠ紧密连锁的微卫星DNA标记SM7和SM5,设计了相应的引物,采用聚丙烯酰胺凝胶电泳及EB染色的方法使ADPKD基因诊断更加简便、快速。目前发现SM7有11个等位片段,多态信息含量(PIC)为0.63,而SM5 PIC为0.19,因此,将SM7用于ADPKD家系的多态连锁分析中,获得满意结果,确定了SM7作为ADPKDⅠ的一个多态遗传性标记的价值。
但是经典的ADPKD多态性家系分析方法还是比较繁琐,且在家系普查的过程中耗时长,消耗较大。由于ADPKD多态分析无特定的致病基因条带,只能通过家系中的先证者进行分析,辨析哪些家系成员是ADPKD基因携带者,同时电泳结果必须清晰可靠。而传统PCR扩增后的非特异性条带较多,造成家系分析过程中的困难,而且容易出现误分析影响整个实验的结果。我们通过反复实验探索条件,通过减少引物量,降低退火温度,使退火和延伸合二为一,改良为二温式PCR。改良后引物使用量大为减少,节约费用,便于普查。尤其重要的是改良后使扩增条带更为清晰,非特异性条带大为减少,使家系分析更为方便可靠,避免误诊,同时也加快了实验速度。其次,我们运用聚丙烯凝胶—银染方法,使用DNA条带的分辨率增高,条带清晰,特异性增强,实验结果可以在凝胶上直接辨读,经干胶后结果可长期保存。
, http://www.100md.com
家系1Ⅲ2(R16)未携带A5等位片段,但不能完全排除症前患者,需考虑所选遗传标记与PKD1发生重组可能。同时,ADPKD存在遗传异质性和PKD1以外的基因位点,故需进一步用PKD2、PKD3位点相邻的遗传标记进行基因定位,才能作出基因诊断。因此本方法只能作为ADPKD的初步诊断,对部分发生重组的病人尚不能作出明确的诊断。
*本课题为浙江省教委科研资助项目
参考文献
1 刘玉春,张宏,钟宏琳等.成人型多囊肾病多器官损害205例临床分析.中华内科杂志,1995,34∶612
2 Readers ST,Breuning MH,Davies KE,et al.A highly ploymouphic DNA markers linked to adult polycystic kidney disease on chromosome 16.Nature,1985,317∶542
, http://www.100md.com
3 Daouet MC,Roynolds DM,Bichet DG,et al.Evidence for a third genetic locus for sutosomal dominant polycystic kidney disease.Genomics,1995,25∶733
4 Turco AE,Padovani EM,Chiaffoni GP,et al.Molccular genetic diagnosis of autosomal dominant polycystic kidney disease in a newborn with bilateral cystic kidneys detected prenatally and multiple skeletal malformations.J Med Genet,1993,30∶419
5 Harris PC,Tomas S,Ratcliffe PJ,et al.Rapid gene analysis of families with polycystic kidney disease l by means of a microsatellite marker.Lancet,1991,338∶1484
6 The intermational polycystic kindey disease consortium.Polycystic kindey disease:the complete structure of the PKD gene and its protein.Cell,1995,81∶289
(收稿:1999-05-12), http://www.100md.com
单位:陈怡 俞康 温州医学院附属第一医院血液科(325000);徐玉兰 温州医学院附属第一医院肾内科
关键词:
温州医学院学报/990435 常染色体显性遗传多囊肾病(ADPKD)是终末期肾衰的主要原因,发病率高达1/1000[1]。其基因突变定位在第16号染色体短臂1区3带的PKD1位点[2],后来发现ADPKD存在遗传异质性,定位了PKD2、PKD3位点[3]。国际上常用的PKD1位点相邻的微小卫星体DNA SM7为遗传标记[4]。本研究采用改良二温式PCR扩增法结合聚丙烯酰胺凝胶电泳与银染色对10个ADPKD家系成员进行基因连锁分析,结果表明这是一种快速、简便、有效的ADPKDI基因诊断方法。介绍如下。
, 百拇医药
1 材料和方法
1.1 染色体DNA分离纯化 取静脉血10ml,EDTA(1mg/ml)抗凝,分离白细胞,蛋白酶E水解后,高盐沉淀法提取DNA,用紫光分光光度计测定DNA浓度及纯度,DNA溶于TE溶液100μl(-20℃)保存备用,DNA的纯度A260/A280≥1.7。
1.2 PCR扩增
1.2.1 引物序列:
SM7:(TG)5’-ACATATGTAGTCTTCTGCAGG-3’
(CA)5’-ACAAGAGTGAATCTCTGACAG-3’
引物由上海复旦大学遗传研究所合成。
, 百拇医药 1.2.2 试剂:dATP,dGTP,dCTP,dTTP及TaqDNA多聚酶(附有缓冲液及MgCl2)均购自Promega公司。
1.2.3 PCR反应条件:取模板DNA(80~100ng),加入引物6pmol,dNTP(每种200μmol/L),TaqDNA多聚酶(一个单位),MgCl2(1~4mmol/L),扩增缓冲液加至总体积25μl,反应液上覆盖液状石蜡2滴,于美国PE公司生产DNA扩增仪上扩增,扩增温度98℃,10分钟预变性后,94℃ 1.5分钟,56℃ 2分钟,72℃ 1.5分钟,循环30次,最后72℃ 10分钟,扩增产物约100~150bp,4℃储藏待鉴定。
1.3 PCR产物鉴定及分析 取8μl扩增产物加载体缓冲液2μl,10%聚丙烯酰胺凝胶电泳,电压250V,电泳4~5小时(4℃)电泳结束后,按Budowle等方法凝胶Ag+染色,真空干燥后观察结果。
, http://www.100md.com
1.4 研究对象 来自我院ADPKD专家门诊共10个家系,共103个家庭成员,其中包括29个B超确诊的ADPKD患者。选用家系符合以下条件:①20岁以后发病的经B超确诊的双肾多囊的临床先证者;②每个家系至少有两个经B超确诊的患者(两代中每代至少1个或同代有两个以上);③至少有1个正常成员;④发病符合常染色体显性遗传规律。
2 结果
利用上法对10个ADPKD家系成员进行了基因连锁分析。在103个家庭成员中除29个先证者外,又有9个成员通过ADPKD家系分析得以确诊为ADPKD症前患者。图1显示家系1的遗传关系,图2示家系1的ADPKD凝胶电泳图谱,附家系1基因连锁分析表:此家系的SM7等位片段共5个,从小到大为A1~A5,A5与病变基因连锁关系确切。此谱系中Ⅲ3(R17)携带A5等位片段,故其为PKD1基因携带者,应是症前患者。
, 百拇医药
附表 家系1基因连锁分析表 个体
Ⅱ1(R18)
Ⅱ2(R19)
Ⅱ3(R14)
Ⅲ1(R15)
Ⅲ2(R16)
Ⅲ3(R17)
基因型
A2A5
A1A3
, 百拇医药
A2A4
A2A5
A2A3
A2A5

图1 家系1遗传关系图

图2 家系1ADPKD凝胶电泳结果图
3 讨论
ADPKD是终末期肾衰的主要原因之一,迄今仍缺乏有效的治疗方法,及早对ADPKD家系中有发病风险的成员做出症前基因诊断,有利于尽早对携带致病基因而尚未出现症状的成员定期随访,实施医疗监护。
, http://www.100md.com
1990年Sarris[5]等采用PCR技术及变性梯度凝胶电泳方法,成功对一个ADPKD家系进行基因诊断,取代了RFLP方法,但仍较繁琐。1991年Harris等[6]分离到两个与ADPKDⅠ紧密连锁的微卫星DNA标记SM7和SM5,设计了相应的引物,采用聚丙烯酰胺凝胶电泳及EB染色的方法使ADPKD基因诊断更加简便、快速。目前发现SM7有11个等位片段,多态信息含量(PIC)为0.63,而SM5 PIC为0.19,因此,将SM7用于ADPKD家系的多态连锁分析中,获得满意结果,确定了SM7作为ADPKDⅠ的一个多态遗传性标记的价值。
但是经典的ADPKD多态性家系分析方法还是比较繁琐,且在家系普查的过程中耗时长,消耗较大。由于ADPKD多态分析无特定的致病基因条带,只能通过家系中的先证者进行分析,辨析哪些家系成员是ADPKD基因携带者,同时电泳结果必须清晰可靠。而传统PCR扩增后的非特异性条带较多,造成家系分析过程中的困难,而且容易出现误分析影响整个实验的结果。我们通过反复实验探索条件,通过减少引物量,降低退火温度,使退火和延伸合二为一,改良为二温式PCR。改良后引物使用量大为减少,节约费用,便于普查。尤其重要的是改良后使扩增条带更为清晰,非特异性条带大为减少,使家系分析更为方便可靠,避免误诊,同时也加快了实验速度。其次,我们运用聚丙烯凝胶—银染方法,使用DNA条带的分辨率增高,条带清晰,特异性增强,实验结果可以在凝胶上直接辨读,经干胶后结果可长期保存。
, http://www.100md.com
家系1Ⅲ2(R16)未携带A5等位片段,但不能完全排除症前患者,需考虑所选遗传标记与PKD1发生重组可能。同时,ADPKD存在遗传异质性和PKD1以外的基因位点,故需进一步用PKD2、PKD3位点相邻的遗传标记进行基因定位,才能作出基因诊断。因此本方法只能作为ADPKD的初步诊断,对部分发生重组的病人尚不能作出明确的诊断。
*本课题为浙江省教委科研资助项目
参考文献
1 刘玉春,张宏,钟宏琳等.成人型多囊肾病多器官损害205例临床分析.中华内科杂志,1995,34∶612
2 Readers ST,Breuning MH,Davies KE,et al.A highly ploymouphic DNA markers linked to adult polycystic kidney disease on chromosome 16.Nature,1985,317∶542
, http://www.100md.com
3 Daouet MC,Roynolds DM,Bichet DG,et al.Evidence for a third genetic locus for sutosomal dominant polycystic kidney disease.Genomics,1995,25∶733
4 Turco AE,Padovani EM,Chiaffoni GP,et al.Molccular genetic diagnosis of autosomal dominant polycystic kidney disease in a newborn with bilateral cystic kidneys detected prenatally and multiple skeletal malformations.J Med Genet,1993,30∶419
5 Harris PC,Tomas S,Ratcliffe PJ,et al.Rapid gene analysis of families with polycystic kidney disease l by means of a microsatellite marker.Lancet,1991,338∶1484
6 The intermational polycystic kindey disease consortium.Polycystic kindey disease:the complete structure of the PKD gene and its protein.Cell,1995,81∶289
(收稿:1999-05-12), http://www.100md.com