口服髓鞘碱性蛋白与T细胞疫苗接种联合诱导免疫耐受防治实验性自身免疫性脑脊髓炎
作者:刘学彬 武锦玲△ 谢蜀生
单位:北京医科大学免疫学系,北京 100083
关键词:致脑炎碱性蛋白类;治疗应用;脑脊髓炎;药物疗法;免疫耐受;T细胞接种☆;脑炎;疫苗接种
990315 摘 要 目的:口服髓鞘碱性蛋白(myelin basic protein, MBP)与T细胞疫苗接种(T cell vaccination, TCV)联合应用诱导免疫耐受,以提高特异性的免疫疗法对实验性自身免疫性脑脊髓膜炎(experimental autoimmune encephalomyelitis, EAE)的防治效果。方法:从gpSCH/CFA诱发EAE的DA大鼠体内取淋巴细胞,体外再以MBP刺激,并用rIL-2促进增殖,反复数个循环,可获得MBP特异的T淋巴细胞系。将此T细胞系经照射(15 Gy)灭活处理后,静脉接种至同基因正常DA大鼠体内,同时给此DA大鼠多次口服MBP诱导耐受,最后以脊髓匀浆/完全福氏佐剂(SCH/CFA)攻击经上述处理的大鼠,以观察其EAE的发病情况。结果:单独口服MBP诱导耐受及单独TCV处理的DA大鼠对随后诱发的EAE的抑制率分别为67%和50%,而将二者联合应用,则抑制率可达80%。结论:口服MBP与MBP特异的T细胞疫苗接种联合应用,可获得更深程度的耐受效果,多种手段联合应用可能成为临床今后通过诱导耐受防治自身免疫病的新策略。
, http://www.100md.com
中国图书资料分类法分类号 R512.3-332
Suppression of experimental autoimmune encephalomyelitis
in DA rats using the combination of oral tolerance and T cell vaccination
LIU Xue-Bin, WU Jin-Ling, XIE Shu-Sheng
(Department of Immunology, Beijing Medical University, Beijing 100083)
MeSH Encephalitogenic basic proteins/ther use Encephalomyelitis/drug eff Immunological tolerance T cell vaccination☆ Encephalitis, post-vaccinal
, 百拇医药
ABSTRACT Objective:To improve the therapeutic effects of experimental autoimmune encephalomyelitis (EAE) by induction of specific immunologic tolerance, we explored the effects of the combination of inoculation with attenuated myelin basic protein (MBP)-reactive T cell lines and oral administration of MBP on prevention of EAE induced by gpSCH/CFA in DA rats. Methods:DA rats were immunized with gpSCH/CFA. 9 days later, MBP-specific CD4+T cells were isolated from draining lymph node cells at the site of immunization, and were cultured in vitro in the presence of 1 mg.L-1 MBP Then they were isolated by density gradient centrifugation and expanded in vitro in the condition medium containing rIL-2. After several rounds of MBP-dependent activation and rIL-2-driven expansion, the amount of the MBP-specific CD4+ T cells were sufficient to be transfed into naive DA rats to induce tolerance or transfer EAE. The induction of oral tolerance was performed in the DA rats of the same group by oral administration of 1mg MBP for five times within a narrower time frame (day -10, -8, -6, -4, and -2). After the above treatment, the rats were challenged with 200 μg gpSCH emulsified in CFA to induce active experimental autoimmune encephalomyelitis, and then to assess the resistance of the tolerant DA rats to EAE. Results:Oral tolerance and T cell vaccination (TCV) were used in combination could enhance the inhibition efficiency of EAE in DA rats 13 or 30 percentage higher than of oral tolerance alone or TCV alone, respectively. Conclusion:The data obtained indicate that TCV and oral tolerance were used in combination are more effective on suppression of EAE induced with gpSCH/CFA, which may be considered as a novel therapeutic stratege.
, 百拇医药
(J Beijing Med Univ, 1999,31:247-251)
多发性硬化症(multiple sclerosis, MS)是由自身反应性CD4+T淋巴细胞介导的、以中枢神经系统(central nervous system, CNS)血管周围单核细胞浸润和白质脱髓鞘为典型特征的神经系统自身免疫性疾病。目前,尽管对MS发病机制的研究取得了许多重要进展,但临床上对MS的治疗仍无理想的治疗方法。研究表明,诱导机体对自身抗原特异性的免疫耐受,是预防和治疗自身免疫病的理想方法[1]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)为发生于动物中枢神经系统内,由MBP特异的自身反应性CD4+T淋巴细胞所介导的自身免疫性疾病,EAE与MS在临床、生化、免疫及病理等诸方面都具有相同的特征,是公认的MS的理想动物模型[2]。近年来,以MS的动物模型EAE为研究对象,通过诱导抗原-特异性的免疫耐受,如口服耐受或T细胞疫苗接种预防和治疗EAE的研究,在实验动物的研究中已取得了令人鼓舞的效果,但上述疗法在临床上单独应用时,其效果仍不尽人意。本研究发现口服耐受与T细胞疫苗接种联合应用能加强耐受诱导的深度,明显提高防治EAE的疗效。
, 百拇医药
1 材料与方法
1.1 材料
动物:豚鼠,体重300~400g。DA纯系大鼠,6~8周龄,雌性,体重30~180g,均由北京医科大学实验动物部提供。
试剂:髓鞘碱性蛋白(myelin basic protein, MBP,本室从豚鼠脑、脊髓中提取产品,以豚鼠脑、脊髓为预料,通过反复去脂、抽洗、酸溶解、高速离心等步骤提取MBP,再过柱进一步纯化,-20 ℃保存备用), MBP标准品(Sigma公司,美国),完全福氏佐剂(complete Freund's adjuvant, CFA,DIFCO LABORATORIES产品, 美国), 百日咳疫苗(10×1010ml-1,北京生物制品研究所疫苗室产品)。
1.2 方法
, 百拇医药
抗原(完全福氏佐剂)的乳化:豚鼠心脏抽血处死,取脊髓制成500g.L-1的脊髓匀浆(spinal cord homogenate, SCH),与等量的4g.L-1卡介苗的CFA混合,置两只注射器中来回抽推制成gpSCH/CFA油包水乳剂,4℃保存备用。
EAE的诱导[3]:于DA大鼠一侧后足跖真皮内注射gpSCH/CFA乳剂0.1ml, 同时大鼠后脚背皮内注射0.2ml百日咳疫苗(约2×1010个菌体),对照组单纯注射完全福氏佐剂。每天观察EAE发病情况,并按下列标准对神经症状分级评分:0级,无明显异常;1级,鼠尾麻痹;2级,后肢无力;3级,后肢麻痹;4级,后肢麻痹伴有前肢无力或麻痹或因EAE而死亡。组织病理学检查: 部分大鼠于发病将近死亡、刚死亡或免疫后第16天处死,迅速取脑和脊髓固定于0.1kg.L-1福尔马林液中,石蜡包埋,切片(厚7~10μm),HE染色,光镜下观察摄片。
, 百拇医药
口服耐受的诱导[4]:将MBP溶解于PBS中,配成1g.L-1备用。于致敏前第10、8、6、4、2天分别给大鼠灌胃MBP一次,每次每鼠1.5mg,共5次,对照组口服PBS或卵清蛋白(ovalbumin, OVA),于致敏当天用gpSCH/CFA免疫大鼠主动诱发EAE,此后每天观察上述动物发病及疾病进展情况。
T细胞疫苗的制备[5]:用gpSCH/CFA免疫DA大鼠9d后,无菌取大鼠注射抗原一侧的腹股沟淋巴结,制备单个淋巴结细胞悬液,用刺激培养基(RM:体积分数为2%的同基因DA大鼠血清的不完全RPMI-1640培养液)调细胞浓度至1×107ml-1,取5ml细胞悬液于60mm培养瓶中,加MBP(50 mg.L-1)于37℃,5%(体积分数)CO2孵箱中培养3d,刺激MBP特异的T细胞,使之活化。培养72h后,收集细胞,室温离心(1200r.min-1,10min),用2ml RPMI-1640液重悬细胞。用3ml Ficoll淋巴细胞分离液于1700r.min-1, 30min条件下分离淋巴细胞液活化的T细胞母细胞。加入完全RPMI-1640液,调细胞浓度至1×106 ml-1,同时加入rIL-2(作为T细胞生长因子)80u.ml-1,于60mm培养瓶中 (每瓶5 ml), 37℃,5%(体积分数)的CO2中培养。3d后,用RM调T细胞浓度至1×106ml-1,与1×107ml-1同基因DA大鼠胸腺细胞悬液(30Gy照射后)及50μl MBP,在37℃, 5%(体积分数)的CO2孵箱中共同培养2~3d。培养结束后,用Ficoll分离活化的T细胞,再以含rIL-2的生长培养基培养扩增4d。在T细胞生长培养基中,当T细胞开始变小,并不再增殖时,则用MBP再次刺激T细胞活化,并培养扩增。如此反复,经过几个活化、扩增循环后,便可得到足够数量的MBP反应T细胞,以便用于过继转移疾病或用作制备T细胞疫苗。
, http://www.100md.com
T淋巴细胞减毒疫苗制备及接种:取MBP反复刺激,扩增后得到的T淋巴细胞系,用RPMI-1640培养液调细胞浓度至1×107ml-1,用15GyCo60照射进行灭活处理。将上述细胞经舌下静脉接种到正常同基因的DA大鼠,每只鼠1×107,隔周接种,共接种3次。最后一次接种完成后1周,用gpSCH/CFA攻击受体大鼠(方法同前)。每天观察并记录发病情况。
T细胞疫苗接种与口服MBP联合诱导耐受:于致敏前第21、14、7天分别给大鼠接种照射处理(30 Gy)的MBP反应T淋巴细胞系,接种量为每只鼠1×107。于致敏前第10、8、6、4、2天分别给同一组接种T细胞疫苗的大鼠口服MBP,每次每只鼠1.5mg。于致敏当天将所有大鼠用gpSCH/CFA免疫(方法同前),每天观察大鼠发病情况,并详细记录。
脑组织病理学检查:所有用gpSCH/CFA免疫后第12天,处死部分大鼠,取脑固定于0.1 kg.L-1福尔马林液中,石蜡包埋,切片,HE染色,镜下观察脑组织病理变化,并摄片记录。
, 百拇医药
1.3 统计学处理
数据以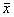 ±s表示,量反应资料组间比较用Student's t检验;质反应资料组间比较用χ2检验。
±s表示,量反应资料组间比较用Student's t检验;质反应资料组间比较用χ2检验。
2 结果
口服MBP 对EAE的抑制作用:在用gpSCH/CFA诱发EAE之前给予大鼠口服MBP诱导耐受,结果见表1和图1。对照组(口服PBS或口服OVA)动物全部发生了严重的EAE临床症状,持续时间长,并且体重平均减轻(28±10) g。耐受组12只大鼠在致炎前口服MBP,可明显推迟EAE的发病时间,降低EAE的发病率,并使患鼠症状明显减轻(第16天评分为1.8±0.9)。耐受组中有8只大鼠在整个实验过程中未发生任何EAE症状,抑制率为67%。另有4只口服MBP的大鼠发生了中度的EAE,但发病日期较对照组有明显推迟,而且发病鼠病程也明显缩短,仅为(4.5±0.5)d。这些结果表明,口服MBP可以诱导出明显的口服耐受,预防EAE的发生。
, http://www.100md.com
表1 口服MBP对大鼠实验性自身免疫性脑脊髓炎的作用
Table 1 Effect of feeding MBP to rats on the development of EAE Group
Feeding
ta/d
Incidence of EAEb
Clinical scorec
te/d
EAE control
PBS
, 百拇医药
11.0±1.3
5/5
3.6±0.4
9.0±1.5
EAE control
OVA
11.0±1.1
5/5
3.5±0.5
7.0±1.0
MBP prevention
MBP
, http://www.100md.com
13.0±1.0
4/12
1.8±0.9
4.5±0.5
*P<0.05, P<0.01, vs PBS contral; a, mean day of onset of disease for animal within each group; b, number of rats with EAE/number of rats in each group. c : mean of the scores assessed on day 16 in each group; e, mean the lasting days of the disease achieved of rats in that group.
, 百拇医药
图1 EAE发病鼠及MBP耐受鼠疾病过程中体重变化
Figure 1 Mean body weight loss of DA rats in different
group during the course of disease
T细胞疫苗接种对EAE发病的影响:将MBP-T淋巴细胞系在体外活化后直接过继给正常同基因DA大鼠,可使受体鼠发生EAE症状。而将MBP-T淋巴细胞系在体外经灭活处理(15 Gy照射),然后接种到正常DA大鼠,大鼠并不发病,照此隔周接种3次后,再用gpSCH/CFA免疫被接种的动物,则4/8的T细胞接种动物获得对EAE的抵抗性(表2),另一半发病的动物,EAE临床症状表现为中度,但在5 d左右便恢复,较未接种鼠病程短。接种正常鼠的淋巴细胞对随后gpSCH/CFA主动诱导的EAE无抵抗性。联合诱导免疫耐受对EAE发病的影响:将T细胞疫苗接种与口服MBP联合应用,观察其对EAE的抑制率,结果见表 3。单独口服MBP诱导耐受及单独TCV对主动诱发的EAE的抑制率分别为67%和50%,而将二者联合应用对EAE的抑制率可达80%。上述结果表明,联合应用口服耐受和T细胞疫苗接种获得了更深程度的耐受,从而达到对EAE更高的抑制率。
, 百拇医药
表2 T细胞疫苗接种使DA大鼠获得对EAE的抵抗性
Table 2 Vaccination of irradiated MBP-reactive T-cell
sinduced a resistance to EAE in DA rats Vaccination with
T cells
Irradiated
(15 Gy)
Incidence of
adoptive disease
MBP-CFA challengea
, 百拇医药
Incidence
t/d
None
-
-
5/5
8
MBP-specifie T cells
No
5/6
-
-
MBP-specifie T cells
, 百拇医药
Yes
0/8
4/8
4
Naive rat's T cells
No
0/6
6/6
7.5
a, one week after vaccination, recipients were challenged with gpSCH/CFA. 表3 联合诱导耐受对EAE的抑制作用
, 百拇医药 Table 3 Suppressive effect of combination of oral tolerance and
T cell vaccination on EAE in DA rats Group
fed-MBP
1.5 mg/rat×5
Vaccine with
MBP-T cells
MBP-CFA challenge
Incidence
t/d
Control
, 百拇医药
No
No
8/8
7
MBP-tolerant
Yes
No
4/12
6
TCV
No
Yes
4/8
, 百拇医药
4
Combination
Yes
Yes
2/10
4.5
神经组织病理学检查:从图2~5可以看出,EAE发病鼠大脑、脑干白质血管周围,有大量单核细胞和淋巴细胞浸润,形成典型的血管“套袖”状;部分可见灶性坏死,胶质细胞增生;但未见脱髓鞘病变。口服MBP耐受组脑组织检查发现,CNS中单个核细胞浸润的数目和范围明显减少,甚至检测不到。T细胞疫苗接种组动物脑组织病理改变较EAE组明显减轻,但在脑膜血管周围仍可见单核巨噬细胞和淋巴细胞浸润,较口服耐受组稍严重。
, 百拇医药
图2 正常大鼠脑组织HE×200
Figure 2 Normal rat brainHE×200
图3 EAE组大鼠脑组织,免疫后14 d,小胶质细胞增生,小血管周围可见淋巴样细胞套袖状浸润HE×200
Figure 3 EAE rat brain , past immunigation day 14, proliferation
of microglial cells and perivascular cuffing infiltration
of lymphocyle like cells HE×200
, 百拇医药
图4 MBP组大鼠脑组织,免疫后14天,仅见少数小胶质细胞增生HE×200
Figure 4 MBP rat brain, past immunigation day 14, some
microglial cells prolifertion HE×200
图5 MBP-T细胞疫苗组大鼠脑组织,脑实质无明显病变,仅在蛛网膜下腔有少数淋巴细胞浸润HE×200
Figure 5 MBP-T cells vaccination rat brain , nearly normal
brain parenchyma, some lymphocyte like cells infiltration in
, http://www.100md.com
subarachnoid space only HE×200
3 讨论
MS是由CD4+T淋巴细胞介导的中枢神经系统脱髓鞘性自身免疫病,该病的发生、发展与MBP特异的自身反应性T细胞的异常活化及Th1/Th2细胞亚群平衡的偏离密切相关[6]。通过对MS的动物模型EAE的研究,发现神经组织中的MBP是此病的主要自身靶抗原,口服MBP抗原进入肠道淋巴组织中的Peyers斑,其中的APC细胞在此环境中优先提呈抗原诱导Th2细胞活化,通过细胞因子网络的调节作用,纠正出现Th1/Th2平衡的偏离,从而有效地抑制EAE的发生[7]。本文研究证实,口服MBP可明显推迟EAE的发病时间,降低EAE的发病率(从100%下降到33%),并使患鼠症状明显减轻,中枢神经病理改变明显减轻。另一个通过诱导耐受防治EAE的方法是T细胞疫苗接种(Tcell vaccination, TCV),研究表明,逃脱胸腺选择的自身反应性T细胞在外周血及淋巴组织中,通过抗原识别受体上独特型决定基的相互识别而处于一个稳固的克隆型调节网络之中,对防止自身反应性T细胞的活化和维持自身耐受起着重要作用。克隆型调节网络失调,将导致自身反应T细胞活化增殖,引发自身免疫病。因此,可将自身反应性T细胞看作是引起自身免疫病的“病原体”,它们被灭活后可作为疫苗用于自身免疫病的防治,这一过程与传统预防感染性疾病的疫苗相似,故称为T细胞疫苗接种[8]。其机制可能是将自身反应T细胞在体外进一步活化并灭活后,注入患病动物体内,激发强有力的抗独特型(又称抗克隆型)T细胞,使得抗独特型T细胞相继活化扩增,从而重新将自身反应T细胞置于强大的独特型网络的控制之下,达到治疗自身免疫病的效果。TCV防治EAE的效果各家报道不一,在我们的实验系统中,TCV对EAE的抑制率为50%,说明单独TCV还不能有效地控制EAE的发生。
, 百拇医药
口服耐受和T细胞疫苗接种众多的研究结果表明,通过诱导抗原特异性的免疫耐受防治自身免疫病是完全可能的,但耐受程度需加深,以提高疗效。由于免疫系统对自身耐受稳定的维持是一个多机制共同作用的过程,免疫调节是由多种免疫细胞和免疫分子等共同参与组成的网络系统。口服耐受和TCV的动物模型及临床研究结果均表明,单一细胞因子调节网络或单一克隆型调节网络机制虽然有效,但尚不能获得完全、持久的免疫耐受。因此,本文探索了细胞因子网络和克隆型调节网络相结合,加深耐受程度,即将口服耐受与TCV联合应用,观察对EAE的耐受效果。结果证明联合诱导耐受分别比单一口服耐受和单一TCV疗法分别提高了13%和30%。目前,将口服MBP与TCV二种诱导耐受方式联合应用观察对EAE的疗效,国内外尚未见报道。本文应用多途径联合应用诱导免疫耐受,证明了通过不同的耐受机制的协同作用可以明显地增加耐受深度,提高防治EAE的效果,本文的结果可能对临床通过诱导耐受的方法防治MS提供了一种新的治疗策略。
* 高等学校博士学科点专项科研基金资助课题;
, 百拇医药
△一九九四级基础医学系学生;
☆ 自由词。
参考文献
1 Weiner HL,Khoury S,Hafler DA, et al. Oral tolerance:immunologic mechanisms and treatment of animal and human organ-specific autoimmune disease by oral administration of autoantigens.Annu Rev Immunol,1994,12:809-837
2 Stinissen P,Raus J,Zhang JW.Autoimmune pathogenesis of multiple sclerosis:role of autoreactive T lymphocytes and new immunotherapeutic strategies.Crit Rev Immunol,1997,17:33-75
, 百拇医药
3 Lider O, Santon LM, Weiner HL, et al. Suppression of experimental autoimmune encephalomyelitis by oral administration of myelin basic protein,Cell Immunol,1988,147:440-445
4 Miller A,Lider O,Weiner HL, et al. Suppressor T cells generated by oral tolerization to myelin basic protein suppress both in vitro and in vivo immune responses by the release of transforming growth factor-β after antigen-specific triggering.Proc Natl Acad Sci USA,1992,89:421-425
, 百拇医药
5 Archie BHG, Hinrichs DJ. Experimental allergic encephalomyelitis and vaccination-induced resistance in DA rats.Cell Immunol, 1997,175:92-98
6 Navikas V,Link H.Cytokines and the pathogenesis of MS.J Neurosci Res, 1996,45:322~333
7 Khoury SJ,Hancock WW,Weiner HL.Oral tolerance to myelin basic protein and natural recovery from experimental autoimmune encephalomyelitis are associated with downregulation of inflammatory cytokines and differential upregulartion of transforming growth factor β, interleukin 4, and prostaglandin E expression in the brain.J Exp Med, 1992,176:1355-1364
8 Zhang J,Raus J.T-cell vaccination in autoimmune diseases from laboratory to clinic.Human Immunol,1993, 38:87-96
(1999-01-17收稿), 百拇医药
单位:北京医科大学免疫学系,北京 100083
关键词:致脑炎碱性蛋白类;治疗应用;脑脊髓炎;药物疗法;免疫耐受;T细胞接种☆;脑炎;疫苗接种
990315 摘 要 目的:口服髓鞘碱性蛋白(myelin basic protein, MBP)与T细胞疫苗接种(T cell vaccination, TCV)联合应用诱导免疫耐受,以提高特异性的免疫疗法对实验性自身免疫性脑脊髓膜炎(experimental autoimmune encephalomyelitis, EAE)的防治效果。方法:从gpSCH/CFA诱发EAE的DA大鼠体内取淋巴细胞,体外再以MBP刺激,并用rIL-2促进增殖,反复数个循环,可获得MBP特异的T淋巴细胞系。将此T细胞系经照射(15 Gy)灭活处理后,静脉接种至同基因正常DA大鼠体内,同时给此DA大鼠多次口服MBP诱导耐受,最后以脊髓匀浆/完全福氏佐剂(SCH/CFA)攻击经上述处理的大鼠,以观察其EAE的发病情况。结果:单独口服MBP诱导耐受及单独TCV处理的DA大鼠对随后诱发的EAE的抑制率分别为67%和50%,而将二者联合应用,则抑制率可达80%。结论:口服MBP与MBP特异的T细胞疫苗接种联合应用,可获得更深程度的耐受效果,多种手段联合应用可能成为临床今后通过诱导耐受防治自身免疫病的新策略。
, http://www.100md.com
中国图书资料分类法分类号 R512.3-332
Suppression of experimental autoimmune encephalomyelitis
in DA rats using the combination of oral tolerance and T cell vaccination
LIU Xue-Bin, WU Jin-Ling, XIE Shu-Sheng
(Department of Immunology, Beijing Medical University, Beijing 100083)
MeSH Encephalitogenic basic proteins/ther use Encephalomyelitis/drug eff Immunological tolerance T cell vaccination☆ Encephalitis, post-vaccinal
, 百拇医药
ABSTRACT Objective:To improve the therapeutic effects of experimental autoimmune encephalomyelitis (EAE) by induction of specific immunologic tolerance, we explored the effects of the combination of inoculation with attenuated myelin basic protein (MBP)-reactive T cell lines and oral administration of MBP on prevention of EAE induced by gpSCH/CFA in DA rats. Methods:DA rats were immunized with gpSCH/CFA. 9 days later, MBP-specific CD4+T cells were isolated from draining lymph node cells at the site of immunization, and were cultured in vitro in the presence of 1 mg.L-1 MBP Then they were isolated by density gradient centrifugation and expanded in vitro in the condition medium containing rIL-2. After several rounds of MBP-dependent activation and rIL-2-driven expansion, the amount of the MBP-specific CD4+ T cells were sufficient to be transfed into naive DA rats to induce tolerance or transfer EAE. The induction of oral tolerance was performed in the DA rats of the same group by oral administration of 1mg MBP for five times within a narrower time frame (day -10, -8, -6, -4, and -2). After the above treatment, the rats were challenged with 200 μg gpSCH emulsified in CFA to induce active experimental autoimmune encephalomyelitis, and then to assess the resistance of the tolerant DA rats to EAE. Results:Oral tolerance and T cell vaccination (TCV) were used in combination could enhance the inhibition efficiency of EAE in DA rats 13 or 30 percentage higher than of oral tolerance alone or TCV alone, respectively. Conclusion:The data obtained indicate that TCV and oral tolerance were used in combination are more effective on suppression of EAE induced with gpSCH/CFA, which may be considered as a novel therapeutic stratege.
, 百拇医药
(J Beijing Med Univ, 1999,31:247-251)
多发性硬化症(multiple sclerosis, MS)是由自身反应性CD4+T淋巴细胞介导的、以中枢神经系统(central nervous system, CNS)血管周围单核细胞浸润和白质脱髓鞘为典型特征的神经系统自身免疫性疾病。目前,尽管对MS发病机制的研究取得了许多重要进展,但临床上对MS的治疗仍无理想的治疗方法。研究表明,诱导机体对自身抗原特异性的免疫耐受,是预防和治疗自身免疫病的理想方法[1]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)为发生于动物中枢神经系统内,由MBP特异的自身反应性CD4+T淋巴细胞所介导的自身免疫性疾病,EAE与MS在临床、生化、免疫及病理等诸方面都具有相同的特征,是公认的MS的理想动物模型[2]。近年来,以MS的动物模型EAE为研究对象,通过诱导抗原-特异性的免疫耐受,如口服耐受或T细胞疫苗接种预防和治疗EAE的研究,在实验动物的研究中已取得了令人鼓舞的效果,但上述疗法在临床上单独应用时,其效果仍不尽人意。本研究发现口服耐受与T细胞疫苗接种联合应用能加强耐受诱导的深度,明显提高防治EAE的疗效。
, 百拇医药
1 材料与方法
1.1 材料
动物:豚鼠,体重300~400g。DA纯系大鼠,6~8周龄,雌性,体重30~180g,均由北京医科大学实验动物部提供。
试剂:髓鞘碱性蛋白(myelin basic protein, MBP,本室从豚鼠脑、脊髓中提取产品,以豚鼠脑、脊髓为预料,通过反复去脂、抽洗、酸溶解、高速离心等步骤提取MBP,再过柱进一步纯化,-20 ℃保存备用), MBP标准品(Sigma公司,美国),完全福氏佐剂(complete Freund's adjuvant, CFA,DIFCO LABORATORIES产品, 美国), 百日咳疫苗(10×1010ml-1,北京生物制品研究所疫苗室产品)。
1.2 方法
, 百拇医药
抗原(完全福氏佐剂)的乳化:豚鼠心脏抽血处死,取脊髓制成500g.L-1的脊髓匀浆(spinal cord homogenate, SCH),与等量的4g.L-1卡介苗的CFA混合,置两只注射器中来回抽推制成gpSCH/CFA油包水乳剂,4℃保存备用。
EAE的诱导[3]:于DA大鼠一侧后足跖真皮内注射gpSCH/CFA乳剂0.1ml, 同时大鼠后脚背皮内注射0.2ml百日咳疫苗(约2×1010个菌体),对照组单纯注射完全福氏佐剂。每天观察EAE发病情况,并按下列标准对神经症状分级评分:0级,无明显异常;1级,鼠尾麻痹;2级,后肢无力;3级,后肢麻痹;4级,后肢麻痹伴有前肢无力或麻痹或因EAE而死亡。组织病理学检查: 部分大鼠于发病将近死亡、刚死亡或免疫后第16天处死,迅速取脑和脊髓固定于0.1kg.L-1福尔马林液中,石蜡包埋,切片(厚7~10μm),HE染色,光镜下观察摄片。
, 百拇医药
口服耐受的诱导[4]:将MBP溶解于PBS中,配成1g.L-1备用。于致敏前第10、8、6、4、2天分别给大鼠灌胃MBP一次,每次每鼠1.5mg,共5次,对照组口服PBS或卵清蛋白(ovalbumin, OVA),于致敏当天用gpSCH/CFA免疫大鼠主动诱发EAE,此后每天观察上述动物发病及疾病进展情况。
T细胞疫苗的制备[5]:用gpSCH/CFA免疫DA大鼠9d后,无菌取大鼠注射抗原一侧的腹股沟淋巴结,制备单个淋巴结细胞悬液,用刺激培养基(RM:体积分数为2%的同基因DA大鼠血清的不完全RPMI-1640培养液)调细胞浓度至1×107ml-1,取5ml细胞悬液于60mm培养瓶中,加MBP(50 mg.L-1)于37℃,5%(体积分数)CO2孵箱中培养3d,刺激MBP特异的T细胞,使之活化。培养72h后,收集细胞,室温离心(1200r.min-1,10min),用2ml RPMI-1640液重悬细胞。用3ml Ficoll淋巴细胞分离液于1700r.min-1, 30min条件下分离淋巴细胞液活化的T细胞母细胞。加入完全RPMI-1640液,调细胞浓度至1×106 ml-1,同时加入rIL-2(作为T细胞生长因子)80u.ml-1,于60mm培养瓶中 (每瓶5 ml), 37℃,5%(体积分数)的CO2中培养。3d后,用RM调T细胞浓度至1×106ml-1,与1×107ml-1同基因DA大鼠胸腺细胞悬液(30Gy照射后)及50μl MBP,在37℃, 5%(体积分数)的CO2孵箱中共同培养2~3d。培养结束后,用Ficoll分离活化的T细胞,再以含rIL-2的生长培养基培养扩增4d。在T细胞生长培养基中,当T细胞开始变小,并不再增殖时,则用MBP再次刺激T细胞活化,并培养扩增。如此反复,经过几个活化、扩增循环后,便可得到足够数量的MBP反应T细胞,以便用于过继转移疾病或用作制备T细胞疫苗。
, http://www.100md.com
T淋巴细胞减毒疫苗制备及接种:取MBP反复刺激,扩增后得到的T淋巴细胞系,用RPMI-1640培养液调细胞浓度至1×107ml-1,用15GyCo60照射进行灭活处理。将上述细胞经舌下静脉接种到正常同基因的DA大鼠,每只鼠1×107,隔周接种,共接种3次。最后一次接种完成后1周,用gpSCH/CFA攻击受体大鼠(方法同前)。每天观察并记录发病情况。
T细胞疫苗接种与口服MBP联合诱导耐受:于致敏前第21、14、7天分别给大鼠接种照射处理(30 Gy)的MBP反应T淋巴细胞系,接种量为每只鼠1×107。于致敏前第10、8、6、4、2天分别给同一组接种T细胞疫苗的大鼠口服MBP,每次每只鼠1.5mg。于致敏当天将所有大鼠用gpSCH/CFA免疫(方法同前),每天观察大鼠发病情况,并详细记录。
脑组织病理学检查:所有用gpSCH/CFA免疫后第12天,处死部分大鼠,取脑固定于0.1 kg.L-1福尔马林液中,石蜡包埋,切片,HE染色,镜下观察脑组织病理变化,并摄片记录。
, 百拇医药
1.3 统计学处理
数据以
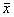 ±s表示,量反应资料组间比较用Student's t检验;质反应资料组间比较用χ2检验。
±s表示,量反应资料组间比较用Student's t检验;质反应资料组间比较用χ2检验。2 结果
口服MBP 对EAE的抑制作用:在用gpSCH/CFA诱发EAE之前给予大鼠口服MBP诱导耐受,结果见表1和图1。对照组(口服PBS或口服OVA)动物全部发生了严重的EAE临床症状,持续时间长,并且体重平均减轻(28±10) g。耐受组12只大鼠在致炎前口服MBP,可明显推迟EAE的发病时间,降低EAE的发病率,并使患鼠症状明显减轻(第16天评分为1.8±0.9)。耐受组中有8只大鼠在整个实验过程中未发生任何EAE症状,抑制率为67%。另有4只口服MBP的大鼠发生了中度的EAE,但发病日期较对照组有明显推迟,而且发病鼠病程也明显缩短,仅为(4.5±0.5)d。这些结果表明,口服MBP可以诱导出明显的口服耐受,预防EAE的发生。
, http://www.100md.com
表1 口服MBP对大鼠实验性自身免疫性脑脊髓炎的作用
Table 1 Effect of feeding MBP to rats on the development of EAE Group
Feeding
ta/d
Incidence of EAEb
Clinical scorec
te/d
EAE control
PBS
, 百拇医药
11.0±1.3
5/5
3.6±0.4
9.0±1.5
EAE control
OVA
11.0±1.1
5/5
3.5±0.5
7.0±1.0
MBP prevention
MBP
, http://www.100md.com
13.0±1.0
4/12
1.8±0.9
4.5±0.5
*P<0.05, P<0.01, vs PBS contral; a, mean day of onset of disease for animal within each group; b, number of rats with EAE/number of rats in each group. c : mean of the scores assessed on day 16 in each group; e, mean the lasting days of the disease achieved of rats in that group.

, 百拇医药
图1 EAE发病鼠及MBP耐受鼠疾病过程中体重变化
Figure 1 Mean body weight loss of DA rats in different
group during the course of disease
T细胞疫苗接种对EAE发病的影响:将MBP-T淋巴细胞系在体外活化后直接过继给正常同基因DA大鼠,可使受体鼠发生EAE症状。而将MBP-T淋巴细胞系在体外经灭活处理(15 Gy照射),然后接种到正常DA大鼠,大鼠并不发病,照此隔周接种3次后,再用gpSCH/CFA免疫被接种的动物,则4/8的T细胞接种动物获得对EAE的抵抗性(表2),另一半发病的动物,EAE临床症状表现为中度,但在5 d左右便恢复,较未接种鼠病程短。接种正常鼠的淋巴细胞对随后gpSCH/CFA主动诱导的EAE无抵抗性。联合诱导免疫耐受对EAE发病的影响:将T细胞疫苗接种与口服MBP联合应用,观察其对EAE的抑制率,结果见表 3。单独口服MBP诱导耐受及单独TCV对主动诱发的EAE的抑制率分别为67%和50%,而将二者联合应用对EAE的抑制率可达80%。上述结果表明,联合应用口服耐受和T细胞疫苗接种获得了更深程度的耐受,从而达到对EAE更高的抑制率。
, 百拇医药
表2 T细胞疫苗接种使DA大鼠获得对EAE的抵抗性
Table 2 Vaccination of irradiated MBP-reactive T-cell
sinduced a resistance to EAE in DA rats Vaccination with
T cells
Irradiated
(15 Gy)
Incidence of
adoptive disease
MBP-CFA challengea
, 百拇医药
Incidence
t/d
None
-
-
5/5
8
MBP-specifie T cells
No
5/6
-
-
MBP-specifie T cells
, 百拇医药
Yes
0/8
4/8
4
Naive rat's T cells
No
0/6
6/6
7.5
a, one week after vaccination, recipients were challenged with gpSCH/CFA. 表3 联合诱导耐受对EAE的抑制作用
, 百拇医药 Table 3 Suppressive effect of combination of oral tolerance and
T cell vaccination on EAE in DA rats Group
fed-MBP
1.5 mg/rat×5
Vaccine with
MBP-T cells
MBP-CFA challenge
Incidence
t/d
Control
, 百拇医药
No
No
8/8
7
MBP-tolerant
Yes
No
4/12
6
TCV
No
Yes
4/8
, 百拇医药
4
Combination
Yes
Yes
2/10
4.5
神经组织病理学检查:从图2~5可以看出,EAE发病鼠大脑、脑干白质血管周围,有大量单核细胞和淋巴细胞浸润,形成典型的血管“套袖”状;部分可见灶性坏死,胶质细胞增生;但未见脱髓鞘病变。口服MBP耐受组脑组织检查发现,CNS中单个核细胞浸润的数目和范围明显减少,甚至检测不到。T细胞疫苗接种组动物脑组织病理改变较EAE组明显减轻,但在脑膜血管周围仍可见单核巨噬细胞和淋巴细胞浸润,较口服耐受组稍严重。

, 百拇医药
图2 正常大鼠脑组织HE×200
Figure 2 Normal rat brainHE×200

图3 EAE组大鼠脑组织,免疫后14 d,小胶质细胞增生,小血管周围可见淋巴样细胞套袖状浸润HE×200
Figure 3 EAE rat brain , past immunigation day 14, proliferation
of microglial cells and perivascular cuffing infiltration
of lymphocyle like cells HE×200

, 百拇医药
图4 MBP组大鼠脑组织,免疫后14天,仅见少数小胶质细胞增生HE×200
Figure 4 MBP rat brain, past immunigation day 14, some
microglial cells prolifertion HE×200

图5 MBP-T细胞疫苗组大鼠脑组织,脑实质无明显病变,仅在蛛网膜下腔有少数淋巴细胞浸润HE×200
Figure 5 MBP-T cells vaccination rat brain , nearly normal
brain parenchyma, some lymphocyte like cells infiltration in
, http://www.100md.com
subarachnoid space only HE×200
3 讨论
MS是由CD4+T淋巴细胞介导的中枢神经系统脱髓鞘性自身免疫病,该病的发生、发展与MBP特异的自身反应性T细胞的异常活化及Th1/Th2细胞亚群平衡的偏离密切相关[6]。通过对MS的动物模型EAE的研究,发现神经组织中的MBP是此病的主要自身靶抗原,口服MBP抗原进入肠道淋巴组织中的Peyers斑,其中的APC细胞在此环境中优先提呈抗原诱导Th2细胞活化,通过细胞因子网络的调节作用,纠正出现Th1/Th2平衡的偏离,从而有效地抑制EAE的发生[7]。本文研究证实,口服MBP可明显推迟EAE的发病时间,降低EAE的发病率(从100%下降到33%),并使患鼠症状明显减轻,中枢神经病理改变明显减轻。另一个通过诱导耐受防治EAE的方法是T细胞疫苗接种(Tcell vaccination, TCV),研究表明,逃脱胸腺选择的自身反应性T细胞在外周血及淋巴组织中,通过抗原识别受体上独特型决定基的相互识别而处于一个稳固的克隆型调节网络之中,对防止自身反应性T细胞的活化和维持自身耐受起着重要作用。克隆型调节网络失调,将导致自身反应T细胞活化增殖,引发自身免疫病。因此,可将自身反应性T细胞看作是引起自身免疫病的“病原体”,它们被灭活后可作为疫苗用于自身免疫病的防治,这一过程与传统预防感染性疾病的疫苗相似,故称为T细胞疫苗接种[8]。其机制可能是将自身反应T细胞在体外进一步活化并灭活后,注入患病动物体内,激发强有力的抗独特型(又称抗克隆型)T细胞,使得抗独特型T细胞相继活化扩增,从而重新将自身反应T细胞置于强大的独特型网络的控制之下,达到治疗自身免疫病的效果。TCV防治EAE的效果各家报道不一,在我们的实验系统中,TCV对EAE的抑制率为50%,说明单独TCV还不能有效地控制EAE的发生。
, 百拇医药
口服耐受和T细胞疫苗接种众多的研究结果表明,通过诱导抗原特异性的免疫耐受防治自身免疫病是完全可能的,但耐受程度需加深,以提高疗效。由于免疫系统对自身耐受稳定的维持是一个多机制共同作用的过程,免疫调节是由多种免疫细胞和免疫分子等共同参与组成的网络系统。口服耐受和TCV的动物模型及临床研究结果均表明,单一细胞因子调节网络或单一克隆型调节网络机制虽然有效,但尚不能获得完全、持久的免疫耐受。因此,本文探索了细胞因子网络和克隆型调节网络相结合,加深耐受程度,即将口服耐受与TCV联合应用,观察对EAE的耐受效果。结果证明联合诱导耐受分别比单一口服耐受和单一TCV疗法分别提高了13%和30%。目前,将口服MBP与TCV二种诱导耐受方式联合应用观察对EAE的疗效,国内外尚未见报道。本文应用多途径联合应用诱导免疫耐受,证明了通过不同的耐受机制的协同作用可以明显地增加耐受深度,提高防治EAE的效果,本文的结果可能对临床通过诱导耐受的方法防治MS提供了一种新的治疗策略。
* 高等学校博士学科点专项科研基金资助课题;
, 百拇医药
△一九九四级基础医学系学生;
☆ 自由词。
参考文献
1 Weiner HL,Khoury S,Hafler DA, et al. Oral tolerance:immunologic mechanisms and treatment of animal and human organ-specific autoimmune disease by oral administration of autoantigens.Annu Rev Immunol,1994,12:809-837
2 Stinissen P,Raus J,Zhang JW.Autoimmune pathogenesis of multiple sclerosis:role of autoreactive T lymphocytes and new immunotherapeutic strategies.Crit Rev Immunol,1997,17:33-75
, 百拇医药
3 Lider O, Santon LM, Weiner HL, et al. Suppression of experimental autoimmune encephalomyelitis by oral administration of myelin basic protein,Cell Immunol,1988,147:440-445
4 Miller A,Lider O,Weiner HL, et al. Suppressor T cells generated by oral tolerization to myelin basic protein suppress both in vitro and in vivo immune responses by the release of transforming growth factor-β after antigen-specific triggering.Proc Natl Acad Sci USA,1992,89:421-425
, 百拇医药
5 Archie BHG, Hinrichs DJ. Experimental allergic encephalomyelitis and vaccination-induced resistance in DA rats.Cell Immunol, 1997,175:92-98
6 Navikas V,Link H.Cytokines and the pathogenesis of MS.J Neurosci Res, 1996,45:322~333
7 Khoury SJ,Hancock WW,Weiner HL.Oral tolerance to myelin basic protein and natural recovery from experimental autoimmune encephalomyelitis are associated with downregulation of inflammatory cytokines and differential upregulartion of transforming growth factor β, interleukin 4, and prostaglandin E expression in the brain.J Exp Med, 1992,176:1355-1364
8 Zhang J,Raus J.T-cell vaccination in autoimmune diseases from laboratory to clinic.Human Immunol,1993, 38:87-96
(1999-01-17收稿), 百拇医药