以杆状病毒作为基因治疗载体的一种新方法
作者:陆爱丽 董东生 程 康 伏 爽 王德炳 侯纬敏
单位:陆爱丽 侯纬敏 北京医科大学生物化学与分子生物学系,北京 100083董东生 北京同仁医院;程 康 伏 爽 王德炳 血液病研究所
关键词:血小板生成素;基因治疗;昆虫病毒;杆状病毒科;转染
北京医科大学学报990408 摘 要 目的:报道一种新的基因治疗方法。方法:将人全长血小板生成素(thrombopoietin, TPO)基因克隆至pBacMam-2载体,与BacVector-3000病毒DNA共转染昆虫sf9细胞,经筛选后获得可在哺乳类动物细胞高效表达的昆虫病毒,以此为载体,将人TPO基因导入小鼠体内。结果:获得可在哺乳类动物细胞高效表达的昆虫病毒株,动物实验外周血小板计数升高至正常的2~3倍,RT-PCR结果显示TPO在小鼠组织中得到表达。结论:重组rhTPO昆虫病毒是一种有效的基因治疗载体。
, 百拇医药
中国图书资料分类法分类号 Q343.11
A new method of gene therapy using baculovirus as a gene delivery system
LU Ai-Li#, DONG Dong-Sheng, CHENG Kang, FU Shuang, WANG De-Bing, HOU Wei-Min
(#Department of Biochemistry and Molecular Biology, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To introduce a new method of gene therapy. Methods: Full-sized of thrombopoietin (TPO) cDNA was cloned into a pBacMam plasmid, recombinant baculovirus was generated by cotransfection of insect cells sf9 with BacVector-3000 virus DNA, and screened for highly expressed TPO in mammalian cells, the baculovirus which only expressed in mammalian cells was introduced into mouse. Results: Baculovirus with high TPO expression in mammalian cells was obtained. And when it was introduced into laboratory animals, platelet number in peripheral blood reached 2-3 times higher than that of the normal. RT-PCR analysis showed that TPO was transcripted in mouse tissues. Conclusion: A new recombinant rhTPO baculovirus was succesfully applied on mouse for gene therapy.
, 百拇医药
MeSH Thrombopoietin gene therapy Insect viruses Transfection Baculoviridae
人血小板生成素(thrombopoietin,TPO)的作用为刺激巨核细胞的生成 、成熟及血小板从巨核细胞释放至血液中。临床上的病人由于肿瘤化疗,骨髓移植后导致血小板减少;TPO是目前已知的唯一可促进血小板生成的细胞因子,可显著提高化疗期间癌症患者的血小板数目[1,2]。有关TPO的分子生物学研究近年来发展很快。我室继1995年克隆出人全长TPO基因后[3],又成功地在大肠杆菌中表达了rhTPO195片段[4]。在此基础上,我们又引进了一种新的pBacMam杆状病毒表达系统,以全长人TPO基因的昆虫病毒为载体,直接导入小鼠体内表达得到了成功。
pBacMam系统是最近开发的一种非化学性的转染哺乳类动物细胞的昆虫病毒系统[5],尚未见有用于基因治疗的报道。我们试用于动物体内,以进一步开展TPO的基因治疗研究。
, 百拇医药
1 材料与方法
pBacVector-3000 transfection kit 购自Novagen公司;其中pBacMam-2转移质粒为7588 bp,含有鸡肌动蛋白的启动子及CMV的增强子,多克隆位点后有兔β球蛋白的终止子(图1)。
含全长rhTPO cDNA 的重组质粒PUC118/TPO为本室构建;sf9昆虫细胞为本室保存, Grace培养基(Gibco公司)27 ℃培养。
DNA的酶切、连接及转化均按本室常规操作。将TPO全长基因亚克隆至pBacMam-2的EcoRⅠ位点后经酶切图谱挑出正向插入的阳性克隆。再将重组体BacMam-2/TPO 与BacVector-3000共转染sf9细胞,4 d后取培养上清(含重组病毒原种)按本室常规以蚀斑实验法纯化重组病毒。纯化的病毒在sf9细胞中扩增数次,使其滴度大于108 pfu.ml-1。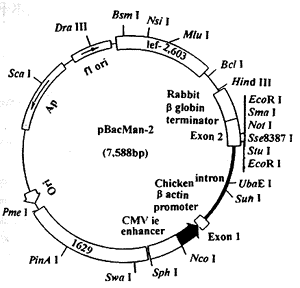
, 百拇医药
图1 pBacMam-2质粒
Figure 1 pBacMam-2 plasmid
BALB/c小鼠为我校实验动物部提供,体重18~20g,雌性。基因导入于后腿肌肉一次性注射昆虫病毒,滴度为108~109 pfu.ml-1。注射剂量为每千克体重小鼠2.5×1010 pfu.ml-1。组织RNA按TRIZOL试剂盒产品说明书提取。RT-PCR按照本室方法进行。
随机挑选BALB/c小鼠分3组进行动物实验:(1)a对照组(NaCl组):背部皮下注射医用生理盐水;(2)b实验组(BM/TPO组):背部皮下注射重组TPO 病毒, 剂量同前;(3)c阳性对照组(TPO组):背部皮下注射本室生产重组TPO 因子, 剂量为每千克体重200 μg。外周血小板计数按常规进行。
, 百拇医药
2 结果
将PUC118/TPO中TPOcDNA亚克隆至病毒转移载体BacMam-2后,经BamHⅠ和HindⅢ双酶切鉴定,正向插入可见一条约1.15 kb条带;反向插入则可见一条约0.95 kb条带(结果略)。 依照琼脂糖电泳结果挑出重组BacMam-2/TPO阳性克隆与BacVector-3000共转染sf9细胞,经病毒扩增、蚀斑筛选后任取3株阳性病毒重组子(即:BM/TPO1,BM/TPO2,BM/TPO4)。初步动物实验结果证实BM/TPO1较BM/TPO2 与BM/TPO 4的活性稍差。故我们选定BM/TPO 4为动物实验的昆虫病毒株。
RT-PCR结果如图2所示,实验组各孔均可见约500 bp(TPO)扩增条带,而正常对照孔只见约300 bp之G3PDH表达。提示BM/TPO已经导入动物体内,且在mRNA水平上有稳定表达。
, 百拇医药
图2 RT-PCR检测TPO在小鼠体内的表达
Figure 2 RT-PCR examination of TPO expression in mice
血小板计数动物实验结果如表1所示,实验组于注射后第4天外周血小板计数开始升高,升高幅度明显高于阳性对照组(P<0.01),第8天血小板计数达到峰值600×109 L-1,为对照组的2.35倍,且血小板计数持续升高,与阳性对照组相比均有显著性差异(P<0.01或P<0.05),直至第28天恢复正常水平。这一结果说明重组rhTPO昆虫病毒作为一种新的基因治疗手段,较TPO因子治疗的前景更为乐观。
3 讨论
目前,临床基因治疗实验常用载体为逆转录病毒及腺病毒载体,但由于逆转录病毒只能感染分裂期细胞,因而转染效率极低,且容纳外源基因的容量有限,还可使宿主细胞基因异常激活甚至有灭活的可能;腺病毒虽较逆转录病毒的转染效率高一些,但其所携带或产生的病毒蛋白可诱发机体局部的炎性反应及全身性细胞免疫反应,其安全性,特别是远期的后果尚难以预料。本文报道的这种新型杆状病毒表达系统本来只是作为一种在昆虫细胞中表达外源基因的体系来应用。近来发现,杆状病毒可进入几乎所有的哺乳类动物细胞[6]。利用这一特点,构建了这一非化学性的细胞转染方法。其优点是转染效率可高达100%,插入的外源基因片段可>20 kb;病毒极易制造,传代快,密度高,应用起来也很方便,只需直接感染宿主细胞,并可转染多种类型细胞(包括某些原代细胞),对基因的表达也易于控制[7]。而且昆虫病毒对哺乳动物细胞无毒副性作用。Fredeerick[8]用每个细胞1 000 pfu的BacMam重组病毒感染原代培养的肝上皮细胞后,未发现与未被感染的正常细胞在形态学上有任何差别;也未见有任何病毒基因在细胞内的表达。BacMam-2 载体上原有的多角体蛋白启动子改装成真核细胞启动子后,使重组病毒可在昆虫细胞中扩增,但不表达重组蛋白,而进入哺乳类动物细胞中可高效表达,但病毒不会扩增。因此,以昆虫病毒作为基因治疗实验中的载体,有着安全,有效,简单易于操作等优点。
, 百拇医药
表1 BM/TPO对正常小鼠血小板计数的影响( ±s)
±s)
Table 1 Effect of BM/TPO on platelet count
of normal mice ( ±s) Platelet count/×109 L-1 t/d
±s) Platelet count/×109 L-1 t/d
NaCl
TPO
BM/TPO
0
270±18
, http://www.100md.com
263±22
253±23
4
262±19
375±31**
507±29**++
8
255±29
512±30**
600±30**++
12
, 百拇医药 262±34
430±24**
572±26**++
16
250±28
386±28**
540±31**++
20
247±27
368±34**
413±24**+
, http://www.100md.com
24
243±24
285±29*
327±27**+
28
252±20
257±35
247±28
n=6; *P<0.05, **P<0.01, compared with NaCl group;+P<0.05, ++P<0.01, compared with TPO group.
BacMam杆状病毒表达系统作为一种细胞表达体系和非化学性的细胞转染方法最近刚刚开始应用,迄今为止尚未见有直接用于整体动物作为基因治疗手段的报道。我们将重组的BacMam-2/TPO昆虫病毒直接导入动物体内进行了初步的基因治疗尝试,取得了良好的预期效果。
, 百拇医药
但昆虫病毒进入哺乳动物细胞的机制尚不十分清楚,作为基因治疗还需更深入的观察。
“九五”国家科技攻关项目(96-906-01-19)。
参考文献
1 Basser R L,Rasko J E J, Clarke K, et al. Thrombopoietic effects of pegylated recombinant human megakaryocyte growth and development factor(PEG-rHuMGDF) in patients with advanced cancer. Lancet, 1996,348:1279-1281
2 Archimbaud E, Ottmann O, Yin L A, et al. A randomized, double blind, placebocontroled study using PEG-rHuMGDF as an adjunct to chemotherapy for adults with de no-vo acute myeloid leukemia(AML): Early results(Abstr.). Blood,1996,88(suppl 1):447
, http://www.100md.com
3 侯纬敏,陆爱丽,岱美茹,等.分子克隆人血小板生成素基因.北京医科大学学报,1996,28(1):1-3
4 陆爱丽,岱美茹,董东生,等.rhTPO的分子克隆表达及活性测定.北京医科大学学报,1997,29(3):196-198
5 Shoji IH. Efficient gene transfer into various mammalian cells, inclduding non-hepatic cells, by baculovirus vectors. J Gen Virol, 1997,78:2657-2664
6 Hofmann C, Sandig V, Jennings GL, et al. Efficient gene transfer into human hepatocytes by baculovirus vectora. Proc Natl Acad Sci USA, 1995, 92:10 099-10 103
, 百拇医药
7 Boyce FM, Bucher NLR. Baculovirus-mediated gene transfer into mammalian cells. Proc Natl Acad Sci USA, 1996, 93, 2 348-2 352
8 Frederick B. Non-chemical gene transter into mammalian cells: a new DNA transduction system based on baculovirus. Wisconsin: Novagen Technical Literature, 1999.1-7
(1999-05-14收稿), 百拇医药
单位:陆爱丽 侯纬敏 北京医科大学生物化学与分子生物学系,北京 100083董东生 北京同仁医院;程 康 伏 爽 王德炳 血液病研究所
关键词:血小板生成素;基因治疗;昆虫病毒;杆状病毒科;转染
北京医科大学学报990408 摘 要 目的:报道一种新的基因治疗方法。方法:将人全长血小板生成素(thrombopoietin, TPO)基因克隆至pBacMam-2载体,与BacVector-3000病毒DNA共转染昆虫sf9细胞,经筛选后获得可在哺乳类动物细胞高效表达的昆虫病毒,以此为载体,将人TPO基因导入小鼠体内。结果:获得可在哺乳类动物细胞高效表达的昆虫病毒株,动物实验外周血小板计数升高至正常的2~3倍,RT-PCR结果显示TPO在小鼠组织中得到表达。结论:重组rhTPO昆虫病毒是一种有效的基因治疗载体。
, 百拇医药
中国图书资料分类法分类号 Q343.11
A new method of gene therapy using baculovirus as a gene delivery system
LU Ai-Li#, DONG Dong-Sheng, CHENG Kang, FU Shuang, WANG De-Bing, HOU Wei-Min
(#Department of Biochemistry and Molecular Biology, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To introduce a new method of gene therapy. Methods: Full-sized of thrombopoietin (TPO) cDNA was cloned into a pBacMam plasmid, recombinant baculovirus was generated by cotransfection of insect cells sf9 with BacVector-3000 virus DNA, and screened for highly expressed TPO in mammalian cells, the baculovirus which only expressed in mammalian cells was introduced into mouse. Results: Baculovirus with high TPO expression in mammalian cells was obtained. And when it was introduced into laboratory animals, platelet number in peripheral blood reached 2-3 times higher than that of the normal. RT-PCR analysis showed that TPO was transcripted in mouse tissues. Conclusion: A new recombinant rhTPO baculovirus was succesfully applied on mouse for gene therapy.
, 百拇医药
MeSH Thrombopoietin gene therapy Insect viruses Transfection Baculoviridae
人血小板生成素(thrombopoietin,TPO)的作用为刺激巨核细胞的生成 、成熟及血小板从巨核细胞释放至血液中。临床上的病人由于肿瘤化疗,骨髓移植后导致血小板减少;TPO是目前已知的唯一可促进血小板生成的细胞因子,可显著提高化疗期间癌症患者的血小板数目[1,2]。有关TPO的分子生物学研究近年来发展很快。我室继1995年克隆出人全长TPO基因后[3],又成功地在大肠杆菌中表达了rhTPO195片段[4]。在此基础上,我们又引进了一种新的pBacMam杆状病毒表达系统,以全长人TPO基因的昆虫病毒为载体,直接导入小鼠体内表达得到了成功。
pBacMam系统是最近开发的一种非化学性的转染哺乳类动物细胞的昆虫病毒系统[5],尚未见有用于基因治疗的报道。我们试用于动物体内,以进一步开展TPO的基因治疗研究。
, 百拇医药
1 材料与方法
pBacVector-3000 transfection kit 购自Novagen公司;其中pBacMam-2转移质粒为7588 bp,含有鸡肌动蛋白的启动子及CMV的增强子,多克隆位点后有兔β球蛋白的终止子(图1)。
含全长rhTPO cDNA 的重组质粒PUC118/TPO为本室构建;sf9昆虫细胞为本室保存, Grace培养基(Gibco公司)27 ℃培养。
DNA的酶切、连接及转化均按本室常规操作。将TPO全长基因亚克隆至pBacMam-2的EcoRⅠ位点后经酶切图谱挑出正向插入的阳性克隆。再将重组体BacMam-2/TPO 与BacVector-3000共转染sf9细胞,4 d后取培养上清(含重组病毒原种)按本室常规以蚀斑实验法纯化重组病毒。纯化的病毒在sf9细胞中扩增数次,使其滴度大于108 pfu.ml-1。

, 百拇医药
图1 pBacMam-2质粒
Figure 1 pBacMam-2 plasmid
BALB/c小鼠为我校实验动物部提供,体重18~20g,雌性。基因导入于后腿肌肉一次性注射昆虫病毒,滴度为108~109 pfu.ml-1。注射剂量为每千克体重小鼠2.5×1010 pfu.ml-1。组织RNA按TRIZOL试剂盒产品说明书提取。RT-PCR按照本室方法进行。
随机挑选BALB/c小鼠分3组进行动物实验:(1)a对照组(NaCl组):背部皮下注射医用生理盐水;(2)b实验组(BM/TPO组):背部皮下注射重组TPO 病毒, 剂量同前;(3)c阳性对照组(TPO组):背部皮下注射本室生产重组TPO 因子, 剂量为每千克体重200 μg。外周血小板计数按常规进行。
, 百拇医药
2 结果
将PUC118/TPO中TPOcDNA亚克隆至病毒转移载体BacMam-2后,经BamHⅠ和HindⅢ双酶切鉴定,正向插入可见一条约1.15 kb条带;反向插入则可见一条约0.95 kb条带(结果略)。 依照琼脂糖电泳结果挑出重组BacMam-2/TPO阳性克隆与BacVector-3000共转染sf9细胞,经病毒扩增、蚀斑筛选后任取3株阳性病毒重组子(即:BM/TPO1,BM/TPO2,BM/TPO4)。初步动物实验结果证实BM/TPO1较BM/TPO2 与BM/TPO 4的活性稍差。故我们选定BM/TPO 4为动物实验的昆虫病毒株。
RT-PCR结果如图2所示,实验组各孔均可见约500 bp(TPO)扩增条带,而正常对照孔只见约300 bp之G3PDH表达。提示BM/TPO已经导入动物体内,且在mRNA水平上有稳定表达。

, 百拇医药
图2 RT-PCR检测TPO在小鼠体内的表达
Figure 2 RT-PCR examination of TPO expression in mice
血小板计数动物实验结果如表1所示,实验组于注射后第4天外周血小板计数开始升高,升高幅度明显高于阳性对照组(P<0.01),第8天血小板计数达到峰值600×109 L-1,为对照组的2.35倍,且血小板计数持续升高,与阳性对照组相比均有显著性差异(P<0.01或P<0.05),直至第28天恢复正常水平。这一结果说明重组rhTPO昆虫病毒作为一种新的基因治疗手段,较TPO因子治疗的前景更为乐观。
3 讨论
目前,临床基因治疗实验常用载体为逆转录病毒及腺病毒载体,但由于逆转录病毒只能感染分裂期细胞,因而转染效率极低,且容纳外源基因的容量有限,还可使宿主细胞基因异常激活甚至有灭活的可能;腺病毒虽较逆转录病毒的转染效率高一些,但其所携带或产生的病毒蛋白可诱发机体局部的炎性反应及全身性细胞免疫反应,其安全性,特别是远期的后果尚难以预料。本文报道的这种新型杆状病毒表达系统本来只是作为一种在昆虫细胞中表达外源基因的体系来应用。近来发现,杆状病毒可进入几乎所有的哺乳类动物细胞[6]。利用这一特点,构建了这一非化学性的细胞转染方法。其优点是转染效率可高达100%,插入的外源基因片段可>20 kb;病毒极易制造,传代快,密度高,应用起来也很方便,只需直接感染宿主细胞,并可转染多种类型细胞(包括某些原代细胞),对基因的表达也易于控制[7]。而且昆虫病毒对哺乳动物细胞无毒副性作用。Fredeerick[8]用每个细胞1 000 pfu的BacMam重组病毒感染原代培养的肝上皮细胞后,未发现与未被感染的正常细胞在形态学上有任何差别;也未见有任何病毒基因在细胞内的表达。BacMam-2 载体上原有的多角体蛋白启动子改装成真核细胞启动子后,使重组病毒可在昆虫细胞中扩增,但不表达重组蛋白,而进入哺乳类动物细胞中可高效表达,但病毒不会扩增。因此,以昆虫病毒作为基因治疗实验中的载体,有着安全,有效,简单易于操作等优点。
, 百拇医药
表1 BM/TPO对正常小鼠血小板计数的影响(
 ±s)
±s)Table 1 Effect of BM/TPO on platelet count
of normal mice (
 ±s) Platelet count/×109 L-1 t/d
±s) Platelet count/×109 L-1 t/dNaCl
TPO
BM/TPO
0
270±18
, http://www.100md.com
263±22
253±23
4
262±19
375±31**
507±29**++
8
255±29
512±30**
600±30**++
12
, 百拇医药 262±34
430±24**
572±26**++
16
250±28
386±28**
540±31**++
20
247±27
368±34**
413±24**+
, http://www.100md.com
24
243±24
285±29*
327±27**+
28
252±20
257±35
247±28
n=6; *P<0.05, **P<0.01, compared with NaCl group;+P<0.05, ++P<0.01, compared with TPO group.
BacMam杆状病毒表达系统作为一种细胞表达体系和非化学性的细胞转染方法最近刚刚开始应用,迄今为止尚未见有直接用于整体动物作为基因治疗手段的报道。我们将重组的BacMam-2/TPO昆虫病毒直接导入动物体内进行了初步的基因治疗尝试,取得了良好的预期效果。
, 百拇医药
但昆虫病毒进入哺乳动物细胞的机制尚不十分清楚,作为基因治疗还需更深入的观察。
“九五”国家科技攻关项目(96-906-01-19)。
参考文献
1 Basser R L,Rasko J E J, Clarke K, et al. Thrombopoietic effects of pegylated recombinant human megakaryocyte growth and development factor(PEG-rHuMGDF) in patients with advanced cancer. Lancet, 1996,348:1279-1281
2 Archimbaud E, Ottmann O, Yin L A, et al. A randomized, double blind, placebocontroled study using PEG-rHuMGDF as an adjunct to chemotherapy for adults with de no-vo acute myeloid leukemia(AML): Early results(Abstr.). Blood,1996,88(suppl 1):447
, http://www.100md.com
3 侯纬敏,陆爱丽,岱美茹,等.分子克隆人血小板生成素基因.北京医科大学学报,1996,28(1):1-3
4 陆爱丽,岱美茹,董东生,等.rhTPO的分子克隆表达及活性测定.北京医科大学学报,1997,29(3):196-198
5 Shoji IH. Efficient gene transfer into various mammalian cells, inclduding non-hepatic cells, by baculovirus vectors. J Gen Virol, 1997,78:2657-2664
6 Hofmann C, Sandig V, Jennings GL, et al. Efficient gene transfer into human hepatocytes by baculovirus vectora. Proc Natl Acad Sci USA, 1995, 92:10 099-10 103
, 百拇医药
7 Boyce FM, Bucher NLR. Baculovirus-mediated gene transfer into mammalian cells. Proc Natl Acad Sci USA, 1996, 93, 2 348-2 352
8 Frederick B. Non-chemical gene transter into mammalian cells: a new DNA transduction system based on baculovirus. Wisconsin: Novagen Technical Literature, 1999.1-7
(1999-05-14收稿), 百拇医药