钙调神经磷酸酶依赖的信号通路在大鼠心肌肥大中的作用*
作者:符民桂 许松 柴三葆 王晓红 庞永正 刘乃奎 唐朝枢
单位:北京医科大学第一医院心血管病研究所 许松 中心实验室,北京 100034
关键词:钙调神经磷酸酶☆;信号传递;心肌;病理学;血管紧张素Ⅱ;药理学;心肌肥大☆;环孢菌素;药理学
北京医科大学学报990614 摘 要 目的:观察钙调神经磷酸酶(calcineurin, CaN)依赖的信号通路在大鼠心肌肥大中的作用。方法:通过腹主动脉缩窄复制大鼠压力超荷性心肌肥大模型,观察CaN特异性抑制剂-环孢素A(cyclosporin A, CsA)对大鼠心系数以及血浆及心肌组织心钠素(aritrial natriuretic peptide, ANP)水平的影响。同时,在培养的大鼠心肌细胞及心脏成纤维细胞上,观察CsA对血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)刺激的3H-亮氨酸及3H-胸腺嘧啶参入的影响。结果:腹主动脉缩窄大鼠心系数较假手术组增高38%(P<0.01)。应用CsA治疗的大鼠心系数下降了85%(P<0.001)。同时,观察到腹主动脉缩窄大鼠心肌组织及血浆ANP含量较对照组分别增高135%和117%(P<0.01),CsA处理后,ANP分别下降了16%和14%。在培养的大鼠心肌细胞及心脏成纤维细胞上,观察到CsA(0.1~10μmol.L-1)可以浓度依赖的方式抑制血管紧张素Ⅱ刺激的3H-亮氨酸及3H-胸腺嘧啶参入的增加。结论:CaN依赖的信号通路可能参与了压力超负荷及血管紧张素Ⅱ诱导的大鼠心肌肥大的发病过程。
, 百拇医药
中国图书资料分类法分类号 R542.2-332
The role of calcineurin-dependent signal pathway in cardiac hypertrophy of rats
FU Min-Gui#,XU Song, CHAI San-Bao,WANG Xiao-Hong,PANG Yong-Zheng,LIU Nai-Kui,et al
(#Institute of Cardiovascular Diseases Research, the First Hospital, Beijing Medical University, Beijing 100034)
MeSH Calcineurin☆ Signal transduction Myocardium/pathol Angiotensin Ⅱ/pharmacol Cardiac hypertrophy☆ Cyclosporine/pharmacol
, 百拇医药
ABSTRACT Objective:To determine the role of calcineurin-dependent signal pathway in cardiac hypertrophy of rats. Methods: The rat model of pressure overload-induced cardiac hypertrophy was produced by constriction of the abdominal aorta. The heart/body weight ratio and the atrial natriuretic peptide (ANP) levels in plasma and heart tissues of rats were investigated. The primary cardiac myocytes and fibroblasts were cultured under the standard conditions. Protein/DNA synthesis rate was assessed by 3H-Leucine/3H-TdR incorporation. Results: The heart/body weight ratio of each rat with abdominal aorta constriction was increased by 38% compared with that of the sham-operated group, and cyclosporin A (CsA) treatment decreased 85%. The ANP levels in plasma and heart tissues of rats with abdominal aorta constriction were signicantly increased by 135% and 117% respectively, compared with that in the sham-operated group, which was slightly reduced by CsA treatment. CsA(0.1-10 umol.L-1) decreased protein synthesis rate in AngⅡ-treated cardiomyocytes and DNA synthesis rate in AngII-treated fibroblasts in a dose-dependent manner. Conclusion: Calcineurin-dependent signal pathway may involve in pressure overload- and AngII-induced cardiac hypertrophy.
, 百拇医药
(J Beijing Med Unvi, 1999,31:532-535)
心肌肥大(cardiac hypertrophy)是指心肌细胞增大而无细胞分裂,是心肌细胞对高血压、瓣膜病、急性心肌梗死及先天性心脏病等常见临床疾病的一种基本应答。由心肌肥大发展到心力衰竭(心衰),由心衰而死亡是临床病人的主要死因之一。目前对心肌肥大的分子机制仍不清楚。很多研究表明[1,2],细胞内Ca2+浓度升高是外界刺激和/或内在功能缺陷所致心肌肥大发生发展的中心环节,而肥大基因的过度表达是各种病理刺激心肌肥大的共同分子机制。但胞内Ca2+浓度升高与肥大基因活化间的耦联环节一直不甚清楚。钙调神经磷酸酶(calcineurin, CaN)是唯一受Ca2+及钙调素(calmodulin,CaM)活化的磷蛋白磷酸酶,可通过活化转录因子NF-AT而调节基因表达。Molkentin等[3]新近报道,过度表达CaN或NF-AT3的转基因鼠均出现了与人类心肌肥大相似的病理变化,而如果在CaN高表达的转基因鼠生后给予CaN特异性抑制剂—环胞素A(cyclosporin A,CsA)注射,则可阻止心肌肥大的发生,提示CaN介导的信号通路可能在心肌肥大的发生发展中起重要作用。但CaN是否在各种刺激因素如机械负荷、血管紧张素Ⅱ(AngⅡ)等诱导的心肌肥大中均起作用,目前仍不清楚。本工作在腹主动脉缩窄所致的大鼠心肌肥大模型上,观察应用CsA阻断CaN通路对心肌肥大的影响。并在培养的原代心肌细胞及心脏成纤维细胞上,观察CsA对AngII刺激的心肌细胞肥大及成纤维细胞增殖的影响。
, http://www.100md.com
1 材料与方法
1.1 动物及试剂
Wistar大鼠及乳鼠均由北京医科大学实验动物中心提供。环孢素A为Sandoz公司产品,AngⅡ、对硝基磷酸酚(p-nitrophenyl phosphate,PNPP)、CaM、二硫苏糖醇(dithiothreitol, DTT)、苯*****(phenylmethyl sulfonyl fluoride,PMSF)、大豆胰酶抑制剂(soybean trypsin inhibitor,STI)、抑肽酶(aprotinin)均为Sigma公司产品 ,Dulbecco's modified eagle medium(DMEM)培养基干粉购自Gibco公司,RNA提取及探针标记药盒购自Promega公司,心钠素(atrial natriuretic peptide, ANP)放免药盒购自北京福瑞生物工程公司,其它试剂为分析纯级。
1.2 压力超荷性大鼠心肌肥大模型的制备
, 百拇医药
参照Baker等[4]的方法并改进。雄性Wistar大鼠180~200g,6 g.L-1戊巴比妥钠(60 mg.kg-1)麻醉,作腹正中切口,在左肾动脉上方分离腹主动脉,实验分3组:(1)肥大组(n=8):腹主动脉与一8号针头一起结扎,抽出针头,分层关闭腹腔。术后,每日腹腔注射等量生理盐水;(2)治疗组(n=8):行腹主动脉缩窄术,术前2 d及术后8 d均腹腔注射环孢素A (20 mg.kg-1.d-1,用生理盐水稀释);(3)假手术组(n=7):除不结扎腹主动脉外,其它操作同肥大组。所有动物于术后第10日,麻醉后称体重,摘取心脏,以心重/体重计算心系数。收集血浆及心肌组织,应用放免试剂盒测定ANP水平。
1.3 细胞培养
按Simpson等[5]描述的方法分离1d龄大鼠心室肌细胞及成纤维细胞。剪碎心室肌,用1.25g.L-1胰酶分部消化分离细胞,在含10%(体积分数)胎牛血清的DMEM中,于37℃、5%(体积分数)CO2-95%(体积分数)空气的条件下培养,30 min后,已贴壁的细胞绝大部分为心脏成纤维细胞,在含20%(体积分数)胎牛血清的培养液中传代培养;将未贴壁的细胞悬液转移到另瓶培养,加入5'-溴脱氧尿苷(0.1 mmol.L-1),以抑制非心肌细胞的生长。心肌细胞在相差显微镜下可见自发性搏动,成纤维细胞经α-actin 染色为阴性。
, http://www.100md.com
1.4 3H-亮氨酸及3H-胸腺嘧啶参入
将每毫升3×105的心肌细胞或1×105成纤维细胞接种于24孔板上,24 h后换成无血清培养液,次日加处理因素。AngⅡ组每孔加 AngⅡ 10-7 mol.L-1;CsA0.1、CsA1和CsA10组除AngⅡ外,分别另加CsA,终浓度为0.1、1和10μmol.L-1;对照组不加处理因素。12h后加入3H-亮氨酸或3H-胸腺嘧啶每孔3.7 kBq,继续培养12 h,在Millipore上将细胞收集于微孔滤膜上,用10%(体积分数)高氯酸破碎细胞,PBS冲洗,滤膜烘干后置于5 ml闪烁液的测定瓶内,用LKB液体闪烁仪测定3H放射性强度。
, http://www.100md.com
1.5 细胞存活率测定
应用0.1、1和10 μmol.ml-1 CsA分别与心肌细胞及心脏成纤维细胞共孵育24h,取培养上清作乳糖酸脱氢酶(LDH)测定;细胞悬液用2 g.L-1台盼蓝染色,在显微镜下计算每100个细胞中着色细胞数。
1.6 统计学分析
数据以(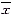 ±s)表示,采用方差分析及组间q检验作统计学处理,P<0.05为差异有显著性。
±s)表示,采用方差分析及组间q检验作统计学处理,P<0.05为差异有显著性。
2 结果
CsA对腹主动脉缩窄大鼠心系数、血浆及心肌组织ANP水平的影响:腹主动脉缩窄大鼠心系数较假手术组增高38%(P<0.01),CsA治疗组的大鼠心系数明显降低(P<0.01)。腹主动脉缩窄大鼠心肌组织及血浆ANP含量较对照组分别增高135%和117%(P<0.01),CsA处理后,ANP分别下降了16%和14%(表1)。
, http://www.100md.com
表1 CsA对腹主动脉缩窄大鼠心系数、血浆及
心肌组织ANP含量的影响(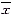 ±s, n=6)
±s, n=6)
Table 1 Effect of CsA on heart/body weight ratio
and ANP levels in plasma and heart tissues of rats
with abdominal aorta contriction(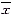 ±s, n=6) Groups
±s, n=6) Groups
[m(heart)/
, 百拇医药
m(body)]×10-3
ρ(ANP)/ng.L-1
[m(ANP)/
m(heart)]×10-9
Sham
3.22±0.19
621±57
271±66
Hyp
4.43±0.64*
, http://www.100md.com 1 352±144**
637±138**
CsA
3.42±0.51#
1 151±116#
533±39#
Sham,sham-operated group; Hyp,aortic-banded group;CsA,CsA-treated group. m,mass; ρ,mass density of ANP in plasma; *P<0.05, **P<0.01 vs Sham; #P<0.05 vs Hyp.
, http://www.100md.com
CsA对AngⅡ刺激的大鼠心肌细胞蛋白合成及成纤维细胞DNA合成的影响: 从图1可见AngⅡ(10-7mol.L-1)刺激的大鼠心肌细胞3H-亮氨酸参入较对照组增高46%(P<0.01);CsA可以浓度依赖的方式抑制AngⅡ刺激的心肌细胞3H-亮氨酸参入。AngⅡ(10-7mol.L-1)刺激的大鼠心脏3H-TdR参入较对照组增高72%(P<0.01);CsA(0.1~10μmol.L-1)可以浓度依赖的方式抑制AngⅡ刺激的心脏成纤维细胞3H-TdR参入。
*P<0.01 vs control; #P<0.05, ##P<0.01 vs AngⅡ; A,control; B, AngⅡ; C, AngⅡ+CsA0.1; D,AngⅡ+CsA1; E,AngⅡ+CsA10; CsA0.1,CsA1 and CsA10 represent 0.1, 1 and 10 μmol.L-1 CsA respectively.
, 百拇医药
图1 CsA对AngⅡ刺激的心肌细胞3H-亮氨酸及
成纤维细胞3H-TdR参入的影响(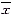 ±s, n=6)
±s, n=6)
Figure 1 Effect of CsA on 3H-Leucine/TdR incorporation
in AngⅡ-stimulated cardiac myocytes/fibroblasts of rats(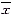 ±s, n=6)
±s, n=6)
CsA对心肌细胞及心脏成纤维细胞活力的影响:CsA(0.1~10μmol.L-1)与心肌细胞或心脏成纤维细胞孵育24h,培养上清中的LDH浓度与对照组差异无显著性(P>0.05); 台盼蓝染色的着色细胞数亦与对照组相近(P>0.05,表2)。
, 百拇医药
表2 环孢素A对大鼠心肌细胞
及心脏成纤维细胞活力的影响(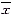 ±s, n=6)
±s, n=6)
Table 2 Effects of CsA on viability of cardiac myocytes
and fibroblasts (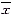 ±s, n=6) Reagent
±s, n=6) Reagent
z(LDH)/μmol.s-1.L-1
Died cell number(%)
, http://www.100md.com
Myocytes
Fibroblasts
Myocytes
Fibroblasts
Control
0.26±0.05
0.05±0.01
5.0±1.2
1.5±0.9
CsAa
0.27±0.05
0.05±0.02
, http://www.100md.com
6.1±1.0
1.9±0.3
CsAb
0.30±0.03
0.05±0.01
6.7±1.7
2.0±0.7
CsAc
0.36±0.11
0.05±0.02
7.5±0.8
2.7±0.8
, 百拇医药
z, enzyme activity; a, concentration of CsA is 0.1 μmol.L-1; b,concentration of CsA is 1 μmol.L-1; c, concentration of CsA is 10 μmol.L-1.3 讨论
心肌肥厚是心血管疾病的一种常见并发症,持续性心肌肥厚可导致扩张性心肌病、心衰和猝死。对心肌肥厚的发病机制虽未完全明确,但很多研究表明[2],胞内Ca2+浓度升高或对Ca2+的敏感性增强是心肌肥厚发病的中心环节。诱导心肌肥大的多种因素,如压力超负荷(机械牵拉)、内皮素、血管紧张素Ⅱ及细胞因子等,其作用的共同特征都是引起细胞内Ca2+浓度升高。但胞内Ca2+浓度升高诱导肥大基因活化的途径,目前仍不清楚。
, http://www.100md.com
CaN是一种Ca2+依赖的磷酸酶,在胞内受Ca2+和钙调素活化后,可使转录因子NF-AT去磷酸化,致使NF-AT的构型发生改变,暴露出核定位序列(NLS),使NF-AT得以转位到核,调节基因表达[6]。最近Sussman等[7]观察到应用CaN特异性抑制剂CsA可阻断几种心肌蛋白基因突变诱发的鼠心肌肥大,同时发现CsA亦可减轻压力负荷所致的心肌肥大,提示CaN依赖的信号通路的活化可能在心肌肥厚的发病中起重要作用。
我们在腹主动脉缩窄造成的大鼠压力超荷性心肌肥大模型上,观察了阻断CaN通路对心肌肥厚的作用。结果显示,腹主动脉缩窄后大鼠心脏明显增大,室壁肥厚,心系数较假手术组增高38%,应用CsA治疗的大鼠心脏未见明显增大,心系数较肥大组明显降低85%(P<0.01),这与Sussman等的结果一致。ANP是胚胎基因,心肌肥大时其表达活化。实验观察到肥大组大鼠心肌组织及血浆ANP含量较对照组明显增高,CsA处理后,心肌组织及血浆ANP含量分别下降了16%和14%。以上结果提示,CaN在压力超荷性心肌肥大的信号传递中可能起到重要作用,其介导ANP基因的活化可能是其机制之一。
, 百拇医药
压力负荷是致心肌肥大的一种主要刺激因素,其部分作用是通过心肌组织的自分泌/旁分泌AngⅡ介导的[8]。AngⅡ不但可诱导心肌细胞肥大,还可刺激成纤维细胞增殖[9,10]。我们在培养的大鼠原代心肌细胞及成纤维细胞上亦观察到CsA可以浓度依赖的方式抑制AngⅡ刺激的蛋白质及DNA合成速率增加。提示CaN通路参与AngⅡ诱导的心肌细胞肥大及成纤维细胞增殖,这可能是CaN介导压力超荷性心肌肥大的机制之一。
有研究证实,MAPK信号途径在机械牵拉诱导的心肌细胞肥大中起重要作用;CaN信号通路与MAPK信号途径的相互关系仍有待进一步研究[11]。
* 国家自然科学基金重点项目(39730220)资助课题;
参考文献
1 Hongo K, White E, Gannier F, et al. Effect of stretch on contraction and the transitent ferret ventricular muscles during hypoxia and acidosis. Am J Physiol, 1995,269:C690-697
, http://www.100md.com
2 Sandoshima J, Isumo S. The cellular and molecular response of cardiac myocyte to mechanical stress. Annu Rev Physiol, 1997,59:551-571
3 Molkentin JD, Lu JR, Antos CL, et al. A calcineurin dependent transcriptional pathway for cardiac hypertrophy. Cell, 1998,93:215-228
4 Baker KM, Chernin MI. Renin-angiotention system involvement in pressure-overload cardiac hypertrophy in rats. Am J Physiol, 1990,259:H324-332
, 百拇医药
5 Simpson P, McGrath A, Savion S. Myocyte hypertrophy in neonatal rat culture and its regulation by serum and by catecholamines. Circ Res, 1982,51:787-801
6 Guerini D. Calcineurin: not just a simple protein phosphase. Biochem Biophys Res Commun, 1997, 235:271-275
7 Baker KM, Chernin MI. Renin-angiotention system involvement in pressure-overload cardiac hypertrophy in rats. Am J Physiol, 1990,259:H324-333
, 百拇医药
8 Sussman MA, LimHW, Gude N, et al. Prevention of cardiac hypertrophy in mice by calcineurin inhibition. Science, 1998, 281: 1690-1693
9 Lee MA, Bohm M, Paul M, et al. Tissue renin-angiotensin system: their role in cardiovascular disease. Cir Res, 1993,87:7
10 Hefti MA, Harder BA, Eppenberger HM, et al. Signaling pathways in cardiac myocyte hypertrophy. J Mol Cell Cardiol, 1997,29:2873-2892
11 Yamazaki T, Komuro I, Kudoh S, et al. Mechanical stress activates protein kinase cascade of phosphorylation in neonatal rat cardiac myocytes. J Clin Invest, 1995,96:438-446
(1999-08-31收稿), 百拇医药
单位:北京医科大学第一医院心血管病研究所 许松 中心实验室,北京 100034
关键词:钙调神经磷酸酶☆;信号传递;心肌;病理学;血管紧张素Ⅱ;药理学;心肌肥大☆;环孢菌素;药理学
北京医科大学学报990614 摘 要 目的:观察钙调神经磷酸酶(calcineurin, CaN)依赖的信号通路在大鼠心肌肥大中的作用。方法:通过腹主动脉缩窄复制大鼠压力超荷性心肌肥大模型,观察CaN特异性抑制剂-环孢素A(cyclosporin A, CsA)对大鼠心系数以及血浆及心肌组织心钠素(aritrial natriuretic peptide, ANP)水平的影响。同时,在培养的大鼠心肌细胞及心脏成纤维细胞上,观察CsA对血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)刺激的3H-亮氨酸及3H-胸腺嘧啶参入的影响。结果:腹主动脉缩窄大鼠心系数较假手术组增高38%(P<0.01)。应用CsA治疗的大鼠心系数下降了85%(P<0.001)。同时,观察到腹主动脉缩窄大鼠心肌组织及血浆ANP含量较对照组分别增高135%和117%(P<0.01),CsA处理后,ANP分别下降了16%和14%。在培养的大鼠心肌细胞及心脏成纤维细胞上,观察到CsA(0.1~10μmol.L-1)可以浓度依赖的方式抑制血管紧张素Ⅱ刺激的3H-亮氨酸及3H-胸腺嘧啶参入的增加。结论:CaN依赖的信号通路可能参与了压力超负荷及血管紧张素Ⅱ诱导的大鼠心肌肥大的发病过程。
, 百拇医药
中国图书资料分类法分类号 R542.2-332
The role of calcineurin-dependent signal pathway in cardiac hypertrophy of rats
FU Min-Gui#,XU Song, CHAI San-Bao,WANG Xiao-Hong,PANG Yong-Zheng,LIU Nai-Kui,et al
(#Institute of Cardiovascular Diseases Research, the First Hospital, Beijing Medical University, Beijing 100034)
MeSH Calcineurin☆ Signal transduction Myocardium/pathol Angiotensin Ⅱ/pharmacol Cardiac hypertrophy☆ Cyclosporine/pharmacol
, 百拇医药
ABSTRACT Objective:To determine the role of calcineurin-dependent signal pathway in cardiac hypertrophy of rats. Methods: The rat model of pressure overload-induced cardiac hypertrophy was produced by constriction of the abdominal aorta. The heart/body weight ratio and the atrial natriuretic peptide (ANP) levels in plasma and heart tissues of rats were investigated. The primary cardiac myocytes and fibroblasts were cultured under the standard conditions. Protein/DNA synthesis rate was assessed by 3H-Leucine/3H-TdR incorporation. Results: The heart/body weight ratio of each rat with abdominal aorta constriction was increased by 38% compared with that of the sham-operated group, and cyclosporin A (CsA) treatment decreased 85%. The ANP levels in plasma and heart tissues of rats with abdominal aorta constriction were signicantly increased by 135% and 117% respectively, compared with that in the sham-operated group, which was slightly reduced by CsA treatment. CsA(0.1-10 umol.L-1) decreased protein synthesis rate in AngⅡ-treated cardiomyocytes and DNA synthesis rate in AngII-treated fibroblasts in a dose-dependent manner. Conclusion: Calcineurin-dependent signal pathway may involve in pressure overload- and AngII-induced cardiac hypertrophy.
, 百拇医药
(J Beijing Med Unvi, 1999,31:532-535)
心肌肥大(cardiac hypertrophy)是指心肌细胞增大而无细胞分裂,是心肌细胞对高血压、瓣膜病、急性心肌梗死及先天性心脏病等常见临床疾病的一种基本应答。由心肌肥大发展到心力衰竭(心衰),由心衰而死亡是临床病人的主要死因之一。目前对心肌肥大的分子机制仍不清楚。很多研究表明[1,2],细胞内Ca2+浓度升高是外界刺激和/或内在功能缺陷所致心肌肥大发生发展的中心环节,而肥大基因的过度表达是各种病理刺激心肌肥大的共同分子机制。但胞内Ca2+浓度升高与肥大基因活化间的耦联环节一直不甚清楚。钙调神经磷酸酶(calcineurin, CaN)是唯一受Ca2+及钙调素(calmodulin,CaM)活化的磷蛋白磷酸酶,可通过活化转录因子NF-AT而调节基因表达。Molkentin等[3]新近报道,过度表达CaN或NF-AT3的转基因鼠均出现了与人类心肌肥大相似的病理变化,而如果在CaN高表达的转基因鼠生后给予CaN特异性抑制剂—环胞素A(cyclosporin A,CsA)注射,则可阻止心肌肥大的发生,提示CaN介导的信号通路可能在心肌肥大的发生发展中起重要作用。但CaN是否在各种刺激因素如机械负荷、血管紧张素Ⅱ(AngⅡ)等诱导的心肌肥大中均起作用,目前仍不清楚。本工作在腹主动脉缩窄所致的大鼠心肌肥大模型上,观察应用CsA阻断CaN通路对心肌肥大的影响。并在培养的原代心肌细胞及心脏成纤维细胞上,观察CsA对AngII刺激的心肌细胞肥大及成纤维细胞增殖的影响。
, http://www.100md.com
1 材料与方法
1.1 动物及试剂
Wistar大鼠及乳鼠均由北京医科大学实验动物中心提供。环孢素A为Sandoz公司产品,AngⅡ、对硝基磷酸酚(p-nitrophenyl phosphate,PNPP)、CaM、二硫苏糖醇(dithiothreitol, DTT)、苯*****(phenylmethyl sulfonyl fluoride,PMSF)、大豆胰酶抑制剂(soybean trypsin inhibitor,STI)、抑肽酶(aprotinin)均为Sigma公司产品 ,Dulbecco's modified eagle medium(DMEM)培养基干粉购自Gibco公司,RNA提取及探针标记药盒购自Promega公司,心钠素(atrial natriuretic peptide, ANP)放免药盒购自北京福瑞生物工程公司,其它试剂为分析纯级。
1.2 压力超荷性大鼠心肌肥大模型的制备
, 百拇医药
参照Baker等[4]的方法并改进。雄性Wistar大鼠180~200g,6 g.L-1戊巴比妥钠(60 mg.kg-1)麻醉,作腹正中切口,在左肾动脉上方分离腹主动脉,实验分3组:(1)肥大组(n=8):腹主动脉与一8号针头一起结扎,抽出针头,分层关闭腹腔。术后,每日腹腔注射等量生理盐水;(2)治疗组(n=8):行腹主动脉缩窄术,术前2 d及术后8 d均腹腔注射环孢素A (20 mg.kg-1.d-1,用生理盐水稀释);(3)假手术组(n=7):除不结扎腹主动脉外,其它操作同肥大组。所有动物于术后第10日,麻醉后称体重,摘取心脏,以心重/体重计算心系数。收集血浆及心肌组织,应用放免试剂盒测定ANP水平。
1.3 细胞培养
按Simpson等[5]描述的方法分离1d龄大鼠心室肌细胞及成纤维细胞。剪碎心室肌,用1.25g.L-1胰酶分部消化分离细胞,在含10%(体积分数)胎牛血清的DMEM中,于37℃、5%(体积分数)CO2-95%(体积分数)空气的条件下培养,30 min后,已贴壁的细胞绝大部分为心脏成纤维细胞,在含20%(体积分数)胎牛血清的培养液中传代培养;将未贴壁的细胞悬液转移到另瓶培养,加入5'-溴脱氧尿苷(0.1 mmol.L-1),以抑制非心肌细胞的生长。心肌细胞在相差显微镜下可见自发性搏动,成纤维细胞经α-actin 染色为阴性。
, http://www.100md.com
1.4 3H-亮氨酸及3H-胸腺嘧啶参入
将每毫升3×105的心肌细胞或1×105成纤维细胞接种于24孔板上,24 h后换成无血清培养液,次日加处理因素。AngⅡ组每孔加 AngⅡ 10-7 mol.L-1;CsA0.1、CsA1和CsA10组除AngⅡ外,分别另加CsA,终浓度为0.1、1和10μmol.L-1;对照组不加处理因素。12h后加入3H-亮氨酸或3H-胸腺嘧啶每孔3.7 kBq,继续培养12 h,在Millipore上将细胞收集于微孔滤膜上,用10%(体积分数)高氯酸破碎细胞,PBS冲洗,滤膜烘干后置于5 ml闪烁液的测定瓶内,用LKB液体闪烁仪测定3H放射性强度。
, http://www.100md.com
1.5 细胞存活率测定
应用0.1、1和10 μmol.ml-1 CsA分别与心肌细胞及心脏成纤维细胞共孵育24h,取培养上清作乳糖酸脱氢酶(LDH)测定;细胞悬液用2 g.L-1台盼蓝染色,在显微镜下计算每100个细胞中着色细胞数。
1.6 统计学分析
数据以(
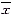 ±s)表示,采用方差分析及组间q检验作统计学处理,P<0.05为差异有显著性。
±s)表示,采用方差分析及组间q检验作统计学处理,P<0.05为差异有显著性。2 结果
CsA对腹主动脉缩窄大鼠心系数、血浆及心肌组织ANP水平的影响:腹主动脉缩窄大鼠心系数较假手术组增高38%(P<0.01),CsA治疗组的大鼠心系数明显降低(P<0.01)。腹主动脉缩窄大鼠心肌组织及血浆ANP含量较对照组分别增高135%和117%(P<0.01),CsA处理后,ANP分别下降了16%和14%(表1)。
, http://www.100md.com
表1 CsA对腹主动脉缩窄大鼠心系数、血浆及
心肌组织ANP含量的影响(
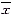 ±s, n=6)
±s, n=6)Table 1 Effect of CsA on heart/body weight ratio
and ANP levels in plasma and heart tissues of rats
with abdominal aorta contriction(
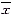 ±s, n=6) Groups
±s, n=6) Groups[m(heart)/
, 百拇医药
m(body)]×10-3
ρ(ANP)/ng.L-1
[m(ANP)/
m(heart)]×10-9
Sham
3.22±0.19
621±57
271±66
Hyp
4.43±0.64*
, http://www.100md.com 1 352±144**
637±138**
CsA
3.42±0.51#
1 151±116#
533±39#
Sham,sham-operated group; Hyp,aortic-banded group;CsA,CsA-treated group. m,mass; ρ,mass density of ANP in plasma; *P<0.05, **P<0.01 vs Sham; #P<0.05 vs Hyp.
, http://www.100md.com
CsA对AngⅡ刺激的大鼠心肌细胞蛋白合成及成纤维细胞DNA合成的影响: 从图1可见AngⅡ(10-7mol.L-1)刺激的大鼠心肌细胞3H-亮氨酸参入较对照组增高46%(P<0.01);CsA可以浓度依赖的方式抑制AngⅡ刺激的心肌细胞3H-亮氨酸参入。AngⅡ(10-7mol.L-1)刺激的大鼠心脏3H-TdR参入较对照组增高72%(P<0.01);CsA(0.1~10μmol.L-1)可以浓度依赖的方式抑制AngⅡ刺激的心脏成纤维细胞3H-TdR参入。

*P<0.01 vs control; #P<0.05, ##P<0.01 vs AngⅡ; A,control; B, AngⅡ; C, AngⅡ+CsA0.1; D,AngⅡ+CsA1; E,AngⅡ+CsA10; CsA0.1,CsA1 and CsA10 represent 0.1, 1 and 10 μmol.L-1 CsA respectively.
, 百拇医药
图1 CsA对AngⅡ刺激的心肌细胞3H-亮氨酸及
成纤维细胞3H-TdR参入的影响(
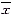 ±s, n=6)
±s, n=6)Figure 1 Effect of CsA on 3H-Leucine/TdR incorporation
in AngⅡ-stimulated cardiac myocytes/fibroblasts of rats(
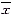 ±s, n=6)
±s, n=6)CsA对心肌细胞及心脏成纤维细胞活力的影响:CsA(0.1~10μmol.L-1)与心肌细胞或心脏成纤维细胞孵育24h,培养上清中的LDH浓度与对照组差异无显著性(P>0.05); 台盼蓝染色的着色细胞数亦与对照组相近(P>0.05,表2)。
, 百拇医药
表2 环孢素A对大鼠心肌细胞
及心脏成纤维细胞活力的影响(
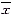 ±s, n=6)
±s, n=6)Table 2 Effects of CsA on viability of cardiac myocytes
and fibroblasts (
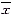 ±s, n=6) Reagent
±s, n=6) Reagentz(LDH)/μmol.s-1.L-1
Died cell number(%)
, http://www.100md.com
Myocytes
Fibroblasts
Myocytes
Fibroblasts
Control
0.26±0.05
0.05±0.01
5.0±1.2
1.5±0.9
CsAa
0.27±0.05
0.05±0.02
, http://www.100md.com
6.1±1.0
1.9±0.3
CsAb
0.30±0.03
0.05±0.01
6.7±1.7
2.0±0.7
CsAc
0.36±0.11
0.05±0.02
7.5±0.8
2.7±0.8
, 百拇医药
z, enzyme activity; a, concentration of CsA is 0.1 μmol.L-1; b,concentration of CsA is 1 μmol.L-1; c, concentration of CsA is 10 μmol.L-1.3 讨论
心肌肥厚是心血管疾病的一种常见并发症,持续性心肌肥厚可导致扩张性心肌病、心衰和猝死。对心肌肥厚的发病机制虽未完全明确,但很多研究表明[2],胞内Ca2+浓度升高或对Ca2+的敏感性增强是心肌肥厚发病的中心环节。诱导心肌肥大的多种因素,如压力超负荷(机械牵拉)、内皮素、血管紧张素Ⅱ及细胞因子等,其作用的共同特征都是引起细胞内Ca2+浓度升高。但胞内Ca2+浓度升高诱导肥大基因活化的途径,目前仍不清楚。
, http://www.100md.com
CaN是一种Ca2+依赖的磷酸酶,在胞内受Ca2+和钙调素活化后,可使转录因子NF-AT去磷酸化,致使NF-AT的构型发生改变,暴露出核定位序列(NLS),使NF-AT得以转位到核,调节基因表达[6]。最近Sussman等[7]观察到应用CaN特异性抑制剂CsA可阻断几种心肌蛋白基因突变诱发的鼠心肌肥大,同时发现CsA亦可减轻压力负荷所致的心肌肥大,提示CaN依赖的信号通路的活化可能在心肌肥厚的发病中起重要作用。
我们在腹主动脉缩窄造成的大鼠压力超荷性心肌肥大模型上,观察了阻断CaN通路对心肌肥厚的作用。结果显示,腹主动脉缩窄后大鼠心脏明显增大,室壁肥厚,心系数较假手术组增高38%,应用CsA治疗的大鼠心脏未见明显增大,心系数较肥大组明显降低85%(P<0.01),这与Sussman等的结果一致。ANP是胚胎基因,心肌肥大时其表达活化。实验观察到肥大组大鼠心肌组织及血浆ANP含量较对照组明显增高,CsA处理后,心肌组织及血浆ANP含量分别下降了16%和14%。以上结果提示,CaN在压力超荷性心肌肥大的信号传递中可能起到重要作用,其介导ANP基因的活化可能是其机制之一。
, 百拇医药
压力负荷是致心肌肥大的一种主要刺激因素,其部分作用是通过心肌组织的自分泌/旁分泌AngⅡ介导的[8]。AngⅡ不但可诱导心肌细胞肥大,还可刺激成纤维细胞增殖[9,10]。我们在培养的大鼠原代心肌细胞及成纤维细胞上亦观察到CsA可以浓度依赖的方式抑制AngⅡ刺激的蛋白质及DNA合成速率增加。提示CaN通路参与AngⅡ诱导的心肌细胞肥大及成纤维细胞增殖,这可能是CaN介导压力超荷性心肌肥大的机制之一。
有研究证实,MAPK信号途径在机械牵拉诱导的心肌细胞肥大中起重要作用;CaN信号通路与MAPK信号途径的相互关系仍有待进一步研究[11]。
* 国家自然科学基金重点项目(39730220)资助课题;
参考文献
1 Hongo K, White E, Gannier F, et al. Effect of stretch on contraction and the transitent ferret ventricular muscles during hypoxia and acidosis. Am J Physiol, 1995,269:C690-697
, http://www.100md.com
2 Sandoshima J, Isumo S. The cellular and molecular response of cardiac myocyte to mechanical stress. Annu Rev Physiol, 1997,59:551-571
3 Molkentin JD, Lu JR, Antos CL, et al. A calcineurin dependent transcriptional pathway for cardiac hypertrophy. Cell, 1998,93:215-228
4 Baker KM, Chernin MI. Renin-angiotention system involvement in pressure-overload cardiac hypertrophy in rats. Am J Physiol, 1990,259:H324-332
, 百拇医药
5 Simpson P, McGrath A, Savion S. Myocyte hypertrophy in neonatal rat culture and its regulation by serum and by catecholamines. Circ Res, 1982,51:787-801
6 Guerini D. Calcineurin: not just a simple protein phosphase. Biochem Biophys Res Commun, 1997, 235:271-275
7 Baker KM, Chernin MI. Renin-angiotention system involvement in pressure-overload cardiac hypertrophy in rats. Am J Physiol, 1990,259:H324-333
, 百拇医药
8 Sussman MA, LimHW, Gude N, et al. Prevention of cardiac hypertrophy in mice by calcineurin inhibition. Science, 1998, 281: 1690-1693
9 Lee MA, Bohm M, Paul M, et al. Tissue renin-angiotensin system: their role in cardiovascular disease. Cir Res, 1993,87:7
10 Hefti MA, Harder BA, Eppenberger HM, et al. Signaling pathways in cardiac myocyte hypertrophy. J Mol Cell Cardiol, 1997,29:2873-2892
11 Yamazaki T, Komuro I, Kudoh S, et al. Mechanical stress activates protein kinase cascade of phosphorylation in neonatal rat cardiac myocytes. J Clin Invest, 1995,96:438-446
(1999-08-31收稿), 百拇医药