人重组粒细胞集落刺激因子突变体rhG-CSF-Ala-17的纯化及部分理化性质
作者:范慧 莫晓宁 张颖妹 杨璐 宋泉声 范中玉 马大龙
单位:北京大学基础医学院免疫学系,北京 100083
关键词:点突变;大肠杆菌;粒细胞集落刺激因子;分离和提纯;rhG-CSF-Ala-17
北京医科大学学报000416 [摘 要] 目的:建立高效简便的人重组粒细胞集落刺激因子突变体rhG-CSF-Ala-17纯化工艺,并对其进行鉴定。方法:大肠杆菌表达的rhG-CSF-Ala-17经包涵体洗涤、变性复性后,采用DEAE Sepharose Fast Flow阴离子交换层析和Superdex75凝胶过滤层析分离纯化。经SDS-PAGE和FPLC检测纯度,并进行N端氨基酸序列分析、比活性分析、紫外最大吸收光谱分析、内毒素检测等指标对其进行鉴定。结果:纯化后的rhG-CSF-Ala-17纯度可达99.64%,比活为1×108 U*mg-1。其N端19个氨基酸分析与预期序列一致,紫外最大吸收光谱位于280 nm,氨基酸的组成与预期结果一致,内毒素含量低于部颁标准。结论:两步层析即可获得高纯度的rhG-CSF-Ala-17重组蛋白质,为进一步的rhG-CSF-Ala-17临床前和临床研究打下了基础。
, http://www.100md.com
[中图分类号] Q343.13 [文献标识码] A [文章编号] 1000-1530(2000)04-0337-03
Purification and identification of recombinant human granulocyte
colony-stimulating factor muteint (rhG-CSF-Ala-17)
FAN Hui
(Department of Immunology, Peking University, Beijing 100083, China)
MO Xiao-Ning
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHANG Ying-Mei
(Department of Immunology, Peking University, Beijing 100083, China)
YANG Lu
(Department of Immunology, Peking University, Beijing 100083, China)
SONG Quan-Sheng
(Department of Immunology, Peking University, Beijing 100083, China)
FAN Zhong-Yu
, http://www.100md.com (Department of Immunology, Peking University, Beijing 100083, China)
MA Da-Long
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To establish a cost-effective procedure for the purification and identification of rhG-CSF-Ala-17. Methods: The inclusion body of the rhG-CSF-Ala-17 recombinant protein expressed in E.coli was washed, denatured and renatured. The two steps of chromatography (DEAE Sepharose FF ion exchange and Supexdex 75 size exclusion) were used for the purification. The purity and properties of the recombinant protein was detected by SDS-PAGE, FPLC, amino acid analysis, ultravidet (UV) absorption and endotoxin analysis. Results: Following the procedure, up to 99.64% rhG-CSF-Ala-17 can be achieved and there is no endotoxin contamination. The bioactivity of the recombinant protein is 1×108U/mg; the maximal UV absorption is at 280 nm, and the N-terminal amino acid analysis shows that the first 19 amino acids sequence is the same as the theoretic prediction. Conclusion: We have established a purification procedure for rhG-CSF-Ala-17 with highly efficiency and simplicity. It will make a base for preclinical and clinical trials of rhG-CSF-Ala-17.
, 百拇医药
KEY WORDS Point muteint; Escherichia coli; Granulocyte colony-stimulating factor/isol
(J Beijing Med Univ, 2000,32:337-339)
人重组粒细胞集落刺激因子突变体rhG-CSF-Ala-17是利用基因工程技术将野生型人重组粒细胞集落刺激因子rhG-CSF进行改造,使其具有更稳定的结构。有更高的体内活性和体外稳定性[1],弥补细胞因子类药物稳定性差、体内半衰期短的弊端,更利于运输贮藏和广泛应用。本文在大肠杆菌表达成功rhG-CSF-Ala-17的基础上[1],进一步对其蛋白质纯化工艺进行研究,通过表达、包涵体洗涤、变性、复性、二步层析程序,建立了一套高效快速的分离纯化技术路线。
1 材料与方法
, 百拇医药
1.1 质粒与菌株
rhG-CSF-Ala-17蛋白表达质粒pKpL- GCSF-Ala17由本室构建[2]。大肠杆菌pop2136(C600衍生株,含C1857基因,编码温度敏感的λ阻遏蛋白),由Raiband博士惠赠。
1.2 介质及纯化设备
DEAE Sepharose Fast Flow, Superdex75 16/60预装柱及低压层析设备均为Pharmacia产品。
1.3 rhG-CSF-Ala-17的表达及纯化
质粒转化及诱导表达技术按本室方法进行[2,3],rhG-CSF-Ala-17工程菌经超声破碎后洗涤包涵体,利用含100 mmol.L-1 β-ME 的8 mol.L-1尿素进行变性,离心取变性上清,在缓冲液中(50 mmol.L-1 Tris-HCl pH 8.0)稀释复性。复性液先通过DEAE Sepharose Fast Flow进行阴离子交换层析,直线梯度洗脱,于0.2 mol.L-1 NaCl洗出目的蛋白,洗出的蛋白峰经浓缩后过凝胶过滤Superdex 75 16/60预装柱,收集rhG-CSF-Ala-17蛋白峰。
, http://www.100md.com
1.4 rhG-CSF-Ala-17的蛋白质鉴定
rhG-CSF-Ala-17蛋白的纯度检定选30 g.L-1浓缩胶,125g.L-1分离胶,非还原SDS-PAGE电泳,银染色分析蛋白带。rhG-CSF-Ala-17相对分子质量检定选用30g.L-1浓缩胶,125g.L-1分离胶还原型SDS-PAGE电泳,考马斯亮蓝R-250染色。
rhG-CSF-Ala-17蛋白的生物学活性测定以NFS-60白血病细胞株为依赖株(由中国生物制品检定所丁锡申教授惠赠)选用MTT法进行检测。
紫外最大吸收光谱分析于BECKMAN DU640型紫外可见分光光度计进行220~400 nm紫外全波长扫描。
, http://www.100md.com
等电点的测定用等电聚焦法测定G-CSF-Ala-17蛋白等电点,选用Pharmacia产Phast System电泳仪。
氨基酸成份分析采用酸解法于日立885-50型氨基酸自动分析仪进行分析测定,委托我校细胞生物学教研室检测。
N-端氨基酸序列测定选用Edman降解法于BECKMAN LT3000测序仪测定,委托中国医学科学院基础所检测。
内毒素检测采用家兔热原检测法及鲎试剂法,参照《中国生物制品规程(一部)》生物制品热原质试验规程进行。
2 结果
2.1 rhG-CSF-Ala-17蛋白的纯化
rhG-CSF-Ala-17蛋白在大肠杆菌以包涵体形式表达,经变性,复性,DEAE Sepharose Fast Flow层析样品于0.2 mol.L-1 NaCl洗出纯度达66.17%(图1)。再经Superdex75层析分离,得到纯蛋白(图2),经非还原SDS-PAGE检定为单一蛋白带,相对分子质量为18.3×103(图3、4),FPLC检测为单一峰型,纯度达99.64%。自原始工程菌10.5%的表达量至终产品纯化倍数为9.52倍,表1对纯化的效率进行了总结。
, http://www.100md.com
表1 rhG-CSF-Ala-17分步纯化效果
Table 1 The purification of rhG-CSF-Ala-17 Step
m/mg
Recovery
(%)
Specific
protein (%)
Purification
fold
Engineered E.coli
-
, http://www.100md.com
-
10.5
-
Indusion bodies
-
-
21.6
2.06
Renature solution
14.8
100
35.3
3.36
, http://www.100md.com
DEAE-SepharoseFF
4.37
29.53
66.7
6.35
Superdex75
2.53
17.09
100
9.52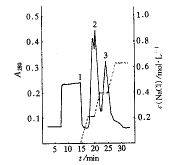
Column 1.6 cm×3 cm flow rate 5 ml.min-1;
, 百拇医药
peak 2, rhG-CSF-Ala-17.
图1 DEAE Sepharose FF阴离子
交换层析分离rhG-CSF-Ala-17
Figure 1 DEAE Sepharose FF ion exchange chromatographic
profile of rhG-CSF-Ala-17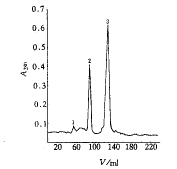
Column 1.6 cm×60 cm Folw rate 0.8 ml.min-1; peak 2, rhG-CSF-Ala-17.
图2 Superdex 75凝胶过滤层析分离rhG-CSF-Ala-17
, 百拇医药
Figure 2 Superdex 75 Gel filtration chromatographic
profile of rhG-CSF-Ala-17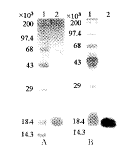
1, Protein markers; 2, rhG-CSF-Ala-17;
A,SDS-PAGE coomassie brilliant blue R250 stain;
B, SDS-PAGE silver stain.
图3 非还原SDS-PAGE电泳检定rhG-CSF-Ala-17
Figure 3 SDS-PAGE analysis of rhG-CSF-Ala-17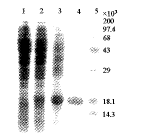
, http://www.100md.com
1, E.coli 2136/rhG-CSF-Ala-17 control;
2, E.coli 2136/rhG-CSF-Ala-17 induced;
3, rhG-CSF-Ala-17 indusion bodies;
4, purified rhG-CSF-Ala-17; 5, protein markers.
图4 人重组rhG-CSF-Ala-17在大肠杆菌的表达及纯化
Figure 4 SDS-PAGE analysis of rhG-CSF-Ala-17
2.2 rhG-CSF-Ala-17蛋白的鉴定
, 百拇医药
用NFS60细胞检测rhG-CSF-Ala-17的比活性为1(108u.mg-1,与野生型G-CSF的比活性相当,图略)。紫外最大吸收峰位于280 nm处,等电点pI 6.08,氨基酸组成比例与理论预期值基本一致(表2)。N端19个氨基酸序列测定结果为:Met-Thr-Pro-Leu-Gly-Pro-Ala-Ser-Ser-Leu-Pro-Gln-Ser-Phe-Leu-Leu-Lys-Ala-Leu上述序列表明rhG-CSF-Ala-1的N端含有附加的Met,从第2个氨基酸算起,第17位氨基酸的确由丙氨酸替代了半胱氨酸,证明原设计正确。
表2 rhG-CSF-Ala-17氨基酸成份分析
Table 2 Amino acid composition of rhG-CSF-Ala-17 Amino
acid
, 百拇医药
c/mmol.L-1
Amino
acid
c/mmol.L-1
TV
PV
TV
PV
Asp
0.037
0.031
Ile
, 百拇医药
0.029
0.031
Thr
0.052
0.052
Leu
0.242
0.251
Ser
0.096
0.115
Tyr
0.020
, 百拇医药
0.023
Glu
0.214
0.076
Phe
0.047
0.046
Gly
0.105
0.107
Lys
0.034
0.038
, http://www.100md.com
Ala
0.152
0.152
His
0.022
0.038
Cys
0.031
Trp
0.015
Val
0.054
0.061
, 百拇医药
Arg
0.040
0.038
Met
0.008
0.023
Pro
0.078
0.098
TV, tested value; PV, prediction value. 纯化后的rhG-CSF-Ala-17蛋白质内内毒素和热原检测均为为阴性。
3 讨论
, 百拇医药
以原核细胞大肠杆菌表达的基因重组蛋白,因其周期短、产量高、成本低而受到广泛应用,但其在下游生产中常常操作繁杂,纯化条件不易掌握,需要反复多次的层析分离,回收率低,容易影响生物学活性,因而阻碍了其产品的工业化生产。为此,选用合理的层析条件,较少的层析步骤,以求达到最优的工艺路线,获得合格的产品,是基因工程下游技术实现产业化的关键。本文经过反复分析比较,选用尿素作变性剂,因其具有电中性,成本低廉的优点,在rhG-CSF-Ala-17蛋白的变性复性效果良好,并且可直接过DEAE Sepharose FF阴离子交换层析,使目的蛋白得到快速浓缩,洗脱后得到较浓的蛋白样品。再经Superdex 75的层析一步分离,其终产品纯度即达99.64%,内毒素呈阴性反应,这一工艺快速简便,且重复性好,易于放大生产,产品纯度达到临床前和临床实验的标准,为其进一步研究奠定了基础。本文建立的纯化工艺还有可能应用于其它重组蛋白质的分离纯化,可望促进这一领域的发展。
基金项目:国家863计划资助课题;
, http://www.100md.com
参考文献
1,李 芳,莫晓宁,张颖妹,等.人重组粒细胞集落刺激因子突变体的构建,表达和其体内外生物学活性研究[J].中华微生物学和免疫学杂志,1999,19(4):319-322
2,马大龙,劳者歌,孙 英等,高效表达非融合蛋白的大肠杆菌质粒载体的构建[J].北京医科大学学报,1990,22(2):81-83
3,刘 洁,马大龙,狄春辉,等,重组人白细胞介素3同源双体分子基因在大肠杆菌的表达[J].中华血液学杂志,1993,14(9);475
(1999-05-20收稿), 百拇医药
单位:北京大学基础医学院免疫学系,北京 100083
关键词:点突变;大肠杆菌;粒细胞集落刺激因子;分离和提纯;rhG-CSF-Ala-17
北京医科大学学报000416 [摘 要] 目的:建立高效简便的人重组粒细胞集落刺激因子突变体rhG-CSF-Ala-17纯化工艺,并对其进行鉴定。方法:大肠杆菌表达的rhG-CSF-Ala-17经包涵体洗涤、变性复性后,采用DEAE Sepharose Fast Flow阴离子交换层析和Superdex75凝胶过滤层析分离纯化。经SDS-PAGE和FPLC检测纯度,并进行N端氨基酸序列分析、比活性分析、紫外最大吸收光谱分析、内毒素检测等指标对其进行鉴定。结果:纯化后的rhG-CSF-Ala-17纯度可达99.64%,比活为1×108 U*mg-1。其N端19个氨基酸分析与预期序列一致,紫外最大吸收光谱位于280 nm,氨基酸的组成与预期结果一致,内毒素含量低于部颁标准。结论:两步层析即可获得高纯度的rhG-CSF-Ala-17重组蛋白质,为进一步的rhG-CSF-Ala-17临床前和临床研究打下了基础。
, http://www.100md.com
[中图分类号] Q343.13 [文献标识码] A [文章编号] 1000-1530(2000)04-0337-03
Purification and identification of recombinant human granulocyte
colony-stimulating factor muteint (rhG-CSF-Ala-17)
FAN Hui
(Department of Immunology, Peking University, Beijing 100083, China)
MO Xiao-Ning
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHANG Ying-Mei
(Department of Immunology, Peking University, Beijing 100083, China)
YANG Lu
(Department of Immunology, Peking University, Beijing 100083, China)
SONG Quan-Sheng
(Department of Immunology, Peking University, Beijing 100083, China)
FAN Zhong-Yu
, http://www.100md.com (Department of Immunology, Peking University, Beijing 100083, China)
MA Da-Long
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To establish a cost-effective procedure for the purification and identification of rhG-CSF-Ala-17. Methods: The inclusion body of the rhG-CSF-Ala-17 recombinant protein expressed in E.coli was washed, denatured and renatured. The two steps of chromatography (DEAE Sepharose FF ion exchange and Supexdex 75 size exclusion) were used for the purification. The purity and properties of the recombinant protein was detected by SDS-PAGE, FPLC, amino acid analysis, ultravidet (UV) absorption and endotoxin analysis. Results: Following the procedure, up to 99.64% rhG-CSF-Ala-17 can be achieved and there is no endotoxin contamination. The bioactivity of the recombinant protein is 1×108U/mg; the maximal UV absorption is at 280 nm, and the N-terminal amino acid analysis shows that the first 19 amino acids sequence is the same as the theoretic prediction. Conclusion: We have established a purification procedure for rhG-CSF-Ala-17 with highly efficiency and simplicity. It will make a base for preclinical and clinical trials of rhG-CSF-Ala-17.
, 百拇医药
KEY WORDS Point muteint; Escherichia coli; Granulocyte colony-stimulating factor/isol
(J Beijing Med Univ, 2000,32:337-339)
人重组粒细胞集落刺激因子突变体rhG-CSF-Ala-17是利用基因工程技术将野生型人重组粒细胞集落刺激因子rhG-CSF进行改造,使其具有更稳定的结构。有更高的体内活性和体外稳定性[1],弥补细胞因子类药物稳定性差、体内半衰期短的弊端,更利于运输贮藏和广泛应用。本文在大肠杆菌表达成功rhG-CSF-Ala-17的基础上[1],进一步对其蛋白质纯化工艺进行研究,通过表达、包涵体洗涤、变性、复性、二步层析程序,建立了一套高效快速的分离纯化技术路线。
1 材料与方法
, 百拇医药
1.1 质粒与菌株
rhG-CSF-Ala-17蛋白表达质粒pKpL- GCSF-Ala17由本室构建[2]。大肠杆菌pop2136(C600衍生株,含C1857基因,编码温度敏感的λ阻遏蛋白),由Raiband博士惠赠。
1.2 介质及纯化设备
DEAE Sepharose Fast Flow, Superdex75 16/60预装柱及低压层析设备均为Pharmacia产品。
1.3 rhG-CSF-Ala-17的表达及纯化
质粒转化及诱导表达技术按本室方法进行[2,3],rhG-CSF-Ala-17工程菌经超声破碎后洗涤包涵体,利用含100 mmol.L-1 β-ME 的8 mol.L-1尿素进行变性,离心取变性上清,在缓冲液中(50 mmol.L-1 Tris-HCl pH 8.0)稀释复性。复性液先通过DEAE Sepharose Fast Flow进行阴离子交换层析,直线梯度洗脱,于0.2 mol.L-1 NaCl洗出目的蛋白,洗出的蛋白峰经浓缩后过凝胶过滤Superdex 75 16/60预装柱,收集rhG-CSF-Ala-17蛋白峰。
, http://www.100md.com
1.4 rhG-CSF-Ala-17的蛋白质鉴定
rhG-CSF-Ala-17蛋白的纯度检定选30 g.L-1浓缩胶,125g.L-1分离胶,非还原SDS-PAGE电泳,银染色分析蛋白带。rhG-CSF-Ala-17相对分子质量检定选用30g.L-1浓缩胶,125g.L-1分离胶还原型SDS-PAGE电泳,考马斯亮蓝R-250染色。
rhG-CSF-Ala-17蛋白的生物学活性测定以NFS-60白血病细胞株为依赖株(由中国生物制品检定所丁锡申教授惠赠)选用MTT法进行检测。
紫外最大吸收光谱分析于BECKMAN DU640型紫外可见分光光度计进行220~400 nm紫外全波长扫描。
, http://www.100md.com
等电点的测定用等电聚焦法测定G-CSF-Ala-17蛋白等电点,选用Pharmacia产Phast System电泳仪。
氨基酸成份分析采用酸解法于日立885-50型氨基酸自动分析仪进行分析测定,委托我校细胞生物学教研室检测。
N-端氨基酸序列测定选用Edman降解法于BECKMAN LT3000测序仪测定,委托中国医学科学院基础所检测。
内毒素检测采用家兔热原检测法及鲎试剂法,参照《中国生物制品规程(一部)》生物制品热原质试验规程进行。
2 结果
2.1 rhG-CSF-Ala-17蛋白的纯化
rhG-CSF-Ala-17蛋白在大肠杆菌以包涵体形式表达,经变性,复性,DEAE Sepharose Fast Flow层析样品于0.2 mol.L-1 NaCl洗出纯度达66.17%(图1)。再经Superdex75层析分离,得到纯蛋白(图2),经非还原SDS-PAGE检定为单一蛋白带,相对分子质量为18.3×103(图3、4),FPLC检测为单一峰型,纯度达99.64%。自原始工程菌10.5%的表达量至终产品纯化倍数为9.52倍,表1对纯化的效率进行了总结。
, http://www.100md.com
表1 rhG-CSF-Ala-17分步纯化效果
Table 1 The purification of rhG-CSF-Ala-17 Step
m/mg
Recovery
(%)
Specific
protein (%)
Purification
fold
Engineered E.coli
-
, http://www.100md.com
-
10.5
-
Indusion bodies
-
-
21.6
2.06
Renature solution
14.8
100
35.3
3.36
, http://www.100md.com
DEAE-SepharoseFF
4.37
29.53
66.7
6.35
Superdex75
2.53
17.09
100
9.52

Column 1.6 cm×3 cm flow rate 5 ml.min-1;
, 百拇医药
peak 2, rhG-CSF-Ala-17.
图1 DEAE Sepharose FF阴离子
交换层析分离rhG-CSF-Ala-17
Figure 1 DEAE Sepharose FF ion exchange chromatographic
profile of rhG-CSF-Ala-17

Column 1.6 cm×60 cm Folw rate 0.8 ml.min-1; peak 2, rhG-CSF-Ala-17.
图2 Superdex 75凝胶过滤层析分离rhG-CSF-Ala-17
, 百拇医药
Figure 2 Superdex 75 Gel filtration chromatographic
profile of rhG-CSF-Ala-17

1, Protein markers; 2, rhG-CSF-Ala-17;
A,SDS-PAGE coomassie brilliant blue R250 stain;
B, SDS-PAGE silver stain.
图3 非还原SDS-PAGE电泳检定rhG-CSF-Ala-17
Figure 3 SDS-PAGE analysis of rhG-CSF-Ala-17

, http://www.100md.com
1, E.coli 2136/rhG-CSF-Ala-17 control;
2, E.coli 2136/rhG-CSF-Ala-17 induced;
3, rhG-CSF-Ala-17 indusion bodies;
4, purified rhG-CSF-Ala-17; 5, protein markers.
图4 人重组rhG-CSF-Ala-17在大肠杆菌的表达及纯化
Figure 4 SDS-PAGE analysis of rhG-CSF-Ala-17
2.2 rhG-CSF-Ala-17蛋白的鉴定
, 百拇医药
用NFS60细胞检测rhG-CSF-Ala-17的比活性为1(108u.mg-1,与野生型G-CSF的比活性相当,图略)。紫外最大吸收峰位于280 nm处,等电点pI 6.08,氨基酸组成比例与理论预期值基本一致(表2)。N端19个氨基酸序列测定结果为:Met-Thr-Pro-Leu-Gly-Pro-Ala-Ser-Ser-Leu-Pro-Gln-Ser-Phe-Leu-Leu-Lys-Ala-Leu上述序列表明rhG-CSF-Ala-1的N端含有附加的Met,从第2个氨基酸算起,第17位氨基酸的确由丙氨酸替代了半胱氨酸,证明原设计正确。
表2 rhG-CSF-Ala-17氨基酸成份分析
Table 2 Amino acid composition of rhG-CSF-Ala-17 Amino
acid
, 百拇医药
c/mmol.L-1
Amino
acid
c/mmol.L-1
TV
PV
TV
PV
Asp
0.037
0.031
Ile
, 百拇医药
0.029
0.031
Thr
0.052
0.052
Leu
0.242
0.251
Ser
0.096
0.115
Tyr
0.020
, 百拇医药
0.023
Glu
0.214
0.076
Phe
0.047
0.046
Gly
0.105
0.107
Lys
0.034
0.038
, http://www.100md.com
Ala
0.152
0.152
His
0.022
0.038
Cys
0.031
Trp
0.015
Val
0.054
0.061
, 百拇医药
Arg
0.040
0.038
Met
0.008
0.023
Pro
0.078
0.098
TV, tested value; PV, prediction value. 纯化后的rhG-CSF-Ala-17蛋白质内内毒素和热原检测均为为阴性。
3 讨论
, 百拇医药
以原核细胞大肠杆菌表达的基因重组蛋白,因其周期短、产量高、成本低而受到广泛应用,但其在下游生产中常常操作繁杂,纯化条件不易掌握,需要反复多次的层析分离,回收率低,容易影响生物学活性,因而阻碍了其产品的工业化生产。为此,选用合理的层析条件,较少的层析步骤,以求达到最优的工艺路线,获得合格的产品,是基因工程下游技术实现产业化的关键。本文经过反复分析比较,选用尿素作变性剂,因其具有电中性,成本低廉的优点,在rhG-CSF-Ala-17蛋白的变性复性效果良好,并且可直接过DEAE Sepharose FF阴离子交换层析,使目的蛋白得到快速浓缩,洗脱后得到较浓的蛋白样品。再经Superdex 75的层析一步分离,其终产品纯度即达99.64%,内毒素呈阴性反应,这一工艺快速简便,且重复性好,易于放大生产,产品纯度达到临床前和临床实验的标准,为其进一步研究奠定了基础。本文建立的纯化工艺还有可能应用于其它重组蛋白质的分离纯化,可望促进这一领域的发展。
基金项目:国家863计划资助课题;
, http://www.100md.com
参考文献
1,李 芳,莫晓宁,张颖妹,等.人重组粒细胞集落刺激因子突变体的构建,表达和其体内外生物学活性研究[J].中华微生物学和免疫学杂志,1999,19(4):319-322
2,马大龙,劳者歌,孙 英等,高效表达非融合蛋白的大肠杆菌质粒载体的构建[J].北京医科大学学报,1990,22(2):81-83
3,刘 洁,马大龙,狄春辉,等,重组人白细胞介素3同源双体分子基因在大肠杆菌的表达[J].中华血液学杂志,1993,14(9);475
(1999-05-20收稿), 百拇医药