经肝动脉肝内移植异种胰岛细胞治疗糖尿病的实验研究
作者:王维 罗贤明 刘晟 叶斌 杨元华
单位:410013 长沙,湖南医科大学附属第三医院放射科(王维、罗贤明、刘晟、叶斌),病理科(杨元华)
关键词:放射学,介入性;胰岛移植;移植,异种;动物,实验
中华放射学杂志990305 【摘要】 目的 探讨经肝动脉异种肝内植入新生猪胰岛细胞的可行性,以及移植物生理功能和产生副反应的特点。方法 化学药物诱导法制作5只犬的糖尿病模型以后,将分离、纯化后的新生猪胰岛细胞经肝动脉植入糖尿病动物模型的肝内;测量移植前后胰岛素用量、血糖以及血清C肽水平和肝功能的变化,并对肝、肾进行病理检查。结果 移植以后血清C肽明显增高,对葡萄糖刺激试验反应敏感(P=0.0122);血糖逐步恢复正常(P=0.000015),胰岛素用量由移植前的每日(21.4±2.4)U减少至(0.4±0.9)U(P=0.000089),移植3个月后4只动物停用胰岛素;移植前后肝功能无明显变化(P=0.3728);病理检查各重要脏器基本正常。 结论 新生猪胰岛细胞经肝动脉植入犬糖尿病模型的肝脏以后,能纠正异种动物糖尿病模型的高血糖状态,没有明显副作用发生。
, 百拇医药
Transartery intrahepatic xenotransplantation of islets——an experimental therapy of diabetes WANG Wei, LUO Xiangming, LIU Shen, et al. Department of Radiology, the Third Affiliated Hospital, Hunan Medical University, Changsha 410013
【Abstract】 Objective To evaluate the physiologic features and probable adverse reactions of transartery intrahepatic xenotransplantation of newborn porcine islets. Methods 5 dogs were induced diabetic states with alloxan and streptozotocin, then were perfused (4~6)×105 porcine islets through the hepatic artery. The C peptide, glucose tolerance test, dose of insulin, function of livers of the dogs were measured before and after transplantation, samples of the livers, pancreases and kidneys were examined by pathologist 3 months after operation. Results After transplantation of porcine islets, the serum C peptide elevated markedly, with high sensitivity to the glucose tolerance test(P=0.00133), the plasma glucose recovered normal gradually(P=0.00008), the dose of insulin showed decline(P=0.00589), 3 month after operation,the usage of insulin in 4 dogs could be ceased. The function of livers keep normal (P=0.34158). The pathologic examination showed ICC located in the interlobular artery of livers, the livers and kidneys of canines were not damaged. Conclusions The transplantation corrected the high plasma glucose level of canines with diabetes, and no evidence of adverse reaction was revealed.
, 百拇医药
【Key words】 Radiology, interventional Islets of langerhans transplantation Transplantation, heterologous Animals, laboratory
糖尿病是严重影响人民身体健康的世界公共卫生问题之一,内科药物治疗不能避免其产生严重的并发症。胰岛移植治疗糖尿病是有效的治疗方法,特别是胎猪和新生猪胰岛细胞经短期体外培养以后,抗原性很弱,是胰岛移植最有前途的供体来源。国内外对胰岛细胞移植的方法和移植的部位已有一些研究,但均存在一些问题尚待解决[1-4]。
我们自1997年7月至1998年9月对5只形成了Ⅰ型糖尿病模型的犬经肝动脉移植了分离、纯化后的新生猪胰岛细胞。目的是探讨经肝动脉肝内移植异种胰岛细胞能否发挥其生理功能,以及了解可能要发生的并发症,了解是否可能将介入治疗技术引入器官移植的领域。现将研究方法以及初步结果报道如下。
, 百拇医药
材料与方法
1. 实验动物:8~10 kg健康成年雄性犬5只,1~5日龄新生猪20头(雌、雄各半)。实验动物由湖南医科大学实验动物学部提供,均为合格动物。
2. 实验方法:(1) 糖尿病动物模型的制作[5]:8~10 kg[(8.9±1.6)kg]健康成年雄性犬经静脉注入四氧嘧啶(50mg/kg)(Alloxan,Sigma公司提供)及链脲霉素(30mg/kg)(Streptozotocin, Sigma公司提供)。每日测定血糖(Ⅱ型微量血糖计测定,美国强生公司产),血糖维持11.1mmol/L以上2周即认为已形成Ⅰ型糖尿病模型[6]。确定模型制作成功以后,每日肌肉注射短效胰岛素维持动物血糖在正常范围。每周作葡萄糖刺激试验一次(实验前停用胰岛素48小时)。(2) 猪胰岛细胞的分离、纯化和培养:出生2~5天的新生猪用戊巴比妥钠麻醉后,无菌状态下剖腹取胰,去除胰外组织、导管及结缔组织后剪成1mm3大小;用Ⅴ型胶原酶(CollagenaseⅤ,Sigma公司提供)充分消化后,移入含小牛血清的RPMI 1640液,置于5%CO2、95%空气、37℃细胞培养箱内培养;培养期间换培养液3~4次,去除残留的树突样细胞、血管内皮细胞和过路淋巴细胞。第5天作胰岛素释放试验,第7~8天在倒置显微镜下观察胰岛细胞形态,平板计数法计算胰岛细胞团的收获量,镜检胰岛细胞与其他细胞之比,以测量细胞纯度。(3) 体外胰岛细胞功能试验(胰岛素释放试验):用Hank液分别配制含2.7mmol/L葡萄糖的低糖培养液,16.5mmol/L葡萄糖的高糖培养液,含16.5mmol/L葡萄糖和10mmol/L茶碱的高糖+茶碱培养液。在细胞培养5天时用以上3种培养液分别置换原培养基,37℃孵育4小时后,分别收集培养液测定胰岛素含量(成都华西糖尿病科研所提供放射免疫药盒测定)。(4) 胰岛细胞的移植:经糖尿病犬的股动脉插入4F导管至肝固有动脉,以3ml/秒的注射速度(造影剂总量10ml)行肝动脉造影(图1);经导管缓慢注入培养7~12天的猪胰岛细胞。每只犬移植胰岛细胞(4~6)×105个。移植后每日测尿糖,48小时测量空腹血糖,每周测量葡萄糖刺激前后血清C肽浓度变化。移植以后动物不使用任何免疫抑制剂。(5) 动物的一般表现:测量动物的进食、活动情况,精神状态以及体重的变化。(6) 病理检查:实验动物喂养3个月后肝脏、肾脏和胰腺分别取标本进行病理切片检查,取样方法为多点取材(每个器官取10个点)。 标本切片采用HE染色。(7) 统计学方法:本研究统计数据均以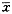 ±s表达,显著性检验的统计学方法使用配对设计的差值均数与总体均数比较的t检验。
±s表达,显著性检验的统计学方法使用配对设计的差值均数与总体均数比较的t检验。
, http://www.100md.com
结 果
1. 胰岛细胞形态学表现:倒置显微镜下胰岛细胞呈半透明、圆形,多数松散贴壁生长,少数悬浮于培养液中,有少量纤维细胞(图2)。培养7~10天以后,培养液中已经很难见到抗原性强、与排斥反应有密切关系的淋巴细胞、树突样细胞或血管内皮细胞。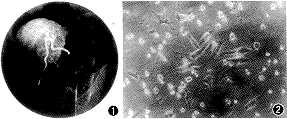
图1 经股动脉插入导管至犬肝动脉的肝内分支,作选择性血管造影
图2 倒置显微镜观察经7天原代培养的胰岛细胞,细胞密集,形态正常。未见树突状细胞、淋巴细胞、内皮细胞。胰岛细胞之间可见梭形成纤维细胞(HE ×10)
2. 分离和纯化后胰岛细胞的产量:本实验每次处理4只新生猪的胰腺[7],每次胰岛细胞团的收获量为(4~6)×105个,纯度为82%。
, 百拇医药
3. 胰岛素释放试验:本研究在体外对胰岛细胞进行功能检查,本组胰岛细胞对高糖和茶碱的刺激有明显反应,结果见表1。 表1 各组胰岛素释放试验结果比较 组别
样本数
胰岛素释放试验结果(mU/L)
均数(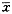 )
)
标准差(s)
低糖刺激
5
88.80
8.13
高糖刺激
, 百拇医药
5
150.80
10.33
高糖+茶碱刺激
5
237.18
9.38
2. 分离和纯化后胰岛细胞的产量:本实验每次处理4只新生猪的胰腺[7],每次胰岛细胞团的收获量为(4~6)×105个,纯度为82%。
3. 胰岛素释放试验:本研究在体外对胰岛细胞进行功能检查,本组胰岛细胞对高糖和茶碱的刺激有明显反应,结果见表1。 表1 各组胰岛素释放试验结果比较
, 百拇医药
空腹血糖
(mmol/L)
胰岛素用
量(U)
葡萄糖刺激试验前
后C肽水平差值
(刺激后30分钟)
丙氨酸转
氨酶(U)
移植前
22.7±3.2
21.4±2.4
, 百拇医药 20.5±11.8
21.58±7.21
移植3个月后
5.2±1.5
0.4±0.9
265.3±146.0
19.98±9.1
t值
6.59
3.25
4.29
0.34
, http://www.100md.com P值
0.0001
0.0059
0.0013
0.3416
注:本研究采用King法测定血清丙氨酸转氨酶
8. 动物一般表现:糖尿病模型形成以后,动物明显表现多饮、多食、多尿,体重减轻。肝内移植胰岛细胞以后以上症状逐步减轻,移植3~4周以后糖尿病症状基本消失,体重恢复到糖尿病模型形成以前。
9. 病理改变:实验动物无胸、腹水,肉眼观肝、肾形态无异常,脏器表面光滑,有光泽,未见结节状改变;光镜下在肝小叶间动脉内可见存活的胰岛细胞(图7,8),无肝纤维化征象(图9)。胰腺病理检查,光镜下显示胰岛萎缩、未见再生胰岛细胞,其外分泌腺结构正常(图10)。肾小球、肾小管以及肾间质细胞均未见异常。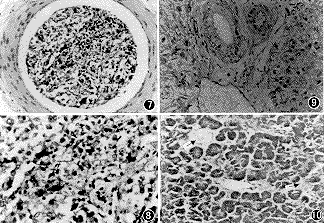
, http://www.100md.com
图7 犬肝内移植胰岛细胞以后的肝组织病理切片,示肝脏小叶间动脉内可见存活的胰岛细胞(HE ×10)
图8 所示为图7血管内胰岛细胞的放大图像(HE ×40),显示胰岛细胞呈圆形,胞浆丰富
图9 移植胰岛细胞以后犬肝组织病理切片(HE ×4),示肝小叶结构完整,肝细胞无坏死,汇管区未见纤维组织增生,未见炎性细胞浸润
图10 胰腺病理切片(HE ×10)示:显微镜下包括3个小叶未见正常胰岛,可见胰岛变性(↑)。胰腺外分泌腺部分无受累
讨 论
近年的研究证明,胰岛移植不仅能纠正糖尿病患者的糖代谢异常,更重要的是可以防止糖尿病微血管病变的发生发展,而这是药物治疗比较难以控制的。80年代我国胡远峰等[8]利用人胎胰腺分离胰岛细胞进行外科移植,取得一定的治疗效果,但受到胚胎供体不足以及人胚胰岛细胞难以及时分离培养而不能保证活性的限制。90年代以来关于来源不受限制的异种胰腺移植的研究越来越多,认为是有望解决器官移植供体缺乏这一棘手问题的方法之一[9-12]。抗原性低的猪胰岛细胞是异种移植最有希望的供体来源。其意义不仅可解决供体短缺的问题,Mandel等[13]认为在Ⅰ型糖尿病中移植猪胰岛细胞可能将避免移植人胰岛而招致的自身免疫攻击。
, 百拇医药
目前的研究认为植入胰岛的部位对移植后胰岛细胞的生理功能有明显影响,使用较多的移植部位有肾被膜下、骨骼肌、脾脏等,均不够理想[1,2,4]。Walsh等[3,14,15]研究经门静脉移植胰岛细胞,结果认为经该途径植入胰岛细胞比较拟合生理状态,对糖尿病控制的效果优于骨骼肌以及肾被膜下等移植部位,但经门静脉移植可能产生门静脉高压、肝梗死和肝功能衰竭等严重并发症。本研究选择经肝动脉肝内移植是考虑到以下原因:(1)肝脏为肝动脉和门静脉两路供血(以门静脉为主),通过肝动脉植入胰岛细胞不会明显影响肝脏功能和血流动力学特点,而植入的细胞团停留在血运丰富的肝组织内,有利于植入胰岛细胞的存活;(2)植入的胰岛细胞随血流进入肝窦或窦前肝血管内,而减少了手术或穿刺植入移植体周围形成纤维瘢痕的可能,有利于植入细胞的存活和功能的发挥;(3)肝脏是糖代谢的重要器官, 由于肝细胞与胰岛细胞在糖代谢方面相互影响,肝脏是胰岛素的重要靶器官,胰岛移植于肝内比较接近生理状态,有利于植入胰岛细胞生理功能的发挥;(4)肝脏作为相对免疫特许区[11],有利于移植细胞的存活。
, http://www.100md.com
本组实验结果说明,经过分离、培养和纯化以后的新生猪胰岛细胞经肝动脉肝内移植后,病理检查显示存活的胰岛细胞团(islets cell cluster,ICC)停留在肝窦前血管内,移植区域及其邻近组织和汇管区没有炎性细胞浸润;在未使用免疫抑制剂的情况下,没有出现超急性或急性免疫排斥反应。肝功能生化检查和肝、肾病理检查结果还表明:移植物对肾脏和肝脏没有明显损害,没有明显肝纤维化的征象。肝内移植ICC以后血清C肽增高,移植后的ICC对葡萄糖刺激试验反应敏感,在葡萄糖刺激15~30分钟出现明显分泌峰值,与移植以前的葡萄糖刺激试验的结果差别显著,说明植入胰岛接受宿主不同生理状态下的有效调节控制,在肝内保留了其内分泌的正常生理功能;移植后动物空腹血糖较移植前明显降低,胰岛素使用剂量明显减少,移植3个月时已有4只实验犬停止使用胰岛素,1只实验犬胰岛素剂量由移植前的每日23U下降至移植后的2U;血糖维持在正常水平,尿糖转阴。胰腺病理检查未发现胰岛再生现象,可确认以上C肽和血糖的改变是植入猪胰岛细胞的作用。
本组实验的结论认为:经肝动脉移植纯化后的新生猪胰岛细胞,可以使糖尿病异种动物模型在术后未使用任何免疫抑制剂的情况下,胰岛素用量逐渐降低,动物的高血糖状态逐步得到纠正,部分动物停用胰岛素以后可维持血糖正常。病理检查显示肝内移植异种胰岛细胞不发生肝脏、肾脏的解剖结构、生理、生化的异常。初步结果证明植入的异种胰岛细胞可以安全、有效地发挥其生理功能。
, http://www.100md.com
由于本实验的设计是为了确定经肝动脉肝内移植异种胰岛细胞能否发挥其生理功能,以及了解可能发生的并发症。因此,对于该方法与其他移植方法的比较,以及了解慢性排斥反应对植入胰岛细胞的作用等问题,尚待进一步的深入研究
本研究为国家自然科学基金资助项目,批准号:39770233
参考文献
1 Lacy PE, Davie JM, Finke EH, et al. Prolongation of islets allograft survival. Transplant, 1979,72:171-174.
2 Kretschiner GJ, Satherland DER, Matas AS, et al. Autotransplantation of pancreatic fragments to the portal vein and spleen of totally pancreatectomized dogs: a comparative evaluation. Ann Surg, 1978, 187:79-86.
, http://www.100md.com
3 Walsh TJ, Eggleston JC, Cameron JL, et al. Portal hypertensin, hepatic infarction, and liver failure complicating pancreatic islet autotransplantation. Surgery, 1982,91:485-487.
4 Gupta V, Cameron JL, Grotting C, et al. The defective glucagon response from transplanted intrahepatic pancreatic islets during hypoglycemia is transplantation-site determined. Diabetes, 1997,46:28-33.
5 Black HE, Rosenblum IY, Capen CC. Chemically induced (streptozocin-alloxan) diabetes mellitus in the dog. Am J Path, 1980, 98:295-305.
, http://www.100md.com
6 袁晖,李汝权,梁达晃, 等. 犬糖尿病模型制作和胰腺移植的实验. 中华器官移植杂志,1998,19:188.
7 胡远峰,欧异芳,张洪德, 等. 我国胰岛移植临床研究的现状. 中华器官移植杂志, 1988, 9:102-104.
8 胡远峰,张宏,张洪德, 等. 人胎儿胰腺组织培养和24例Ⅰ型糖尿病的胰岛移植研究报告. 中华器官移植杂志,1984,5: 113-117.
9 Davalli AM, Ogawa Y, Scaglia L, et al. Function, mass and replication of porcine and rat islets transplanted into diabetic nude mice. Diabetes, 1995,44:104-111.
10 Korsgren O, Sandler S, Landatron AS, et al. Lang-scale production of fetal porcine pancreatic islet-like cell clusters. Transplant, 1988,45:509-511.
, 百拇医药
11 Satske M, Kretschmer GJ. Xenotranplantation and xenoimmunity. Pathol Biol Paris, 1994, 42:209-213.
12 Anderson A, Groth CG, Korsgren O, et al. Transplantation of porcine fetal islet-like cell clusters to three diadetes patients. Transplant Proc, 1992, 24: 677-678.
13 Mandel TE, Watt PC, Mullen Y, et al. Islet grafts in NOD mice:a comparison of aso, allo, and pig Xenotransplantation. Transplant Proc, 1989, 21:3813-3817.
, http://www.100md.com
14 Warnock GL, Rajotte RV. Critical mass of purified islets that induce normoglycemia after implantation into dogs. Diabetes, 1988, 37: 467-470.
15 Matas AJ, Payne WD,Grotting JC, et al. Portal versus systemic transplantation of dispersed neonatal pancreas. Transplant, 1977, 24:333-337.
16 柳峰. 胰岛移植的进展(综述). 国外医学内分泌学分册, 1991, 4:188.
(收稿:1998-11-05 修回:1998-12-18), 百拇医药
单位:410013 长沙,湖南医科大学附属第三医院放射科(王维、罗贤明、刘晟、叶斌),病理科(杨元华)
关键词:放射学,介入性;胰岛移植;移植,异种;动物,实验
中华放射学杂志990305 【摘要】 目的 探讨经肝动脉异种肝内植入新生猪胰岛细胞的可行性,以及移植物生理功能和产生副反应的特点。方法 化学药物诱导法制作5只犬的糖尿病模型以后,将分离、纯化后的新生猪胰岛细胞经肝动脉植入糖尿病动物模型的肝内;测量移植前后胰岛素用量、血糖以及血清C肽水平和肝功能的变化,并对肝、肾进行病理检查。结果 移植以后血清C肽明显增高,对葡萄糖刺激试验反应敏感(P=0.0122);血糖逐步恢复正常(P=0.000015),胰岛素用量由移植前的每日(21.4±2.4)U减少至(0.4±0.9)U(P=0.000089),移植3个月后4只动物停用胰岛素;移植前后肝功能无明显变化(P=0.3728);病理检查各重要脏器基本正常。 结论 新生猪胰岛细胞经肝动脉植入犬糖尿病模型的肝脏以后,能纠正异种动物糖尿病模型的高血糖状态,没有明显副作用发生。
, 百拇医药
Transartery intrahepatic xenotransplantation of islets——an experimental therapy of diabetes WANG Wei, LUO Xiangming, LIU Shen, et al. Department of Radiology, the Third Affiliated Hospital, Hunan Medical University, Changsha 410013
【Abstract】 Objective To evaluate the physiologic features and probable adverse reactions of transartery intrahepatic xenotransplantation of newborn porcine islets. Methods 5 dogs were induced diabetic states with alloxan and streptozotocin, then were perfused (4~6)×105 porcine islets through the hepatic artery. The C peptide, glucose tolerance test, dose of insulin, function of livers of the dogs were measured before and after transplantation, samples of the livers, pancreases and kidneys were examined by pathologist 3 months after operation. Results After transplantation of porcine islets, the serum C peptide elevated markedly, with high sensitivity to the glucose tolerance test(P=0.00133), the plasma glucose recovered normal gradually(P=0.00008), the dose of insulin showed decline(P=0.00589), 3 month after operation,the usage of insulin in 4 dogs could be ceased. The function of livers keep normal (P=0.34158). The pathologic examination showed ICC located in the interlobular artery of livers, the livers and kidneys of canines were not damaged. Conclusions The transplantation corrected the high plasma glucose level of canines with diabetes, and no evidence of adverse reaction was revealed.
, 百拇医药
【Key words】 Radiology, interventional Islets of langerhans transplantation Transplantation, heterologous Animals, laboratory
糖尿病是严重影响人民身体健康的世界公共卫生问题之一,内科药物治疗不能避免其产生严重的并发症。胰岛移植治疗糖尿病是有效的治疗方法,特别是胎猪和新生猪胰岛细胞经短期体外培养以后,抗原性很弱,是胰岛移植最有前途的供体来源。国内外对胰岛细胞移植的方法和移植的部位已有一些研究,但均存在一些问题尚待解决[1-4]。
我们自1997年7月至1998年9月对5只形成了Ⅰ型糖尿病模型的犬经肝动脉移植了分离、纯化后的新生猪胰岛细胞。目的是探讨经肝动脉肝内移植异种胰岛细胞能否发挥其生理功能,以及了解可能要发生的并发症,了解是否可能将介入治疗技术引入器官移植的领域。现将研究方法以及初步结果报道如下。
, 百拇医药
材料与方法
1. 实验动物:8~10 kg健康成年雄性犬5只,1~5日龄新生猪20头(雌、雄各半)。实验动物由湖南医科大学实验动物学部提供,均为合格动物。
2. 实验方法:(1) 糖尿病动物模型的制作[5]:8~10 kg[(8.9±1.6)kg]健康成年雄性犬经静脉注入四氧嘧啶(50mg/kg)(Alloxan,Sigma公司提供)及链脲霉素(30mg/kg)(Streptozotocin, Sigma公司提供)。每日测定血糖(Ⅱ型微量血糖计测定,美国强生公司产),血糖维持11.1mmol/L以上2周即认为已形成Ⅰ型糖尿病模型[6]。确定模型制作成功以后,每日肌肉注射短效胰岛素维持动物血糖在正常范围。每周作葡萄糖刺激试验一次(实验前停用胰岛素48小时)。(2) 猪胰岛细胞的分离、纯化和培养:出生2~5天的新生猪用戊巴比妥钠麻醉后,无菌状态下剖腹取胰,去除胰外组织、导管及结缔组织后剪成1mm3大小;用Ⅴ型胶原酶(CollagenaseⅤ,Sigma公司提供)充分消化后,移入含小牛血清的RPMI 1640液,置于5%CO2、95%空气、37℃细胞培养箱内培养;培养期间换培养液3~4次,去除残留的树突样细胞、血管内皮细胞和过路淋巴细胞。第5天作胰岛素释放试验,第7~8天在倒置显微镜下观察胰岛细胞形态,平板计数法计算胰岛细胞团的收获量,镜检胰岛细胞与其他细胞之比,以测量细胞纯度。(3) 体外胰岛细胞功能试验(胰岛素释放试验):用Hank液分别配制含2.7mmol/L葡萄糖的低糖培养液,16.5mmol/L葡萄糖的高糖培养液,含16.5mmol/L葡萄糖和10mmol/L茶碱的高糖+茶碱培养液。在细胞培养5天时用以上3种培养液分别置换原培养基,37℃孵育4小时后,分别收集培养液测定胰岛素含量(成都华西糖尿病科研所提供放射免疫药盒测定)。(4) 胰岛细胞的移植:经糖尿病犬的股动脉插入4F导管至肝固有动脉,以3ml/秒的注射速度(造影剂总量10ml)行肝动脉造影(图1);经导管缓慢注入培养7~12天的猪胰岛细胞。每只犬移植胰岛细胞(4~6)×105个。移植后每日测尿糖,48小时测量空腹血糖,每周测量葡萄糖刺激前后血清C肽浓度变化。移植以后动物不使用任何免疫抑制剂。(5) 动物的一般表现:测量动物的进食、活动情况,精神状态以及体重的变化。(6) 病理检查:实验动物喂养3个月后肝脏、肾脏和胰腺分别取标本进行病理切片检查,取样方法为多点取材(每个器官取10个点)。 标本切片采用HE染色。(7) 统计学方法:本研究统计数据均以
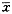 ±s表达,显著性检验的统计学方法使用配对设计的差值均数与总体均数比较的t检验。
±s表达,显著性检验的统计学方法使用配对设计的差值均数与总体均数比较的t检验。, http://www.100md.com
结 果
1. 胰岛细胞形态学表现:倒置显微镜下胰岛细胞呈半透明、圆形,多数松散贴壁生长,少数悬浮于培养液中,有少量纤维细胞(图2)。培养7~10天以后,培养液中已经很难见到抗原性强、与排斥反应有密切关系的淋巴细胞、树突样细胞或血管内皮细胞。

图1 经股动脉插入导管至犬肝动脉的肝内分支,作选择性血管造影
图2 倒置显微镜观察经7天原代培养的胰岛细胞,细胞密集,形态正常。未见树突状细胞、淋巴细胞、内皮细胞。胰岛细胞之间可见梭形成纤维细胞(HE ×10)
2. 分离和纯化后胰岛细胞的产量:本实验每次处理4只新生猪的胰腺[7],每次胰岛细胞团的收获量为(4~6)×105个,纯度为82%。
, 百拇医药
3. 胰岛素释放试验:本研究在体外对胰岛细胞进行功能检查,本组胰岛细胞对高糖和茶碱的刺激有明显反应,结果见表1。 表1 各组胰岛素释放试验结果比较 组别
样本数
胰岛素释放试验结果(mU/L)
均数(
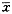 )
)标准差(s)
低糖刺激
5
88.80
8.13
高糖刺激
, 百拇医药
5
150.80
10.33
高糖+茶碱刺激
5
237.18
9.38
2. 分离和纯化后胰岛细胞的产量:本实验每次处理4只新生猪的胰腺[7],每次胰岛细胞团的收获量为(4~6)×105个,纯度为82%。
3. 胰岛素释放试验:本研究在体外对胰岛细胞进行功能检查,本组胰岛细胞对高糖和茶碱的刺激有明显反应,结果见表1。 表1 各组胰岛素释放试验结果比较
, 百拇医药
空腹血糖
(mmol/L)
胰岛素用
量(U)
葡萄糖刺激试验前
后C肽水平差值
(刺激后30分钟)
丙氨酸转
氨酶(U)
移植前
22.7±3.2
21.4±2.4
, 百拇医药 20.5±11.8
21.58±7.21
移植3个月后
5.2±1.5
0.4±0.9
265.3±146.0
19.98±9.1
t值
6.59
3.25
4.29
0.34
, http://www.100md.com P值
0.0001
0.0059
0.0013
0.3416
注:本研究采用King法测定血清丙氨酸转氨酶
8. 动物一般表现:糖尿病模型形成以后,动物明显表现多饮、多食、多尿,体重减轻。肝内移植胰岛细胞以后以上症状逐步减轻,移植3~4周以后糖尿病症状基本消失,体重恢复到糖尿病模型形成以前。
9. 病理改变:实验动物无胸、腹水,肉眼观肝、肾形态无异常,脏器表面光滑,有光泽,未见结节状改变;光镜下在肝小叶间动脉内可见存活的胰岛细胞(图7,8),无肝纤维化征象(图9)。胰腺病理检查,光镜下显示胰岛萎缩、未见再生胰岛细胞,其外分泌腺结构正常(图10)。肾小球、肾小管以及肾间质细胞均未见异常。

, http://www.100md.com
图7 犬肝内移植胰岛细胞以后的肝组织病理切片,示肝脏小叶间动脉内可见存活的胰岛细胞(HE ×10)
图8 所示为图7血管内胰岛细胞的放大图像(HE ×40),显示胰岛细胞呈圆形,胞浆丰富
图9 移植胰岛细胞以后犬肝组织病理切片(HE ×4),示肝小叶结构完整,肝细胞无坏死,汇管区未见纤维组织增生,未见炎性细胞浸润
图10 胰腺病理切片(HE ×10)示:显微镜下包括3个小叶未见正常胰岛,可见胰岛变性(↑)。胰腺外分泌腺部分无受累
讨 论
近年的研究证明,胰岛移植不仅能纠正糖尿病患者的糖代谢异常,更重要的是可以防止糖尿病微血管病变的发生发展,而这是药物治疗比较难以控制的。80年代我国胡远峰等[8]利用人胎胰腺分离胰岛细胞进行外科移植,取得一定的治疗效果,但受到胚胎供体不足以及人胚胰岛细胞难以及时分离培养而不能保证活性的限制。90年代以来关于来源不受限制的异种胰腺移植的研究越来越多,认为是有望解决器官移植供体缺乏这一棘手问题的方法之一[9-12]。抗原性低的猪胰岛细胞是异种移植最有希望的供体来源。其意义不仅可解决供体短缺的问题,Mandel等[13]认为在Ⅰ型糖尿病中移植猪胰岛细胞可能将避免移植人胰岛而招致的自身免疫攻击。
, 百拇医药
目前的研究认为植入胰岛的部位对移植后胰岛细胞的生理功能有明显影响,使用较多的移植部位有肾被膜下、骨骼肌、脾脏等,均不够理想[1,2,4]。Walsh等[3,14,15]研究经门静脉移植胰岛细胞,结果认为经该途径植入胰岛细胞比较拟合生理状态,对糖尿病控制的效果优于骨骼肌以及肾被膜下等移植部位,但经门静脉移植可能产生门静脉高压、肝梗死和肝功能衰竭等严重并发症。本研究选择经肝动脉肝内移植是考虑到以下原因:(1)肝脏为肝动脉和门静脉两路供血(以门静脉为主),通过肝动脉植入胰岛细胞不会明显影响肝脏功能和血流动力学特点,而植入的细胞团停留在血运丰富的肝组织内,有利于植入胰岛细胞的存活;(2)植入的胰岛细胞随血流进入肝窦或窦前肝血管内,而减少了手术或穿刺植入移植体周围形成纤维瘢痕的可能,有利于植入细胞的存活和功能的发挥;(3)肝脏是糖代谢的重要器官, 由于肝细胞与胰岛细胞在糖代谢方面相互影响,肝脏是胰岛素的重要靶器官,胰岛移植于肝内比较接近生理状态,有利于植入胰岛细胞生理功能的发挥;(4)肝脏作为相对免疫特许区[11],有利于移植细胞的存活。
, http://www.100md.com
本组实验结果说明,经过分离、培养和纯化以后的新生猪胰岛细胞经肝动脉肝内移植后,病理检查显示存活的胰岛细胞团(islets cell cluster,ICC)停留在肝窦前血管内,移植区域及其邻近组织和汇管区没有炎性细胞浸润;在未使用免疫抑制剂的情况下,没有出现超急性或急性免疫排斥反应。肝功能生化检查和肝、肾病理检查结果还表明:移植物对肾脏和肝脏没有明显损害,没有明显肝纤维化的征象。肝内移植ICC以后血清C肽增高,移植后的ICC对葡萄糖刺激试验反应敏感,在葡萄糖刺激15~30分钟出现明显分泌峰值,与移植以前的葡萄糖刺激试验的结果差别显著,说明植入胰岛接受宿主不同生理状态下的有效调节控制,在肝内保留了其内分泌的正常生理功能;移植后动物空腹血糖较移植前明显降低,胰岛素使用剂量明显减少,移植3个月时已有4只实验犬停止使用胰岛素,1只实验犬胰岛素剂量由移植前的每日23U下降至移植后的2U;血糖维持在正常水平,尿糖转阴。胰腺病理检查未发现胰岛再生现象,可确认以上C肽和血糖的改变是植入猪胰岛细胞的作用。
本组实验的结论认为:经肝动脉移植纯化后的新生猪胰岛细胞,可以使糖尿病异种动物模型在术后未使用任何免疫抑制剂的情况下,胰岛素用量逐渐降低,动物的高血糖状态逐步得到纠正,部分动物停用胰岛素以后可维持血糖正常。病理检查显示肝内移植异种胰岛细胞不发生肝脏、肾脏的解剖结构、生理、生化的异常。初步结果证明植入的异种胰岛细胞可以安全、有效地发挥其生理功能。
, http://www.100md.com
由于本实验的设计是为了确定经肝动脉肝内移植异种胰岛细胞能否发挥其生理功能,以及了解可能发生的并发症。因此,对于该方法与其他移植方法的比较,以及了解慢性排斥反应对植入胰岛细胞的作用等问题,尚待进一步的深入研究
本研究为国家自然科学基金资助项目,批准号:39770233
参考文献
1 Lacy PE, Davie JM, Finke EH, et al. Prolongation of islets allograft survival. Transplant, 1979,72:171-174.
2 Kretschiner GJ, Satherland DER, Matas AS, et al. Autotransplantation of pancreatic fragments to the portal vein and spleen of totally pancreatectomized dogs: a comparative evaluation. Ann Surg, 1978, 187:79-86.
, http://www.100md.com
3 Walsh TJ, Eggleston JC, Cameron JL, et al. Portal hypertensin, hepatic infarction, and liver failure complicating pancreatic islet autotransplantation. Surgery, 1982,91:485-487.
4 Gupta V, Cameron JL, Grotting C, et al. The defective glucagon response from transplanted intrahepatic pancreatic islets during hypoglycemia is transplantation-site determined. Diabetes, 1997,46:28-33.
5 Black HE, Rosenblum IY, Capen CC. Chemically induced (streptozocin-alloxan) diabetes mellitus in the dog. Am J Path, 1980, 98:295-305.
, http://www.100md.com
6 袁晖,李汝权,梁达晃, 等. 犬糖尿病模型制作和胰腺移植的实验. 中华器官移植杂志,1998,19:188.
7 胡远峰,欧异芳,张洪德, 等. 我国胰岛移植临床研究的现状. 中华器官移植杂志, 1988, 9:102-104.
8 胡远峰,张宏,张洪德, 等. 人胎儿胰腺组织培养和24例Ⅰ型糖尿病的胰岛移植研究报告. 中华器官移植杂志,1984,5: 113-117.
9 Davalli AM, Ogawa Y, Scaglia L, et al. Function, mass and replication of porcine and rat islets transplanted into diabetic nude mice. Diabetes, 1995,44:104-111.
10 Korsgren O, Sandler S, Landatron AS, et al. Lang-scale production of fetal porcine pancreatic islet-like cell clusters. Transplant, 1988,45:509-511.
, 百拇医药
11 Satske M, Kretschmer GJ. Xenotranplantation and xenoimmunity. Pathol Biol Paris, 1994, 42:209-213.
12 Anderson A, Groth CG, Korsgren O, et al. Transplantation of porcine fetal islet-like cell clusters to three diadetes patients. Transplant Proc, 1992, 24: 677-678.
13 Mandel TE, Watt PC, Mullen Y, et al. Islet grafts in NOD mice:a comparison of aso, allo, and pig Xenotransplantation. Transplant Proc, 1989, 21:3813-3817.
, http://www.100md.com
14 Warnock GL, Rajotte RV. Critical mass of purified islets that induce normoglycemia after implantation into dogs. Diabetes, 1988, 37: 467-470.
15 Matas AJ, Payne WD,Grotting JC, et al. Portal versus systemic transplantation of dispersed neonatal pancreas. Transplant, 1977, 24:333-337.
16 柳峰. 胰岛移植的进展(综述). 国外医学内分泌学分册, 1991, 4:188.
(收稿:1998-11-05 修回:1998-12-18), 百拇医药