原癌基因c-jun、c-fos在早孕绒毛及蜕膜中的表达
作者:朱瑾 周剑萍 刘银坤 张俊慧 吴欣
单位:200011 上海医科大学妇产科医院(朱瑾,周剑萍,张俊慧);中山医院肝癌研究所(刘银坤,吴欣)
关键词:
中华妇产科杂志980417 原癌基因是一类编码关键性调控蛋白的正常细胞基因,在正常情况下c-jun、c-fos基因不表达或只有有限表达,当受到理化等因素作用而活化时,它们可以异常表达,导致细胞的增殖、分化或癌变。胚泡着床是一个复杂而精密的调控过程,胚泡着床前后能分泌产生大量的雌、孕激素及生长因子等,而这些激素与生物活性物质共同能诱导c-jun、c-fos基因的表达。Mercola[1]发现,在胚泡着床前后胚胎和子宫组织有大量的生长因子及其受体转录的证据,并证实了它们与c-fos基因表达的相关性。以往对原癌基因c-jun、c-fos的研究着重于它们在肿瘤发生、发展中的作用,而对胚泡着床前后的表达研究较少。我们通过研究人分泌期子宫内膜与早孕期不同孕周蜕膜与绒毛c-jun、c-fos的表达,探讨原癌基因与胚泡着床的关系。
, http://www.100md.com
一、资料与方法
1.材料来源:正常分泌期子宫内膜来源于本院(1996年7月~1996年12月)5例正常育龄妇女,年龄25~35岁,月经周期28~30天,于月经周期第21~28天门诊刮宫取得的子宫内膜,并由病理检查证实为分泌期。孕早期的绒毛、蜕膜选择来我院要求行人工流产术者15例,年龄23~30岁,月经周期28~30天。分别于孕35天、42天、49天刮宫取绒毛和蜕膜,每组5例。以上各组术前3个月内均未使用过激素类药物。
2.方法:(1)总RNA的提取:组织10~20 mg,用TRIzol(Gibco, BRL公司)提取制备总RNA。70℃热变性后,取产物1 μg行甲醛变性凝胶电泳分析,见到18S、28S的条带,并用紫外分光光度计测定RNA OD260与OD280的值,计算出总RNA的浓度。(2)RT-PCR:将4μg的RNA溶液,加1×10-3U/L RNAsin, 0.01μg/L的oligod T12~18,2mmol dNTP,10UAMV逆转录酶,加水至总体积为20 μl,42℃合成cDNA第一链。取cDNA溶液6μl,依次加入0.4μmol的两条引物,10×Tag酶反应缓冲液,6μl Tag酶,并加水至总体积50μl,扩增条件为:变性温度:95℃,1分钟;退火温度:55℃(c-fos为60℃),1分钟;延伸温度:72℃,1分30秒,循环数为35。(3)扩增产物的定性和半定量分析:扩增产物用Qiagen公司生产的DNA快速纯化回收试剂盒回收,用两种特异性限制性内切酶分别对c-jun、c-fos基因切割并进行定性分析。扩增产物经1.5%琼脂糖凝胶电泳后,在Pharmaciabiotech扫描系统下扫描,比较各组信号强度,并以c-jun、c-fos mRNA表达的强度和管家基因β-actin的强度的比值来计算mRNA表达量的变化。(4)统计处理:计算出每组数据的平均值和标准差,进行t检验以比较不同组数据之间的差异。
, 百拇医药
二、结果
经1.5%琼脂糖凝胶电泳分析,c-jun、c-fos,β-actin的RT-PCR产物和理论长度一致。c-jun、c-fos活性酶切后的片段和预先设计片段长度一致,证明为c-jun、c-fos的片段。
半定量分析结果表明,正常分泌期子宫内膜有一定c-jun、c-fos的RNA的表达,其较β-actin的表达水平要低。妊娠35天的绒毛、蜕膜c-jun、c-fos的RNA表达有升高,并且和正常内膜组相比,差异有显著性(P<0.001)。随着妊娠的继续,妊娠42天绒毛、蜕膜c-jun、c-fos的RNA表达水平较35天时有所下降,且差异有极显著性(P<0.001)。同样49天时的表达水平较42天又有明显下降(P<0.001),但仍高于正常内膜的表达水平。见表1,2。
三、讨论
结果表明,正常的分泌期内膜有一定的c-jun、c-fos基因的表达,胚泡着床后,早孕35天绒毛、蜕膜c-jun、c-fos基因mRNA表达较正常内膜明显增加,这和胚泡着床前后分泌产生的大量雌、孕激素、生长因子对c-jun、c-fos表达的影响有关[2],它们调节c-jun、c-fos基因的转录机理可能是通过Activator protein-1,(AP-1)与激素核受体相互作用而实现的[3,4]。AP-1能与特定的DNA序列结合,从而调节c-jun、c-fos及其它基因的转录。现在已经在c-fos的编码区内发现了一段雌激素依赖的增强子顺序GCAGAnnnTGACC[5],对其结构功能研究表明,TGACC序列与雌激素受体结合有关。
, http://www.100md.com
表1 原癌基因c-jun、c-fos在正常内膜、早孕绒毛中的表达(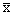 ±s) 类别
±s) 类别
c-fos
c-jun
正常内膜
0.714±0.020
0.524±0.020
35天绒毛
2.710±0.113
2.024±0.099
42天绒毛
, 百拇医药
1.040±0.029
2.026±0.065
49天绒毛
0.905±0.012
1.677±0.039
表2 原癌基因c-jun、c-fos在正常内膜、早孕蜕膜中的表达(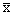 ±s) 类别
±s) 类别
c-fos
c-jun
正常内膜
0.714±0.020
, http://www.100md.com
0.524±0.020
35天蜕膜
2.493±0.050
2.325±0.091
42天蜕膜
2.096±0.066
1.749±0.052
49天蜕膜
1.303±0.013
0.666±0.013
随着妊娠的继续,早孕35天、42天、49天绒毛、蜕膜c-jun、c-fos表达出现下降趋势,这可能和着床部位局部内环境的改变以及雌、孕激素水平的改变有关。Parr等[6]报道,小鼠孕卵着床开始后,着床部位附近的子宫上皮细胞因受到胚泡的挤压以致缺氧和受到胚泡分泌的某些信号的刺激而发生程序性死亡。另外,Vu Hai[7]报道,小鼠孕卵着床开始后,E2水平下降,一方面可能给胚泡植入提供一个相对稳定的环境;另一方面,伴随着孕酮的分泌,子宫的孕激素受体有一高峰。这些都证实了孕35天、42天、49天绒毛蜕膜c-jun、c-fos表达的下降趋势和雌、孕激素水平的改变有关,雌、孕激素水平的改变,不仅削弱了雌激素与AP-1结合促进c-jun、c-fos表达增强的作用,而且增强了孕激素受体与AP-1结合抑制基因转录的作用。
, http://www.100md.com
人的胚泡着床发生在月经周期的第21天,我们难以收集到较孕35天更早的子宫内膜,所以不能确切提出c-jun、c-fos表达的高峰,但是根据动物实验报道及本研究结果,可以推测高峰发生在35天以前,并提示c-jun、c-fos基因与胚泡着床及其早期分化有关。参考文献
1 Mercola M. Growth factor super families and mammalian embryogenesis development. Stiles CD, 1988, 102:451-460.
2 Sherman ML, Datta R, Hallahan DE. Ionizing radiation regulates expression of the c-jun protooncogene. Proc Natl Acad Sci USA, 1990, 87:5663-5670.
3 Bruggemeier Y, Rogge L, Winnacker EL, et al. Nuclear factor I acts as a transcription factor on the MMTV. EMBO J, 1990, 9:2233.
, 百拇医药
4 Gaub MP, Bellard M, Schever I, et al. Activation of the gene by the estrogen receptor involves the fos-jun comples. Cell, 1990, 63:1267.
5 Hyder SM, Stancel GM, Loose-Mitchell DS, et al. Presence of an estrodiol response region in the mouse-fos oncogene. Steroid, 1991, 56, 498-504.
6 Parr EL, Tung HN, Parr MB, et al. Apoptosis as the mode of uterine epithelial cell death during embryo implantation in mice and rats. Biol, 1987, 36:211.
7 Vu Hai MT. Progesterone receptors in the rat uterus: Variation in cytosol and nucler during the oestrous cycle and pregnancy. J Ensocrinol, 1987, 76:43.
(收稿:1997-07-03 修回:1998-01-07), http://www.100md.com
单位:200011 上海医科大学妇产科医院(朱瑾,周剑萍,张俊慧);中山医院肝癌研究所(刘银坤,吴欣)
关键词:
中华妇产科杂志980417 原癌基因是一类编码关键性调控蛋白的正常细胞基因,在正常情况下c-jun、c-fos基因不表达或只有有限表达,当受到理化等因素作用而活化时,它们可以异常表达,导致细胞的增殖、分化或癌变。胚泡着床是一个复杂而精密的调控过程,胚泡着床前后能分泌产生大量的雌、孕激素及生长因子等,而这些激素与生物活性物质共同能诱导c-jun、c-fos基因的表达。Mercola[1]发现,在胚泡着床前后胚胎和子宫组织有大量的生长因子及其受体转录的证据,并证实了它们与c-fos基因表达的相关性。以往对原癌基因c-jun、c-fos的研究着重于它们在肿瘤发生、发展中的作用,而对胚泡着床前后的表达研究较少。我们通过研究人分泌期子宫内膜与早孕期不同孕周蜕膜与绒毛c-jun、c-fos的表达,探讨原癌基因与胚泡着床的关系。
, http://www.100md.com
一、资料与方法
1.材料来源:正常分泌期子宫内膜来源于本院(1996年7月~1996年12月)5例正常育龄妇女,年龄25~35岁,月经周期28~30天,于月经周期第21~28天门诊刮宫取得的子宫内膜,并由病理检查证实为分泌期。孕早期的绒毛、蜕膜选择来我院要求行人工流产术者15例,年龄23~30岁,月经周期28~30天。分别于孕35天、42天、49天刮宫取绒毛和蜕膜,每组5例。以上各组术前3个月内均未使用过激素类药物。
2.方法:(1)总RNA的提取:组织10~20 mg,用TRIzol(Gibco, BRL公司)提取制备总RNA。70℃热变性后,取产物1 μg行甲醛变性凝胶电泳分析,见到18S、28S的条带,并用紫外分光光度计测定RNA OD260与OD280的值,计算出总RNA的浓度。(2)RT-PCR:将4μg的RNA溶液,加1×10-3U/L RNAsin, 0.01μg/L的oligod T12~18,2mmol dNTP,10UAMV逆转录酶,加水至总体积为20 μl,42℃合成cDNA第一链。取cDNA溶液6μl,依次加入0.4μmol的两条引物,10×Tag酶反应缓冲液,6μl Tag酶,并加水至总体积50μl,扩增条件为:变性温度:95℃,1分钟;退火温度:55℃(c-fos为60℃),1分钟;延伸温度:72℃,1分30秒,循环数为35。(3)扩增产物的定性和半定量分析:扩增产物用Qiagen公司生产的DNA快速纯化回收试剂盒回收,用两种特异性限制性内切酶分别对c-jun、c-fos基因切割并进行定性分析。扩增产物经1.5%琼脂糖凝胶电泳后,在Pharmaciabiotech扫描系统下扫描,比较各组信号强度,并以c-jun、c-fos mRNA表达的强度和管家基因β-actin的强度的比值来计算mRNA表达量的变化。(4)统计处理:计算出每组数据的平均值和标准差,进行t检验以比较不同组数据之间的差异。
, 百拇医药
二、结果
经1.5%琼脂糖凝胶电泳分析,c-jun、c-fos,β-actin的RT-PCR产物和理论长度一致。c-jun、c-fos活性酶切后的片段和预先设计片段长度一致,证明为c-jun、c-fos的片段。
半定量分析结果表明,正常分泌期子宫内膜有一定c-jun、c-fos的RNA的表达,其较β-actin的表达水平要低。妊娠35天的绒毛、蜕膜c-jun、c-fos的RNA表达有升高,并且和正常内膜组相比,差异有显著性(P<0.001)。随着妊娠的继续,妊娠42天绒毛、蜕膜c-jun、c-fos的RNA表达水平较35天时有所下降,且差异有极显著性(P<0.001)。同样49天时的表达水平较42天又有明显下降(P<0.001),但仍高于正常内膜的表达水平。见表1,2。
三、讨论
结果表明,正常的分泌期内膜有一定的c-jun、c-fos基因的表达,胚泡着床后,早孕35天绒毛、蜕膜c-jun、c-fos基因mRNA表达较正常内膜明显增加,这和胚泡着床前后分泌产生的大量雌、孕激素、生长因子对c-jun、c-fos表达的影响有关[2],它们调节c-jun、c-fos基因的转录机理可能是通过Activator protein-1,(AP-1)与激素核受体相互作用而实现的[3,4]。AP-1能与特定的DNA序列结合,从而调节c-jun、c-fos及其它基因的转录。现在已经在c-fos的编码区内发现了一段雌激素依赖的增强子顺序GCAGAnnnTGACC[5],对其结构功能研究表明,TGACC序列与雌激素受体结合有关。
, http://www.100md.com
表1 原癌基因c-jun、c-fos在正常内膜、早孕绒毛中的表达(
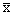 ±s) 类别
±s) 类别c-fos
c-jun
正常内膜
0.714±0.020
0.524±0.020
35天绒毛
2.710±0.113
2.024±0.099
42天绒毛
, 百拇医药
1.040±0.029
2.026±0.065
49天绒毛
0.905±0.012
1.677±0.039
表2 原癌基因c-jun、c-fos在正常内膜、早孕蜕膜中的表达(
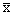 ±s) 类别
±s) 类别c-fos
c-jun
正常内膜
0.714±0.020
, http://www.100md.com
0.524±0.020
35天蜕膜
2.493±0.050
2.325±0.091
42天蜕膜
2.096±0.066
1.749±0.052
49天蜕膜
1.303±0.013
0.666±0.013
随着妊娠的继续,早孕35天、42天、49天绒毛、蜕膜c-jun、c-fos表达出现下降趋势,这可能和着床部位局部内环境的改变以及雌、孕激素水平的改变有关。Parr等[6]报道,小鼠孕卵着床开始后,着床部位附近的子宫上皮细胞因受到胚泡的挤压以致缺氧和受到胚泡分泌的某些信号的刺激而发生程序性死亡。另外,Vu Hai[7]报道,小鼠孕卵着床开始后,E2水平下降,一方面可能给胚泡植入提供一个相对稳定的环境;另一方面,伴随着孕酮的分泌,子宫的孕激素受体有一高峰。这些都证实了孕35天、42天、49天绒毛蜕膜c-jun、c-fos表达的下降趋势和雌、孕激素水平的改变有关,雌、孕激素水平的改变,不仅削弱了雌激素与AP-1结合促进c-jun、c-fos表达增强的作用,而且增强了孕激素受体与AP-1结合抑制基因转录的作用。
, http://www.100md.com
人的胚泡着床发生在月经周期的第21天,我们难以收集到较孕35天更早的子宫内膜,所以不能确切提出c-jun、c-fos表达的高峰,但是根据动物实验报道及本研究结果,可以推测高峰发生在35天以前,并提示c-jun、c-fos基因与胚泡着床及其早期分化有关。参考文献
1 Mercola M. Growth factor super families and mammalian embryogenesis development. Stiles CD, 1988, 102:451-460.
2 Sherman ML, Datta R, Hallahan DE. Ionizing radiation regulates expression of the c-jun protooncogene. Proc Natl Acad Sci USA, 1990, 87:5663-5670.
3 Bruggemeier Y, Rogge L, Winnacker EL, et al. Nuclear factor I acts as a transcription factor on the MMTV. EMBO J, 1990, 9:2233.
, 百拇医药
4 Gaub MP, Bellard M, Schever I, et al. Activation of the gene by the estrogen receptor involves the fos-jun comples. Cell, 1990, 63:1267.
5 Hyder SM, Stancel GM, Loose-Mitchell DS, et al. Presence of an estrodiol response region in the mouse-fos oncogene. Steroid, 1991, 56, 498-504.
6 Parr EL, Tung HN, Parr MB, et al. Apoptosis as the mode of uterine epithelial cell death during embryo implantation in mice and rats. Biol, 1987, 36:211.
7 Vu Hai MT. Progesterone receptors in the rat uterus: Variation in cytosol and nucler during the oestrous cycle and pregnancy. J Ensocrinol, 1987, 76:43.
(收稿:1997-07-03 修回:1998-01-07), http://www.100md.com