粒细胞集落刺激因子对人卵巢癌细胞株生长的影响
作者:吴楠 崔恒 钱和年 冯捷 李蔚范 傅天云 李小平 葛华
单位:100034 北京医科大学人民医院妇科肿瘤中心[吴楠(现在北京军区总医院妇产科),崔恒,钱和年,冯捷,李蔚范,傅天云,李小平,葛华]
关键词:卵巢肿瘤;细胞系;粒细胞集落刺激因子;受体;粒细胞集落刺激因子
中华妇产科杂志990313 【摘要】 目的 了解粒细胞集落刺激因子(G-CSF)对人卵巢癌细胞株生长的影响。方法 采用XTT比色法,检测G-CSF对卵巢癌细胞株SKOV3、3AO及CAOV3生长的影响;对有影响的细胞株进行流式细胞仪检测和G-CSF受体的检测,观察外源性G-CSF对该细胞株的裸鼠皮下瘤生长的影响。结果 XTT法检测G-CSF对3AO及CAOV3细胞生长无显著影响;SKOV3细胞在G-CSF浓度分别为100ng/ml 、1 000ng/ml时,吸光度较对照分别增高3.4%和4.8%。流式细胞仪检测未发现G-CSF对SKOV3细胞的各周期细胞比例有显著性影响。逆转录聚合酶链反应检测SKOV3细胞G-CSF受体mRNA为阴性。外源性G-CSF对裸鼠SKOV3细胞皮下瘤生长也未发现显著性影响。结论 G-CSF对所检测的卵巢癌细胞株生长无显著影响。
, http://www.100md.com
The Growth Effect of Granulocyte Colony-stimulating Factors on Ovarian Carcinoma Cell Lines WU Nan*, CUI Heng, QIAN Henian, et al. General Hospital of Beijing Military Area, Beijing 100700
【Abstract】 Objective To evaluate the growth effects of granulocyte colony-stimulating factors (G-CSF) on ovarian carcinoma cell lines. Methods We investigated the possible growth effects of G-CSF on three ovarian carcinoma cell lines (SKOV3, 3AO, and CAOV3). Cell proliferation and viability was measured by XTT colorimetric assay. Flow cytometer (FCM) and G-CSF receptor mRNA were measured for response cell lines, the response cell lines were xenotransplanted into athymic mice, to investigated in vivo growth under systemic subcutaneous infusion of G-CSF.Results G-CSF showed no growth-stimulating effects in 3AO and CAOV3 cell lines. In SKOV3, an increase in growth (<5%) was seen by XTT assay at 100ng/ml and 1000ng/ml after 24 hours treatment, but no significant proliferation was observed by FCM. No G-CSF receptor mRNA was detected by RT-polymerase chain reaction, and no significant alteration of the tumor growth was by G-CSF. Conclusion Although, the above results suggest that G-CSF may act as growth factors in a few ovarian carcinoma cell lines, yet the worry about tumor growth stimulation by G-CSF as potential hazards for their clinical application in ovarian carcinoma patients as an adjuvant with cytotoxic chemotherapy is not necessary.
, http://www.100md.com
【Key words】 Ovarian neoplasms Cell lines Granulocyte colony-stimulating factor Receptor,granulocyte colony-stimulating factor
目前,粒细胞集落刺激因子(G-CSF)已广泛应用于卵巢癌化疗所致粒细胞减少症的预防及治疗。然而,一些体外实验的报告显示[1-3],G-CSF对某些卵巢癌细胞株及原代培养卵巢癌细胞的生长有促进增殖作用。本实验采用XTT比色法,检测G-CSF对卵巢癌细胞株SKOV3、3AO及CAOV3细胞生长的影响,并对有反应的细胞株进行进一步的研究,以期从多个层次、较全面的反映G-CSF对卵巢癌细胞株生长的影响。
材料和方法
一、主要材料
, http://www.100md.com
1.试剂与仪器:G-CSF为日本麒麟啤酒株式会社惠赠;XTT、碘化丙锭(PI)均为美国Sigma公司产品;硫酸酚嗪甲脂(PMS)为瑞士Fluka公司产品;mRNA快速提取试剂盒为瑞典Pharmacia公司产品;逆转录聚合酶链反应(RT-PCR)试剂盒为北方同正公司产品。酶联分析仪为美国BIO-RAD公司生产的Model 550;流式细胞仪为美国Becton Dickinson公司生产的FACSTAR。
2.实验材料:卵巢癌细胞株SKOV3为卵巢浆液性乳头状囊腺癌细胞株,来源于美国Memorial Sloan-Kettering 癌症中心;3AO为卵巢上皮性癌细胞株,来源于中国科学院细胞库;CAOV3为卵巢上皮性癌细胞株,来源于军事医学科学院。G-CSF受体阳性细胞株U937为白血病细胞株,来源于北京医科大学免疫系。上述细胞均在本实验室传代维持。实验动物BALB/c裸鼠为雌性,6周龄,北京医科大学实验动物中心提供。
二、实验方法
, 百拇医药
1.XTT比色法检测:用每毫升含有0.1ng、1ng、10ng、100ng、1 000ng G-CSF的培养液,37℃、5%CO2孵育卵巢癌细胞24小时后,应用XTT法检测[4]。重复3次。
2.流式细胞仪(FCM)检测[5,6]:将用含有不同浓度G-CSF的培养液孵育24小时的卵巢癌细胞制成单细胞悬液,以冷磷酸缓冲液(PBS)洗两次,加入冷的终浓度为70%乙醇,置于4℃备用。经乙醇固定的样品,以1 000r/min离心5分钟,弃上清液;加入PBS 10ml洗涤细胞,以1 000 r/min离心5分钟,弃上清液,重复1次;加入2mg/ml RNA酶25 μl,混匀,37℃水浴30分钟;加入PBS 175μl、PI染色液 250μl,混匀,4℃避光染色20分钟;以FCM测定各周期细胞的比例。重复3次。
3.G-CSF受体的检测:标本的mRNA提取及RT-PCR均按试剂盒提供的方案进行;G-CSF受体引物序列、PCR反应体系及步骤均参考Tomeczkowski等[7]的报道;阳性对照为U937细胞;阴性对照用三蒸水作为模板。PCR产物经1.5%的琼脂糖凝胶电泳鉴定,阳性条带的大小为668 bp。
, 百拇医药
4.裸鼠皮下移植瘤的药物敏感性检测:卵巢癌细胞悬液5×107/ml~1×108/ml,分别注入裸鼠双侧肩胛皮下,每点0.1ml。7天后随机分两组,每组裸鼠5只。实验组裸鼠背部皮下注射G-CSF 10μg*kg-1/d,共20天;对照组注射等量生理盐水。观察皮下瘤出现时间及大小,测量最大直径(L)和垂直径(W),按以下公式计算移植瘤体积[8]:肿瘤体积=1/2 LW 2。皮下接种60天后,手术切取皮下瘤,测量体积大小、称重。
三、统计学分析方法
FCM结果应用Becton Dickinson DNA Cell-Cycle Analysis Software-Ver C 5/87 Sum of Broadened Rectangles Model软件分析;两均数差别检验采用t检验。
, 百拇医药 结 果
一、XTT法检测G-CSF对卵巢癌细胞株生长的影响
3AO 、CAOV3细胞的G-CSF与对照组相比,差异均无显著性(P>0.05);SKOV3细胞的G-CSF分别为100ng/ml 、1 000ng/ml时,其吸光度(A)较对照组分别增高3.4%和4.8%,差异均有显著性(P<0.05)。见表1。
表1 XTT法检测不同浓度G-CSF对卵巢癌
细胞生长的影响(A值,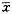 ±s) G-CSF(ng/ml)
±s) G-CSF(ng/ml)
SKOV3
3AO
, 百拇医药
CAOV3
0(对照组)
1.016±0.012
0.954±0.062
0.472±0.028
0.1
1.039±0.018
0.971±0.037
0.478±0.020
1
1.036±0.013
0.997±0.031
, 百拇医药
0.493±0.000
10
1.019±0.027
0.960±0.058
0.532±0.052
100
1.051±0.009*
0.950±0.021
0.478±0.021
1 000
1.065±0.018*
, 百拇医药
1.025±0.036
0.496±0.014
与对照组比较,P<0.05
二、FCM检测G-CSF对SKOV3细胞DNA周期的影响
G-CSF各周期细胞比例与对照组相比,差异均无显著性(P>0.05)。见表2。
表2 不同浓度G-CSF对SKOV3细胞DNA周期的影响(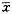 ±s) G-CSF (ng/ml)
±s) G-CSF (ng/ml)
G1
S
, http://www.100md.com
G2M
0(对照组)
41.67±3.682
38.67±2.055
19.67±1.700
0.1
41.67±1.247
38.67±1.886
19.00±2.449
1
43.33±4.110
33.33±6.128
, 百拇医药
23.00±1.633
10
42.67±4.190
33.67±1.886
23.33±4.110
100
43.00±3.742
36.33±8.807
21.00±4.967
1 000
44.00±2.944
34.00±5.888
, http://www.100md.com
21.67±3.091
三、RT-PCR检测卵巢癌细胞G-CSF受体
G-CSF受体阳性的U937细胞,在大约668 bp处扩增出特异性的条带;SKOV3细胞及阴性对照均未扩增出特异性条带。
四、裸鼠皮下移植瘤药物敏感性检测
皮下接种60天,皮下注射G-CSF的实验组及对照组皮下瘤重量分别为(0.375±0.131)g/只、(0.538±0.28)g/只,差异无显著性(P>0.05)。不同时间测量的实验组皮下瘤体积与对照组相比,差异均无显著性(P>0.05)。见表3。 表3 不同皮下接种时间G-CSF对SKOV3裸鼠
皮下瘤体积的影响(cm3) 皮下接种天数
, 百拇医药 实验组
对照组
20
0.047±0.025
0.058±0.021
40
0.143±0.065
0.168±0.048
60
0.203±0.084
0.371±0.138
讨 论 一、G-CSF对卵巢癌细胞生长的影响
, 百拇医药
G-CSF作为化疗的辅助治疗,目前已广泛用于化疗所致的粒细胞减少症的预防及治疗。虽然目前尚未见有关临床应用G-CSF可促进肿瘤生长的报道,但体外实验发现,G-CSF对包括卵巢癌等在内的某些恶性肿瘤细胞株及原代培养肿瘤细胞的生长,有促进增殖作用。其中Connor等[1]对4种卵巢癌细胞株及5例原代培养卵巢癌细胞进行检测,结果G-CSF对1例原代培养肿瘤细胞生长有显著的促进作用。Spinner等[2]检测4种卵巢癌细胞株及1例原代培养,发现G-CSF可促使1种细胞株增殖2~3倍。Fanning等[3]检测G-CSF对6种卵巢癌细胞株生长的影响,结果G-CSF可促进3种细胞株生长分别较对照提高7%~19%。虽然G-CSF对卵巢癌细胞的促进增殖作用,只局限于少数体外实验中的个别细胞株,但也显示了G-CSF有促进卵巢癌细胞生长的可能性。
本实验应用XTT比色法检测的结果显示,G-CSF对3AO及CAOV3细胞生长均未发现显著性的影响。而G-CSF浓度为100ng/ml、1 000ng/ml作用24小时,对SKOV3细胞生长均有幅度较低的促进作用。进一步采用FCM检测,结果显示,G-CSF对SKOV3细胞的各周期细胞比例均无显著性影响。尽管XTT法检测G-CSF对SKOV3细胞生长有促进作用,但幅度较低;而且FCM检测也未发现G-CSF对SKOV3细胞的细胞周期有显著性的影响。所以,G-CSF可促进细胞增殖的结果,意义并不大,尚有待进一步研究。
, 百拇医药
二、G-CSF受体检测及其与肿瘤细胞增殖作用的关系
据报道,G-CSF可促进增殖的肿瘤细胞,同时也发现其存在G-CSF受体。如Avalos等[9]发现,G-CSF可促进小细胞肺癌细胞株H128、H69细胞集落形成,同时125I-G-CSF结合试验显示,在肿瘤细胞表面也存在高亲和性G-CSF受体。Tachibana等[10]通过3H掺入及流式细胞检测发现,G-CSF对膀胱移行细胞癌细胞有促进增殖作用,同时RT-PCR检测发现G-CSF受体mRNA的存在等。根据上述实验结果推测,G-CSF对肿瘤细胞生长的影响,是通过与其靶细胞上的受体结合而发挥其生物学功能的。
本实验应用XTT法检测,只有当SKOV3细胞与浓度为100ng/ml、1 000ng/ml 的G-CSF作用时才有幅度较低的增殖反应;而通过RT-PCR检测,未发现G-CSF受体mRNA的存在,进一步提示G-CSF促进SKOV3细胞增殖的意义不大。
, http://www.100md.com
三、G-CSF在体内对肿瘤细胞生长的影响
G-CSF在体内影响肿瘤生长的因素很复杂,可能既直接影响肿瘤细胞生长,又对机体有诸多作用,如G-CSF可促进体内粒细胞、巨噬细胞活性,促进抗体依赖的细胞毒作用(ADCC),增强免疫功能等,而这些作用又可间接对肿瘤细胞生长起作用。本实验采用免疫功能缺陷的裸鼠进行体内实验,结果显示,G-CSF对裸鼠SKOV3细胞皮下瘤生长未发现显著性的影响。
综合本实验结果,G-CSF对所检测的卵巢癌细胞株生长无显著的促进作用。有研究报道,G-CSF可促进某些肿瘤细胞的分化,使静止期细胞进入细胞增殖周期,有助于化疗药物对肿瘤细胞的杀灭[11,12]。因此推论,在卵巢癌化疗过程中使用G-CSF应是较为安全的,与G-CSF潜在的促进肿瘤细胞增殖的作用相比,其对化疗的辅助治疗作用更为重要。当然最后的结论需要通过进一步观察应用G-CSF的患者的长期生存率而获得。在没有得出明确的结论之前,在不进行化疗的情况下,大量应用G-CSF应慎重。
, 百拇医药
参考文献
1 Connor JP, Squatrito RC, Terrell KL, et al. In vitro growth effects of colony stimulating factors in ovarian cancer. Gynecol Oncol, 1994, 52: 347-352.
2 Spinner DM, Brandstetter T, Schwarz MK, et al. c-jun expression and growth stimulation in human ovarian carcinoma cell lines following exposure to cytokines. Int J Cancer, 1995, 63: 423-427.
3 Fanning J, Hilgers RD, Kane C, et al. Sequential granulocyte colony-stimulating factor increases cisplatin cytotoxicity in human epithelial ovarian cancer cell lines. Gynecol Oncol, 1996, 60: 450-453.
, 百拇医药
4 吴楠,崔恒,钱和年,等. 卵巢癌细胞活性检测XTT比色法的建立.北京医科大学学报,1998,30:83-84.
5 宋平根,李素文主编. 流式细胞术的原理和应用. 第1版. 北京:北京师范大学出版社,1992:88.
6 左连富主编,流式细胞术样品制备技术. 第1版.北京:华夏出版社,1991.400.
7 Tomeczkowski J, Yakisan E, Wieland B, et al. Absence of G-CSF receptors and absent response to G-CSF in childhood Burkott′s lymphoma and B-ALL cell. Br J Haematol, 1995, 89: 771-779.
8 Rubin SC,Hoskins WJ,Markman M, et al. Synergistic activity of tumor necrosis factor and interferon in a nude mouse model of human ovarian cancer. Gynecol Oncol, 1989, 34: 353-356.
, http://www.100md.com
9 Avalos BR, Gasson JC, Hedvat C, et al. Human granulocyte colony-stimulating factor: biologic activities and receptor characterization on hematopoietic cells and small cell lung cancer cell lines. Blood, 1990, 75: 851-857.
10 Tachibana M, Miyakana A, Tazaki H, et al. Autocrine growth of transitional cell carcinoma of the bladder induced by granulocyte-colony stimulating factor. Cancer Res, 1995, 55: 3438-3443.
11 Nara N, Murohashi I, Suzuki T, et al. Effects of purified human native granulocyte colony-stimulating factor (G-CSF) on proliferation of blast progenitors in acute myeloblastic leukemia. Am J Hematol, 1988, 27: 84-88.
12 黄非,赵惠平,高雪芝,等. 重组人粒系集落刺激因子对白血病细胞的作用. 癌症,1994,13:29-31.
(收稿:1998-03-26 修回:1999-01-11), 百拇医药
单位:100034 北京医科大学人民医院妇科肿瘤中心[吴楠(现在北京军区总医院妇产科),崔恒,钱和年,冯捷,李蔚范,傅天云,李小平,葛华]
关键词:卵巢肿瘤;细胞系;粒细胞集落刺激因子;受体;粒细胞集落刺激因子
中华妇产科杂志990313 【摘要】 目的 了解粒细胞集落刺激因子(G-CSF)对人卵巢癌细胞株生长的影响。方法 采用XTT比色法,检测G-CSF对卵巢癌细胞株SKOV3、3AO及CAOV3生长的影响;对有影响的细胞株进行流式细胞仪检测和G-CSF受体的检测,观察外源性G-CSF对该细胞株的裸鼠皮下瘤生长的影响。结果 XTT法检测G-CSF对3AO及CAOV3细胞生长无显著影响;SKOV3细胞在G-CSF浓度分别为100ng/ml 、1 000ng/ml时,吸光度较对照分别增高3.4%和4.8%。流式细胞仪检测未发现G-CSF对SKOV3细胞的各周期细胞比例有显著性影响。逆转录聚合酶链反应检测SKOV3细胞G-CSF受体mRNA为阴性。外源性G-CSF对裸鼠SKOV3细胞皮下瘤生长也未发现显著性影响。结论 G-CSF对所检测的卵巢癌细胞株生长无显著影响。
, http://www.100md.com
The Growth Effect of Granulocyte Colony-stimulating Factors on Ovarian Carcinoma Cell Lines WU Nan*, CUI Heng, QIAN Henian, et al. General Hospital of Beijing Military Area, Beijing 100700
【Abstract】 Objective To evaluate the growth effects of granulocyte colony-stimulating factors (G-CSF) on ovarian carcinoma cell lines. Methods We investigated the possible growth effects of G-CSF on three ovarian carcinoma cell lines (SKOV3, 3AO, and CAOV3). Cell proliferation and viability was measured by XTT colorimetric assay. Flow cytometer (FCM) and G-CSF receptor mRNA were measured for response cell lines, the response cell lines were xenotransplanted into athymic mice, to investigated in vivo growth under systemic subcutaneous infusion of G-CSF.Results G-CSF showed no growth-stimulating effects in 3AO and CAOV3 cell lines. In SKOV3, an increase in growth (<5%) was seen by XTT assay at 100ng/ml and 1000ng/ml after 24 hours treatment, but no significant proliferation was observed by FCM. No G-CSF receptor mRNA was detected by RT-polymerase chain reaction, and no significant alteration of the tumor growth was by G-CSF. Conclusion Although, the above results suggest that G-CSF may act as growth factors in a few ovarian carcinoma cell lines, yet the worry about tumor growth stimulation by G-CSF as potential hazards for their clinical application in ovarian carcinoma patients as an adjuvant with cytotoxic chemotherapy is not necessary.
, http://www.100md.com
【Key words】 Ovarian neoplasms Cell lines Granulocyte colony-stimulating factor Receptor,granulocyte colony-stimulating factor
目前,粒细胞集落刺激因子(G-CSF)已广泛应用于卵巢癌化疗所致粒细胞减少症的预防及治疗。然而,一些体外实验的报告显示[1-3],G-CSF对某些卵巢癌细胞株及原代培养卵巢癌细胞的生长有促进增殖作用。本实验采用XTT比色法,检测G-CSF对卵巢癌细胞株SKOV3、3AO及CAOV3细胞生长的影响,并对有反应的细胞株进行进一步的研究,以期从多个层次、较全面的反映G-CSF对卵巢癌细胞株生长的影响。
材料和方法
一、主要材料
, http://www.100md.com
1.试剂与仪器:G-CSF为日本麒麟啤酒株式会社惠赠;XTT、碘化丙锭(PI)均为美国Sigma公司产品;硫酸酚嗪甲脂(PMS)为瑞士Fluka公司产品;mRNA快速提取试剂盒为瑞典Pharmacia公司产品;逆转录聚合酶链反应(RT-PCR)试剂盒为北方同正公司产品。酶联分析仪为美国BIO-RAD公司生产的Model 550;流式细胞仪为美国Becton Dickinson公司生产的FACSTAR。
2.实验材料:卵巢癌细胞株SKOV3为卵巢浆液性乳头状囊腺癌细胞株,来源于美国Memorial Sloan-Kettering 癌症中心;3AO为卵巢上皮性癌细胞株,来源于中国科学院细胞库;CAOV3为卵巢上皮性癌细胞株,来源于军事医学科学院。G-CSF受体阳性细胞株U937为白血病细胞株,来源于北京医科大学免疫系。上述细胞均在本实验室传代维持。实验动物BALB/c裸鼠为雌性,6周龄,北京医科大学实验动物中心提供。
二、实验方法
, 百拇医药
1.XTT比色法检测:用每毫升含有0.1ng、1ng、10ng、100ng、1 000ng G-CSF的培养液,37℃、5%CO2孵育卵巢癌细胞24小时后,应用XTT法检测[4]。重复3次。
2.流式细胞仪(FCM)检测[5,6]:将用含有不同浓度G-CSF的培养液孵育24小时的卵巢癌细胞制成单细胞悬液,以冷磷酸缓冲液(PBS)洗两次,加入冷的终浓度为70%乙醇,置于4℃备用。经乙醇固定的样品,以1 000r/min离心5分钟,弃上清液;加入PBS 10ml洗涤细胞,以1 000 r/min离心5分钟,弃上清液,重复1次;加入2mg/ml RNA酶25 μl,混匀,37℃水浴30分钟;加入PBS 175μl、PI染色液 250μl,混匀,4℃避光染色20分钟;以FCM测定各周期细胞的比例。重复3次。
3.G-CSF受体的检测:标本的mRNA提取及RT-PCR均按试剂盒提供的方案进行;G-CSF受体引物序列、PCR反应体系及步骤均参考Tomeczkowski等[7]的报道;阳性对照为U937细胞;阴性对照用三蒸水作为模板。PCR产物经1.5%的琼脂糖凝胶电泳鉴定,阳性条带的大小为668 bp。
, 百拇医药
4.裸鼠皮下移植瘤的药物敏感性检测:卵巢癌细胞悬液5×107/ml~1×108/ml,分别注入裸鼠双侧肩胛皮下,每点0.1ml。7天后随机分两组,每组裸鼠5只。实验组裸鼠背部皮下注射G-CSF 10μg*kg-1/d,共20天;对照组注射等量生理盐水。观察皮下瘤出现时间及大小,测量最大直径(L)和垂直径(W),按以下公式计算移植瘤体积[8]:肿瘤体积=1/2 LW 2。皮下接种60天后,手术切取皮下瘤,测量体积大小、称重。
三、统计学分析方法
FCM结果应用Becton Dickinson DNA Cell-Cycle Analysis Software-Ver C 5/87 Sum of Broadened Rectangles Model软件分析;两均数差别检验采用t检验。
, 百拇医药 结 果
一、XTT法检测G-CSF对卵巢癌细胞株生长的影响
3AO 、CAOV3细胞的G-CSF与对照组相比,差异均无显著性(P>0.05);SKOV3细胞的G-CSF分别为100ng/ml 、1 000ng/ml时,其吸光度(A)较对照组分别增高3.4%和4.8%,差异均有显著性(P<0.05)。见表1。
表1 XTT法检测不同浓度G-CSF对卵巢癌
细胞生长的影响(A值,
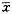 ±s) G-CSF(ng/ml)
±s) G-CSF(ng/ml)SKOV3
3AO
, 百拇医药
CAOV3
0(对照组)
1.016±0.012
0.954±0.062
0.472±0.028
0.1
1.039±0.018
0.971±0.037
0.478±0.020
1
1.036±0.013
0.997±0.031
, 百拇医药
0.493±0.000
10
1.019±0.027
0.960±0.058
0.532±0.052
100
1.051±0.009*
0.950±0.021
0.478±0.021
1 000
1.065±0.018*
, 百拇医药
1.025±0.036
0.496±0.014
与对照组比较,P<0.05
二、FCM检测G-CSF对SKOV3细胞DNA周期的影响
G-CSF各周期细胞比例与对照组相比,差异均无显著性(P>0.05)。见表2。
表2 不同浓度G-CSF对SKOV3细胞DNA周期的影响(
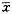 ±s) G-CSF (ng/ml)
±s) G-CSF (ng/ml)G1
S
, http://www.100md.com
G2M
0(对照组)
41.67±3.682
38.67±2.055
19.67±1.700
0.1
41.67±1.247
38.67±1.886
19.00±2.449
1
43.33±4.110
33.33±6.128
, 百拇医药
23.00±1.633
10
42.67±4.190
33.67±1.886
23.33±4.110
100
43.00±3.742
36.33±8.807
21.00±4.967
1 000
44.00±2.944
34.00±5.888
, http://www.100md.com
21.67±3.091
三、RT-PCR检测卵巢癌细胞G-CSF受体
G-CSF受体阳性的U937细胞,在大约668 bp处扩增出特异性的条带;SKOV3细胞及阴性对照均未扩增出特异性条带。
四、裸鼠皮下移植瘤药物敏感性检测
皮下接种60天,皮下注射G-CSF的实验组及对照组皮下瘤重量分别为(0.375±0.131)g/只、(0.538±0.28)g/只,差异无显著性(P>0.05)。不同时间测量的实验组皮下瘤体积与对照组相比,差异均无显著性(P>0.05)。见表3。 表3 不同皮下接种时间G-CSF对SKOV3裸鼠
皮下瘤体积的影响(cm3) 皮下接种天数
, 百拇医药 实验组
对照组
20
0.047±0.025
0.058±0.021
40
0.143±0.065
0.168±0.048
60
0.203±0.084
0.371±0.138
讨 论 一、G-CSF对卵巢癌细胞生长的影响
, 百拇医药
G-CSF作为化疗的辅助治疗,目前已广泛用于化疗所致的粒细胞减少症的预防及治疗。虽然目前尚未见有关临床应用G-CSF可促进肿瘤生长的报道,但体外实验发现,G-CSF对包括卵巢癌等在内的某些恶性肿瘤细胞株及原代培养肿瘤细胞的生长,有促进增殖作用。其中Connor等[1]对4种卵巢癌细胞株及5例原代培养卵巢癌细胞进行检测,结果G-CSF对1例原代培养肿瘤细胞生长有显著的促进作用。Spinner等[2]检测4种卵巢癌细胞株及1例原代培养,发现G-CSF可促使1种细胞株增殖2~3倍。Fanning等[3]检测G-CSF对6种卵巢癌细胞株生长的影响,结果G-CSF可促进3种细胞株生长分别较对照提高7%~19%。虽然G-CSF对卵巢癌细胞的促进增殖作用,只局限于少数体外实验中的个别细胞株,但也显示了G-CSF有促进卵巢癌细胞生长的可能性。
本实验应用XTT比色法检测的结果显示,G-CSF对3AO及CAOV3细胞生长均未发现显著性的影响。而G-CSF浓度为100ng/ml、1 000ng/ml作用24小时,对SKOV3细胞生长均有幅度较低的促进作用。进一步采用FCM检测,结果显示,G-CSF对SKOV3细胞的各周期细胞比例均无显著性影响。尽管XTT法检测G-CSF对SKOV3细胞生长有促进作用,但幅度较低;而且FCM检测也未发现G-CSF对SKOV3细胞的细胞周期有显著性的影响。所以,G-CSF可促进细胞增殖的结果,意义并不大,尚有待进一步研究。
, 百拇医药
二、G-CSF受体检测及其与肿瘤细胞增殖作用的关系
据报道,G-CSF可促进增殖的肿瘤细胞,同时也发现其存在G-CSF受体。如Avalos等[9]发现,G-CSF可促进小细胞肺癌细胞株H128、H69细胞集落形成,同时125I-G-CSF结合试验显示,在肿瘤细胞表面也存在高亲和性G-CSF受体。Tachibana等[10]通过3H掺入及流式细胞检测发现,G-CSF对膀胱移行细胞癌细胞有促进增殖作用,同时RT-PCR检测发现G-CSF受体mRNA的存在等。根据上述实验结果推测,G-CSF对肿瘤细胞生长的影响,是通过与其靶细胞上的受体结合而发挥其生物学功能的。
本实验应用XTT法检测,只有当SKOV3细胞与浓度为100ng/ml、1 000ng/ml 的G-CSF作用时才有幅度较低的增殖反应;而通过RT-PCR检测,未发现G-CSF受体mRNA的存在,进一步提示G-CSF促进SKOV3细胞增殖的意义不大。
, http://www.100md.com
三、G-CSF在体内对肿瘤细胞生长的影响
G-CSF在体内影响肿瘤生长的因素很复杂,可能既直接影响肿瘤细胞生长,又对机体有诸多作用,如G-CSF可促进体内粒细胞、巨噬细胞活性,促进抗体依赖的细胞毒作用(ADCC),增强免疫功能等,而这些作用又可间接对肿瘤细胞生长起作用。本实验采用免疫功能缺陷的裸鼠进行体内实验,结果显示,G-CSF对裸鼠SKOV3细胞皮下瘤生长未发现显著性的影响。
综合本实验结果,G-CSF对所检测的卵巢癌细胞株生长无显著的促进作用。有研究报道,G-CSF可促进某些肿瘤细胞的分化,使静止期细胞进入细胞增殖周期,有助于化疗药物对肿瘤细胞的杀灭[11,12]。因此推论,在卵巢癌化疗过程中使用G-CSF应是较为安全的,与G-CSF潜在的促进肿瘤细胞增殖的作用相比,其对化疗的辅助治疗作用更为重要。当然最后的结论需要通过进一步观察应用G-CSF的患者的长期生存率而获得。在没有得出明确的结论之前,在不进行化疗的情况下,大量应用G-CSF应慎重。
, 百拇医药
参考文献
1 Connor JP, Squatrito RC, Terrell KL, et al. In vitro growth effects of colony stimulating factors in ovarian cancer. Gynecol Oncol, 1994, 52: 347-352.
2 Spinner DM, Brandstetter T, Schwarz MK, et al. c-jun expression and growth stimulation in human ovarian carcinoma cell lines following exposure to cytokines. Int J Cancer, 1995, 63: 423-427.
3 Fanning J, Hilgers RD, Kane C, et al. Sequential granulocyte colony-stimulating factor increases cisplatin cytotoxicity in human epithelial ovarian cancer cell lines. Gynecol Oncol, 1996, 60: 450-453.
, 百拇医药
4 吴楠,崔恒,钱和年,等. 卵巢癌细胞活性检测XTT比色法的建立.北京医科大学学报,1998,30:83-84.
5 宋平根,李素文主编. 流式细胞术的原理和应用. 第1版. 北京:北京师范大学出版社,1992:88.
6 左连富主编,流式细胞术样品制备技术. 第1版.北京:华夏出版社,1991.400.
7 Tomeczkowski J, Yakisan E, Wieland B, et al. Absence of G-CSF receptors and absent response to G-CSF in childhood Burkott′s lymphoma and B-ALL cell. Br J Haematol, 1995, 89: 771-779.
8 Rubin SC,Hoskins WJ,Markman M, et al. Synergistic activity of tumor necrosis factor and interferon in a nude mouse model of human ovarian cancer. Gynecol Oncol, 1989, 34: 353-356.
, http://www.100md.com
9 Avalos BR, Gasson JC, Hedvat C, et al. Human granulocyte colony-stimulating factor: biologic activities and receptor characterization on hematopoietic cells and small cell lung cancer cell lines. Blood, 1990, 75: 851-857.
10 Tachibana M, Miyakana A, Tazaki H, et al. Autocrine growth of transitional cell carcinoma of the bladder induced by granulocyte-colony stimulating factor. Cancer Res, 1995, 55: 3438-3443.
11 Nara N, Murohashi I, Suzuki T, et al. Effects of purified human native granulocyte colony-stimulating factor (G-CSF) on proliferation of blast progenitors in acute myeloblastic leukemia. Am J Hematol, 1988, 27: 84-88.
12 黄非,赵惠平,高雪芝,等. 重组人粒系集落刺激因子对白血病细胞的作用. 癌症,1994,13:29-31.
(收稿:1998-03-26 修回:1999-01-11), 百拇医药