离体异位子宫内膜细胞中单核细胞趋化蛋白-1的测定
作者:高颖 罗丽兰 何福仙
单位:高颖 同济医科大学附属协和医院妇产科 430022 武汉;罗丽兰,何福仙 附属同济医院妇产科
关键词:子宫内膜异位症;细胞;培养的;单核细胞化学吸引蛋白质;白细胞介素1肿瘤坏死因子
中华妇产科杂志991011 【摘要】 目的 探讨异位子宫内膜细胞产生单核细胞趋化蛋白-1(MCP-1)的临床意义。方法 收集15例子宫内膜异位症患者的异位内膜组织进行体外细胞培养,分别加入纯培养液(对照组)、含白细胞介素-1β(IL-1β)2 ng/ml(IL-1β诱导组)及肿瘤坏死因子α(TNF-α)20 mg/ml(TNF-α诱导组)的培养液培养4小时,应用斑点杂交、免疫组织化学及夹心酶联免疫吸附试验检测各组异位细胞中MCP-1 mRNA蛋白的表达水平及其培养上清中MCP-1的含量。结果 与对照组相比,异位内膜细胞经IL-1β及TNF-α作用后表达的MCP-1 mRNA和蛋白水平显著增加(P<0.01,P<0.05);培养上清中MCP-1的含量也显著增加(P<0.01,P<0.05)。结论 IL-1β及TNF-α可刺激异位内膜细胞中MCP-1的表达显著增加,这可能和子宫内膜异位症的病变发展有关。
, http://www.100md.com
Determination of Monocyte Chemotactic Protein-1
in Cultured Endometriotic Cells
GAO Ying*, LUO Lilan, HE Fuxian.
* Union Hospital, Tongji Medical University, Wuhan 430022
【Abstract】 Objective To investigate the clinical significance of monocyte chemotactic protein-1 (MCP-1) produced by endometriotic tissues. Methods Expressions of MCP-1 mRNA and MCP-1 protein were determined by dot blot analysis, immunohistochemical method [streptavidin biotin-peroxidase complex (SABC)] and enzyme linked immunosorbent assay (ELISA) methods in cultured endometriotic cells with median (controls) or with interleukin-1β(IL-1β)2 ng/ml (IL-1β group), and tumor necrosis factor-α(TNF-α)20 mg/ml(TNF-α group) respectively. The endometriotic tissues were sourced from 15 patients with endometriosis. Meanwhile, the MCP-1 protein content of cultured supernatent was also measured. Results After exposured to IL-1β or TNF-α, the expression of MCP-1 mRNA and MEP-1 protein in the endometriotic cells were significantly higher than that in the control group (P<0.01, P<0.05 respectively); so was the MCP-1 protien content of supernatent. Conclusions IL-1 β and TNF-α can up-regulate the expression of MCP-1 in endometriotic cells, which may be related to the development of emdometriosis.
, http://www.100md.com
【Key words】 Endometriosis Cell, cultured Monocyte chemoattractant protein-1 Interleukin-1Tumor necrosis factor
子宫内膜异位症(内异症)为妇产科最常见的疾病之一,该病发展的病理生理过程较为复杂。有学者认为,内异症患者腹腔液中巨噬细胞的含量及活性显著增加与该病的发生、发展密切相关[1,2],单核细胞趋化蛋白-1(MCP-1)对单核细胞具有特异的趋化活性,可能是腹腔液巨噬细胞增加的加强因素[3]。因内异症患者腹腔液中的白细胞介素-1β(IL-1β)及肿瘤坏死因子α(TNF-α)的水平明显增高[4],我们采用体外培养的方法,观察这两种细胞因子对盆腔的异位内膜细胞产生MCP-1的影响,探讨异位病灶在内异症发生、发展中的作用。
资料及方法
, http://www.100md.com
一、资料来源
收集1997年4月至1997年11月间,因内异症而在同济医科大学附属同济医院妇产科行手术治疗的15例患者的典型异位病灶组织(卵巢、盆腔腹膜及腹壁异位灶)。标本取出后立即置入4℃无菌、含青霉素及链霉素的平衡溶液(Hank溶液)中送入实验室。患者年龄26~42岁,手术均在月经中晚期进行,所有患者近3个月内未接受任何药物治疗。所取组织均经病理学检查证实。
二、方法
1.组织处理及细胞培养:将所取的新鲜组织尽量剪碎,加入0.1%胶原酶溶液混匀后于37℃、5%二氧化碳培养箱中放置120~150分钟。在消化后的细胞悬液(含有内膜腺细胞及间质细胞)中加入培养液,置入37℃、5%二氧化碳培养箱中培养,培养液的配制为改良eagle培养基(MEM, 美国Gibco公司产品)中,加入10%小牛血清、2%谷氨酰胺、20 mmol缓冲盐(Hepes)、100 U/ml青霉素、100 mg/ml链霉素。24小时后倒去未贴壁细胞继续培养。
, 百拇医药
2.分组:待细胞全部融合或大部分融合(约5~6天),用胰蛋白酶消化后将细胞平均分种于24孔板及放有小玻片的培养瓶中,待细胞长满(约3天,每孔细胞数为1×105个)后,将细胞分为3组:(1)对照组:单用培养液培养;(2)IL-1β诱导组:于培养液中加入终浓度为2ng/ml的IL-1β(美国Gibco公司产品);(3)TNF-α诱导组:于培养液中加入TNF-α(美国Gibco公司产品),终浓度为20mg/ml。各组细胞孵育4小时(本实验证实,IL-1β及TNF-α刺激4小时后内膜细胞MCP-1的分泌活性即可达高峰)后,分别收集各组细胞和细胞爬片。
3.MCP-1的测定:(1) 培养细胞中MCP-1 mRNA的测定:采用斑点杂交分析方法。收集24孔板的细胞采用总RNA按一步提取法(Trizol试剂,美国Gibco公司产品)提取总RNA。各组取20 μg RNA点于硝酸纤维素微孔滤膜上。用于杂交的MCP-1探针(西安医科大学免疫病理室合成),是由35个碱基组成的寡核苷酸,与MCP-1 cDNA序列的第257~292个核苷酸互补。探针的5′末端按DNA标记试剂盒(德国Promeaga公司产品)的步骤进行γ-磷32(北京福瑞公司)标记。经预杂交、杂交、曝光后,应用全自动图象分析仪对每一斑点的积分吸光度双盲法进行检测,MCP-1 mRNA表达水平与积分吸光度值呈正相关。(2) 培养细胞中MCP-1蛋白的测定:收集异位细胞爬片,采用免疫组织化学链霉亲和素-生物素-过氧化物酶复合物法(SABC法,试剂盒购自武汉博士德生物工程公司)染色,用兔抗MCP-1抗血清检测细胞内MCP-1含量,经显色、脱水、透明,中性树胶封固后,全自动图像分析仪测定细胞内显色颗粒的平均吸光度值。(3) 细胞培养上清中MCP-1含量的测定:采用夹心酶联免疫吸附试验法(ELISA法,试剂购自美国Gibco公司)。对照组、IL-1β诱导组及TNF-α诱导组细胞培养4小时后,更换单纯培养液(每孔1 ml)继续孵育24小时后收集上清。兔抗人MCP-1多克隆抗体(军事医学科学院产品)及人类MCP-1 抗原用于检测各组异位内膜细胞培养上清中MCP-1的含量,用酶标分析仪测量波长490 nm处的光吸收率,从MCP-1的标准曲线确定培养上清中MCP-1的含量。在倒置显微镜下观察3组细胞的形态变化。
, http://www.100md.com
三、统计学方法
各组实验结果均以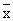 ±s表示,采用方差分析及t检验进行显著性分析。
±s表示,采用方差分析及t检验进行显著性分析。
结果
一、细胞形态
3组体外培养的异位内膜细胞腺上皮细胞呈旋窝状、插入性生长,细胞为星形、多角形;间质细胞则呈伸展、挺直状。培养5~7天细胞融合后处于相对静止状态。在含IL-1β及TNF-α培养液中培养4小时后,细胞形态在光镜下无改变。
二、各组异位细胞中MCP-1的表达
1. MCP-1 mRNA的测定结果:对照组异位内膜细胞可表达低水平的MCP-1 mRNA,IL-1β诱导组及TNF-α诱导组的细胞MCP-1 mRNA表达水平,均显著增加(P<0.01)。见表1。
, http://www.100md.com
表1 各组异位细胞及细胞培养上清液中MCP-1的水平(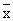 ±s) 组别
±s) 组别
例数
细胞中MCP-1 mRNA
积分吸光度值
细胞中MCP-1
积分吸光度值
培养上清液中MCP-1
含量(ng/ml)
IL-1β诱导组
15
, http://www.100md.com
56.84±3.21*
8.64±0.83**
4.52±0.09*
TNF-α诱导组
15
41.58±2.48*
7.03±0.97**
2.87±0.27**
对照组
15
, 百拇医药
18.34±3.95
4.48±0.44
1.74±0.16
注:与对照组比较,*P<0.01 **P<0.05
2.异位细胞MCP-1的表达水平:各组异位细胞中均有MCP-1表达,对照组细胞中MCP-1表达较弱,胞浆淡染(图1),IL-1β诱导组及TNF-α诱导组细胞中MCP-1的表达明显增强(P<0.05),胞浆呈棕黄色(图2,3)。各组的吸光度值见表1。



, http://www.100md.com
图1 异位内膜细胞胞浆淡染MCP-1蛋白表达较弱。SABC法 ×400



图2 IL-1β刺激后异位内膜细胞胞浆呈棕黄色,MCP-1蛋白的表达明显增强。SABC法 ×400



, 百拇医药
图3 TNF-α刺激后异位内膜细胞胞浆呈棕黄色,MCP-1蛋白的表达明显增强。SABC法 ×400
3.细胞培养上清液中MCP-1的含量:IL-1β诱导组或TNF-α诱导组细胞培养上清液中MCP-1的含量均高于对照组,差异有显著性(分别为P<0.01,P<0.05)。IL-1β的作用更强于TNF-α。见表1。
讨论
内异症即具有功能活性的子宫内膜组织异位生长于子宫腔外,腹腔液成为其生长的特殊微环境。异位内膜组织除具有在位内膜的特性(如激素依赖性等)外,还会因生长环境因素的影响,使其合成及分泌某些细胞因子的能力增强,后者又反作用于周围环境,成为该疾病发生发展的加强因素。
一、MCP-1对巨噬细胞的影响
有研究证实,腹腔巨噬细胞的数量、活化程度及分泌活性增加,这些活化的巨噬细胞可产生使淋巴细胞趋化、增殖及活化的物质,导致腹腔中形成进行性发展的炎性环境[2]。目前的研究认为,MCP-1是影响腹腔液中巨噬细胞变化较为关键的细胞因子[5]。MCP-1属于小分子细胞因子超家族,为一种作用很强的单核细胞趋化、活化因子,特异性地作用于血液单核细胞。体内及体外研究均已证实,MCP-1具募集单核细胞进入肿瘤及组织间隙的潜能,且单核-巨噬细胞表面可表达与MCP-1有高亲合力的特异性结合受体[3]。研究发现,内异症患者腹腔液中MCP-1的含量及腹腔液的趋化活性明显增加,且两者呈正相关关系[6]。提示,MCP-1可能参与内异症患者腹腔液中巨噬细胞的募集及激活过程。
, 百拇医药
二、异位症异位内膜组织与腹腔内环境的关系
内异症患者的异位内膜组织所表达的MCP-1水平较其在位内膜明显增加[7],可能与其腹腔内环境的改变有关,此改变尤以腹腔液中IL-1β及TNF-α的浓度增加[4]较为突出。本研究检测到异位内膜细胞经IL-1β及TNF-α刺激后,其合成MCP-1 mRNA及蛋白的水平均显著增加,说明异位病灶可能是导致腹腔内环境进一步恶化的加强因素。盆腔的异位组织在腹腔液中高浓度的IL-1β及TNF-α刺激下,可产生及释放高水平的MCP-1进入腹腔液中,后者作为一种效应细胞的趋化介质,募集外周血单核细胞进入腹腔液,激活为巨噬细胞,而活化的巨噬细胞进一步分泌IL-1β及TNF-α[8]。因此,异位病灶与腹腔内环境之间可能为相互影响,互为因果的关系,异位病灶的趋化活性导致腹腔巨噬细胞增多,而后者产生的细胞因子又作用于异位病灶,由此形成恶性循环,导致原有病变的进一步发展。
, 百拇医药 参考文献
1 Weil SJ, Wang S, Perez MC. Chemotaxis of macrophages by a peritoneal fluid of patients with endometriosis. Fertil Steril, 1997, 67: 865-869.
2 Weil SJ, Wang S, Perez MC. Basal and stimulates of secretion of cytokines by peritoneal macrophages. Fertil Steril, 1996, 65: 922-930.
3 Yoshimura T, Leonard EJ. Identification of high affinity receptors for human monocyte chemoattractant protein-1 on human monocytes. J Immunol, 1990, 145: 292-297.
, 百拇医药
4 Taketani Y, Kuo TM, Mizuno M. Comparison of cytokine levels and embryo toxicity in peritoneal fluid in infertil women with untreated and treated endometriosis. Am J Obstet Gynecol, 1992, 67: 765-770.
5 Akoum A. Elevates and biologic activity of monocyte chemotactic protein-1 in the peritoneal fluid of patients whit endometriosis. Fertil Steril, 1996, 66: 17-23.
6 Arici A, Oral E, Attar E,et al. Monocyte chemotactic protein-1 concentration in peritoneal fluid of women with endometriosis and its modulation of expression in mesothelial cells. Fertil Steril, 1997, 67: 1065-1072.
, 百拇医药
7 Jolicoeur C, Boutouil I, Paradis R, et al. Increased expression of monocyte chemotactic protein-1 in the endometrium of woman with endometriosis. Am J Pathol, 1998, 152: 125-133.
8 Furie MB, Randolph GJ. Chemokines and tissue injury. Am J Pathol, 1995, 146: 1287-1301.
(收稿:1998-10-20 修回:1999-06-01), 百拇医药
单位:高颖 同济医科大学附属协和医院妇产科 430022 武汉;罗丽兰,何福仙 附属同济医院妇产科
关键词:子宫内膜异位症;细胞;培养的;单核细胞化学吸引蛋白质;白细胞介素1肿瘤坏死因子
中华妇产科杂志991011 【摘要】 目的 探讨异位子宫内膜细胞产生单核细胞趋化蛋白-1(MCP-1)的临床意义。方法 收集15例子宫内膜异位症患者的异位内膜组织进行体外细胞培养,分别加入纯培养液(对照组)、含白细胞介素-1β(IL-1β)2 ng/ml(IL-1β诱导组)及肿瘤坏死因子α(TNF-α)20 mg/ml(TNF-α诱导组)的培养液培养4小时,应用斑点杂交、免疫组织化学及夹心酶联免疫吸附试验检测各组异位细胞中MCP-1 mRNA蛋白的表达水平及其培养上清中MCP-1的含量。结果 与对照组相比,异位内膜细胞经IL-1β及TNF-α作用后表达的MCP-1 mRNA和蛋白水平显著增加(P<0.01,P<0.05);培养上清中MCP-1的含量也显著增加(P<0.01,P<0.05)。结论 IL-1β及TNF-α可刺激异位内膜细胞中MCP-1的表达显著增加,这可能和子宫内膜异位症的病变发展有关。
, http://www.100md.com
Determination of Monocyte Chemotactic Protein-1
in Cultured Endometriotic Cells
GAO Ying*, LUO Lilan, HE Fuxian.
* Union Hospital, Tongji Medical University, Wuhan 430022
【Abstract】 Objective To investigate the clinical significance of monocyte chemotactic protein-1 (MCP-1) produced by endometriotic tissues. Methods Expressions of MCP-1 mRNA and MCP-1 protein were determined by dot blot analysis, immunohistochemical method [streptavidin biotin-peroxidase complex (SABC)] and enzyme linked immunosorbent assay (ELISA) methods in cultured endometriotic cells with median (controls) or with interleukin-1β(IL-1β)2 ng/ml (IL-1β group), and tumor necrosis factor-α(TNF-α)20 mg/ml(TNF-α group) respectively. The endometriotic tissues were sourced from 15 patients with endometriosis. Meanwhile, the MCP-1 protein content of cultured supernatent was also measured. Results After exposured to IL-1β or TNF-α, the expression of MCP-1 mRNA and MEP-1 protein in the endometriotic cells were significantly higher than that in the control group (P<0.01, P<0.05 respectively); so was the MCP-1 protien content of supernatent. Conclusions IL-1 β and TNF-α can up-regulate the expression of MCP-1 in endometriotic cells, which may be related to the development of emdometriosis.
, http://www.100md.com
【Key words】 Endometriosis Cell, cultured Monocyte chemoattractant protein-1 Interleukin-1Tumor necrosis factor
子宫内膜异位症(内异症)为妇产科最常见的疾病之一,该病发展的病理生理过程较为复杂。有学者认为,内异症患者腹腔液中巨噬细胞的含量及活性显著增加与该病的发生、发展密切相关[1,2],单核细胞趋化蛋白-1(MCP-1)对单核细胞具有特异的趋化活性,可能是腹腔液巨噬细胞增加的加强因素[3]。因内异症患者腹腔液中的白细胞介素-1β(IL-1β)及肿瘤坏死因子α(TNF-α)的水平明显增高[4],我们采用体外培养的方法,观察这两种细胞因子对盆腔的异位内膜细胞产生MCP-1的影响,探讨异位病灶在内异症发生、发展中的作用。
资料及方法
, http://www.100md.com
一、资料来源
收集1997年4月至1997年11月间,因内异症而在同济医科大学附属同济医院妇产科行手术治疗的15例患者的典型异位病灶组织(卵巢、盆腔腹膜及腹壁异位灶)。标本取出后立即置入4℃无菌、含青霉素及链霉素的平衡溶液(Hank溶液)中送入实验室。患者年龄26~42岁,手术均在月经中晚期进行,所有患者近3个月内未接受任何药物治疗。所取组织均经病理学检查证实。
二、方法
1.组织处理及细胞培养:将所取的新鲜组织尽量剪碎,加入0.1%胶原酶溶液混匀后于37℃、5%二氧化碳培养箱中放置120~150分钟。在消化后的细胞悬液(含有内膜腺细胞及间质细胞)中加入培养液,置入37℃、5%二氧化碳培养箱中培养,培养液的配制为改良eagle培养基(MEM, 美国Gibco公司产品)中,加入10%小牛血清、2%谷氨酰胺、20 mmol缓冲盐(Hepes)、100 U/ml青霉素、100 mg/ml链霉素。24小时后倒去未贴壁细胞继续培养。
, 百拇医药
2.分组:待细胞全部融合或大部分融合(约5~6天),用胰蛋白酶消化后将细胞平均分种于24孔板及放有小玻片的培养瓶中,待细胞长满(约3天,每孔细胞数为1×105个)后,将细胞分为3组:(1)对照组:单用培养液培养;(2)IL-1β诱导组:于培养液中加入终浓度为2ng/ml的IL-1β(美国Gibco公司产品);(3)TNF-α诱导组:于培养液中加入TNF-α(美国Gibco公司产品),终浓度为20mg/ml。各组细胞孵育4小时(本实验证实,IL-1β及TNF-α刺激4小时后内膜细胞MCP-1的分泌活性即可达高峰)后,分别收集各组细胞和细胞爬片。
3.MCP-1的测定:(1) 培养细胞中MCP-1 mRNA的测定:采用斑点杂交分析方法。收集24孔板的细胞采用总RNA按一步提取法(Trizol试剂,美国Gibco公司产品)提取总RNA。各组取20 μg RNA点于硝酸纤维素微孔滤膜上。用于杂交的MCP-1探针(西安医科大学免疫病理室合成),是由35个碱基组成的寡核苷酸,与MCP-1 cDNA序列的第257~292个核苷酸互补。探针的5′末端按DNA标记试剂盒(德国Promeaga公司产品)的步骤进行γ-磷32(北京福瑞公司)标记。经预杂交、杂交、曝光后,应用全自动图象分析仪对每一斑点的积分吸光度双盲法进行检测,MCP-1 mRNA表达水平与积分吸光度值呈正相关。(2) 培养细胞中MCP-1蛋白的测定:收集异位细胞爬片,采用免疫组织化学链霉亲和素-生物素-过氧化物酶复合物法(SABC法,试剂盒购自武汉博士德生物工程公司)染色,用兔抗MCP-1抗血清检测细胞内MCP-1含量,经显色、脱水、透明,中性树胶封固后,全自动图像分析仪测定细胞内显色颗粒的平均吸光度值。(3) 细胞培养上清中MCP-1含量的测定:采用夹心酶联免疫吸附试验法(ELISA法,试剂购自美国Gibco公司)。对照组、IL-1β诱导组及TNF-α诱导组细胞培养4小时后,更换单纯培养液(每孔1 ml)继续孵育24小时后收集上清。兔抗人MCP-1多克隆抗体(军事医学科学院产品)及人类MCP-1 抗原用于检测各组异位内膜细胞培养上清中MCP-1的含量,用酶标分析仪测量波长490 nm处的光吸收率,从MCP-1的标准曲线确定培养上清中MCP-1的含量。在倒置显微镜下观察3组细胞的形态变化。
, http://www.100md.com
三、统计学方法
各组实验结果均以
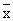 ±s表示,采用方差分析及t检验进行显著性分析。
±s表示,采用方差分析及t检验进行显著性分析。结果
一、细胞形态
3组体外培养的异位内膜细胞腺上皮细胞呈旋窝状、插入性生长,细胞为星形、多角形;间质细胞则呈伸展、挺直状。培养5~7天细胞融合后处于相对静止状态。在含IL-1β及TNF-α培养液中培养4小时后,细胞形态在光镜下无改变。
二、各组异位细胞中MCP-1的表达
1. MCP-1 mRNA的测定结果:对照组异位内膜细胞可表达低水平的MCP-1 mRNA,IL-1β诱导组及TNF-α诱导组的细胞MCP-1 mRNA表达水平,均显著增加(P<0.01)。见表1。
, http://www.100md.com
表1 各组异位细胞及细胞培养上清液中MCP-1的水平(
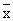 ±s) 组别
±s) 组别例数
细胞中MCP-1 mRNA
积分吸光度值
细胞中MCP-1
积分吸光度值
培养上清液中MCP-1
含量(ng/ml)
IL-1β诱导组
15
, http://www.100md.com
56.84±3.21*
8.64±0.83**
4.52±0.09*
TNF-α诱导组
15
41.58±2.48*
7.03±0.97**
2.87±0.27**
对照组
15
, 百拇医药
18.34±3.95
4.48±0.44
1.74±0.16
注:与对照组比较,*P<0.01 **P<0.05
2.异位细胞MCP-1的表达水平:各组异位细胞中均有MCP-1表达,对照组细胞中MCP-1表达较弱,胞浆淡染(图1),IL-1β诱导组及TNF-α诱导组细胞中MCP-1的表达明显增强(P<0.05),胞浆呈棕黄色(图2,3)。各组的吸光度值见表1。




, http://www.100md.com
图1 异位内膜细胞胞浆淡染MCP-1蛋白表达较弱。SABC法 ×400




图2 IL-1β刺激后异位内膜细胞胞浆呈棕黄色,MCP-1蛋白的表达明显增强。SABC法 ×400




, 百拇医药
图3 TNF-α刺激后异位内膜细胞胞浆呈棕黄色,MCP-1蛋白的表达明显增强。SABC法 ×400
3.细胞培养上清液中MCP-1的含量:IL-1β诱导组或TNF-α诱导组细胞培养上清液中MCP-1的含量均高于对照组,差异有显著性(分别为P<0.01,P<0.05)。IL-1β的作用更强于TNF-α。见表1。
讨论
内异症即具有功能活性的子宫内膜组织异位生长于子宫腔外,腹腔液成为其生长的特殊微环境。异位内膜组织除具有在位内膜的特性(如激素依赖性等)外,还会因生长环境因素的影响,使其合成及分泌某些细胞因子的能力增强,后者又反作用于周围环境,成为该疾病发生发展的加强因素。
一、MCP-1对巨噬细胞的影响
有研究证实,腹腔巨噬细胞的数量、活化程度及分泌活性增加,这些活化的巨噬细胞可产生使淋巴细胞趋化、增殖及活化的物质,导致腹腔中形成进行性发展的炎性环境[2]。目前的研究认为,MCP-1是影响腹腔液中巨噬细胞变化较为关键的细胞因子[5]。MCP-1属于小分子细胞因子超家族,为一种作用很强的单核细胞趋化、活化因子,特异性地作用于血液单核细胞。体内及体外研究均已证实,MCP-1具募集单核细胞进入肿瘤及组织间隙的潜能,且单核-巨噬细胞表面可表达与MCP-1有高亲合力的特异性结合受体[3]。研究发现,内异症患者腹腔液中MCP-1的含量及腹腔液的趋化活性明显增加,且两者呈正相关关系[6]。提示,MCP-1可能参与内异症患者腹腔液中巨噬细胞的募集及激活过程。
, 百拇医药
二、异位症异位内膜组织与腹腔内环境的关系
内异症患者的异位内膜组织所表达的MCP-1水平较其在位内膜明显增加[7],可能与其腹腔内环境的改变有关,此改变尤以腹腔液中IL-1β及TNF-α的浓度增加[4]较为突出。本研究检测到异位内膜细胞经IL-1β及TNF-α刺激后,其合成MCP-1 mRNA及蛋白的水平均显著增加,说明异位病灶可能是导致腹腔内环境进一步恶化的加强因素。盆腔的异位组织在腹腔液中高浓度的IL-1β及TNF-α刺激下,可产生及释放高水平的MCP-1进入腹腔液中,后者作为一种效应细胞的趋化介质,募集外周血单核细胞进入腹腔液,激活为巨噬细胞,而活化的巨噬细胞进一步分泌IL-1β及TNF-α[8]。因此,异位病灶与腹腔内环境之间可能为相互影响,互为因果的关系,异位病灶的趋化活性导致腹腔巨噬细胞增多,而后者产生的细胞因子又作用于异位病灶,由此形成恶性循环,导致原有病变的进一步发展。
, 百拇医药 参考文献
1 Weil SJ, Wang S, Perez MC. Chemotaxis of macrophages by a peritoneal fluid of patients with endometriosis. Fertil Steril, 1997, 67: 865-869.
2 Weil SJ, Wang S, Perez MC. Basal and stimulates of secretion of cytokines by peritoneal macrophages. Fertil Steril, 1996, 65: 922-930.
3 Yoshimura T, Leonard EJ. Identification of high affinity receptors for human monocyte chemoattractant protein-1 on human monocytes. J Immunol, 1990, 145: 292-297.
, 百拇医药
4 Taketani Y, Kuo TM, Mizuno M. Comparison of cytokine levels and embryo toxicity in peritoneal fluid in infertil women with untreated and treated endometriosis. Am J Obstet Gynecol, 1992, 67: 765-770.
5 Akoum A. Elevates and biologic activity of monocyte chemotactic protein-1 in the peritoneal fluid of patients whit endometriosis. Fertil Steril, 1996, 66: 17-23.
6 Arici A, Oral E, Attar E,et al. Monocyte chemotactic protein-1 concentration in peritoneal fluid of women with endometriosis and its modulation of expression in mesothelial cells. Fertil Steril, 1997, 67: 1065-1072.
, 百拇医药
7 Jolicoeur C, Boutouil I, Paradis R, et al. Increased expression of monocyte chemotactic protein-1 in the endometrium of woman with endometriosis. Am J Pathol, 1998, 152: 125-133.
8 Furie MB, Randolph GJ. Chemokines and tissue injury. Am J Pathol, 1995, 146: 1287-1301.
(收稿:1998-10-20 修回:1999-06-01), 百拇医药