衣原体感染与分泌性中耳炎关系的初步研究
作者:张官萍 宁波 李永奇 陈靖
单位:张官萍、李永奇、陈靖 广州 中山医科大学第三临床学院耳鼻咽喉科 510630 ;宁波 中山医科大学免疫学教研室
关键词:中耳炎;伴渗出性;衣原体;肺炎;衣原体;沙眼;聚合酶链反应;免疫学试验
中华耳鼻咽喉科杂志990208 【摘要】 目的 了解衣原体感染与分泌性中耳炎的关系,初步建立临床上鼓室抽吸液衣原体的检测方法。方法 收集44例(50耳)分泌性中耳炎患者的血清及鼓室抽吸液,分别以微量免疫荧光法检测衣原体特异性抗体,聚合酶链反应法(polymerase chain reaction, PCR)检测衣原体特异性DNA,用Hep-2细胞进行鼓室抽吸液中肺炎衣原体(Chlamydia pneumoniae, Cpn)培养。结果 1例Cpn培养阳性,且其血清及鼓室抽吸液特异性IgG抗体达到诊断水平,PCR检测特异性DNA阳性;14例血清及鼓室抽吸中沙眼衣原体(Chlamydia trachomatis,Ct)特异性IgG增高,同时PCR检测鼓室抽吸液Ct特异性质粒DNA阳性。结论 衣原体是分泌性中耳炎的重要的致病微生物。
, 百拇医药
Study on the relationship between Chlamydia infection and otitis media with effusion
ZHANG Guanping, NING Bo, LI Yongqi, et al. Department of Otorhinolaryngology, Third Affiliated Hospital, Sun Yat-sen University of Medical Sciences,Guangzhou 510630
【Abstract】 Objective To evaluate the relationship between Chlamydia infection and otitis media with effusion and to establish a method for detection of Chlamydia antibodies in local fluids. Methods Sera and tympanocentesis aspirates from 44 patients with otitis media with effusion were collected. The specimens were used to detect the Chlamydia specific IgG, IgM antibodies using micro-immune fluorescent assay; to detect Chlamydia trachomatis plasmid DNA and Chlamydia pneumoniae genome DNA with polymerase chain reaction (PCR); and to separate Chlamydia pneumoniae in tympanocentesis aspirates with Hep-2 cell culture. Results One Chlamydia pneumoniae positive culture was found in tympanocentesis aspirate culture from one of the 44 patients, with positive Chlamydiae pneumoniae specific IgG antibody and DNA. Chlamydia trachomatis specific IgG antibody was increased in 14 cases sera and local secretion accordingly, with Chlamydia trachomatis plasmid DNA positive by PCR. Conclusion Chlamydia is a common pathogen in otitis media with effusion.
, 百拇医药
【Key words】 Otitis media with effusion Chlamydia pneumoniae Chlamydia trachomatis Polymerase chain reaction Immunologic tests
衣原体属现分4个种:鹦鹉热衣原体(Chlamdiae psittaci)、沙眼衣原体(Chlamdiae trachomatis,Ct)及新近发现的肺炎衣原体(Chlamdiae pneumoniae, Cpn)、家畜衣原体(Chlamdiae pecorum)。Ct又分为3个组18个血清型,Cpn目前仅为1个血清型。Ct及Cpn是人类的重要致病菌,鹦鹉热衣原体则是少见的人畜共患病原菌[1,2]。我们以微量免疫荧光法、聚合酶链反应法(polymerase chain reaction, PCR)及细胞培养法同时检测血清及中耳抽吸液中Ct和Cpn,并对Ct进行血清学分型,初步了解衣原体在中耳感染的特殊性,为进一步研究衣原体性分泌性中耳炎的临床发病特点、病理形态学改变,并为临床治疗提供参考。
, http://www.100md.com
材料及方法 一、临床资料
我科1996年12月~1998年3月门诊经纯音测听、声导抗测试及局部电耳镜鼓膜像检查、鼻窦内窥镜或鼻后孔镜检查诊断为分泌性中耳炎,并排除鼻咽、咽鼓管周明显机械性阻塞的患者,第一次就诊时同时收集患者血清及局部鼓室抽吸液,即测或-80℃冻存备用。
共收集病例44例(50耳):其中单耳发病38例,双耳发病6例;男30例,女14例;年龄5~67岁,平均38.2岁;病程2 d~20年,20 d以内24例,3个月以内12例,1~20年8例。
二、实验方法
1.衣原体血清及鼓室抽吸液特异性抗体检测:Cpn血清及鼓室抽吸液特异性IgG、IgM、IgA抗体微量免疫荧光法检测(microimmunofluorescence assay),方法及结果判断见文献[3]。Ct血清及鼓室抽吸液特异性IgG、IgM、IgA检测,结果判断及血清学分型也采用微量免疫荧光法,主要步骤如下。
, http://www.100md.com
抗原片制备:Ct C组(血清型C、J、H、I)和B组(血清型B、E和D,中山医科大学免疫学教研室提供)与Cpn原体抗原及鹦鹉热衣原体B11001原体抗原同时以蘸水笔尖点于印有4 mm直径小孔的载玻片各小孔内,室温风干,丙酮固定5 min,即用或干燥密封后-30 ℃保存备用。
血清抗体检测:将血清或中耳抽吸液以pH 7.4 磷酸盐缓冲液(phosphate buffer saline, PBS)稀释成(1:8)~(1:1 024), 分别加于抗原片相应孔中,每孔5 μL,37 ℃孵育30 min,PBS浸洗3次,每次3 min; 再分别加异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记羊抗人IgG、IgM和IgA荧光二抗(Dako公司,丹麦), 每孔5 μL ,37 ℃孵育30 min,PBS浸洗3次,每次3 min;抗原片风干后用pH8.6磷酸甘油缓冲液封片,Olympus 落射式荧光显微镜下400或1 000倍读取结果。凡抗原点红色背景中(0.01% 伊文蓝衬染) 见均匀分布发明亮苹果绿或黄绿色荧光的衣原体颗粒为阳性反应,以最高稀释倍数仍可见明显荧光反应为终点记录效价。
, http://www.100md.com
2.聚合酶链反应检测:Cpn检测取鼓室抽吸液标本20 μL加40 μL裂解液混匀,15 000 r/min离心去上清液,再加裂解液20 μL,煮沸5 min,提取DNA。参照Campbell等[4]报道的Cpn Pst Ⅰ474片段特异性引物序列,自行设计,引物扩增的特异性片段为456 bp,引物序列为:
H1 5'TATTCACCGTCGTACAGCAGA(21 base)3'
H2 5'CCTACGGTGTGTTTCTAATACC(22 base)3'
常规PCR反应条件为94℃变性45 s,55℃退火45 s,72℃延伸1 min,循环30~35次,最后在72℃保温5~7 min。取2 μL扩增反应产物经10%聚丙烯酰胺凝胶电泳,银染观察结果。
Ct检测使用PCR诊断试剂盒由中山医科大学达安医学生物工程公司提供,为Ct质粒DNA特异性,其标本处理、PCR反应参照试剂盒说明书。PCR扩增反应产物经10%聚丙烯酰胺水平电泳,银染观察结果,扩增产物特异性片段为225pb,在此处出现条带为阳性结果。
, 百拇医药
3.Cpn培养和检测:将Hep-2细胞接种于培养基为RPMI-1640,含10%小牛血清、10 mmol/L HEPES(N-[2-Hydroxyethyl]piperazine-N'[2-ethanesulfonic acid])和10 μg/ml庆大霉素的24孔板中,其中一半孔放盖玻片,待细胞长成单层后接种标本,每孔50 μL,接种复孔(其中1孔有盖玻片);30 ℃ 2 500 r/min离心50 min,37℃孵育1 h;弃去上清换成感染培养基(培养基同上,另含1 μg/ml 放线菌酮和100 μg/ml万古霉素),35℃下5% CO2孵育96 h;取出盖玻片PBS漂洗,风干后丙酮固定,加Cpn单抗(杂交瘤bb6,自制)染色30 min(37℃), PBS浸洗3次,每次3 min;再加羊抗鼠IgG-FITC(武汉生物制品所)复染30 min(37℃), PBS浸洗3次,每次3 min。pH8.6磷酸甘油缓冲液封片,Olympus 落射式荧光显微镜下200倍读取结果,凡红色细胞背景(0.01% 伊文蓝衬染)见胞浆中有发明亮苹果绿荧光衣原体包涵体为阳性反应,并在400倍镜下确认。
, 百拇医药
结果 Cpn血清及局部鼓室抽吸液特异性抗体测定及PCR检测:44例中仅1例血清及鼓室抽吸液IgG效价达1:1 024,PCR检测阳性(图1);细胞培养经单抗染色发现衣原体包涵体呈阳性反应(图2),衣原体Hep-2 细胞培养包涵体阳性对照见图3。分泌性中耳炎 Cpn感染阳性率2.3%,此例患者临床病程为10 d。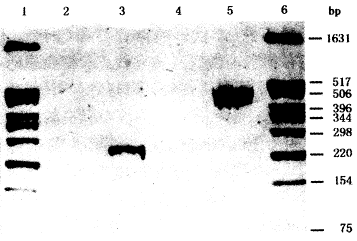
1,6 pBR322/Hinf DNA分子量; 2 Ct质粒PCR阴性标本;3 Ct质粒PCR阳性标本;4 Cpn Pst I 474 bp 片段PCR 阴性标本;5 Cpn Pst I 474 bp片段PCR 阳性标本
图1 PCR检测结果

, http://www.100md.com
图2 中耳渗出液标本Hep-2细胞培养96 h,单抗bb6间接免疫荧光染色肺炎衣原体包涵体阳性。a ×200, b ×400
图3 肺炎衣原体包涵体阳性对照。TW-183株Hep-2细胞培养96 h,单抗bb6间接免疫荧光染色。×200
Ct血清及局部鼓室抽吸液特异性抗体测定:44例中14例血清及鼓室抽吸液特异性IgG抗体分别达(1∶32)~(1∶512)的诊断水平;IgM抗体效价不高; 2例鼓室抽吸液IgA抗体为(1∶8)~(1∶64)。血清与鼓室抽吸液IgG抗体效价经统计学处理:t=0.19,P=0.852,P>0.05,差异无显著性。经血清学初步分型,5例为C组感染,3例为B组感染。PCR检测:在14例血清学阳性标本中鼓室抽吸液PCR检测DNA扩增产物其电泳条带与阳性对照分子量相等,呈阳性反应(图1)。分泌性中耳炎 Ct感染阳性率为31.8%(14/44),其中9例(64.2%)病程为20 d以内,3例(21.4%)1~2个月,2例(14.3%)10~20年。
, http://www.100md.com
鹦鹉热衣原体血清及鼓室抽吸液中特异性抗体均阴性。
讨论 分泌性中耳炎是中耳的常见病,迄今为止发病机理尚未完全阐明。咽鼓管的机械性阻塞、局部病原菌及其毒素的作用、局部及全身免疫系统的异常均为临床上不可忽视的因素。衣原体感染与分泌性中耳炎的关系在国内外均有报道。
Ct是导致沙眼、泌尿生殖道感染、性病性淋巴肉芽肿的重要病原,近期国内外文献报道,已从上呼吸道的不同部位(扁桃体、鼓室抽吸液)分离培养出此病原菌。Cpn则主要寄生于上呼吸道上皮。衣原体感染的临床特点为明显的局部炎症反应到无典型症状的迁延状态,病理特点为局部受累器官的轻微的炎细胞浸润到肉芽组织增生、瘢痕形成。因此,中耳衣原体感染也有可能导致咽鼓管及鼓室肉芽肿形成、咽鼓管阻塞、鼓室胆固醇性肉芽肿,致使分泌性中耳炎迁延不愈,严重影响声音传导等[5,6]。以上的推论还有赖于动物模型的建立及术中病理标本的确立。
, 百拇医药
本实验结果中Cpn在分泌性中耳炎的感染率为2.3%,病程为10 d;Ct在分泌性中耳炎的感染率为31.8%,其中64.2%(9例)在20 d以内,21.4%(3例)在2个月以内,14.3%(2例)的患者临床症状反复发作,迁延10~20年,需要鼓室置管治疗。本组病例中除了2例反复发作、迁延10年以上的患者需鼓室置管以外,其他患者经全身抗衣原体(罗红霉素)治疗,局部一次穿刺抽液,地塞米松注入,临床症状均改善,鼓室积液消退,近期观察未见复发。可见分泌性中耳炎衣原体感染在早期诊断的重要性。衣原体为细胞内寄生,常反复发作,迁延不愈,且对四环素类、大环内脂类较敏感,因此疗程要足够,至少一周以上,条件允许最好作药敏实验,选择有效抗生素[7]。Cpn在分泌性中耳炎的感染与国外学者Hashiguchi报道[8]的急性期抗体阳性率23.5%有一定的差异,Ct 在分泌性中耳炎感染的阳性率与国内(44.4%)、国外(0~50%)报道基本相同[9]。临床病因学诊断应以病原菌培养阳性为标准,遗憾的是本组病例由于鼓室积液标本有限,未作Ct培养。本实验表明鼓室抽吸液特异性抗体与血清抗体效价经统计学处理差异无显著性,说明中耳衣原体感染可以在血清中有特异性抗体效价增高反应,但单一血清抗体效价增高不能排除其他部位的感染。鼓室抽吸液中特异性抗体的增高及PCR检测特异性DNA是确立诊断的重要参考依据;而鼓室抽吸液或组织的病原菌培养阳性则是诊断的标准。
, http://www.100md.com
本实验表明,衣原体是分泌性中耳炎的重要病原微生物之一,早期诊断、合理治疗是防止反复发作、迁延不愈的可靠手段。
参考文献
1 Meijer A, Kwakkel GJ,de Vries A, et al. Species identification of Chlamydia isolates by analyzing restriction fragment length polymorphism of the 16S-23S rRNA spacer region. J Clin Microbiol,1997, 35:1179-1183.
2 Wang SP,Grayston JT. Three new serovars of Chlamydia trachomatis: Da,Ia, and L2a. J Infect Dis, 1991,163:403-405.
, 百拇医药
3 张官萍,宁波.急性咽喉炎患者肺炎衣原体的检测.中华耳鼻咽喉科杂志,1994,29:121.
4 Campbell LA, Perez Melgosa M ,Hamilton DJ,et al. Detection of Chlamydia pneumoniae by polymerase chain reaction. J Clin Microbiol,1992,30:434-439.
5 Grayston JT, Wang S. New knowledge of chlamydiae and the diseases they cause. J Infect Dis, 1975, 132:87-105.
6 李豫峰,罗丽兰.生殖道沙眼衣原体感染与输卵管性不孕关系的研究.中华妇产科杂志,1995,30:471-474.
, 百拇医药
7 Ogawa H, Hashiguchi K, Kazuyama Y. Recovery of chlamydia pneumoniae, in six patients with otitis media with effusion. J Laryngol Otol,1992,106:490-492.
8 Hashiguchi K,Ogawa H,Kazuyama Y.Seroprevalence of Chlamydia pneumoniae infections in otolaryngeal diseases. J Laryngol Otol,1992,106:208-210.
9 王德辉,步星耀,王正敏. 多聚酶链反应法检测中耳渗液中沙眼衣原体. 临床耳鼻咽喉科杂志,1995,9:271-272.
(收稿:1998-10-13 修回:1999-01-07), 百拇医药
单位:张官萍、李永奇、陈靖 广州 中山医科大学第三临床学院耳鼻咽喉科 510630 ;宁波 中山医科大学免疫学教研室
关键词:中耳炎;伴渗出性;衣原体;肺炎;衣原体;沙眼;聚合酶链反应;免疫学试验
中华耳鼻咽喉科杂志990208 【摘要】 目的 了解衣原体感染与分泌性中耳炎的关系,初步建立临床上鼓室抽吸液衣原体的检测方法。方法 收集44例(50耳)分泌性中耳炎患者的血清及鼓室抽吸液,分别以微量免疫荧光法检测衣原体特异性抗体,聚合酶链反应法(polymerase chain reaction, PCR)检测衣原体特异性DNA,用Hep-2细胞进行鼓室抽吸液中肺炎衣原体(Chlamydia pneumoniae, Cpn)培养。结果 1例Cpn培养阳性,且其血清及鼓室抽吸液特异性IgG抗体达到诊断水平,PCR检测特异性DNA阳性;14例血清及鼓室抽吸中沙眼衣原体(Chlamydia trachomatis,Ct)特异性IgG增高,同时PCR检测鼓室抽吸液Ct特异性质粒DNA阳性。结论 衣原体是分泌性中耳炎的重要的致病微生物。
, 百拇医药
Study on the relationship between Chlamydia infection and otitis media with effusion
ZHANG Guanping, NING Bo, LI Yongqi, et al. Department of Otorhinolaryngology, Third Affiliated Hospital, Sun Yat-sen University of Medical Sciences,Guangzhou 510630
【Abstract】 Objective To evaluate the relationship between Chlamydia infection and otitis media with effusion and to establish a method for detection of Chlamydia antibodies in local fluids. Methods Sera and tympanocentesis aspirates from 44 patients with otitis media with effusion were collected. The specimens were used to detect the Chlamydia specific IgG, IgM antibodies using micro-immune fluorescent assay; to detect Chlamydia trachomatis plasmid DNA and Chlamydia pneumoniae genome DNA with polymerase chain reaction (PCR); and to separate Chlamydia pneumoniae in tympanocentesis aspirates with Hep-2 cell culture. Results One Chlamydia pneumoniae positive culture was found in tympanocentesis aspirate culture from one of the 44 patients, with positive Chlamydiae pneumoniae specific IgG antibody and DNA. Chlamydia trachomatis specific IgG antibody was increased in 14 cases sera and local secretion accordingly, with Chlamydia trachomatis plasmid DNA positive by PCR. Conclusion Chlamydia is a common pathogen in otitis media with effusion.
, 百拇医药
【Key words】 Otitis media with effusion Chlamydia pneumoniae Chlamydia trachomatis Polymerase chain reaction Immunologic tests
衣原体属现分4个种:鹦鹉热衣原体(Chlamdiae psittaci)、沙眼衣原体(Chlamdiae trachomatis,Ct)及新近发现的肺炎衣原体(Chlamdiae pneumoniae, Cpn)、家畜衣原体(Chlamdiae pecorum)。Ct又分为3个组18个血清型,Cpn目前仅为1个血清型。Ct及Cpn是人类的重要致病菌,鹦鹉热衣原体则是少见的人畜共患病原菌[1,2]。我们以微量免疫荧光法、聚合酶链反应法(polymerase chain reaction, PCR)及细胞培养法同时检测血清及中耳抽吸液中Ct和Cpn,并对Ct进行血清学分型,初步了解衣原体在中耳感染的特殊性,为进一步研究衣原体性分泌性中耳炎的临床发病特点、病理形态学改变,并为临床治疗提供参考。
, http://www.100md.com
材料及方法 一、临床资料
我科1996年12月~1998年3月门诊经纯音测听、声导抗测试及局部电耳镜鼓膜像检查、鼻窦内窥镜或鼻后孔镜检查诊断为分泌性中耳炎,并排除鼻咽、咽鼓管周明显机械性阻塞的患者,第一次就诊时同时收集患者血清及局部鼓室抽吸液,即测或-80℃冻存备用。
共收集病例44例(50耳):其中单耳发病38例,双耳发病6例;男30例,女14例;年龄5~67岁,平均38.2岁;病程2 d~20年,20 d以内24例,3个月以内12例,1~20年8例。
二、实验方法
1.衣原体血清及鼓室抽吸液特异性抗体检测:Cpn血清及鼓室抽吸液特异性IgG、IgM、IgA抗体微量免疫荧光法检测(microimmunofluorescence assay),方法及结果判断见文献[3]。Ct血清及鼓室抽吸液特异性IgG、IgM、IgA检测,结果判断及血清学分型也采用微量免疫荧光法,主要步骤如下。
, http://www.100md.com
抗原片制备:Ct C组(血清型C、J、H、I)和B组(血清型B、E和D,中山医科大学免疫学教研室提供)与Cpn原体抗原及鹦鹉热衣原体B11001原体抗原同时以蘸水笔尖点于印有4 mm直径小孔的载玻片各小孔内,室温风干,丙酮固定5 min,即用或干燥密封后-30 ℃保存备用。
血清抗体检测:将血清或中耳抽吸液以pH 7.4 磷酸盐缓冲液(phosphate buffer saline, PBS)稀释成(1:8)~(1:1 024), 分别加于抗原片相应孔中,每孔5 μL,37 ℃孵育30 min,PBS浸洗3次,每次3 min; 再分别加异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记羊抗人IgG、IgM和IgA荧光二抗(Dako公司,丹麦), 每孔5 μL ,37 ℃孵育30 min,PBS浸洗3次,每次3 min;抗原片风干后用pH8.6磷酸甘油缓冲液封片,Olympus 落射式荧光显微镜下400或1 000倍读取结果。凡抗原点红色背景中(0.01% 伊文蓝衬染) 见均匀分布发明亮苹果绿或黄绿色荧光的衣原体颗粒为阳性反应,以最高稀释倍数仍可见明显荧光反应为终点记录效价。
, http://www.100md.com
2.聚合酶链反应检测:Cpn检测取鼓室抽吸液标本20 μL加40 μL裂解液混匀,15 000 r/min离心去上清液,再加裂解液20 μL,煮沸5 min,提取DNA。参照Campbell等[4]报道的Cpn Pst Ⅰ474片段特异性引物序列,自行设计,引物扩增的特异性片段为456 bp,引物序列为:
H1 5'TATTCACCGTCGTACAGCAGA(21 base)3'
H2 5'CCTACGGTGTGTTTCTAATACC(22 base)3'
常规PCR反应条件为94℃变性45 s,55℃退火45 s,72℃延伸1 min,循环30~35次,最后在72℃保温5~7 min。取2 μL扩增反应产物经10%聚丙烯酰胺凝胶电泳,银染观察结果。
Ct检测使用PCR诊断试剂盒由中山医科大学达安医学生物工程公司提供,为Ct质粒DNA特异性,其标本处理、PCR反应参照试剂盒说明书。PCR扩增反应产物经10%聚丙烯酰胺水平电泳,银染观察结果,扩增产物特异性片段为225pb,在此处出现条带为阳性结果。
, 百拇医药
3.Cpn培养和检测:将Hep-2细胞接种于培养基为RPMI-1640,含10%小牛血清、10 mmol/L HEPES(N-[2-Hydroxyethyl]piperazine-N'[2-ethanesulfonic acid])和10 μg/ml庆大霉素的24孔板中,其中一半孔放盖玻片,待细胞长成单层后接种标本,每孔50 μL,接种复孔(其中1孔有盖玻片);30 ℃ 2 500 r/min离心50 min,37℃孵育1 h;弃去上清换成感染培养基(培养基同上,另含1 μg/ml 放线菌酮和100 μg/ml万古霉素),35℃下5% CO2孵育96 h;取出盖玻片PBS漂洗,风干后丙酮固定,加Cpn单抗(杂交瘤bb6,自制)染色30 min(37℃), PBS浸洗3次,每次3 min;再加羊抗鼠IgG-FITC(武汉生物制品所)复染30 min(37℃), PBS浸洗3次,每次3 min。pH8.6磷酸甘油缓冲液封片,Olympus 落射式荧光显微镜下200倍读取结果,凡红色细胞背景(0.01% 伊文蓝衬染)见胞浆中有发明亮苹果绿荧光衣原体包涵体为阳性反应,并在400倍镜下确认。
, 百拇医药
结果 Cpn血清及局部鼓室抽吸液特异性抗体测定及PCR检测:44例中仅1例血清及鼓室抽吸液IgG效价达1:1 024,PCR检测阳性(图1);细胞培养经单抗染色发现衣原体包涵体呈阳性反应(图2),衣原体Hep-2 细胞培养包涵体阳性对照见图3。分泌性中耳炎 Cpn感染阳性率2.3%,此例患者临床病程为10 d。

1,6 pBR322/Hinf DNA分子量; 2 Ct质粒PCR阴性标本;3 Ct质粒PCR阳性标本;4 Cpn Pst I 474 bp 片段PCR 阴性标本;5 Cpn Pst I 474 bp片段PCR 阳性标本
图1 PCR检测结果


, http://www.100md.com
图2 中耳渗出液标本Hep-2细胞培养96 h,单抗bb6间接免疫荧光染色肺炎衣原体包涵体阳性。a ×200, b ×400

图3 肺炎衣原体包涵体阳性对照。TW-183株Hep-2细胞培养96 h,单抗bb6间接免疫荧光染色。×200
Ct血清及局部鼓室抽吸液特异性抗体测定:44例中14例血清及鼓室抽吸液特异性IgG抗体分别达(1∶32)~(1∶512)的诊断水平;IgM抗体效价不高; 2例鼓室抽吸液IgA抗体为(1∶8)~(1∶64)。血清与鼓室抽吸液IgG抗体效价经统计学处理:t=0.19,P=0.852,P>0.05,差异无显著性。经血清学初步分型,5例为C组感染,3例为B组感染。PCR检测:在14例血清学阳性标本中鼓室抽吸液PCR检测DNA扩增产物其电泳条带与阳性对照分子量相等,呈阳性反应(图1)。分泌性中耳炎 Ct感染阳性率为31.8%(14/44),其中9例(64.2%)病程为20 d以内,3例(21.4%)1~2个月,2例(14.3%)10~20年。
, http://www.100md.com
鹦鹉热衣原体血清及鼓室抽吸液中特异性抗体均阴性。
讨论 分泌性中耳炎是中耳的常见病,迄今为止发病机理尚未完全阐明。咽鼓管的机械性阻塞、局部病原菌及其毒素的作用、局部及全身免疫系统的异常均为临床上不可忽视的因素。衣原体感染与分泌性中耳炎的关系在国内外均有报道。
Ct是导致沙眼、泌尿生殖道感染、性病性淋巴肉芽肿的重要病原,近期国内外文献报道,已从上呼吸道的不同部位(扁桃体、鼓室抽吸液)分离培养出此病原菌。Cpn则主要寄生于上呼吸道上皮。衣原体感染的临床特点为明显的局部炎症反应到无典型症状的迁延状态,病理特点为局部受累器官的轻微的炎细胞浸润到肉芽组织增生、瘢痕形成。因此,中耳衣原体感染也有可能导致咽鼓管及鼓室肉芽肿形成、咽鼓管阻塞、鼓室胆固醇性肉芽肿,致使分泌性中耳炎迁延不愈,严重影响声音传导等[5,6]。以上的推论还有赖于动物模型的建立及术中病理标本的确立。
, 百拇医药
本实验结果中Cpn在分泌性中耳炎的感染率为2.3%,病程为10 d;Ct在分泌性中耳炎的感染率为31.8%,其中64.2%(9例)在20 d以内,21.4%(3例)在2个月以内,14.3%(2例)的患者临床症状反复发作,迁延10~20年,需要鼓室置管治疗。本组病例中除了2例反复发作、迁延10年以上的患者需鼓室置管以外,其他患者经全身抗衣原体(罗红霉素)治疗,局部一次穿刺抽液,地塞米松注入,临床症状均改善,鼓室积液消退,近期观察未见复发。可见分泌性中耳炎衣原体感染在早期诊断的重要性。衣原体为细胞内寄生,常反复发作,迁延不愈,且对四环素类、大环内脂类较敏感,因此疗程要足够,至少一周以上,条件允许最好作药敏实验,选择有效抗生素[7]。Cpn在分泌性中耳炎的感染与国外学者Hashiguchi报道[8]的急性期抗体阳性率23.5%有一定的差异,Ct 在分泌性中耳炎感染的阳性率与国内(44.4%)、国外(0~50%)报道基本相同[9]。临床病因学诊断应以病原菌培养阳性为标准,遗憾的是本组病例由于鼓室积液标本有限,未作Ct培养。本实验表明鼓室抽吸液特异性抗体与血清抗体效价经统计学处理差异无显著性,说明中耳衣原体感染可以在血清中有特异性抗体效价增高反应,但单一血清抗体效价增高不能排除其他部位的感染。鼓室抽吸液中特异性抗体的增高及PCR检测特异性DNA是确立诊断的重要参考依据;而鼓室抽吸液或组织的病原菌培养阳性则是诊断的标准。
, http://www.100md.com
本实验表明,衣原体是分泌性中耳炎的重要病原微生物之一,早期诊断、合理治疗是防止反复发作、迁延不愈的可靠手段。
参考文献
1 Meijer A, Kwakkel GJ,de Vries A, et al. Species identification of Chlamydia isolates by analyzing restriction fragment length polymorphism of the 16S-23S rRNA spacer region. J Clin Microbiol,1997, 35:1179-1183.
2 Wang SP,Grayston JT. Three new serovars of Chlamydia trachomatis: Da,Ia, and L2a. J Infect Dis, 1991,163:403-405.
, 百拇医药
3 张官萍,宁波.急性咽喉炎患者肺炎衣原体的检测.中华耳鼻咽喉科杂志,1994,29:121.
4 Campbell LA, Perez Melgosa M ,Hamilton DJ,et al. Detection of Chlamydia pneumoniae by polymerase chain reaction. J Clin Microbiol,1992,30:434-439.
5 Grayston JT, Wang S. New knowledge of chlamydiae and the diseases they cause. J Infect Dis, 1975, 132:87-105.
6 李豫峰,罗丽兰.生殖道沙眼衣原体感染与输卵管性不孕关系的研究.中华妇产科杂志,1995,30:471-474.
, 百拇医药
7 Ogawa H, Hashiguchi K, Kazuyama Y. Recovery of chlamydia pneumoniae, in six patients with otitis media with effusion. J Laryngol Otol,1992,106:490-492.
8 Hashiguchi K,Ogawa H,Kazuyama Y.Seroprevalence of Chlamydia pneumoniae infections in otolaryngeal diseases. J Laryngol Otol,1992,106:208-210.
9 王德辉,步星耀,王正敏. 多聚酶链反应法检测中耳渗液中沙眼衣原体. 临床耳鼻咽喉科杂志,1995,9:271-272.
(收稿:1998-10-13 修回:1999-01-07), 百拇医药