柯萨奇B3病毒对小鼠离体心肌细胞力学和收缩蛋白分子的影响
作者:万朝敏 彭文珍 高云钦 王德诚 刘惠莲 王正荣
单位:610041 成都,华西医科大学附属第二医院儿科
关键词:心肌;柯萨奇病毒B组;基因表达;收缩蛋白质类
中华儿科杂志/980908 【摘要】 目的 探讨病毒性心肌炎时病毒直接损伤心肌细胞的发病机理。方法 培养新生BALB/c小鼠的离体心肌细胞,加柯萨奇B3病毒,造成病毒对心肌细胞直接损伤的细胞模型,检测心肌细胞力学和心肌收缩蛋白分子——心肌肌凝蛋白的α重链(α-MHC),β重链 (β-MHC)的基因表达。 结果 柯萨奇B3病毒对体外培养的心肌细胞有高度的易感性,并造成收缩力下降,其中感染24小时的心肌细胞收缩力减弱比12小时更为明显;感染后的心肌细胞收缩蛋白分子发生了改变,表现为α-MHC含量降低(由0.15±0.02减少到 0.13±0.06),而β-MHC含量增加(由0.087±0.008增加到0.111±0.009)。 结论 病毒直接损伤心肌细胞,使心肌细胞收缩蛋白分子的结构发生了改变,从而造成心肌细胞收缩力的下降。
, 百拇医药
The cardiac myocyte mechanics and gene expression of myocardial contractile protein in murine myocytes infected with coxsackievirus B3
Wan Chaomin, Peng Wenzhen, Gao Yunqin, et al. Department of Pediatrics, West China University of Medical Sciences, Chengdu, 610041
【Abstract】 Objective To determine the mechanism responsible for direct damage of cardiac muscle cell by virus in myocarditis. Methods Cellular model of directly injuried cardiac muscle cell by Coxsackievirus B3(CVB3) was established by adding CVB3 into the culture of cardiac muscle cells to detect cardiac muscle cell mechanics and the genes expression of myocardial contractile protein, α-myosin heavy chain (α-MHC) and β-MHC. Results Cultured cardiac muscle cell was susceptible to CVB3. The contractility of cardiac muscle cell infected by CVB3 decreased significantly as compared with normal cardiac muscle cell and decreased more significantly at 24 hours than at 12 hours after infection by CVB3. The gene expression of α-MHC mRNA by cardiac muscle cell infected by CVB3 was significantly decreased (from 0.15±0.02 to 0.13±0.06) but that of β-MHC mRNA was increased (from 0.087±0.008 to 0.111±0.009) as compared with normal cardiac muscle cells. Conclusion CVB3 may directly damage cardiac muscle cell, alter the structure of myocyte contractile proteins and therefore reduce the cardiac muscle cell contractility.
, 百拇医药
【Key words】 Myocardium Coxsackieviruses B Gene expression Contractle proteins
病毒性心肌炎多发生于小儿,它是由病毒(主要是柯萨奇病毒)侵犯心脏所致,其临床症状轻重悬殊[1]。病毒性心肌炎的发病机理目前尚不完全清楚。有学者认为,病毒性心肌炎的早期,主要是病毒在心肌细胞内的大量复制造成细胞损伤。另有研究结果显示,病毒对心肌细胞的损害主要是通过T淋巴细胞促进巨噬细胞积聚所致。本研究通过培养离体的心肌细胞造成柯萨奇B3病毒对心肌细胞的直接损伤的细胞模型,并对其进行细胞力学测试和分子生物学的研究,以探讨病毒性心肌炎的发病机理,为临床有效的治疗提供理论依据。
材料和方法
一、材料
1.病毒:柯萨奇B3病毒,Woodruf亲心肌株,由首都儿科研究所提供。
, 百拇医药
2.试剂和试药:胰蛋白酶(BE04700,25 g装,SerVa公司产品),胶元酶(BE0340,100 mg装,Sigma公司产品),α-心肌肌凝蛋白重链(α-MHC)及β-心肌肌凝蛋白重链(β-MHC)探针(美国Marvin Boluyt博士赠送)等。
3.实验动物:新生BALB/c小鼠,二级动物,由华西医科大学实验动物中心提供。
附表 柯萨奇B3病毒对心肌细胞收缩力的影响(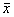 ±s) 组别
±s) 组别
Vmax(μm/s)
ΔSmax(%)
ΔLmax(%)
F值
, http://www.100md.com
P值
t值
P值
正常心肌细胞
230±24
28±8
21±4
16.7*
<0.01
感染后心肌细胞
3.75**
<0.001
, 百拇医药
感染后12h
203±22
21±5
20±6
2.04△
<0.05
感染后24h
188±25
18±6
16±6
*正常心肌细胞与感染后心肌细胞相比 **正常心肌细胞与感染后12小时相比,△感染后12小时与感染后24小时相比
, 百拇医药
4.实验仪器:CO2培养箱(德国荷尔公司产品),倒置显微镜(olympus,1-M型,日本Olympus公司产品),摄像头(JVC,TK-1080E型,日本JVC公司产品),图像分析处理系统(Mias-2000,四川联大计算机图像图形研究所产品),紫外分光光度自动分析仪(UV-240,日本岛津生产),计算机光密度扫描仪(Model CDS-200,日本岛津生产)。
二、方法
1.病毒扩增:按柯萨奇B3病毒标准培养方法[2],经HeLa细胞传代生长3代,收集所有细胞悬液,离心10分钟(3 000 r/min),取上清液测病毒浓度为108 PFU/ml(空斑形成单位),分装后,-30℃保存,以备接种心肌细胞。
2.心肌细胞培养:无毒条件下取出生2天的新生BALB/c小鼠10只的心脏,采用Kasten[3]方法,培养心肌细胞,并用孙红[4]报道的方法进行体外培养心肌细胞的纯化,然后传代接种多瓶再继续培养。
, http://www.100md.com
3.心肌细胞细胞力学的测定:心肌细胞传代培养5天后,将其置于连接了图像处理系统的倒置显微镜下进行检测,其中包括:心肌细胞最大收缩速度(Vmax)、收缩末期时心肌细胞面积最大缩小率(ΔSmax)及心肌细胞长度最大缩短率(ΔLmax),以此作为评价心肌细胞收缩力参数的正常对照值。并对观测视野(5个/瓶,共3瓶)作好标记,以便以后再观察。
4.病毒感染心肌细胞:按每个心肌细胞感染100 PFU的柯萨奇B3病毒,然后在37℃,静置于CO2培养箱中。于接种后12、24小时再检测上述心肌细胞收缩力的参数。
5.心肌细胞中心肌细胞α-MHC mRNA,β-MHC mRNA水平测定:用胰蛋白酶分别将培养的正常心肌细胞和病毒接种的心肌细胞进行消化,用Brinkman polyton匀浆器将其捣碎成匀浆,用异硫氰酸胍-酚-氯仿法(AGPC,一步法)提取总RNA[5]。用紫外分光光度自动分析仪,测定所提取的每一组心肌细胞中总RNA吸光度A(曾称光密度OD)值,可定出总RNA的含量。
, http://www.100md.com
α-MHC寡核苷酸探针和β-MHC寡核苷酸探针,按照Greene等[6]方法,用地高辛标记的α-MHC和β-MHC寡核苷酸探针与打点在尼龙膜上的总RNA进行打点杂交。杂交后的显色结果用计算机密度扫描仪扫描,分别测定每一瓶心肌细胞中的α-MHC,β-MHC杂交后的吸光度A值,共3瓶,根据A值可定量反映出各组心肌细胞的α-MHC,β-MHC的mRNA水平。
取杂交后每一组心肌细胞的α-MHC或β-MHC吸光度值(Aα或Aβ)与总RNA的吸光度值(AT)之比,即Aα/AT或Aβ/AT,可定出反映心肌细胞的α-MHC,β-MHC的表达水平,并消除心肌细胞量以及提取RNA过程中的误差和影响。
用F检验分析正常细胞和感染柯萨奇B3病毒12、24小时时心肌细胞收缩力参数差异的统计学意义。用配对t检验分析正常心肌细胞与柯萨奇B3病毒感染心肌细胞中α-MHC mRNA和β-MHC mRNA之间的关系。
, 百拇医药
结果
一、柯萨奇B3病毒感染心肌细胞
离体的新生BALB/c小鼠的心肌细胞在接种柯萨奇B3病毒后2小时发现心肌细胞开始被感染,6小时约有20%的心肌细胞被感染,12小时有65%心肌细胞被感染,24小时有95%以上的心肌细胞被感染。表现为细胞内出现空泡、细胞肿胀、核仁不清楚、细胞逐渐脱落。感染后4天大部分细胞脱落。
二、柯萨奇B3病毒对心肌细胞收缩力的影响
柯萨奇B3病毒可使体外培养的心肌细胞收缩力减弱,24小时心肌细胞收缩力减弱比12小时更明显(附表)。
三、心肌细胞中心肌细胞α-MHC mRNA,β-MHC mRNA水平
, 百拇医药
图1可见在感染柯萨B3病毒前α-MHC杂交信号强,β-MHC杂交信号相对弱;感染后α-MHC杂交
信号减弱,而β-MHC杂交信号增强。
正常心肌细胞与柯萨奇B3病毒感染的心肌细胞中α-MHC mRNA和β-MHC mRNA含量之间相对的定量关系见图2。
图1 正常心肌细胞与病毒感染的心肌细胞α-MHC、β-MHC斑点杂交图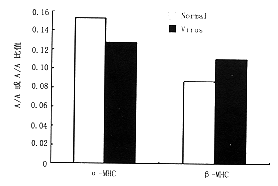
图2 正常心肌细胞与病毒感染的心肌细胞中α-MHC mRNA、β-MHC mRNA水平的比较
, 百拇医药
讨论
国内外许多学者从形态学的角度研究了病毒对心肌细胞的直接损伤过程[7],还有学者从器官水平对病毒性心肌炎的心肌收缩力学进行了大量的研究[8],尚未见有关病毒性心肌炎的心肌细胞力学和心肌收缩蛋白分子的研究报道。
目前认为病毒性心肌炎的发病过程包括两个阶段[9],其中第一阶段以感染后病毒在心肌细胞内大量复制或由于病毒毒素、代谢产物所造成的心肌细胞的直接损伤为主。第二阶段则是免疫反应造成的心肌组织损伤。本研究就是通过柯萨奇B3病毒感染体外培养的心肌细胞,造成病毒对心肌细胞的直接损伤模型,然后观测病毒损伤时心肌细胞力学的特性和心肌细胞收缩蛋白分子的表达水平。有研究结果显示,心肌细胞收缩能量来源于水解肌凝蛋白(myosin)的ATP酶活性,水解肌凝蛋白的ATP酶的活性与心肌细胞的收缩速度成相关关系[10],柯萨奇B3病毒感染,可增加细胞膜能量的消耗,减少细胞内水解肌凝蛋白的ATP酶活性,心肌细胞收缩速度将随着ATP酶活性的降低而减慢。收缩末期时心肌细胞面积缩小的百分率(ΔSmax)以及心肌细胞长度缩短的百分率(ΔLmax),代表了心肌细胞面积以及心肌细胞长度大小,它反映了心肌细胞收缩力的大小。在病毒感染时,心肌细胞收缩力的参数都发生了改变。在没有心室压力负荷的条件下,心肌细胞的收缩速度的减慢,表明了内在心肌细胞的功能下降和收缩力减弱。而肌凝蛋白的ATP酶活性改变的机制,可能与肌凝蛋白重链发生改变有关[11]。心肌细胞的肌凝蛋白重链由α-MHC,β-MHC组成,在正常情况下,肌凝蛋白的重链主要是由α-MHC组成,在心肌细胞产生收缩力方面,α-MHC为主的水解肌凝蛋白远比β-MHC为主的水解肌凝蛋白强。该研究结果显示,当病毒感染心肌细胞时,肌凝蛋白的重链α-MHC水平降低,而β-MHC水平升高,从而使心肌收缩力下降。
, http://www.100md.com
参考文献
1 九省市小儿心肌炎协作组.九省市小儿病毒性心肌炎长期随诊.中华儿科杂志,1987,25:70-73.
2 Crowell RL, Syver JJ. The mammalian cell-virus relationship:VI. Sustained infection of heLa cells by Coxsackie B3 virus and effect on superinfection. J Exp Med, 1961,113:419-435.
3 Kasten FH. Mammalian myocardial cells. In: Kruse PF Jr, Patterson MK Jr, eds. Tissue Culture, methods and applications. New York: Academic Press, 1973.72-86.
, http://www.100md.com
4 孙红.体外培养心肌细胞的纯化方法及其应用.细胞生物学杂志,1988,10:85-87.
5 Kingston RE. Chomczynski P, Sacchi N. Guanidinium methods for total RNA preparation. In: Ausubel FM. Short protocols in molecular biology. 3rd ed. Canada: John Wiley Inc, 1995. 4-8.
6 Greene JM, Struhl K. S1 analysis of messenger RNA using single-stranded DNA probes. In: Ausubel FM. Short protocols in molecular biology. 3rd ed. Canada: John Wiley Inc, 1995. 4-17.
, http://www.100md.com
7 Klingel K. Kandolf R. The role of enterovirus replication in the development of acute and chronic heart muscle disease in different immunocompetent mouse strains. Scand J Infect Dis, 1993,88:79-85.
8 Hamrell BB, Huber SA, Leslie KO. Reduced unloaded sarcomere shortening velocity and a shift to a slower myosin isoform in acute murine coxsackievirus myocarditis. Cir Res, 1994,75:462-472.
9 Wolfgram LJ, Beisel KW, Herskowitz A, et al. Variations in the suceptibility to coxsackievirus B3-induced myocarditis among different strains of mice. J Immunol, 1986,5:1846-1852.
, 百拇医药
10 Sata M, Sugiura S, Yamashita H, et al. Dynamic interaction between cardiac myosin isoforms modifies velocity of actomyosin sliding in vitro. Circ Res, 1993,73:696-704.
11 Yoshinori Seko, Tsuchimochi H, Nakamura T, et al. Expression of major histocompatibility complex class I antigen in murine ventricular myocytes infected with Coxsackievirus B3. Circ Res, 1990,67:360-367.
(收稿:1997-08-01 修回:1998-03-17)
, 百拇医药
单位:610041 成都,华西医科大学附属第二医院儿科
关键词:心肌;柯萨奇病毒B组;基因表达;收缩蛋白质类
中华儿科杂志/980908 【摘要】 目的 探讨病毒性心肌炎时病毒直接损伤心肌细胞的发病机理。方法 培养新生BALB/c小鼠的离体心肌细胞,加柯萨奇B3病毒,造成病毒对心肌细胞直接损伤的细胞模型,检测心肌细胞力学和心肌收缩蛋白分子——心肌肌凝蛋白的α重链(α-MHC),β重链 (β-MHC)的基因表达。 结果 柯萨奇B3病毒对体外培养的心肌细胞有高度的易感性,并造成收缩力下降,其中感染24小时的心肌细胞收缩力减弱比12小时更为明显;感染后的心肌细胞收缩蛋白分子发生了改变,表现为α-MHC含量降低(由0.15±0.02减少到 0.13±0.06),而β-MHC含量增加(由0.087±0.008增加到0.111±0.009)。 结论 病毒直接损伤心肌细胞,使心肌细胞收缩蛋白分子的结构发生了改变,从而造成心肌细胞收缩力的下降。
, 百拇医药
The cardiac myocyte mechanics and gene expression of myocardial contractile protein in murine myocytes infected with coxsackievirus B3
Wan Chaomin, Peng Wenzhen, Gao Yunqin, et al. Department of Pediatrics, West China University of Medical Sciences, Chengdu, 610041
【Abstract】 Objective To determine the mechanism responsible for direct damage of cardiac muscle cell by virus in myocarditis. Methods Cellular model of directly injuried cardiac muscle cell by Coxsackievirus B3(CVB3) was established by adding CVB3 into the culture of cardiac muscle cells to detect cardiac muscle cell mechanics and the genes expression of myocardial contractile protein, α-myosin heavy chain (α-MHC) and β-MHC. Results Cultured cardiac muscle cell was susceptible to CVB3. The contractility of cardiac muscle cell infected by CVB3 decreased significantly as compared with normal cardiac muscle cell and decreased more significantly at 24 hours than at 12 hours after infection by CVB3. The gene expression of α-MHC mRNA by cardiac muscle cell infected by CVB3 was significantly decreased (from 0.15±0.02 to 0.13±0.06) but that of β-MHC mRNA was increased (from 0.087±0.008 to 0.111±0.009) as compared with normal cardiac muscle cells. Conclusion CVB3 may directly damage cardiac muscle cell, alter the structure of myocyte contractile proteins and therefore reduce the cardiac muscle cell contractility.
, 百拇医药
【Key words】 Myocardium Coxsackieviruses B Gene expression Contractle proteins
病毒性心肌炎多发生于小儿,它是由病毒(主要是柯萨奇病毒)侵犯心脏所致,其临床症状轻重悬殊[1]。病毒性心肌炎的发病机理目前尚不完全清楚。有学者认为,病毒性心肌炎的早期,主要是病毒在心肌细胞内的大量复制造成细胞损伤。另有研究结果显示,病毒对心肌细胞的损害主要是通过T淋巴细胞促进巨噬细胞积聚所致。本研究通过培养离体的心肌细胞造成柯萨奇B3病毒对心肌细胞的直接损伤的细胞模型,并对其进行细胞力学测试和分子生物学的研究,以探讨病毒性心肌炎的发病机理,为临床有效的治疗提供理论依据。
材料和方法
一、材料
1.病毒:柯萨奇B3病毒,Woodruf亲心肌株,由首都儿科研究所提供。
, 百拇医药
2.试剂和试药:胰蛋白酶(BE04700,25 g装,SerVa公司产品),胶元酶(BE0340,100 mg装,Sigma公司产品),α-心肌肌凝蛋白重链(α-MHC)及β-心肌肌凝蛋白重链(β-MHC)探针(美国Marvin Boluyt博士赠送)等。
3.实验动物:新生BALB/c小鼠,二级动物,由华西医科大学实验动物中心提供。
附表 柯萨奇B3病毒对心肌细胞收缩力的影响(
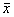 ±s) 组别
±s) 组别Vmax(μm/s)
ΔSmax(%)
ΔLmax(%)
F值
, http://www.100md.com
P值
t值
P值
正常心肌细胞
230±24
28±8
21±4
16.7*
<0.01
感染后心肌细胞
3.75**
<0.001
, 百拇医药
感染后12h
203±22
21±5
20±6
2.04△
<0.05
感染后24h
188±25
18±6
16±6
*正常心肌细胞与感染后心肌细胞相比 **正常心肌细胞与感染后12小时相比,△感染后12小时与感染后24小时相比
, 百拇医药
4.实验仪器:CO2培养箱(德国荷尔公司产品),倒置显微镜(olympus,1-M型,日本Olympus公司产品),摄像头(JVC,TK-1080E型,日本JVC公司产品),图像分析处理系统(Mias-2000,四川联大计算机图像图形研究所产品),紫外分光光度自动分析仪(UV-240,日本岛津生产),计算机光密度扫描仪(Model CDS-200,日本岛津生产)。
二、方法
1.病毒扩增:按柯萨奇B3病毒标准培养方法[2],经HeLa细胞传代生长3代,收集所有细胞悬液,离心10分钟(3 000 r/min),取上清液测病毒浓度为108 PFU/ml(空斑形成单位),分装后,-30℃保存,以备接种心肌细胞。
2.心肌细胞培养:无毒条件下取出生2天的新生BALB/c小鼠10只的心脏,采用Kasten[3]方法,培养心肌细胞,并用孙红[4]报道的方法进行体外培养心肌细胞的纯化,然后传代接种多瓶再继续培养。
, http://www.100md.com
3.心肌细胞细胞力学的测定:心肌细胞传代培养5天后,将其置于连接了图像处理系统的倒置显微镜下进行检测,其中包括:心肌细胞最大收缩速度(Vmax)、收缩末期时心肌细胞面积最大缩小率(ΔSmax)及心肌细胞长度最大缩短率(ΔLmax),以此作为评价心肌细胞收缩力参数的正常对照值。并对观测视野(5个/瓶,共3瓶)作好标记,以便以后再观察。
4.病毒感染心肌细胞:按每个心肌细胞感染100 PFU的柯萨奇B3病毒,然后在37℃,静置于CO2培养箱中。于接种后12、24小时再检测上述心肌细胞收缩力的参数。
5.心肌细胞中心肌细胞α-MHC mRNA,β-MHC mRNA水平测定:用胰蛋白酶分别将培养的正常心肌细胞和病毒接种的心肌细胞进行消化,用Brinkman polyton匀浆器将其捣碎成匀浆,用异硫氰酸胍-酚-氯仿法(AGPC,一步法)提取总RNA[5]。用紫外分光光度自动分析仪,测定所提取的每一组心肌细胞中总RNA吸光度A(曾称光密度OD)值,可定出总RNA的含量。
, http://www.100md.com
α-MHC寡核苷酸探针和β-MHC寡核苷酸探针,按照Greene等[6]方法,用地高辛标记的α-MHC和β-MHC寡核苷酸探针与打点在尼龙膜上的总RNA进行打点杂交。杂交后的显色结果用计算机密度扫描仪扫描,分别测定每一瓶心肌细胞中的α-MHC,β-MHC杂交后的吸光度A值,共3瓶,根据A值可定量反映出各组心肌细胞的α-MHC,β-MHC的mRNA水平。
取杂交后每一组心肌细胞的α-MHC或β-MHC吸光度值(Aα或Aβ)与总RNA的吸光度值(AT)之比,即Aα/AT或Aβ/AT,可定出反映心肌细胞的α-MHC,β-MHC的表达水平,并消除心肌细胞量以及提取RNA过程中的误差和影响。
用F检验分析正常细胞和感染柯萨奇B3病毒12、24小时时心肌细胞收缩力参数差异的统计学意义。用配对t检验分析正常心肌细胞与柯萨奇B3病毒感染心肌细胞中α-MHC mRNA和β-MHC mRNA之间的关系。
, 百拇医药
结果
一、柯萨奇B3病毒感染心肌细胞
离体的新生BALB/c小鼠的心肌细胞在接种柯萨奇B3病毒后2小时发现心肌细胞开始被感染,6小时约有20%的心肌细胞被感染,12小时有65%心肌细胞被感染,24小时有95%以上的心肌细胞被感染。表现为细胞内出现空泡、细胞肿胀、核仁不清楚、细胞逐渐脱落。感染后4天大部分细胞脱落。
二、柯萨奇B3病毒对心肌细胞收缩力的影响
柯萨奇B3病毒可使体外培养的心肌细胞收缩力减弱,24小时心肌细胞收缩力减弱比12小时更明显(附表)。
三、心肌细胞中心肌细胞α-MHC mRNA,β-MHC mRNA水平
, 百拇医药
图1可见在感染柯萨B3病毒前α-MHC杂交信号强,β-MHC杂交信号相对弱;感染后α-MHC杂交
信号减弱,而β-MHC杂交信号增强。
正常心肌细胞与柯萨奇B3病毒感染的心肌细胞中α-MHC mRNA和β-MHC mRNA含量之间相对的定量关系见图2。

图1 正常心肌细胞与病毒感染的心肌细胞α-MHC、β-MHC斑点杂交图

图2 正常心肌细胞与病毒感染的心肌细胞中α-MHC mRNA、β-MHC mRNA水平的比较
, 百拇医药
讨论
国内外许多学者从形态学的角度研究了病毒对心肌细胞的直接损伤过程[7],还有学者从器官水平对病毒性心肌炎的心肌收缩力学进行了大量的研究[8],尚未见有关病毒性心肌炎的心肌细胞力学和心肌收缩蛋白分子的研究报道。
目前认为病毒性心肌炎的发病过程包括两个阶段[9],其中第一阶段以感染后病毒在心肌细胞内大量复制或由于病毒毒素、代谢产物所造成的心肌细胞的直接损伤为主。第二阶段则是免疫反应造成的心肌组织损伤。本研究就是通过柯萨奇B3病毒感染体外培养的心肌细胞,造成病毒对心肌细胞的直接损伤模型,然后观测病毒损伤时心肌细胞力学的特性和心肌细胞收缩蛋白分子的表达水平。有研究结果显示,心肌细胞收缩能量来源于水解肌凝蛋白(myosin)的ATP酶活性,水解肌凝蛋白的ATP酶的活性与心肌细胞的收缩速度成相关关系[10],柯萨奇B3病毒感染,可增加细胞膜能量的消耗,减少细胞内水解肌凝蛋白的ATP酶活性,心肌细胞收缩速度将随着ATP酶活性的降低而减慢。收缩末期时心肌细胞面积缩小的百分率(ΔSmax)以及心肌细胞长度缩短的百分率(ΔLmax),代表了心肌细胞面积以及心肌细胞长度大小,它反映了心肌细胞收缩力的大小。在病毒感染时,心肌细胞收缩力的参数都发生了改变。在没有心室压力负荷的条件下,心肌细胞的收缩速度的减慢,表明了内在心肌细胞的功能下降和收缩力减弱。而肌凝蛋白的ATP酶活性改变的机制,可能与肌凝蛋白重链发生改变有关[11]。心肌细胞的肌凝蛋白重链由α-MHC,β-MHC组成,在正常情况下,肌凝蛋白的重链主要是由α-MHC组成,在心肌细胞产生收缩力方面,α-MHC为主的水解肌凝蛋白远比β-MHC为主的水解肌凝蛋白强。该研究结果显示,当病毒感染心肌细胞时,肌凝蛋白的重链α-MHC水平降低,而β-MHC水平升高,从而使心肌收缩力下降。
, http://www.100md.com
参考文献
1 九省市小儿心肌炎协作组.九省市小儿病毒性心肌炎长期随诊.中华儿科杂志,1987,25:70-73.
2 Crowell RL, Syver JJ. The mammalian cell-virus relationship:VI. Sustained infection of heLa cells by Coxsackie B3 virus and effect on superinfection. J Exp Med, 1961,113:419-435.
3 Kasten FH. Mammalian myocardial cells. In: Kruse PF Jr, Patterson MK Jr, eds. Tissue Culture, methods and applications. New York: Academic Press, 1973.72-86.
, http://www.100md.com
4 孙红.体外培养心肌细胞的纯化方法及其应用.细胞生物学杂志,1988,10:85-87.
5 Kingston RE. Chomczynski P, Sacchi N. Guanidinium methods for total RNA preparation. In: Ausubel FM. Short protocols in molecular biology. 3rd ed. Canada: John Wiley Inc, 1995. 4-8.
6 Greene JM, Struhl K. S1 analysis of messenger RNA using single-stranded DNA probes. In: Ausubel FM. Short protocols in molecular biology. 3rd ed. Canada: John Wiley Inc, 1995. 4-17.
, http://www.100md.com
7 Klingel K. Kandolf R. The role of enterovirus replication in the development of acute and chronic heart muscle disease in different immunocompetent mouse strains. Scand J Infect Dis, 1993,88:79-85.
8 Hamrell BB, Huber SA, Leslie KO. Reduced unloaded sarcomere shortening velocity and a shift to a slower myosin isoform in acute murine coxsackievirus myocarditis. Cir Res, 1994,75:462-472.
9 Wolfgram LJ, Beisel KW, Herskowitz A, et al. Variations in the suceptibility to coxsackievirus B3-induced myocarditis among different strains of mice. J Immunol, 1986,5:1846-1852.
, 百拇医药
10 Sata M, Sugiura S, Yamashita H, et al. Dynamic interaction between cardiac myosin isoforms modifies velocity of actomyosin sliding in vitro. Circ Res, 1993,73:696-704.
11 Yoshinori Seko, Tsuchimochi H, Nakamura T, et al. Expression of major histocompatibility complex class I antigen in murine ventricular myocytes infected with Coxsackievirus B3. Circ Res, 1990,67:360-367.
(收稿:1997-08-01 修回:1998-03-17)
, 百拇医药