大鼠急性感染性脑水肿神经元突触体钙离子浓度与线粒体酶活性的研究
作者:陈立华 杨于嘉 刘运生 陈翔 陶永光 何正文
单位:410008 长沙,湖南医科大学湘雅医院神经病学研究所(陈立华、刘运生、何正文),儿科研究室(杨于嘉,陈翔,陶永光)
关键词:脑水肿;突触体;钙通道;Ca(2+)转运ATP酶;尼莫地平
中华儿科杂志990112 【摘要】 目的 探讨感染性脑水肿神经细胞钙通道变化,神经元细胞内游离钙离子浓度([Ca2+]i)和Ca2+-ATP酶活性变化及其之间的关系。方法 采用急性感染性脑水肿模型,测定神经元突触体胞浆内[Ca2+]i和线粒体Ca2+-ATP酶活性变化,并选用Ca2+通道阻滞剂尼莫地平进行治疗,观察其对突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的影响。结果 在注菌后30分钟4、24小时感染性脑水肿突触体[Ca2+]i分别为305±27、352±21、413±48 nmol/L,线粒体Ca2+-ATP酶活性分别为0.52±0.12、0.35±0.08、0.24±0.12 μmol/(g.h);电镜检查结果亦表明,菌液组突触体和线粒体明显肿胀,内有空泡形成。应用尼莫地平治疗后[Ca2+]i明显下降,而Ca2+-ATP酶活性明显恢复,脑水肿减轻。结论 感染性脑水肿神经细胞钙离子通道开放,细胞内Ca2+超载,突触体[Ca2+]i与线粒体Ca2+-ATP酶活性变化呈负相关关系;尼莫地平通过降低突触体胞浆中[Ca2+]i和恢复线粒体Ca2+-ATP酶活性,从而减轻脑水肿。
, 百拇医药
A study on concentration of cytosolic free calcium in the synaptosomes and mitochondrial Ca2+-ATPase activities following acute brain edema induced by injection of pertussis bacilli in rats CHEN Lihua, YANG Yujia, LIU Yunsheng, et al. Department of Neurosurgery, Xiangya Hospital, Hunan Medical University, Changsha 410008
【Abstract】 Objective To elucidate the changes of neuronal Ca2+ channel and to investigate the relationship between changes of cytosolic free calcium ([Ca2+]i) concentration in the synaptosomes and mitochondrial Ca2+-ATPase activities. Methods The authors determined the level of [Ca2+]i in the synaptosomes and activities of mitochondrial Ca2+-ATPase in the acute brain edema induced by injection of Pertussis bacilli (Pb). Nimodipine, a calcium channel antagonist, was employed to show its effects on [Ca2+]i in the synaptosomes, and alteration of Ca2+-ATPase activity in the mitochondria. Results The level of [Ca2+]i significantly incrcased in the Pb-injected cerebral hemisphere in the Pb group as compared with that of NS group at 30 min after injection. The level of [Ca2+]i kept higher in the Pb group at 4,24 hours after injection of Pb (P<0.05). In contrast, the activities of mitochondrial Ca2+-ATPase were decreased remarkably in the Pb group (P<0.05). Conclusion The neuronal Ca2+ channel opened after injection of Pb. There was a negative correlation between activities of Ca2+-ATPase and [Ca2+]i. Nimodipine reduced brain edema through stimulating the activities of Ca2+-ATPase in the mitochondria, and decreasing the levels of [Ca2+]i in the synaptosomes.
, 百拇医药
【Key words】 Brain edema Synaptosomes Calcium channels Ca(2+)-Transponting ATPase Nimodipine
脑水肿的发生机制尚不完全清楚,多数学者认为细胞内钙离子浓度([Ca2+]i)超载是引起细胞毒性的关键因素[1]。近年来钙离子(Ca2+)通道方面的研究已成为该领域研究的热点[2]。为探讨急性感染性脑水肿神经细胞突触体[Ca2+]i与线粒体Ca2+-ATP酶活性变化及它们之间的关系,我们采用第二代细胞内Ca2+荧光指示剂Fura-2/AM,检测急性感染性脑水肿时突触体胞浆内[Ca2+]i和线粒体Ca2+-ATP酶活性变化。在此基础上采用L-型钙离子通道阻滞剂尼莫地平进行治疗,研究其对突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的影响,为临床治疗措施的制定提供实验和理论依据。
, 百拇医药
材料和方法
一、动物分组
健康SD大鼠共73只,雌雄不分,体重210±30 g,随机分为:(1)正常对照组(8只),不进行任何手术处理;(2)生理盐水组(18只),左颈内动脉注射生理盐水(0.2 ml/kg);(3)百日咳菌液组(26只),左颈内动脉注射百日咳菌液(0.2 ml/kg,每ml含菌量为108亿);(4)尼莫地平治疗组(21只),颈内动脉注射百日咳菌液后,于5分钟内经腹腔内注射尼莫地平(0.25 mg/kg),尼莫地平治疗组于注菌后24小时内每8小时重复注射相同剂量的尼莫地平。大鼠分别于注菌或注生理盐水后30分钟、4小时和24小时断头处死。
二、实验方法
1.突触体和线粒体的制备:参照Dodd等[3]的方法,以不同密度蔗糖梯度低温差速离心法分离出脑突触体和线粒体,具体方法参见文献[4],透射电镜证实所含脑突触体和线粒体的纯度高于85%。采用7170型全自动生化分析仪测定突触体和线粒体的蛋白质浓度,Hepes液调节突触体蛋白质浓度在1.5~2.5 mg/ml。
, 百拇医药
2.电镜检查:分别取制得的突触体和线粒体沉淀物,用含2%多聚甲醛和2.5%戊二醛0.1 mol/L(pH 7.4,4℃下)浸泡2小时后初固定,1%锇酸后固定1小时,常规脱水、渗透、包埋和超薄切。脑组织电镜样本制备及结果参见文献[5]。
3.突触体[Ca2+]i测定:参照Grynkievicz等[6]方法,采用日立-850型荧光分光光度计,测定突触体的荧光强度。根据荧光强度,按下式计算出[Ca2+]i[7]:
[Ca2+]i=Kd×[(F-Fmin)÷(Fmax-F)](nmol/L)
Kd是Fura-2与Ca2+反应的解离常数,Kd=224 nm。F为340 nm激发波长测得的荧光强度,Fmax为加入Triton X-100(终浓度为0.01%~0.1%)后的最大荧光强度,Fmin为在Fmax基础上加入EGTA(终浓度为5 mmol/L)后所测得的最小荧光强度。
, 百拇医药
4.线粒体Ca2+-ATP酶活性测定:参照Pillai等[8]方法,采用Muszbck微量定磷法测定酶的活力。Ca2+、Mg2+-ATP酶与Mg2+-ATP酶之差即为钙泵的Ca2+-ATP酶的活性,酶活性单位以μmol/(g.h)表示。
三、统计学分析
本研究测定值用平均数±标准差(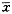 ±s)来表示,多个均数比较用方差分析:采用直线回归相关分析。
±s)来表示,多个均数比较用方差分析:采用直线回归相关分析。
结果
一、突触体[Ca2+]i及线粒体Ca2+-ATP酶活性改变
, 百拇医药
与生理盐水组和正常对照组相比,百日咳菌液组注菌后30分钟注菌侧脑突触体胞浆内
[Ca2+]i即已明显升高,注菌后4小时和24小时组,其[Ca2+]i持续升高,差异均有显著意义(P<0.05);与之相反,注菌后30分钟时,线粒体Ca2+-ATP酶活性明显下降,4小时和24小时Ca2+-ATP酶活性持续进行性下降,差异亦均有显著意义(P<0.05)。尼莫地平治疗组30分钟时,注菌侧脑突触体[Ca2+]i明显低于菌液组,4小时和24小时其[Ca2+]i亦明显下降,尤以4小时[Ca2+]i降低最明显,差异均有显著意义(P<0.05);而线粒体Ca2+-ATP酶活性则明显回升(P<0.05)。详见表1。无论何组及何阶段[Ca2+]i与Ca2+-ATP酶之间均呈负相关关系,r在-0.89~-0.99之间,P均<0.05。
, 百拇医药
表1 各组突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的动态变化(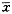 ±s) 组 别
±s) 组 别
[Ca2+]i(nmol/L)
Ca2+-ATP酶[μmol/(g.h)]
30min
4h
24h
30min
4h
24h
, 百拇医药
正常对照组
128± 7(8)*
1.37±0.07*
生理盐水组
133±15(5)*
150±12( 8)*
165±21( 5)*
1.24±0.10*
1.32±0.13*
1.21±0.11*
, http://www.100md.com
百日咳菌液组
305±27(6)
352±21(10)
413±48(10)
0.52±0.12
0.35±0.08
0.24±0.12
尼莫地平组
231±30(5)*
158±12( 8)*
216±33( 8)*
, http://www.100md.com
0.82±0.14*
0.88±0.10*
0.61±0.11*
F值
9.63
20.77
7.52
4.51
9.01
10.34
注:表中()内为大鼠例数;*与百日咳菌液组比较(P<0.05) 二、突触体和线粒体的电镜检查结果
, 百拇医药
注菌侧突触体和线粒体明显肿胀,内有空泡形成,应用尼莫地平治疗后突触体内肿胀明显减轻,超微结构损害显著减轻,从形态学证实应用尼莫地平治疗后神经细胞水肿及脑水肿明显减轻。
讨论
一、突触体[Ca2+]i与线粒体Ca2+-ATP酶活性改变
Ca2+是神经细胞信息传递的重要第二信使,对神经细胞递质的合成与释放、轴浆的运输、多种蛋白激酶和酯酶的活化起着重要的调控作用。细胞内外存在很大的Ca2+浓度梯度差,维持细胞内外Ca2+浓度梯度差主要依赖于细胞膜上的Ca2+通道的高选择性和胞质膜及线粒体Ca2+-ATP酶的主动转运。本实验采用不同蔗糖密度梯度法制备脑突触体,测得正常神经细胞突触体静息状态下[Ca2+]i为128±7 nmol/L。卢步峰等[9]测定神经细胞悬液细胞内[Ca2+]i为109±12 nmol/L;徐如祥等[10]则测得正常神经细胞突触体[Ca2+]i为118±29 nmol/L。本组研究的结果与之基本吻合,同时突触体和线粒体电镜检查亦表明本组制备的突触体和线粒体结构完整,具有良好的生物活性,且其纯度>85%,说明本测定方法是可行的。
, http://www.100md.com
突触体是具有突触区完整形态结构的封闭颗粒,是脑组织在匀浆超速离心过程中,突触前神经末梢从轴突上断裂、自动封闭而形成的神经末梢单位,其内含有各种细胞器,膜上有Ca2+通道,它保留着活细胞的一系列特性。所以,突触体内[Ca2+]i可代表神经元细胞浆内
[Ca2+]i。线粒体富含Ca2+-ATP酶,也称钙泵,是维持细胞内钙稳态平衡的主要细胞器。故本组实验利用线粒体测定其Ca2+-ATP酶活力来反映细胞内Ca2+-ATP酶的活性。感染性脑水肿早期(注菌后30分钟),突触体[Ca2+]i明显高于正常对照组和生理盐水组(P<0.05),注菌后4、24小时突触体[Ca2+]i持续进行性升高,[Ca2+]i随脑水肿时间的延长而进行性增高。与之相反,注菌后30分钟线粒体Ca2+-ATP酶活性则显著下降,注菌后4小时和24小时Ca2+-ATP酶活性持续降低,随注菌后时间的延长而递降。菌液组注菌后4小时线粒体Ca2+-ATP酶活性较生理盐水组降低了73%,注菌后24小时则下降了80%。相关回归分析结果表明,菌液组注菌侧神经细胞突触体[Ca2+]i与线粒体Ca2+-ATP酶活性之间的变化均呈负相关关系。注菌后由于脑缺血等因素引起脑能量代谢障碍,ATP生成不足,造成神经细胞膜Ca2+-ATP酶活性下降,钙泵排出Ca2+的能力下降,进一步加重神经细胞内Ca2+超载,加重脑水肿。这也充分论证了感染性脑水肿后神经元Ca2+通道发生了变化,并揭示了Ca2+通道开放与神经细胞内Ca2+超载和线粒体内Ca2+-ATP酶活性下降存在着内在的密切联系。
, http://www.100md.com
二、尼莫地平对[Ca2+]i与Ca2+-ATP酶活性的影响
尼莫地平与神经细胞膜上L-型钙通道的α1亚单位有非常高的亲和力,当尼莫地平与细胞膜上受体识别位点结合后,引起L型电压依赖性钙离子通道构型发生改变,特异性阻断细胞膜上Ca2+通道,抑制细胞外Ca2+内流,防止细胞内Ca2+超载。同时,尼莫地平还直接刺激神经细胞内ATP依赖性钙离子泵,恢复Ca2+-ATP酶的活性,一方面促进胞浆内Ca2+外排;另一方面,增强线粒体等Ca2+库摄取和储存Ca2+的能力,缓解细胞内Ca2+超载,从而使紊乱的细胞内外Ca2+交换趋于正常,这已从本实验结果得到证明。由于阻止了细胞内Ca2+超载,从而在根本上阻断Ca2+超载所诱发的一系列病理变化,保护脑组织,减轻脑水肿。关于尼莫地平对脑水肿的治疗作用,目前国内外尚存在争论。本组应用尼莫地平治疗感染性脑水肿后,其各时间组线粒体Ca2+-ATP酶活性均明显升高;而突触体[Ca2+]i明显下降,与Ca2+-ATP酶活性升高呈负相关关系。提示尼莫地平可通过阻断L-型钙离子通道和激活线粒体Ca2+-ATP酶活性,从而显著降低突触体[Ca2+]i,对感染性脑水肿有治疗作用,可减轻脑细胞损害,这也得到电镜检查结果的支持。总之,本研究结果提示Ca2+通道阻滞剂是治疗感染性脑水肿的一种有效的辅助途径。
, http://www.100md.com
从本研究结果来看,神经细胞胞浆内[Ca2+]i升高机理,可能与以下两方面有关:(1)神经细胞膜上Ca2+通道开放,使细胞外液中大量的Ca2+内流。(2)脑缺血引起能量代谢障碍,ATP分解增加而合成减少,引起细胞内ATP匮乏,其胞质膜上的Ca2+-ATP酶活性受抑制,细胞内Ca2+外排减少;同时,线粒体Ca2+-ATP酶活性降低,引起线粒体等Ca2+库储存Ca2+的能力下降,从而加重细胞内Ca2+超载。本研究结果亦表明,感染性脑水肿后Ca2+-ATP酶活性随脑水肿时间的延长而递减,且与[Ca2+]i呈负相关关系。Ca2+-ATP酶活性下降在神经细胞胞浆内[Ca2+]i升高的机理中起着重要的作用。
本研究由国家自然科学基金资助(基金项目编号:39470233)
, http://www.100md.com
参考文献
[1] Dalkara T, Ayata C, Demirci M, et al. Effects of cerebral ischemia on N-Methyl-D-Aspartate and dihydropyridine-sensitive calcium currents. Stroke, 1996, 27:127-133.
[2] Tymianski M, Tator CH. Normal and abnormal calcium homeostasis in neurons: a basis for the pathophysiology of traumatic and ischemic central nervous ystem injury. Neurosurgery, 1996, 38:1176-1195.
[3] Dodd PR, Hardy JA, Oakley AE, et al. A rapid method for preparing synaption: comparision, with alternative procedues. Brain Res, 1981, 226:107-118.
, 百拇医药
[4] 陈立华,曹美鸿,杨于嘉,等.Fura-2荧光标记法测定突触体内游离Ca2+ 浓度的原理及方法.临床神经科学.1997,5:71-74.
[5] 陈立华,曹美鸿,杨于嘉,等.尼莫地平对感染性脑水肿的脑保护作用.湖南医科大学学报,1997,22:393-396.
[6] Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985, 260:3440-3450.
[7] Cobbold PH, Rink TJ. Fluorescence and bioluminescen measurement of cytoplasmic free calcium. Biochem J, 1987, 248:313-328.
, http://www.100md.com
[8] Pillai NP, Ross DH. Effects of opiates on high-affinity Ca2+, Mg2+-ATPase in brain membrane subfraxtions. J Neurochem, 1986, 47:1642-1648.
[9] 卢步峰,黄诒森,鲁友明.用Fura-2双波长荧光法测定神经细胞内游离钙.生物化学与生物物理进展,1994,21:275-278.
[10] 徐如祥,易声禹.脑损伤时脑突触体游离钙及脑皮质总钙量变化.中华创伤杂志,1993,9:151-153.
(收稿:1997-12-25 修回:1998-06-12), 百拇医药
单位:410008 长沙,湖南医科大学湘雅医院神经病学研究所(陈立华、刘运生、何正文),儿科研究室(杨于嘉,陈翔,陶永光)
关键词:脑水肿;突触体;钙通道;Ca(2+)转运ATP酶;尼莫地平
中华儿科杂志990112 【摘要】 目的 探讨感染性脑水肿神经细胞钙通道变化,神经元细胞内游离钙离子浓度([Ca2+]i)和Ca2+-ATP酶活性变化及其之间的关系。方法 采用急性感染性脑水肿模型,测定神经元突触体胞浆内[Ca2+]i和线粒体Ca2+-ATP酶活性变化,并选用Ca2+通道阻滞剂尼莫地平进行治疗,观察其对突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的影响。结果 在注菌后30分钟4、24小时感染性脑水肿突触体[Ca2+]i分别为305±27、352±21、413±48 nmol/L,线粒体Ca2+-ATP酶活性分别为0.52±0.12、0.35±0.08、0.24±0.12 μmol/(g.h);电镜检查结果亦表明,菌液组突触体和线粒体明显肿胀,内有空泡形成。应用尼莫地平治疗后[Ca2+]i明显下降,而Ca2+-ATP酶活性明显恢复,脑水肿减轻。结论 感染性脑水肿神经细胞钙离子通道开放,细胞内Ca2+超载,突触体[Ca2+]i与线粒体Ca2+-ATP酶活性变化呈负相关关系;尼莫地平通过降低突触体胞浆中[Ca2+]i和恢复线粒体Ca2+-ATP酶活性,从而减轻脑水肿。
, 百拇医药
A study on concentration of cytosolic free calcium in the synaptosomes and mitochondrial Ca2+-ATPase activities following acute brain edema induced by injection of pertussis bacilli in rats CHEN Lihua, YANG Yujia, LIU Yunsheng, et al. Department of Neurosurgery, Xiangya Hospital, Hunan Medical University, Changsha 410008
【Abstract】 Objective To elucidate the changes of neuronal Ca2+ channel and to investigate the relationship between changes of cytosolic free calcium ([Ca2+]i) concentration in the synaptosomes and mitochondrial Ca2+-ATPase activities. Methods The authors determined the level of [Ca2+]i in the synaptosomes and activities of mitochondrial Ca2+-ATPase in the acute brain edema induced by injection of Pertussis bacilli (Pb). Nimodipine, a calcium channel antagonist, was employed to show its effects on [Ca2+]i in the synaptosomes, and alteration of Ca2+-ATPase activity in the mitochondria. Results The level of [Ca2+]i significantly incrcased in the Pb-injected cerebral hemisphere in the Pb group as compared with that of NS group at 30 min after injection. The level of [Ca2+]i kept higher in the Pb group at 4,24 hours after injection of Pb (P<0.05). In contrast, the activities of mitochondrial Ca2+-ATPase were decreased remarkably in the Pb group (P<0.05). Conclusion The neuronal Ca2+ channel opened after injection of Pb. There was a negative correlation between activities of Ca2+-ATPase and [Ca2+]i. Nimodipine reduced brain edema through stimulating the activities of Ca2+-ATPase in the mitochondria, and decreasing the levels of [Ca2+]i in the synaptosomes.
, 百拇医药
【Key words】 Brain edema Synaptosomes Calcium channels Ca(2+)-Transponting ATPase Nimodipine
脑水肿的发生机制尚不完全清楚,多数学者认为细胞内钙离子浓度([Ca2+]i)超载是引起细胞毒性的关键因素[1]。近年来钙离子(Ca2+)通道方面的研究已成为该领域研究的热点[2]。为探讨急性感染性脑水肿神经细胞突触体[Ca2+]i与线粒体Ca2+-ATP酶活性变化及它们之间的关系,我们采用第二代细胞内Ca2+荧光指示剂Fura-2/AM,检测急性感染性脑水肿时突触体胞浆内[Ca2+]i和线粒体Ca2+-ATP酶活性变化。在此基础上采用L-型钙离子通道阻滞剂尼莫地平进行治疗,研究其对突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的影响,为临床治疗措施的制定提供实验和理论依据。
, 百拇医药
材料和方法
一、动物分组
健康SD大鼠共73只,雌雄不分,体重210±30 g,随机分为:(1)正常对照组(8只),不进行任何手术处理;(2)生理盐水组(18只),左颈内动脉注射生理盐水(0.2 ml/kg);(3)百日咳菌液组(26只),左颈内动脉注射百日咳菌液(0.2 ml/kg,每ml含菌量为108亿);(4)尼莫地平治疗组(21只),颈内动脉注射百日咳菌液后,于5分钟内经腹腔内注射尼莫地平(0.25 mg/kg),尼莫地平治疗组于注菌后24小时内每8小时重复注射相同剂量的尼莫地平。大鼠分别于注菌或注生理盐水后30分钟、4小时和24小时断头处死。
二、实验方法
1.突触体和线粒体的制备:参照Dodd等[3]的方法,以不同密度蔗糖梯度低温差速离心法分离出脑突触体和线粒体,具体方法参见文献[4],透射电镜证实所含脑突触体和线粒体的纯度高于85%。采用7170型全自动生化分析仪测定突触体和线粒体的蛋白质浓度,Hepes液调节突触体蛋白质浓度在1.5~2.5 mg/ml。
, 百拇医药
2.电镜检查:分别取制得的突触体和线粒体沉淀物,用含2%多聚甲醛和2.5%戊二醛0.1 mol/L(pH 7.4,4℃下)浸泡2小时后初固定,1%锇酸后固定1小时,常规脱水、渗透、包埋和超薄切。脑组织电镜样本制备及结果参见文献[5]。
3.突触体[Ca2+]i测定:参照Grynkievicz等[6]方法,采用日立-850型荧光分光光度计,测定突触体的荧光强度。根据荧光强度,按下式计算出[Ca2+]i[7]:
[Ca2+]i=Kd×[(F-Fmin)÷(Fmax-F)](nmol/L)
Kd是Fura-2与Ca2+反应的解离常数,Kd=224 nm。F为340 nm激发波长测得的荧光强度,Fmax为加入Triton X-100(终浓度为0.01%~0.1%)后的最大荧光强度,Fmin为在Fmax基础上加入EGTA(终浓度为5 mmol/L)后所测得的最小荧光强度。
, 百拇医药
4.线粒体Ca2+-ATP酶活性测定:参照Pillai等[8]方法,采用Muszbck微量定磷法测定酶的活力。Ca2+、Mg2+-ATP酶与Mg2+-ATP酶之差即为钙泵的Ca2+-ATP酶的活性,酶活性单位以μmol/(g.h)表示。
三、统计学分析
本研究测定值用平均数±标准差(
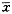 ±s)来表示,多个均数比较用方差分析:采用直线回归相关分析。
±s)来表示,多个均数比较用方差分析:采用直线回归相关分析。结果
一、突触体[Ca2+]i及线粒体Ca2+-ATP酶活性改变
, 百拇医药
与生理盐水组和正常对照组相比,百日咳菌液组注菌后30分钟注菌侧脑突触体胞浆内
[Ca2+]i即已明显升高,注菌后4小时和24小时组,其[Ca2+]i持续升高,差异均有显著意义(P<0.05);与之相反,注菌后30分钟时,线粒体Ca2+-ATP酶活性明显下降,4小时和24小时Ca2+-ATP酶活性持续进行性下降,差异亦均有显著意义(P<0.05)。尼莫地平治疗组30分钟时,注菌侧脑突触体[Ca2+]i明显低于菌液组,4小时和24小时其[Ca2+]i亦明显下降,尤以4小时[Ca2+]i降低最明显,差异均有显著意义(P<0.05);而线粒体Ca2+-ATP酶活性则明显回升(P<0.05)。详见表1。无论何组及何阶段[Ca2+]i与Ca2+-ATP酶之间均呈负相关关系,r在-0.89~-0.99之间,P均<0.05。
, 百拇医药
表1 各组突触体[Ca2+]i和线粒体Ca2+-ATP酶活性的动态变化(
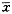 ±s) 组 别
±s) 组 别[Ca2+]i(nmol/L)
Ca2+-ATP酶[μmol/(g.h)]
30min
4h
24h
30min
4h
24h
, 百拇医药
正常对照组
128± 7(8)*
1.37±0.07*
生理盐水组
133±15(5)*
150±12( 8)*
165±21( 5)*
1.24±0.10*
1.32±0.13*
1.21±0.11*
, http://www.100md.com
百日咳菌液组
305±27(6)
352±21(10)
413±48(10)
0.52±0.12
0.35±0.08
0.24±0.12
尼莫地平组
231±30(5)*
158±12( 8)*
216±33( 8)*
, http://www.100md.com
0.82±0.14*
0.88±0.10*
0.61±0.11*
F值
9.63
20.77
7.52
4.51
9.01
10.34
注:表中()内为大鼠例数;*与百日咳菌液组比较(P<0.05) 二、突触体和线粒体的电镜检查结果
, 百拇医药
注菌侧突触体和线粒体明显肿胀,内有空泡形成,应用尼莫地平治疗后突触体内肿胀明显减轻,超微结构损害显著减轻,从形态学证实应用尼莫地平治疗后神经细胞水肿及脑水肿明显减轻。
讨论
一、突触体[Ca2+]i与线粒体Ca2+-ATP酶活性改变
Ca2+是神经细胞信息传递的重要第二信使,对神经细胞递质的合成与释放、轴浆的运输、多种蛋白激酶和酯酶的活化起着重要的调控作用。细胞内外存在很大的Ca2+浓度梯度差,维持细胞内外Ca2+浓度梯度差主要依赖于细胞膜上的Ca2+通道的高选择性和胞质膜及线粒体Ca2+-ATP酶的主动转运。本实验采用不同蔗糖密度梯度法制备脑突触体,测得正常神经细胞突触体静息状态下[Ca2+]i为128±7 nmol/L。卢步峰等[9]测定神经细胞悬液细胞内[Ca2+]i为109±12 nmol/L;徐如祥等[10]则测得正常神经细胞突触体[Ca2+]i为118±29 nmol/L。本组研究的结果与之基本吻合,同时突触体和线粒体电镜检查亦表明本组制备的突触体和线粒体结构完整,具有良好的生物活性,且其纯度>85%,说明本测定方法是可行的。
, http://www.100md.com
突触体是具有突触区完整形态结构的封闭颗粒,是脑组织在匀浆超速离心过程中,突触前神经末梢从轴突上断裂、自动封闭而形成的神经末梢单位,其内含有各种细胞器,膜上有Ca2+通道,它保留着活细胞的一系列特性。所以,突触体内[Ca2+]i可代表神经元细胞浆内
[Ca2+]i。线粒体富含Ca2+-ATP酶,也称钙泵,是维持细胞内钙稳态平衡的主要细胞器。故本组实验利用线粒体测定其Ca2+-ATP酶活力来反映细胞内Ca2+-ATP酶的活性。感染性脑水肿早期(注菌后30分钟),突触体[Ca2+]i明显高于正常对照组和生理盐水组(P<0.05),注菌后4、24小时突触体[Ca2+]i持续进行性升高,[Ca2+]i随脑水肿时间的延长而进行性增高。与之相反,注菌后30分钟线粒体Ca2+-ATP酶活性则显著下降,注菌后4小时和24小时Ca2+-ATP酶活性持续降低,随注菌后时间的延长而递降。菌液组注菌后4小时线粒体Ca2+-ATP酶活性较生理盐水组降低了73%,注菌后24小时则下降了80%。相关回归分析结果表明,菌液组注菌侧神经细胞突触体[Ca2+]i与线粒体Ca2+-ATP酶活性之间的变化均呈负相关关系。注菌后由于脑缺血等因素引起脑能量代谢障碍,ATP生成不足,造成神经细胞膜Ca2+-ATP酶活性下降,钙泵排出Ca2+的能力下降,进一步加重神经细胞内Ca2+超载,加重脑水肿。这也充分论证了感染性脑水肿后神经元Ca2+通道发生了变化,并揭示了Ca2+通道开放与神经细胞内Ca2+超载和线粒体内Ca2+-ATP酶活性下降存在着内在的密切联系。
, http://www.100md.com
二、尼莫地平对[Ca2+]i与Ca2+-ATP酶活性的影响
尼莫地平与神经细胞膜上L-型钙通道的α1亚单位有非常高的亲和力,当尼莫地平与细胞膜上受体识别位点结合后,引起L型电压依赖性钙离子通道构型发生改变,特异性阻断细胞膜上Ca2+通道,抑制细胞外Ca2+内流,防止细胞内Ca2+超载。同时,尼莫地平还直接刺激神经细胞内ATP依赖性钙离子泵,恢复Ca2+-ATP酶的活性,一方面促进胞浆内Ca2+外排;另一方面,增强线粒体等Ca2+库摄取和储存Ca2+的能力,缓解细胞内Ca2+超载,从而使紊乱的细胞内外Ca2+交换趋于正常,这已从本实验结果得到证明。由于阻止了细胞内Ca2+超载,从而在根本上阻断Ca2+超载所诱发的一系列病理变化,保护脑组织,减轻脑水肿。关于尼莫地平对脑水肿的治疗作用,目前国内外尚存在争论。本组应用尼莫地平治疗感染性脑水肿后,其各时间组线粒体Ca2+-ATP酶活性均明显升高;而突触体[Ca2+]i明显下降,与Ca2+-ATP酶活性升高呈负相关关系。提示尼莫地平可通过阻断L-型钙离子通道和激活线粒体Ca2+-ATP酶活性,从而显著降低突触体[Ca2+]i,对感染性脑水肿有治疗作用,可减轻脑细胞损害,这也得到电镜检查结果的支持。总之,本研究结果提示Ca2+通道阻滞剂是治疗感染性脑水肿的一种有效的辅助途径。
, http://www.100md.com
从本研究结果来看,神经细胞胞浆内[Ca2+]i升高机理,可能与以下两方面有关:(1)神经细胞膜上Ca2+通道开放,使细胞外液中大量的Ca2+内流。(2)脑缺血引起能量代谢障碍,ATP分解增加而合成减少,引起细胞内ATP匮乏,其胞质膜上的Ca2+-ATP酶活性受抑制,细胞内Ca2+外排减少;同时,线粒体Ca2+-ATP酶活性降低,引起线粒体等Ca2+库储存Ca2+的能力下降,从而加重细胞内Ca2+超载。本研究结果亦表明,感染性脑水肿后Ca2+-ATP酶活性随脑水肿时间的延长而递减,且与[Ca2+]i呈负相关关系。Ca2+-ATP酶活性下降在神经细胞胞浆内[Ca2+]i升高的机理中起着重要的作用。
本研究由国家自然科学基金资助(基金项目编号:39470233)
, http://www.100md.com
参考文献
[1] Dalkara T, Ayata C, Demirci M, et al. Effects of cerebral ischemia on N-Methyl-D-Aspartate and dihydropyridine-sensitive calcium currents. Stroke, 1996, 27:127-133.
[2] Tymianski M, Tator CH. Normal and abnormal calcium homeostasis in neurons: a basis for the pathophysiology of traumatic and ischemic central nervous ystem injury. Neurosurgery, 1996, 38:1176-1195.
[3] Dodd PR, Hardy JA, Oakley AE, et al. A rapid method for preparing synaption: comparision, with alternative procedues. Brain Res, 1981, 226:107-118.
, 百拇医药
[4] 陈立华,曹美鸿,杨于嘉,等.Fura-2荧光标记法测定突触体内游离Ca2+ 浓度的原理及方法.临床神经科学.1997,5:71-74.
[5] 陈立华,曹美鸿,杨于嘉,等.尼莫地平对感染性脑水肿的脑保护作用.湖南医科大学学报,1997,22:393-396.
[6] Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985, 260:3440-3450.
[7] Cobbold PH, Rink TJ. Fluorescence and bioluminescen measurement of cytoplasmic free calcium. Biochem J, 1987, 248:313-328.
, http://www.100md.com
[8] Pillai NP, Ross DH. Effects of opiates on high-affinity Ca2+, Mg2+-ATPase in brain membrane subfraxtions. J Neurochem, 1986, 47:1642-1648.
[9] 卢步峰,黄诒森,鲁友明.用Fura-2双波长荧光法测定神经细胞内游离钙.生物化学与生物物理进展,1994,21:275-278.
[10] 徐如祥,易声禹.脑损伤时脑突触体游离钙及脑皮质总钙量变化.中华创伤杂志,1993,9:151-153.
(收稿:1997-12-25 修回:1998-06-12), 百拇医药