哮喘患儿外周血白细胞介素10水平及其对白细胞介素2等的调节作用
作者:蒋东波 李华强 史源 潘捷 沈际皋 姚忠凯 刘萍
单位:400042 重庆,第三军医大学附属大坪医院儿科 野战外科研究所
关键词:白细胞介素10;白细胞介素2;一氧化氮;肿瘤坏死因子;哮喘
中华儿科杂志990109 【摘要】 目的 探讨白细胞介素2、10(IL-2、10),一氧化氮(NO)和肿瘤坏死因子α(TNF-α)在小儿哮喘发病机制中的作用。方法 采用双抗夹心酶联免疫吸附试验(ELISA)技术检测了28例哮喘患儿血浆及外周血单个核细胞(PBMC)在植物血凝素(PHA)刺激下产生IL-10的水平,同时检测了NO、IL-2和TNF-α的水平,并研究了重组人IL-10(rhIL-10)对PBMC体外诱生NO、IL-2和TNF-α的调节作用。结果 (1)急性发作期哮喘患儿血浆及PBMC在PHA刺激下产生IL-10水平均比正常儿低(P<0.01),在哮喘缓解期虽有所恢复,但仍低于正常儿童(P<0.05);(2)急性发作期患儿血浆及PBMC在PHA刺激下产生NO水平均升高(P<0.05-0.01),而在缓解期恢复正常
, 百拇医药
(P>0.05);(3)急性发作期哮喘患儿PBMC在PHA刺激下产生IL-2和TNF-α水平均升高(P均<0.01),但在缓解期IL-2水平恢复正常(P>0.05),而TNF-α水平虽较发作期有明显降低,但仍高于正常儿童(P<0.01);(4)急性发作期哮喘患儿PBMC在PHA刺激下产生IL-10水平与IL-2和TNF-α呈负相关(r分别=-0.504、-0.528,P均<0.01),而与NO水平相关不显著(r=-0.319,P>0.05);(5)IL-10能明显抑制PHA刺激的哮喘患儿PBMC诱生NO、IL-2和TNF-α,呈剂量依赖关系。结论 哮喘发作时IL-10分泌及释放减少,NO、IL-2和TNF-α升高,rhIL-10对PHA刺激的哮喘患儿PBMC体外诱生NO、IL-2和TNF-α呈负相调节作用。
IL-10 levels in asthmatic children and effect of rhIL-10 on in vitro production of NO, IL-2 and TNF-α JIANG Dongbo, LI Huaqiang, SHI Yuan, et al. Daping Hospital, Institute of Surgery, the Third Military Medical College, Chongqing 400042
, 百拇医药
【Abstract】 Objective To investigate the roles of interleukin-2,10 (IL-2,10), nitric oxide (NO) and tumor necrosis factor alpha (TNF-α) in the pathogenesis of asthma. Methods The authors examined IL-10, nitrite and nitrate
( ) levels in the plasma and the production of IL-2, 10, TNF-α and
) levels in the plasma and the production of IL-2, 10, TNF-α and  by PHA-activated peripheral blood mononuclear cells (PBMC) levels in 28 asthmatic children and 20 age-matched normal children. At the same time, the authors studied the effect of recombinant human IL-10 (rhIL-10) on in vitro production of IL-2,
by PHA-activated peripheral blood mononuclear cells (PBMC) levels in 28 asthmatic children and 20 age-matched normal children. At the same time, the authors studied the effect of recombinant human IL-10 (rhIL-10) on in vitro production of IL-2,  and TNF-α by PHA-activated PBMC. Results Asthmatic children in acute attack stage had decreased amounts of the plasma IL-10 and the production of IL-10 by PHA-activated PBMC compared with normal control subjects (P<0.01 for both), while in relieving stage the IL-10 levels had restored to some degree, but were still lower than the normal levels (P<0.05). Asthmatic children in acute attack stage had increased amounts of the plasma
and TNF-α by PHA-activated PBMC. Results Asthmatic children in acute attack stage had decreased amounts of the plasma IL-10 and the production of IL-10 by PHA-activated PBMC compared with normal control subjects (P<0.01 for both), while in relieving stage the IL-10 levels had restored to some degree, but were still lower than the normal levels (P<0.05). Asthmatic children in acute attack stage had increased amounts of the plasma  and the production of
and the production of , IL-2 and TNF-α by PHA-activated PBMC compared with normal control subjects (P<0.05-0.01), while in relieving stage the amounts of plasma
, IL-2 and TNF-α by PHA-activated PBMC compared with normal control subjects (P<0.05-0.01), while in relieving stage the amounts of plasma  and the production of
and the production of  and IL-2 by PHA-activated PBMC decreased to normal levels (P>0.05 for all), but TNF-α was still higher than the normal levels. The results of linear correlation analysis showed that there were obvious correlations between the production of IL-10 and IL-2, TNF-α by PHA-activated PBMC. RhIL-10 may inhibit IL-2, TNF-α and NO production by PBMC in a dose-dependent fashion. Conclusion There were decreased release and secretion of IL-10, and increased production of IL-2, TNF-α and NO in asthmatic children, RhIL-10 have negatively regulative effects on IL-2, TNF-α and NO production by PHA-activated PBMC.
and IL-2 by PHA-activated PBMC decreased to normal levels (P>0.05 for all), but TNF-α was still higher than the normal levels. The results of linear correlation analysis showed that there were obvious correlations between the production of IL-10 and IL-2, TNF-α by PHA-activated PBMC. RhIL-10 may inhibit IL-2, TNF-α and NO production by PBMC in a dose-dependent fashion. Conclusion There were decreased release and secretion of IL-10, and increased production of IL-2, TNF-α and NO in asthmatic children, RhIL-10 have negatively regulative effects on IL-2, TNF-α and NO production by PHA-activated PBMC.
, 百拇医药
【Key words】 Interleukin-10 Interleukin-2 Nitric oxide Tumor necrosis factor Asthma
1989年,美国DNAX研究所发现辅助T淋巴细胞亚群2(Th2)细胞能产生一种细胞因子合成抑制因子[1],后命名为白细胞介素-10 (IL-10),它能有效地抑制辅助T淋巴细胞亚群1 (Th1)细胞株等多种细胞合成其它细胞因子,具有抗炎作用。哮喘是一种慢性气道炎症性疾病,多种免疫细胞和炎症细胞(包括T淋巴细胞、肥大细胞和嗜酸性粒细胞等)及多种细胞因子参与其发病过程。IL-10在哮喘发病机制中可能具有重要的发病学意义。为探讨Th1与Th2两类细胞因子在小儿哮喘时的相互调节,我们检测了哮喘患儿外周血IL-2、10,一氧化氮(NO)和肿瘤坏死因子(TNF-α)水平,并研究了重组人IL-10(rhIL-10)对外周血单个核细胞(PBMC)体外产生IL-2、NO及TNF-α的调节作用,以探讨IL-10和NO等在小儿哮喘发病机理中的作用。
, 百拇医药
对象和方法
一、对象
1.对照组:正常健康体检儿童20名,2~10岁(平均5.0岁),男11名,女9名。既往均无哮喘病史,采血前4周内无感染及用药史。
2.哮喘组:确诊为支气管哮喘的本院住院患儿,均为急性发作期患儿,男17例,女11例,共28例,年龄1~12岁(平均5.2岁)。采血前4周内未用口服及静脉糖皮质激素以及免疫增强或抑制剂等药物。其中18例患儿经糖皮质激素及支气管舒张剂等药物治疗,待临床症状缓解后,于出院前再次采周围静脉血标本待测。
二、方法
1.外周血PBMC培养上清液的制备:无菌采取肝素抗凝静脉血5~6 ml,以淋巴细胞分离液常规分离PBMC,离心洗涤3次,用RPMI1640培养液调细胞浓度为5×106/ml,种入24孔细胞培养板,每孔1 ml,加入1%(V∶V)植物血凝素(PHA),置37℃, 5%CO2孵箱中培养48小时,收集上清液置-20℃保存待测。
, http://www.100md.com
2.IL-10测定:采用双抗夹心ELISA法,人IL-10 ELISA试剂盒购于美国Genzyme公司。首先将标准品rIL-10依次稀释为512、256、64、16、8、0 ng/ml。待测血浆及PBMC培养上清标本不稀释。将各浓度标准品rIL-10、培养的上清液标本分别加入已用鼠抗人IL-10单克隆抗体包被的微孔板内,每孔100 μl,室温避光孵育1小时,洗涤3次拍干,加100 μl生物素化抗人IL-10抗体,孵育1小时,洗涤,加100 μl链霉素亲和素,孵育30分钟,洗涤,加100 μl底物,孵育约15分钟,待标准浓度各孔呈现颜色梯度后加终止液。于450 nm吸收波长处测吸光度(A,旧称光密度OD),绘制标准曲线,根据各标本A值在标准曲线上查得相应IL-10浓度。
3.NO测定:血浆NO水平和PBMC诱生NO水平用镉还原柱层析和比色法,通过检测 浓度以代表NO水平[2]。
浓度以代表NO水平[2]。
, http://www.100md.com
4.IL-2测定:PBMC诱生IL-2水平用CTLL细胞株生物活性法测定[3]。
5.TNF-α测定:PBMC诱生TNF-α水平用L929细胞株生物活性法[4]测定。
6.IL-10对PBMC诱生NO、IL-2及TNF-α的调节作用:同方法1,在加入1%PHA的同时加入不同浓度的重组人IL-10 (rhIL-10) (为美国Genzyme公司产品)。另设不加rhIL-10对照。置37℃,5%CO2孵箱中培养48小时,收集上清液置-20℃保存待测。
三、统计学处理
组间两样本均数比较用t检验,并做直线相关分析。
结果
, 百拇医药
一、哮喘患儿血浆和PBMC产生IL-10的水平
如表1所示,急性发作期哮喘患儿血浆和PBMC产生IL-10水平均降低(t分别=5.358、18.004,P均<0.01);缓解期血浆和PBMC产生IL-10水平均较发作期升高(t分别=3.36、14.681,P均<0.01),但仍低于正常水平(t分别=2.481、2.144,P均<0.05)。
表1 哮喘患儿外周血IL-10、 、IL-2及TNF-α水平(
、IL-2及TNF-α水平(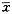 ±s) 组别
±s) 组别
n
IL-10(ng/L) (μmol/L)
(μmol/L)
, 百拇医药
IL-2(kU/L)
TNF-α(kU/L)
血浆
PBMC
血浆
PBMC
PBMC
PBMC
对照组
20
11.2±2.9
64±10
29.6±2.9
, http://www.100md.com
46± 9
37±6
50±15
发作组
28
7.2±2.2**
22± 5**
32.7±4.5*
57±10**
51±9**
213±47**
, http://www.100md.com
缓解组
18
9.2±1.6*
57±10*
30.2±3.1
43± 9
39±6
66±17**
注:* 与对照组比较,P<0.05;**,与对照组和缓解组比较 P<0.01
二、哮喘患儿血浆和PBMC产生NO的水平
, http://www.100md.com
由表1可见,急性发作期患儿血浆和PBMC产生 水平均升高(t分别=2.630、4.057,P分别<0.05,0.01);缓解期血浆
水平均升高(t分别=2.630、4.057,P分别<0.05,0.01);缓解期血浆 水平较发作期虽有下降趋势,但差异无显著意义(P>0.05),与对照比较差异亦无显著意义(P>0.05),而缓解期PBMC产生
水平较发作期虽有下降趋势,但差异无显著意义(P>0.05),与对照比较差异亦无显著意义(P>0.05),而缓解期PBMC产生 水平较发作期降低(t=5.034,P<0.01),与对照比较差异无显著意义(P>0.05)。
水平较发作期降低(t=5.034,P<0.01),与对照比较差异无显著意义(P>0.05)。
三、哮喘患儿PBMC产生IL-2的水平
如表1所示,急性发作期患儿PBMC产生IL-2水平升高(t=5.874, P<0.01),缓解期患儿PBMC产生IL-2水平较发作期降低(t=4.828,P<0.01),与对照比较差异无显著意义(P>0.05)。
, 百拇医药
四、哮喘患儿PBMC产生TNF-α的水平
如表1所示,急性发作期哮喘患儿PBMC产生TNF-α水平升高(t=14.931,P<0.01),而在缓解期虽较发作期有所降低(t=12.746,P<0.01),但仍然高于对照组(t=3.002,P<0.01)。
五、直线相关性
急性发作期患儿PBMC产生IL-10水平与IL-2和TNF-α呈显著负相关(r=-0.504、-0.528,P均<0.01),而与 水平相关不显著(r=-0.319,P>0.05)。
水平相关不显著(r=-0.319,P>0.05)。
六、IL-10对哮喘患儿PBMC诱生IL-2、TNF-α及NO的影响
由表2,3可见,IL-10能明显抑制PHA刺激的哮喘患儿PBMC诱生IL-2、TNF-α及NO,呈剂量依赖关系。在对照组也呈相同趋势。
, 百拇医药
表2 不同浓度IL-10对两组各10例PBMC诱生IL-2、TNF-α和 的调节作用(
的调节作用(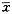 ±s) IL-10
±s) IL-10
(ng/L)
IL-2(kU/L)
TNF-α(kU/L) (μmol/L)
(μmol/L)
对照组
哮喘组
对照组
哮喘组
, 百拇医药
对照组
哮喘组
0
36.8±5.9
50.6±9.2
50±15
213±47
46±9
57±10
10
20.8±1.6
35.4±2.8
30±11
, 百拇医药
93±25
37±7
38± 6
20
15.7±2.1
28.9±1.3
20±10
63±13
32±9
30± 7
30
11.2±1.7
20.4±1.9
, http://www.100md.com
12± 6
45±18
31±6
29± 7
40
8.0±1.2
14.7±1.3
8± 4
23±10
24±6
26± 6
由表3可见,IL-10浓度与IL-2、TNF-α、 均呈负相关关系,P均<0.05或P<0.01;直线相关系数在-0.904~-0.982之间,而与IL-2、TNF-α、
均呈负相关关系,P均<0.05或P<0.01;直线相关系数在-0.904~-0.982之间,而与IL-2、TNF-α、 的对数值的相关系数均有提高,在-0.939~-0.999之间。
的对数值的相关系数均有提高,在-0.939~-0.999之间。
, http://www.100md.com
表3 IL-2、TNF-α、NO-2/NO-3(x)与IL-10(或logIL-10)的相关与回归 变量X
直线回归与相关
对数回归与相关
相关系数(r)
Y=a+bX
相关系数(r)
logY=a+bX
IL-2
对照组
-0.940*
, 百拇医药
Y= 31.94-0.672X
-0.992**
logY=1.525-0.016X
哮喘组
-0.982**
Y= 47.36-0.868X
-0.997**
logY=1.701-0.013X
TNF-α
对照组
-0.959**
, 百拇医药
Y= 44.48-1.023X
-0.999**
logY=1.691-0.020X
哮喘组
-0.906*
Y=173.18-4.288X
-0.987**
logY=2.274-0.023X
对照组
-0.978**
, 百拇医药
Y= 44.12-0.499X
-0.984**
logY=1.652-6.451X
哮喘组
-0.904*
Y= 50.42-0.718X
-0.939*
logY=1.701-8.115X
* P<0.05 ** P<0.01讨论
最新研究表明,辅助性T淋巴细胞亚群功能失调是支气管哮喘慢性气道炎症形成主要原
, http://www.100md.com
因[5]。IL-10是由活化巨噬细胞、B淋巴细胞、Th2细胞等分泌的。能有效地抑制Th1细胞株的一系列后期合成的细胞因子(如IL-2,IFN-γ, TNF-α等)在mRNA水平的合成。至此,有关Th1与Th2细胞间交互调节以及整个细胞因子网络间的调节机制问题的研究进入了一个新阶段。本结果表明,哮喘患儿急性发作期血浆(未刺激)和外周血PBMC在PHA刺激下产生IL-10水平均降低,其原因可能与IL-10 mRNA转录受到抑制致产生减少和清除过多有关[6]。本结果还表明,重组人IL-10能抑制PHA刺激的哮喘患儿PBMC体外产生NO、IL-2和TNF-α,其作用呈剂量依赖关系。故哮喘患儿IL-10水平降低,可导致NO、IL-2和TNF-α等炎症或前炎症细胞因子合成及释放增加,导致或加重气道慢性炎症,引起气道高反应性(BHR)而诱导或加重哮喘发病。
有资料表明,肺巨噬细胞,中性粒细胞,肥大细胞,内皮细胞,上皮细胞,平滑肌细胞及成纤维细胞等在哮喘气道炎症时,细胞上的诱导型一氧化氮合酶(iNOS)可被IL-2、TNF等细胞因子或过敏原激活而合成大量的NO。本研究显示,哮喘患儿血浆和PBMC产生NO水平升高,我们以前发现过敏性哮喘豚鼠支气管肺泡灌洗液中NO水平亦升高[7]。此时NO的产生可能有利于抑制病原微生物的生长,对减轻气道平滑肌的痉挛有益。但是气道组织iNOS的高水平持续地激活和NO的大量生成可产生许多有害作用:它可引起哮喘患儿气道充血,加重血浆渗漏,造成肺上皮细胞及组织损伤,引起BHR[8]。因此,气道组织iNOS持续被激活和大量NO积聚的最终结果,不仅不能有效地舒张气道平滑肌和降低气道反应性,反而加剧气道的炎症反应和组织损害,诱发或进一步加重BHR,导致哮喘发病。
, http://www.100md.com
本结果还表明,哮喘患儿PBMC产生IL-2及TNF-α水平升高。哮喘时在过敏原等的刺激下,肺巨噬细胞活化,释放TNF等一系列前炎性介质,它们作用于T淋巴细胞,使其激活。有研究发现,NO能刺激人外周血单核细胞,促进其葡萄糖转运及TNF-α分泌[9]。同时,活化的T淋巴细胞分泌IL-2反作用于静止期的巨噬细胞,促进其激活。Strieter等[10]证实人肺巨噬细胞和单核细胞均能在IL-2刺激下诱导TNF-α mRNA的积累及TNF-α的产生。这样,肺巨噬细胞与T、B淋巴细胞相互促进,扩大了哮喘炎症的程度和范围,并通过分泌IL-2、TNF-α和NO等介质而参与气道炎性反应过程及肺上皮细胞等的损伤,导致BHR,进而导致迟发性哮喘的发生[11]。急性发作期哮喘患儿外周血PBMC产生IL-10的水平与IL-2和TNF-α呈显著负相关,表明IL-10能抑制IL-2和TNF-α的合成及释放,降低由IL-2、TNF-α所介导的一系列生物学效应。有研究发现,IL-10能明显抑制鼠巨噬细胞合成及释放NO的量[12],如此就可减轻气道慢性炎症,降低BHR,故IL-10具有潜在的哮喘治疗作用,值得进一步探索。
, 百拇医药
另外,我们还发现哮喘患儿经糖皮质激素等治疗后,在缓解期血浆和PBMC产生IL-10水平有明显升高,但仍未恢复正常水平,NO、IL-2和TNF-α水平较发作期有明显降低,但TNF-α水平仍然高于正常对照组。因缓解期IL-10及TNF-α水平仍未恢复正常,气道慢性炎症仍然存在,故需继续抗炎治疗。糖皮质激素可促进IL-10的大量合成[13],IL-10又可抑制多种细胞合成及释放NO、IL-2和TNF-α等多种炎症或前炎症细胞因子,且糖皮质激素还可直接抑制NO、IL-2和TNF-α等的产生及活性,发挥其抗炎作用,减轻气道炎症反应。这也是糖皮质激素的抗炎机制之一。
综上所述,哮喘发作时PBMC无论刺激与否,其合成及释放IL-10的量均低于正常儿童,NO、IL-2和TNF-α水平升高,导致或加重气道慢性炎症反应,引起BHR而诱发哮喘发病,糖皮质激素可促进IL-10的合成,抑制NO、IL-2和TNF-α的产生,具有明显抗炎作用,是治疗哮喘的有效药物。
, 百拇医药
志谢 本课题系第三军医大学附属大坪医院、野战外科研究所青年科学基金课题。感谢第三军医大学附属大坪医院、野战外科研究所科技部提供资金支持
参考文献
[1] Fiorentino DF, Bond MW, Mosmann TR. Two types of mouse T helper cell: Th2 clones secrete a factor that inhibits cytokine production by Th1 clones. J Exp Med, 1989,170:2081-2095.
[2] Shi Y, Shen JG, Wang JH, et al. Plasma nitric oxide levels in newborn infants with sepsis. J Pediatr, 1993,123:435-438.
, 百拇医药
[3] 蒋东波,沈际皋,杨锡强,等. 哮喘患儿白细胞介素2,6的检测及其意义. 中华儿科杂志,1994,32:219-221.
[4] 赵福生. 肿瘤坏死因子的生物活性检测. 见:钱玉昆,主编.实用免疫学新技术. 北京: 北京医科大学中国协和医科大学联合出版社,1994. 55-57.
[5] 王立波,郭履. 人类TH细胞亚群与支气管哮喘[综述]. 国外医学免疫学分册,1995,18:21-23.
[6] Borish L, Aarons A, Rumbyrt J, et al. Interleukin-10 regulation in normal subjects and patients with asthma. J Allergy Clin Immunol, 1996,97:1288-1296.
[7] 蒋东波,李华强,史源, 等. 过敏性哮喘一氧化氮及内皮素水平变化的实验研究. 中华医学杂志,1995,75:501-502.
, 百拇医药
[8] Barnes PJ. Nitric oxide and airways .Eur Respir J, 1993,6:163-166.
[9] Lander HM, Sehaipal P, Levine DM, et al. Activation of human peripheral blood mononuclear cells by nitric oxide generating compounds. J Immunol, 1993,150:1509-1516.
[10] Strieter RM, Remick DG, Lynch JP, et al. Interleukin 2 induced tumor necrosis factor-alpha (TNF-α) gene expression in human alveolar macrophages and blood monocytes. Am Rev Respir Dis, 1989,139:335-342.
, http://www.100md.com
[11] Taylor-Robinson AW, Liew FY, Severn A, et al. Regulation of the immune response by nitric oxide differentially produced by T helper type 1 and T helper type 2 cells. Eur J Immunol, 1994, 24: 980-984.
[12] 戴山林,殷凯生. 白介素-10与支气管哮喘[综述]. 国外医学呼吸系统分册,1997,17:57-61.
[13] Brinkmann V, Kristofic C. Regulation by corticosteroids of Th1 and Th2 cytokine production in human CD+4 effector T cells generated from CD45RO- and CD45RO+ subsets. J Immunol, 1995,155:3322-3327.
(收稿:1998-06-09 修回:1998-08-25), http://www.100md.com
单位:400042 重庆,第三军医大学附属大坪医院儿科 野战外科研究所
关键词:白细胞介素10;白细胞介素2;一氧化氮;肿瘤坏死因子;哮喘
中华儿科杂志990109 【摘要】 目的 探讨白细胞介素2、10(IL-2、10),一氧化氮(NO)和肿瘤坏死因子α(TNF-α)在小儿哮喘发病机制中的作用。方法 采用双抗夹心酶联免疫吸附试验(ELISA)技术检测了28例哮喘患儿血浆及外周血单个核细胞(PBMC)在植物血凝素(PHA)刺激下产生IL-10的水平,同时检测了NO、IL-2和TNF-α的水平,并研究了重组人IL-10(rhIL-10)对PBMC体外诱生NO、IL-2和TNF-α的调节作用。结果 (1)急性发作期哮喘患儿血浆及PBMC在PHA刺激下产生IL-10水平均比正常儿低(P<0.01),在哮喘缓解期虽有所恢复,但仍低于正常儿童(P<0.05);(2)急性发作期患儿血浆及PBMC在PHA刺激下产生NO水平均升高(P<0.05-0.01),而在缓解期恢复正常
, 百拇医药
(P>0.05);(3)急性发作期哮喘患儿PBMC在PHA刺激下产生IL-2和TNF-α水平均升高(P均<0.01),但在缓解期IL-2水平恢复正常(P>0.05),而TNF-α水平虽较发作期有明显降低,但仍高于正常儿童(P<0.01);(4)急性发作期哮喘患儿PBMC在PHA刺激下产生IL-10水平与IL-2和TNF-α呈负相关(r分别=-0.504、-0.528,P均<0.01),而与NO水平相关不显著(r=-0.319,P>0.05);(5)IL-10能明显抑制PHA刺激的哮喘患儿PBMC诱生NO、IL-2和TNF-α,呈剂量依赖关系。结论 哮喘发作时IL-10分泌及释放减少,NO、IL-2和TNF-α升高,rhIL-10对PHA刺激的哮喘患儿PBMC体外诱生NO、IL-2和TNF-α呈负相调节作用。
IL-10 levels in asthmatic children and effect of rhIL-10 on in vitro production of NO, IL-2 and TNF-α JIANG Dongbo, LI Huaqiang, SHI Yuan, et al. Daping Hospital, Institute of Surgery, the Third Military Medical College, Chongqing 400042
, 百拇医药
【Abstract】 Objective To investigate the roles of interleukin-2,10 (IL-2,10), nitric oxide (NO) and tumor necrosis factor alpha (TNF-α) in the pathogenesis of asthma. Methods The authors examined IL-10, nitrite and nitrate
(
 ) levels in the plasma and the production of IL-2, 10, TNF-α and
) levels in the plasma and the production of IL-2, 10, TNF-α and  by PHA-activated peripheral blood mononuclear cells (PBMC) levels in 28 asthmatic children and 20 age-matched normal children. At the same time, the authors studied the effect of recombinant human IL-10 (rhIL-10) on in vitro production of IL-2,
by PHA-activated peripheral blood mononuclear cells (PBMC) levels in 28 asthmatic children and 20 age-matched normal children. At the same time, the authors studied the effect of recombinant human IL-10 (rhIL-10) on in vitro production of IL-2,  and TNF-α by PHA-activated PBMC. Results Asthmatic children in acute attack stage had decreased amounts of the plasma IL-10 and the production of IL-10 by PHA-activated PBMC compared with normal control subjects (P<0.01 for both), while in relieving stage the IL-10 levels had restored to some degree, but were still lower than the normal levels (P<0.05). Asthmatic children in acute attack stage had increased amounts of the plasma
and TNF-α by PHA-activated PBMC. Results Asthmatic children in acute attack stage had decreased amounts of the plasma IL-10 and the production of IL-10 by PHA-activated PBMC compared with normal control subjects (P<0.01 for both), while in relieving stage the IL-10 levels had restored to some degree, but were still lower than the normal levels (P<0.05). Asthmatic children in acute attack stage had increased amounts of the plasma  and the production of
and the production of , IL-2 and TNF-α by PHA-activated PBMC compared with normal control subjects (P<0.05-0.01), while in relieving stage the amounts of plasma
, IL-2 and TNF-α by PHA-activated PBMC compared with normal control subjects (P<0.05-0.01), while in relieving stage the amounts of plasma  and the production of
and the production of  and IL-2 by PHA-activated PBMC decreased to normal levels (P>0.05 for all), but TNF-α was still higher than the normal levels. The results of linear correlation analysis showed that there were obvious correlations between the production of IL-10 and IL-2, TNF-α by PHA-activated PBMC. RhIL-10 may inhibit IL-2, TNF-α and NO production by PBMC in a dose-dependent fashion. Conclusion There were decreased release and secretion of IL-10, and increased production of IL-2, TNF-α and NO in asthmatic children, RhIL-10 have negatively regulative effects on IL-2, TNF-α and NO production by PHA-activated PBMC.
and IL-2 by PHA-activated PBMC decreased to normal levels (P>0.05 for all), but TNF-α was still higher than the normal levels. The results of linear correlation analysis showed that there were obvious correlations between the production of IL-10 and IL-2, TNF-α by PHA-activated PBMC. RhIL-10 may inhibit IL-2, TNF-α and NO production by PBMC in a dose-dependent fashion. Conclusion There were decreased release and secretion of IL-10, and increased production of IL-2, TNF-α and NO in asthmatic children, RhIL-10 have negatively regulative effects on IL-2, TNF-α and NO production by PHA-activated PBMC., 百拇医药
【Key words】 Interleukin-10 Interleukin-2 Nitric oxide Tumor necrosis factor Asthma
1989年,美国DNAX研究所发现辅助T淋巴细胞亚群2(Th2)细胞能产生一种细胞因子合成抑制因子[1],后命名为白细胞介素-10 (IL-10),它能有效地抑制辅助T淋巴细胞亚群1 (Th1)细胞株等多种细胞合成其它细胞因子,具有抗炎作用。哮喘是一种慢性气道炎症性疾病,多种免疫细胞和炎症细胞(包括T淋巴细胞、肥大细胞和嗜酸性粒细胞等)及多种细胞因子参与其发病过程。IL-10在哮喘发病机制中可能具有重要的发病学意义。为探讨Th1与Th2两类细胞因子在小儿哮喘时的相互调节,我们检测了哮喘患儿外周血IL-2、10,一氧化氮(NO)和肿瘤坏死因子(TNF-α)水平,并研究了重组人IL-10(rhIL-10)对外周血单个核细胞(PBMC)体外产生IL-2、NO及TNF-α的调节作用,以探讨IL-10和NO等在小儿哮喘发病机理中的作用。
, 百拇医药
对象和方法
一、对象
1.对照组:正常健康体检儿童20名,2~10岁(平均5.0岁),男11名,女9名。既往均无哮喘病史,采血前4周内无感染及用药史。
2.哮喘组:确诊为支气管哮喘的本院住院患儿,均为急性发作期患儿,男17例,女11例,共28例,年龄1~12岁(平均5.2岁)。采血前4周内未用口服及静脉糖皮质激素以及免疫增强或抑制剂等药物。其中18例患儿经糖皮质激素及支气管舒张剂等药物治疗,待临床症状缓解后,于出院前再次采周围静脉血标本待测。
二、方法
1.外周血PBMC培养上清液的制备:无菌采取肝素抗凝静脉血5~6 ml,以淋巴细胞分离液常规分离PBMC,离心洗涤3次,用RPMI1640培养液调细胞浓度为5×106/ml,种入24孔细胞培养板,每孔1 ml,加入1%(V∶V)植物血凝素(PHA),置37℃, 5%CO2孵箱中培养48小时,收集上清液置-20℃保存待测。
, http://www.100md.com
2.IL-10测定:采用双抗夹心ELISA法,人IL-10 ELISA试剂盒购于美国Genzyme公司。首先将标准品rIL-10依次稀释为512、256、64、16、8、0 ng/ml。待测血浆及PBMC培养上清标本不稀释。将各浓度标准品rIL-10、培养的上清液标本分别加入已用鼠抗人IL-10单克隆抗体包被的微孔板内,每孔100 μl,室温避光孵育1小时,洗涤3次拍干,加100 μl生物素化抗人IL-10抗体,孵育1小时,洗涤,加100 μl链霉素亲和素,孵育30分钟,洗涤,加100 μl底物,孵育约15分钟,待标准浓度各孔呈现颜色梯度后加终止液。于450 nm吸收波长处测吸光度(A,旧称光密度OD),绘制标准曲线,根据各标本A值在标准曲线上查得相应IL-10浓度。
3.NO测定:血浆NO水平和PBMC诱生NO水平用镉还原柱层析和比色法,通过检测
 浓度以代表NO水平[2]。
浓度以代表NO水平[2]。, http://www.100md.com
4.IL-2测定:PBMC诱生IL-2水平用CTLL细胞株生物活性法测定[3]。
5.TNF-α测定:PBMC诱生TNF-α水平用L929细胞株生物活性法[4]测定。
6.IL-10对PBMC诱生NO、IL-2及TNF-α的调节作用:同方法1,在加入1%PHA的同时加入不同浓度的重组人IL-10 (rhIL-10) (为美国Genzyme公司产品)。另设不加rhIL-10对照。置37℃,5%CO2孵箱中培养48小时,收集上清液置-20℃保存待测。
三、统计学处理
组间两样本均数比较用t检验,并做直线相关分析。
结果
, 百拇医药
一、哮喘患儿血浆和PBMC产生IL-10的水平
如表1所示,急性发作期哮喘患儿血浆和PBMC产生IL-10水平均降低(t分别=5.358、18.004,P均<0.01);缓解期血浆和PBMC产生IL-10水平均较发作期升高(t分别=3.36、14.681,P均<0.01),但仍低于正常水平(t分别=2.481、2.144,P均<0.05)。
表1 哮喘患儿外周血IL-10、
 、IL-2及TNF-α水平(
、IL-2及TNF-α水平(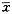 ±s) 组别
±s) 组别n
IL-10(ng/L)
 (μmol/L)
(μmol/L), 百拇医药
IL-2(kU/L)
TNF-α(kU/L)
血浆
PBMC
血浆
PBMC
PBMC
PBMC
对照组
20
11.2±2.9
64±10
29.6±2.9
, http://www.100md.com
46± 9
37±6
50±15
发作组
28
7.2±2.2**
22± 5**
32.7±4.5*
57±10**
51±9**
213±47**
, http://www.100md.com
缓解组
18
9.2±1.6*
57±10*
30.2±3.1
43± 9
39±6
66±17**
注:* 与对照组比较,P<0.05;**,与对照组和缓解组比较 P<0.01
二、哮喘患儿血浆和PBMC产生NO的水平
, http://www.100md.com
由表1可见,急性发作期患儿血浆和PBMC产生
 水平均升高(t分别=2.630、4.057,P分别<0.05,0.01);缓解期血浆
水平均升高(t分别=2.630、4.057,P分别<0.05,0.01);缓解期血浆 水平较发作期虽有下降趋势,但差异无显著意义(P>0.05),与对照比较差异亦无显著意义(P>0.05),而缓解期PBMC产生
水平较发作期虽有下降趋势,但差异无显著意义(P>0.05),与对照比较差异亦无显著意义(P>0.05),而缓解期PBMC产生 水平较发作期降低(t=5.034,P<0.01),与对照比较差异无显著意义(P>0.05)。
水平较发作期降低(t=5.034,P<0.01),与对照比较差异无显著意义(P>0.05)。三、哮喘患儿PBMC产生IL-2的水平
如表1所示,急性发作期患儿PBMC产生IL-2水平升高(t=5.874, P<0.01),缓解期患儿PBMC产生IL-2水平较发作期降低(t=4.828,P<0.01),与对照比较差异无显著意义(P>0.05)。
, 百拇医药
四、哮喘患儿PBMC产生TNF-α的水平
如表1所示,急性发作期哮喘患儿PBMC产生TNF-α水平升高(t=14.931,P<0.01),而在缓解期虽较发作期有所降低(t=12.746,P<0.01),但仍然高于对照组(t=3.002,P<0.01)。
五、直线相关性
急性发作期患儿PBMC产生IL-10水平与IL-2和TNF-α呈显著负相关(r=-0.504、-0.528,P均<0.01),而与
 水平相关不显著(r=-0.319,P>0.05)。
水平相关不显著(r=-0.319,P>0.05)。六、IL-10对哮喘患儿PBMC诱生IL-2、TNF-α及NO的影响
由表2,3可见,IL-10能明显抑制PHA刺激的哮喘患儿PBMC诱生IL-2、TNF-α及NO,呈剂量依赖关系。在对照组也呈相同趋势。
, 百拇医药
表2 不同浓度IL-10对两组各10例PBMC诱生IL-2、TNF-α和
 的调节作用(
的调节作用(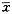 ±s) IL-10
±s) IL-10(ng/L)
IL-2(kU/L)
TNF-α(kU/L)
 (μmol/L)
(μmol/L)对照组
哮喘组
对照组
哮喘组
, 百拇医药
对照组
哮喘组
0
36.8±5.9
50.6±9.2
50±15
213±47
46±9
57±10
10
20.8±1.6
35.4±2.8
30±11
, 百拇医药
93±25
37±7
38± 6
20
15.7±2.1
28.9±1.3
20±10
63±13
32±9
30± 7
30
11.2±1.7
20.4±1.9
, http://www.100md.com
12± 6
45±18
31±6
29± 7
40
8.0±1.2
14.7±1.3
8± 4
23±10
24±6
26± 6
由表3可见,IL-10浓度与IL-2、TNF-α、
 均呈负相关关系,P均<0.05或P<0.01;直线相关系数在-0.904~-0.982之间,而与IL-2、TNF-α、
均呈负相关关系,P均<0.05或P<0.01;直线相关系数在-0.904~-0.982之间,而与IL-2、TNF-α、 的对数值的相关系数均有提高,在-0.939~-0.999之间。
的对数值的相关系数均有提高,在-0.939~-0.999之间。, http://www.100md.com
表3 IL-2、TNF-α、NO-2/NO-3(x)与IL-10(或logIL-10)的相关与回归 变量X
直线回归与相关
对数回归与相关
相关系数(r)
Y=a+bX
相关系数(r)
logY=a+bX
IL-2
对照组
-0.940*
, 百拇医药
Y= 31.94-0.672X
-0.992**
logY=1.525-0.016X
哮喘组
-0.982**
Y= 47.36-0.868X
-0.997**
logY=1.701-0.013X
TNF-α
对照组
-0.959**
, 百拇医药
Y= 44.48-1.023X
-0.999**
logY=1.691-0.020X
哮喘组
-0.906*
Y=173.18-4.288X
-0.987**
logY=2.274-0.023X

对照组
-0.978**
, 百拇医药
Y= 44.12-0.499X
-0.984**
logY=1.652-6.451X
哮喘组
-0.904*
Y= 50.42-0.718X
-0.939*
logY=1.701-8.115X
* P<0.05 ** P<0.01讨论
最新研究表明,辅助性T淋巴细胞亚群功能失调是支气管哮喘慢性气道炎症形成主要原
, http://www.100md.com
因[5]。IL-10是由活化巨噬细胞、B淋巴细胞、Th2细胞等分泌的。能有效地抑制Th1细胞株的一系列后期合成的细胞因子(如IL-2,IFN-γ, TNF-α等)在mRNA水平的合成。至此,有关Th1与Th2细胞间交互调节以及整个细胞因子网络间的调节机制问题的研究进入了一个新阶段。本结果表明,哮喘患儿急性发作期血浆(未刺激)和外周血PBMC在PHA刺激下产生IL-10水平均降低,其原因可能与IL-10 mRNA转录受到抑制致产生减少和清除过多有关[6]。本结果还表明,重组人IL-10能抑制PHA刺激的哮喘患儿PBMC体外产生NO、IL-2和TNF-α,其作用呈剂量依赖关系。故哮喘患儿IL-10水平降低,可导致NO、IL-2和TNF-α等炎症或前炎症细胞因子合成及释放增加,导致或加重气道慢性炎症,引起气道高反应性(BHR)而诱导或加重哮喘发病。
有资料表明,肺巨噬细胞,中性粒细胞,肥大细胞,内皮细胞,上皮细胞,平滑肌细胞及成纤维细胞等在哮喘气道炎症时,细胞上的诱导型一氧化氮合酶(iNOS)可被IL-2、TNF等细胞因子或过敏原激活而合成大量的NO。本研究显示,哮喘患儿血浆和PBMC产生NO水平升高,我们以前发现过敏性哮喘豚鼠支气管肺泡灌洗液中NO水平亦升高[7]。此时NO的产生可能有利于抑制病原微生物的生长,对减轻气道平滑肌的痉挛有益。但是气道组织iNOS的高水平持续地激活和NO的大量生成可产生许多有害作用:它可引起哮喘患儿气道充血,加重血浆渗漏,造成肺上皮细胞及组织损伤,引起BHR[8]。因此,气道组织iNOS持续被激活和大量NO积聚的最终结果,不仅不能有效地舒张气道平滑肌和降低气道反应性,反而加剧气道的炎症反应和组织损害,诱发或进一步加重BHR,导致哮喘发病。
, http://www.100md.com
本结果还表明,哮喘患儿PBMC产生IL-2及TNF-α水平升高。哮喘时在过敏原等的刺激下,肺巨噬细胞活化,释放TNF等一系列前炎性介质,它们作用于T淋巴细胞,使其激活。有研究发现,NO能刺激人外周血单核细胞,促进其葡萄糖转运及TNF-α分泌[9]。同时,活化的T淋巴细胞分泌IL-2反作用于静止期的巨噬细胞,促进其激活。Strieter等[10]证实人肺巨噬细胞和单核细胞均能在IL-2刺激下诱导TNF-α mRNA的积累及TNF-α的产生。这样,肺巨噬细胞与T、B淋巴细胞相互促进,扩大了哮喘炎症的程度和范围,并通过分泌IL-2、TNF-α和NO等介质而参与气道炎性反应过程及肺上皮细胞等的损伤,导致BHR,进而导致迟发性哮喘的发生[11]。急性发作期哮喘患儿外周血PBMC产生IL-10的水平与IL-2和TNF-α呈显著负相关,表明IL-10能抑制IL-2和TNF-α的合成及释放,降低由IL-2、TNF-α所介导的一系列生物学效应。有研究发现,IL-10能明显抑制鼠巨噬细胞合成及释放NO的量[12],如此就可减轻气道慢性炎症,降低BHR,故IL-10具有潜在的哮喘治疗作用,值得进一步探索。
, 百拇医药
另外,我们还发现哮喘患儿经糖皮质激素等治疗后,在缓解期血浆和PBMC产生IL-10水平有明显升高,但仍未恢复正常水平,NO、IL-2和TNF-α水平较发作期有明显降低,但TNF-α水平仍然高于正常对照组。因缓解期IL-10及TNF-α水平仍未恢复正常,气道慢性炎症仍然存在,故需继续抗炎治疗。糖皮质激素可促进IL-10的大量合成[13],IL-10又可抑制多种细胞合成及释放NO、IL-2和TNF-α等多种炎症或前炎症细胞因子,且糖皮质激素还可直接抑制NO、IL-2和TNF-α等的产生及活性,发挥其抗炎作用,减轻气道炎症反应。这也是糖皮质激素的抗炎机制之一。
综上所述,哮喘发作时PBMC无论刺激与否,其合成及释放IL-10的量均低于正常儿童,NO、IL-2和TNF-α水平升高,导致或加重气道慢性炎症反应,引起BHR而诱发哮喘发病,糖皮质激素可促进IL-10的合成,抑制NO、IL-2和TNF-α的产生,具有明显抗炎作用,是治疗哮喘的有效药物。
, 百拇医药
志谢 本课题系第三军医大学附属大坪医院、野战外科研究所青年科学基金课题。感谢第三军医大学附属大坪医院、野战外科研究所科技部提供资金支持
参考文献
[1] Fiorentino DF, Bond MW, Mosmann TR. Two types of mouse T helper cell: Th2 clones secrete a factor that inhibits cytokine production by Th1 clones. J Exp Med, 1989,170:2081-2095.
[2] Shi Y, Shen JG, Wang JH, et al. Plasma nitric oxide levels in newborn infants with sepsis. J Pediatr, 1993,123:435-438.
, 百拇医药
[3] 蒋东波,沈际皋,杨锡强,等. 哮喘患儿白细胞介素2,6的检测及其意义. 中华儿科杂志,1994,32:219-221.
[4] 赵福生. 肿瘤坏死因子的生物活性检测. 见:钱玉昆,主编.实用免疫学新技术. 北京: 北京医科大学中国协和医科大学联合出版社,1994. 55-57.
[5] 王立波,郭履. 人类TH细胞亚群与支气管哮喘[综述]. 国外医学免疫学分册,1995,18:21-23.
[6] Borish L, Aarons A, Rumbyrt J, et al. Interleukin-10 regulation in normal subjects and patients with asthma. J Allergy Clin Immunol, 1996,97:1288-1296.
[7] 蒋东波,李华强,史源, 等. 过敏性哮喘一氧化氮及内皮素水平变化的实验研究. 中华医学杂志,1995,75:501-502.
, 百拇医药
[8] Barnes PJ. Nitric oxide and airways .Eur Respir J, 1993,6:163-166.
[9] Lander HM, Sehaipal P, Levine DM, et al. Activation of human peripheral blood mononuclear cells by nitric oxide generating compounds. J Immunol, 1993,150:1509-1516.
[10] Strieter RM, Remick DG, Lynch JP, et al. Interleukin 2 induced tumor necrosis factor-alpha (TNF-α) gene expression in human alveolar macrophages and blood monocytes. Am Rev Respir Dis, 1989,139:335-342.
, http://www.100md.com
[11] Taylor-Robinson AW, Liew FY, Severn A, et al. Regulation of the immune response by nitric oxide differentially produced by T helper type 1 and T helper type 2 cells. Eur J Immunol, 1994, 24: 980-984.
[12] 戴山林,殷凯生. 白介素-10与支气管哮喘[综述]. 国外医学呼吸系统分册,1997,17:57-61.
[13] Brinkmann V, Kristofic C. Regulation by corticosteroids of Th1 and Th2 cytokine production in human CD+4 effector T cells generated from CD45RO- and CD45RO+ subsets. J Immunol, 1995,155:3322-3327.
(收稿:1998-06-09 修回:1998-08-25), http://www.100md.com