化疗药物体外诱导白血病细胞凋亡的研究
作者:成金蓉 赵新民 郑胡镛 赵卫红
单位:成金蓉(100045 首都医科大学附属北京儿童医院);赵新民(100045 首都医科大学附属北京儿童医院);郑胡镛(100045 首都医科大学附属北京儿童医院);赵卫红(军事医学科学院)
关键词:脱噬作用;白血病;抗肿瘤药
中华儿科杂志000410 【摘要】 目的 研究化疗药物诱导白血病细胞凋亡的作用及其与Bcl-2表达、临床预后指标及临床疗效的关系。方法 利用形态学观察、DNA琼脂糖凝胶电泳、凋亡指示抗体APO 2.7结合流式细胞仪检测法,研究临床治疗相关剂量的化疗药物诱导急性淋巴细胞白血病(ALL)细胞、急性混合性白血病(HAL)细胞的凋亡及其Bcl-2表达率。结果 (1)用临床治疗相关剂量的长春新碱(VCR)、地塞米松(Dex)、柔红霉素(DNR)、阿糖胞苷(Ara-C)作用20~24 h后,多数患儿(分别为22/24、19/24、6/11、6/6)的白血病细胞可发生凋亡。但是DNR引起部分患儿(3/11)的白血病细胞发生坏死。(2)VCR组与Dex组以及Ara-C组与Dex组的诱导凋亡率呈高度正相关,相关系数分别为0.821(P<0.001)和0.994(P<0.001)。(3)新鲜离体白血病细胞的凋亡率为(3.2±1.9)%。ALL及HAL细胞体外培养24 h后的自发凋亡为(18.2±13.5)%,且与VCR,Dex及Ara-C的诱导凋亡率呈正相关,相关系数分别为0.878(P<0.001)、0.893(P<0.001)、0.882(P<0.05)。(4)CD34是影响白血病细胞凋亡率的独立指标。阳性组(CD34≥30%)的VCR、Dex诱导凋亡率及自发凋亡率明显低于阴性组。(5)白血病细胞的Bcl-2表达率与药物诱导凋亡率及自发凋亡率无负相关关系。结论 诱导凋亡是临床治疗相关剂量的化疗药物杀伤白血病细胞的重要机制。
, http://www.100md.com
Apoptosis of leukemic cells induced by chemotherapeutic drugs in vitro
CHENG Jinrong, ZHAO Xinmin, ZHENG Huyong
(Beijing Children′s Hospital Affiliated to Capital University of Medical Sciences, Beijing 100045, China)
【Abstract】 Objective To study the ability of the chemotherapeutic drugs for inducing apoptosis and its relation to the Bcl-2 expression of leukemic cells, the prognostic factors and the efficacy of clinical treatment. Methods The morphologic study, agarose gel electrophoresis and flow cytometry were utilized to investigate the apoptosis of acute lymphoid leukemia (ALL) and hemoblastocy acute leukmia (HAL) cells induced by vincristine (VCR), dexamethasone (Dex), cytosine arabinoside (Ara-C) and daunorubicin (DNR) at clinically relevant dosage. The flow cytometry was also used to study the expression of Bcl-2 on leukemic cells.Results (1) Exposure of leukemic cells to clinically relevant concentrations of VCR, Dex, Ara-C and DNR for 20~24 hours resulted in apoptosis in most patients (22/24, 19/24, 6/11 and 6/6, respectively). Necrosis was found in leukemic cells of some patients (3/11) on DNR treatment. (2)The proportion of apoptotic cells induced by some chemotherapeutic drugs showed positive correlations with each other. The correlation coefficient of apoptotic rate in VCR group and Dex group was 0.821 (P<0.001), in Ara-C group and Dex group was 0.994 (P<0.001). (3)The apoptotic rate of fresh leukemic cells was (3.2±1.9)%. ALL and HAL cells cultured for 24 hours in vitro would develop spontaneous apoptosis in (18.2±13.5)%. The spontaneous apoptosis rate correlated positively to the apoptosis rates induced by VCR, Dex and Ara-c, the relevant coefficients were 0.878 (P<0.001), 0.893 (P<0.001) and 0.882 (P<0.05), respectively. (4)CD34 was an independent factor influencing apoptotic rates, the apoptotic rate was significantly lower in CD34 positive group (CD34≥30%) than that in CD34 negative group. (5)There was no relationship between the expression of Bcl-2 and the apoptic rate of leukemic cells. Conclusion Inducing apoptosis is an important mechanism of killing leukemic cells by chemotherapeutic drugs.
, 百拇医药
【Key words】 Apoptosis; Leukemial; Antineoplastic agents
近年来的研究发现白血病的发生和化疗药物导致的白血病细胞死亡,都与细胞凋亡有密切关系。细胞凋亡是基因控制下的细胞主动死亡过程,现已证实几乎所有化疗药物在体内和体外都能通过细胞凋亡机制杀死白血病细胞[1,2]。化疗药物的抗癌效果不仅取决于药物对靶细胞的直接作用,更在于其诱导肿瘤细胞凋亡的能力。我们研究了几种常用化疗药物在临床治疗相关剂量下对急性淋巴细胞白血病(ALL)细胞及急性混合性白血病(HAL)细胞的凋亡诱导作用及其与临床预后因素的关系。
对象及方法
一、对象
1.病例选择:我院1997年10月~1998年3月住院的初治ALL及HAL患儿共24例。男13例,女11例;年龄4个月~13岁,平均年龄6岁7个月。根据FAB标准,24例初治患儿全部为ALL,其中L1型 2例,L2型 18例,L3型 4例。23例初诊时进行免疫分型,其中B系19例,T系4例。依据Catovsky双表型急性白血病积分法判定其中4例为HAL。
, http://www.100md.com
2.正常对照:共10例,男5例,女5例;年龄1~10岁,平均年龄6岁7个月。骨髓取自骨科畸形矫形手术中的切除骨。
二、主要试剂
1.单克隆抗体: 标记荧光素藻红蛋白(PE)的APO 2.7及IgG1。纯净的APO 2.7,Bcl-2 (购自Immunotech公司,法国),标记荧光素异硫氰酸荧光素(FITC)的羊抗鼠二抗 (购自Dako公司,丹麦)。
2.DNA琼脂糖凝胶电泳试剂:溶液1含10 mmol/L的Tris-Cl (pH 7.6),10 mmol/L KCl,10 mmol/L 的MgCl2; 溶液2含10 mmol/L Tris-Cl (pH7.6), 10 mmol/L 的KCl,10 mmol/L 的MgCl2, 0.5 mol/L 的NaCl, 0.5%的SDS, 2 mmol/L 乙二胺四乙酸二钠盐(EDTA); 5×TBE ,TE , 分子标记物:λ DNA/EcoR I+Hind III(北京中山生物技术公司产品)。
, 百拇医药
3.其他:毛地黄皂苷为Sigma产品;BFA膜处理剂含0.02 mol/L 的PBS (pH 7.2)45 ml、甲醛10 ml、丙酮45 ml;淋巴细胞分层液(比重:1.077)。
三、方法
1.白血病患儿骨髓单个核细胞悬液制备及培养:取肝素抗凝的骨髓液2~3 ml,用淋巴细胞分层液常规分离单个核细胞,用含20%胎牛血清的RPMI 1640培养液约10 ml调整细胞浓度为3×105/ml,加入用生理盐水配制的临床治疗相关剂量的化疗药物0.1 ml,使其终浓度分别为长春新碱(VCR) 1.0 μg/ml,地塞米松(Dex) 5.0 μg/ml,柔红霉素(DNR) 10 μg/ml,阿糖胞苷(Ara-C) 50 μg/ml;生理盐水对照组(自发凋亡组)加入0.1 ml灭菌生理盐水(NS),在37℃,5%CO2孵箱饱和湿度下培养[3]。
, 百拇医药
2.形态学方法检测凋亡:体外培养的白血病细胞经姬姆萨染色和苏木精染色后油镜下观察。
3.DNA琼脂糖凝胶电泳检测凋亡:生理盐水对照组,VCR,Dex,Ara-C组白血病细胞体外培养40~44 h和DNR组白血病细胞体外培养20~24 h后收集细胞,提取DNA进行琼脂糖凝胶电泳观察[4]。
4.用流式细胞仪检测凋亡细胞的比例:在体外培养24 h的生理盐水对照组、VCR、Dex、Ara-C组白血病细胞,新鲜白血病细胞和正常儿童单个核细胞用毛地黄皂苷破膜后以直接法标记凋亡指示抗体APO 2.7,体外培养的DNR组白血病细胞用毛地黄皂苷破膜后以间接法标记凋亡指示抗体APO 2.7(由于DNR有自发红荧光)。最后用FACscan流式细胞仪进行数据分析[5]。
5.白血病细胞和正常儿童骨髓单个核细胞Bcl-2的表达:在1×106细胞悬液0.1 ml中加入1%多聚甲醛0.5 ml及BFA膜处理剂各0.5 ml,室温放置5 min后用间接法标记Bcl-2单抗,然后用FACscan流式细胞仪检测。
, http://www.100md.com
四、统计学处理
数据应用SPSS统计软件进行配对t检验,成组t检验,方差分析,卡方检验,秩和检验,相关分析及多元逐步回归分析。
结果
一、形态学表现
光镜下细胞凋亡的形态学改变主要是染色质凝聚、核固缩断裂、细胞浆浓缩,但细胞膜保持完整。随化疗药物种类及作用时间的不同,细胞凋亡的形态学改变亦不完全相同,并呈阶段性改变。用临床治疗相关剂量的VCR、Dex、DNR、Ara-C作用20~24 h 后,多数患儿(分别为 22/24、19/24、6/11、6/6)的白血病细胞可出现细胞凋亡的形态学改变,主要是早、中期凋亡细胞,而晚期凋亡细胞极少见。但部分患儿(3/11)的白血病细胞加入DNR培养20~24 h即出现以细胞坏死为主的表现。
二、DNA琼脂糖凝胶电泳表现
, http://www.100md.com
用临床治疗相关剂量的不同化疗药物作用于不同患儿的白血病细胞后,在琼脂糖凝胶电泳上出现“梯状”条带(说明发生细胞凋亡)的时间和清晰度有很大差异。多数患儿(6/11)的白血病细胞用DNR作用20~24 h后,凝胶电泳上可出现“梯状”条带,但少部分患儿 (3/11) 的白血病细胞,此时电泳即出现弥漫膜状条带(说明发生细胞坏死)。而应用VCR、Dex、Ara-C作用的白血病细胞约40~44 h后才出现典型的“梯状”条带,且不如用DNR作用的白血病细胞的条带清晰。
三、凋亡指示抗体APO 2.7检测细胞凋亡率
单克隆抗体APO 2.7(anti-7A6)是一种新型的检测早期凋亡的指示抗体[5]。新鲜离体的白血病细胞与正常儿童骨髓单个核细胞的凋亡率均在较低水平,分别为(3.2±1.9)%和(4.3±1.8)%。化疗药物处理白血病细胞10~15 h后,用APO 2.7单抗结合流式细胞仪即可检测出凋亡,而此时形态学及DNA琼脂糖凝胶电泳均不能检出明显凋亡。白血病细胞在体外不加入化疗药物培养也能发生自发凋亡,其与临床治疗相关剂量的VCR、Dex、Ara-C作用白血病细胞24 h后的诱导凋亡率呈正相关关系(表1)。
, http://www.100md.com
表1 不同化疗药物诱导白血病细胞的凋亡率与其相应的自发凋亡率的关系 化疗药物
配对数
细胞凋亡率(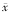 ±s
±s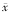 ,%)
,%)
配对比较
P值
两组凋亡率
相关系数r
相关性检验
P值
实验组
, http://www.100md.com
生理盐水对照组
VCR
24
30.4±3.9
18.2±2.8
0.000*
0.878
0.000*
Dex
24
30.7±5.1
18.2±2.8
, http://www.100md.com
0.000*
0.893
0.000*
DNR
11
29.9±7.0
14.2±2.8
0.057
0.106
0.756
Ara-C
6
, 百拇医药
21.5±6.0
12.1±2.2
0.077
0.882
0.020**
注:*差异有极显著性, ** 差异有显著性;生理盐水对照组即自发凋亡组 VCR、Dex、Ara-C三者的凋亡诱导率呈高度正相关。VCR和Dex组(n=24)的相关系数为0.821 (P<0.001),Ara-C和Dex组(n=6)的相关系数为0.994 (P<0.001)。根据流式细胞仪结合凋亡指示抗体APO 2.7检测凋亡百分率(APO 2.7表达率)来判断白血病细胞对药物诱导凋亡的敏感性(表2),VCR与Dex组的凋亡敏感性也呈高度正相关,相关系数r为0.846 (P<0.001)。ALL组与HAL组之间对化疗药物VCR及Dex的凋亡诱导率差异无显著性,P值分别为0.345和0.569。
, 百拇医药
表2 24例患儿白血病细胞对VCR和
Dex诱导凋亡敏感性的对照(例数) VCR组
敏感性
Dex组敏感性
合计
不敏感
低度敏感
中度敏感
高度敏感
不敏感
2
2
, http://www.100md.com 低度敏感
3
3
2
8
中度敏感
4
1
5
高度敏感
1
8
9
合计
, 百拇医药
5
7
3
9
24
注:相关系数rs为0.846(P<0.001);高度敏感:凋亡百分率≥30%;中度敏感:凋亡百分率20%~29%;低度敏感:凋亡百分率10%~19%;不敏感:凋亡百分率<10% 结合细胞形态学观察及DNA电泳检测,发现治疗相关剂量的DNR对白血病细胞的作用机制与VCR、Dex、Ara-C的机制有所不同,11例中6例患儿表现为诱导凋亡为主,3例表现为引起坏死为主,2例无明显作用。三者的APO 2.7表达率差异有显著性,平均秩次分别为8.3、3.7和2.5(P=0.035)。三者的锥虫蓝拒染率差异也有显著性,平均秩次分别为6.8,2.3和9.0(P=0.043)。可见无明显作用的细胞最高,发生凋亡为主的细胞次之,发生坏死为主的细胞最低。
, 百拇医药
四、影响白血病细胞凋亡的因素
1.不同临床预后指标与化疗药物诱导凋亡及自发凋亡的关系(表3):CD34阳性组(CD34≥30%)的VCR、Dex诱导凋亡率及自发凋亡率明显低于阴性组(CD34<30%)。髓系抗原阴性ALL的VCR、Dex诱导凋亡率及自发凋亡率高于髓系抗原阳性ALL。肝脏肋缘下≥5 cm组的VCR、Dex诱导凋亡率及自发凋亡率高于无明显肝脏肿大组。T系白血病的自发凋亡率高于B系白血病。外周血幼稚细胞≥0.30组的自发凋亡率高于外周血幼稚细胞<0.30组。而其他不良预后指标如:年龄>10岁或≤2岁,病程≥3个月,淋巴结肿大(直径≥2.5 cm)及脾脏肿大(肋下≥5 cm),外周血高白细胞(WBC≥25×109/L),骨髓FAB分型为L3型等对药物诱导凋亡率及自发凋亡率均无显著意义。进一步对上述5项阳性指标进行多元逐步回归分析,发现仅有CD34这一个因素对药物诱导凋亡率及自发凋亡率有影响。
, 百拇医药
表3 ALL及HAL患儿白血病细胞的药物诱导凋亡率及
自发凋亡率与不同预后指标的关系(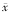 ±s,%) 影响因素
±s,%) 影响因素
例数
自发凋亡率
均值显著性
检验P值
VCR诱导凋亡率
均值显著性
检验P值
Des诱导凋亡率
, 百拇医药 均值显著性
检验P值
CD34
阳性(≥30%)
11
10± 7
0.005*
18± 8
0.001*
18±12
0.026**
阴性(<30%)
, 百拇医药
12
25±15
42±20
41±23
免疫分型
B系
19
16±12
0.035**
29±21
0.505
25±24
0.087
, 百拇医药
T系
4
26± 5
37± 7
22±22
肝脏肋缘下
≥5cm
8
26±12
0.044**
43±22
0.017**
, 百拇医药
45±22
0.039**
<5cm
16
14±13
24±14
23±21
外周血幼稚细胞
≥0.30
10
25±16
0.022**
, 百拇医药
38±21
0.106
42±25
0.057
<0.30
14
13± 8
25±16
22±22
髓系抗原阴性ALL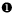
11
26±15
, http://www.100md.com
43±22
42±24
髓系抗原阳性ALL
8
9± 3
20± 5
13± 7
急性混合性白血病
4
14±10
, http://www.100md.com 21±11
28±36
F值
0.022
0.012
0.035
P值 与
与
0.114
0.082
0.507 与
与
, 百拇医药
0.006*
0.010*
0.004* 与
与
0.366
0.860
0.252
* 差异有极显著性, ** 差异有显著性 2.白血病细胞Bcl-2表达率与化疗药物诱导凋亡及自发凋亡的关系:初诊ALL及HAL患儿(n=24)白血病细胞的Bcl-2 表达率明显高于正常对照组儿童 (n=10) 骨髓的单个核细胞Bcl-2的表达率,平均秩次分别为22.5及5.5 (P<0.001)。但进一步分析发现白血病细胞的Bcl-2表达率与体外化疗药物VCR、Dex、DNR、Ara-C诱导凋亡率及自发凋亡率的相关系数分别为 -0.023(n=24),0.071(n=24), 0.275 (n=11), 0.037 (n=6), -0.033 (n=24),它们之间无明显负相关关系。
, http://www.100md.com
讨论
应用治疗相关剂量的VCR、Dex、Ara-C、DNR,均可诱导敏感的ALL或HAL细胞发生凋亡,说明诱导凋亡是化疗药物杀伤白血病细胞的重要机制。几种不同药物的凋亡诱导率呈高度正相关,提示某些化疗药物可能有相似的凋亡诱导途径。Muller等[6]发现以不同浓度的蒽环类药物阿霉素作用于急性淋巴细胞白血病细胞系Molt-4细胞,小剂量发生依赖于RNA合成的凋亡反应,大剂量则不能诱导凋亡,且明显抑制RNA合成。
原癌基因Bcl-2被认为是抑制细胞凋亡的重要基因。但是本试验发现ALL及HAL细胞的Bcl-2蛋白表达率与药物诱导凋亡率及体外自发凋亡率无明显负相关关系。Karawajew等[7]也发现,ALL中Bcl-2蛋白的表达与其体外培养自发凋亡率及CD95介导的凋亡无关。说明单靠Bcl-2蛋白并不能抑制所有细胞的凋亡。其活性也受其他一些蛋白,如p53、Raf-1等的调节。另外Bcl-2基因属于通过相互作用而调节细胞凋亡的Bcl-2基因家族,他们之间的比例决定细胞是否发生凋亡。
, 百拇医药
在各种预后指标中,CD34是一个影响白血病细胞凋亡率的独立指标。研究发现多种生长因子受体与CD34抗原共同表达,如蛋白酪氨酸激酶(PTK)家族成员c-kit和flt-3,在CD34阳性细胞的增殖及分化过程中起重要作用,且对化疗药物诱导CD34阳性白血病细胞凋亡有影响[8]。另外CD34蛋白可能参与跨膜信号传导,推测CD34分子可能通过影响细胞凋亡的信号传导途径而影响凋亡。
新鲜离体的白血病细胞的凋亡率很低,但是在体外培养后可产生不同程度的自发凋亡。骨髓基质细胞可以通过分泌某些抑制凋亡的细胞因子或直接接触作用来阻止白血病细胞的自发凋亡。此外,部分白血病细胞自分泌细胞因子的功能对他的高度增殖和凋亡抑制也有重要意义[9]。另外白血病细胞的体外自发凋亡率与化疗药物诱导凋亡率呈正相关,这对我们预测临床疗效,指导治疗起重要作用。
, http://www.100md.com
我们发现白血病细胞对凋亡诱导的敏感性与临床疗效有关。1例T-ALL患儿的白血病细胞对VCR,Dex诱导凋亡均为高度敏感,给予VP(长春新碱、泼尼松)方案预处理的第2天外周血白细胞立即由260×109/L(幼稚细胞100%)降至2×109/L。部分患儿的白血病细胞对Dex诱导凋亡不敏感,临床单用泼尼松治疗后骨髓白血病细胞比例无明显降低。大部分ALL及HAL患儿的白血病细胞对Ara-C诱导的细胞凋亡不敏感,但1例婴儿白血病患儿对Ara-C诱导的细胞凋亡表现高度敏感。Barnedo等[10]曾报道以Ara-C等抗代谢药为基础的化疗方案成功地使2例复发的白血病婴儿再次获得缓解且长期存活。不同患儿的白血病细胞对不同化疗药物的敏感性差异很大,我们在临床化疗前进行细胞凋亡等药物敏感性试验将有助于个体化治疗,可进一步提高白血病的治疗效果。
参考文献
1,Hirt A, Leibundgut K, Annette RL, et al. Cell birth and death in childhood acute lymphoblastic leukemia: how fast does the neoplastic cell clone expand? Br J Hematol,1997, 98: 999-1001.
, 百拇医药
2,Hickman JA. Apoptosis induced by anticancer drugs. Cancer Metast Rev, 1992,11: 121-139.
3,张鲁榕,孔宪涛,谢映华,等.白血病化疗药物体外敏感试验的临床应用.中华血液学杂志,1990,11:141-142.
4,卢圣栋,主编.现代分子生物学实验技术.北京:高等教育出版社,1993.209-211.
5,Zhang CH, Ao ZH, Seth A, et al. A mitochondrial membrane protein defined by a novel monoclonal antibody is preferentially detected in apoptotic cells. J Immunol, 1996, 157: 3980-3987.
, http://www.100md.com
6,Muller I, Jenner A, Bruchelt G, et al. Effect of concentration on the cytotoxic mechanism of doxorubicin-apoptosis and oxidative DNA damage. Biochem Biophys Res Commun, 1997, 230: 254-257.
7,Karawajew L, Wuchter C, Ruppert V, et al. Differential CD95 expression and function in T and B lineage acute lymphoblastic leukemia cells. Leukemia, 1997, 11: 1245-1252.
8,Hassan HT , Zander A. Stem cell factor as a survival and growth factor in human normal and malignant hematopoiesis. Acta Haematol, 1996 , 95: 257-262.
, http://www.100md.com
9,Pontvert-Delucq S, Hibner V,Vilmer E, et al. Heterogeneity of B lineage acute lymphoblastic leukemia (B-ALL) with regard to their in vitro spontaneous proliferation, growth factor response and Bcl-2 expression. Leuk Lymphoma, 1996, 21: 267-280.
10,Barnedo JC, Yusuf V, Abboud M, et al. Successful treatment of relapsed infant acute lymphoblastic leukemia with intensive antimetabolite-based chemotherapy. Med Pediatr Oncol, 1997, 29: 256-259.
(收稿日期:1999-05-21), 百拇医药
单位:成金蓉(100045 首都医科大学附属北京儿童医院);赵新民(100045 首都医科大学附属北京儿童医院);郑胡镛(100045 首都医科大学附属北京儿童医院);赵卫红(军事医学科学院)
关键词:脱噬作用;白血病;抗肿瘤药
中华儿科杂志000410 【摘要】 目的 研究化疗药物诱导白血病细胞凋亡的作用及其与Bcl-2表达、临床预后指标及临床疗效的关系。方法 利用形态学观察、DNA琼脂糖凝胶电泳、凋亡指示抗体APO 2.7结合流式细胞仪检测法,研究临床治疗相关剂量的化疗药物诱导急性淋巴细胞白血病(ALL)细胞、急性混合性白血病(HAL)细胞的凋亡及其Bcl-2表达率。结果 (1)用临床治疗相关剂量的长春新碱(VCR)、地塞米松(Dex)、柔红霉素(DNR)、阿糖胞苷(Ara-C)作用20~24 h后,多数患儿(分别为22/24、19/24、6/11、6/6)的白血病细胞可发生凋亡。但是DNR引起部分患儿(3/11)的白血病细胞发生坏死。(2)VCR组与Dex组以及Ara-C组与Dex组的诱导凋亡率呈高度正相关,相关系数分别为0.821(P<0.001)和0.994(P<0.001)。(3)新鲜离体白血病细胞的凋亡率为(3.2±1.9)%。ALL及HAL细胞体外培养24 h后的自发凋亡为(18.2±13.5)%,且与VCR,Dex及Ara-C的诱导凋亡率呈正相关,相关系数分别为0.878(P<0.001)、0.893(P<0.001)、0.882(P<0.05)。(4)CD34是影响白血病细胞凋亡率的独立指标。阳性组(CD34≥30%)的VCR、Dex诱导凋亡率及自发凋亡率明显低于阴性组。(5)白血病细胞的Bcl-2表达率与药物诱导凋亡率及自发凋亡率无负相关关系。结论 诱导凋亡是临床治疗相关剂量的化疗药物杀伤白血病细胞的重要机制。
, http://www.100md.com
Apoptosis of leukemic cells induced by chemotherapeutic drugs in vitro
CHENG Jinrong, ZHAO Xinmin, ZHENG Huyong
(Beijing Children′s Hospital Affiliated to Capital University of Medical Sciences, Beijing 100045, China)
【Abstract】 Objective To study the ability of the chemotherapeutic drugs for inducing apoptosis and its relation to the Bcl-2 expression of leukemic cells, the prognostic factors and the efficacy of clinical treatment. Methods The morphologic study, agarose gel electrophoresis and flow cytometry were utilized to investigate the apoptosis of acute lymphoid leukemia (ALL) and hemoblastocy acute leukmia (HAL) cells induced by vincristine (VCR), dexamethasone (Dex), cytosine arabinoside (Ara-C) and daunorubicin (DNR) at clinically relevant dosage. The flow cytometry was also used to study the expression of Bcl-2 on leukemic cells.Results (1) Exposure of leukemic cells to clinically relevant concentrations of VCR, Dex, Ara-C and DNR for 20~24 hours resulted in apoptosis in most patients (22/24, 19/24, 6/11 and 6/6, respectively). Necrosis was found in leukemic cells of some patients (3/11) on DNR treatment. (2)The proportion of apoptotic cells induced by some chemotherapeutic drugs showed positive correlations with each other. The correlation coefficient of apoptotic rate in VCR group and Dex group was 0.821 (P<0.001), in Ara-C group and Dex group was 0.994 (P<0.001). (3)The apoptotic rate of fresh leukemic cells was (3.2±1.9)%. ALL and HAL cells cultured for 24 hours in vitro would develop spontaneous apoptosis in (18.2±13.5)%. The spontaneous apoptosis rate correlated positively to the apoptosis rates induced by VCR, Dex and Ara-c, the relevant coefficients were 0.878 (P<0.001), 0.893 (P<0.001) and 0.882 (P<0.05), respectively. (4)CD34 was an independent factor influencing apoptotic rates, the apoptotic rate was significantly lower in CD34 positive group (CD34≥30%) than that in CD34 negative group. (5)There was no relationship between the expression of Bcl-2 and the apoptic rate of leukemic cells. Conclusion Inducing apoptosis is an important mechanism of killing leukemic cells by chemotherapeutic drugs.
, 百拇医药
【Key words】 Apoptosis; Leukemial; Antineoplastic agents
近年来的研究发现白血病的发生和化疗药物导致的白血病细胞死亡,都与细胞凋亡有密切关系。细胞凋亡是基因控制下的细胞主动死亡过程,现已证实几乎所有化疗药物在体内和体外都能通过细胞凋亡机制杀死白血病细胞[1,2]。化疗药物的抗癌效果不仅取决于药物对靶细胞的直接作用,更在于其诱导肿瘤细胞凋亡的能力。我们研究了几种常用化疗药物在临床治疗相关剂量下对急性淋巴细胞白血病(ALL)细胞及急性混合性白血病(HAL)细胞的凋亡诱导作用及其与临床预后因素的关系。
对象及方法
一、对象
1.病例选择:我院1997年10月~1998年3月住院的初治ALL及HAL患儿共24例。男13例,女11例;年龄4个月~13岁,平均年龄6岁7个月。根据FAB标准,24例初治患儿全部为ALL,其中L1型 2例,L2型 18例,L3型 4例。23例初诊时进行免疫分型,其中B系19例,T系4例。依据Catovsky双表型急性白血病积分法判定其中4例为HAL。
, http://www.100md.com
2.正常对照:共10例,男5例,女5例;年龄1~10岁,平均年龄6岁7个月。骨髓取自骨科畸形矫形手术中的切除骨。
二、主要试剂
1.单克隆抗体: 标记荧光素藻红蛋白(PE)的APO 2.7及IgG1。纯净的APO 2.7,Bcl-2 (购自Immunotech公司,法国),标记荧光素异硫氰酸荧光素(FITC)的羊抗鼠二抗 (购自Dako公司,丹麦)。
2.DNA琼脂糖凝胶电泳试剂:溶液1含10 mmol/L的Tris-Cl (pH 7.6),10 mmol/L KCl,10 mmol/L 的MgCl2; 溶液2含10 mmol/L Tris-Cl (pH7.6), 10 mmol/L 的KCl,10 mmol/L 的MgCl2, 0.5 mol/L 的NaCl, 0.5%的SDS, 2 mmol/L 乙二胺四乙酸二钠盐(EDTA); 5×TBE ,TE , 分子标记物:λ DNA/EcoR I+Hind III(北京中山生物技术公司产品)。
, 百拇医药
3.其他:毛地黄皂苷为Sigma产品;BFA膜处理剂含0.02 mol/L 的PBS (pH 7.2)45 ml、甲醛10 ml、丙酮45 ml;淋巴细胞分层液(比重:1.077)。
三、方法
1.白血病患儿骨髓单个核细胞悬液制备及培养:取肝素抗凝的骨髓液2~3 ml,用淋巴细胞分层液常规分离单个核细胞,用含20%胎牛血清的RPMI 1640培养液约10 ml调整细胞浓度为3×105/ml,加入用生理盐水配制的临床治疗相关剂量的化疗药物0.1 ml,使其终浓度分别为长春新碱(VCR) 1.0 μg/ml,地塞米松(Dex) 5.0 μg/ml,柔红霉素(DNR) 10 μg/ml,阿糖胞苷(Ara-C) 50 μg/ml;生理盐水对照组(自发凋亡组)加入0.1 ml灭菌生理盐水(NS),在37℃,5%CO2孵箱饱和湿度下培养[3]。
, 百拇医药
2.形态学方法检测凋亡:体外培养的白血病细胞经姬姆萨染色和苏木精染色后油镜下观察。
3.DNA琼脂糖凝胶电泳检测凋亡:生理盐水对照组,VCR,Dex,Ara-C组白血病细胞体外培养40~44 h和DNR组白血病细胞体外培养20~24 h后收集细胞,提取DNA进行琼脂糖凝胶电泳观察[4]。
4.用流式细胞仪检测凋亡细胞的比例:在体外培养24 h的生理盐水对照组、VCR、Dex、Ara-C组白血病细胞,新鲜白血病细胞和正常儿童单个核细胞用毛地黄皂苷破膜后以直接法标记凋亡指示抗体APO 2.7,体外培养的DNR组白血病细胞用毛地黄皂苷破膜后以间接法标记凋亡指示抗体APO 2.7(由于DNR有自发红荧光)。最后用FACscan流式细胞仪进行数据分析[5]。
5.白血病细胞和正常儿童骨髓单个核细胞Bcl-2的表达:在1×106细胞悬液0.1 ml中加入1%多聚甲醛0.5 ml及BFA膜处理剂各0.5 ml,室温放置5 min后用间接法标记Bcl-2单抗,然后用FACscan流式细胞仪检测。
, http://www.100md.com
四、统计学处理
数据应用SPSS统计软件进行配对t检验,成组t检验,方差分析,卡方检验,秩和检验,相关分析及多元逐步回归分析。
结果
一、形态学表现
光镜下细胞凋亡的形态学改变主要是染色质凝聚、核固缩断裂、细胞浆浓缩,但细胞膜保持完整。随化疗药物种类及作用时间的不同,细胞凋亡的形态学改变亦不完全相同,并呈阶段性改变。用临床治疗相关剂量的VCR、Dex、DNR、Ara-C作用20~24 h 后,多数患儿(分别为 22/24、19/24、6/11、6/6)的白血病细胞可出现细胞凋亡的形态学改变,主要是早、中期凋亡细胞,而晚期凋亡细胞极少见。但部分患儿(3/11)的白血病细胞加入DNR培养20~24 h即出现以细胞坏死为主的表现。
二、DNA琼脂糖凝胶电泳表现
, http://www.100md.com
用临床治疗相关剂量的不同化疗药物作用于不同患儿的白血病细胞后,在琼脂糖凝胶电泳上出现“梯状”条带(说明发生细胞凋亡)的时间和清晰度有很大差异。多数患儿(6/11)的白血病细胞用DNR作用20~24 h后,凝胶电泳上可出现“梯状”条带,但少部分患儿 (3/11) 的白血病细胞,此时电泳即出现弥漫膜状条带(说明发生细胞坏死)。而应用VCR、Dex、Ara-C作用的白血病细胞约40~44 h后才出现典型的“梯状”条带,且不如用DNR作用的白血病细胞的条带清晰。
三、凋亡指示抗体APO 2.7检测细胞凋亡率
单克隆抗体APO 2.7(anti-7A6)是一种新型的检测早期凋亡的指示抗体[5]。新鲜离体的白血病细胞与正常儿童骨髓单个核细胞的凋亡率均在较低水平,分别为(3.2±1.9)%和(4.3±1.8)%。化疗药物处理白血病细胞10~15 h后,用APO 2.7单抗结合流式细胞仪即可检测出凋亡,而此时形态学及DNA琼脂糖凝胶电泳均不能检出明显凋亡。白血病细胞在体外不加入化疗药物培养也能发生自发凋亡,其与临床治疗相关剂量的VCR、Dex、Ara-C作用白血病细胞24 h后的诱导凋亡率呈正相关关系(表1)。
, http://www.100md.com
表1 不同化疗药物诱导白血病细胞的凋亡率与其相应的自发凋亡率的关系 化疗药物
配对数
细胞凋亡率(
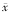 ±s
±s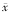 ,%)
,%)配对比较
P值
两组凋亡率
相关系数r
相关性检验
P值
实验组
, http://www.100md.com
生理盐水对照组
VCR
24
30.4±3.9
18.2±2.8
0.000*
0.878
0.000*
Dex
24
30.7±5.1
18.2±2.8
, http://www.100md.com
0.000*
0.893
0.000*
DNR
11
29.9±7.0
14.2±2.8
0.057
0.106
0.756
Ara-C
6
, 百拇医药
21.5±6.0
12.1±2.2
0.077
0.882
0.020**
注:*差异有极显著性, ** 差异有显著性;生理盐水对照组即自发凋亡组 VCR、Dex、Ara-C三者的凋亡诱导率呈高度正相关。VCR和Dex组(n=24)的相关系数为0.821 (P<0.001),Ara-C和Dex组(n=6)的相关系数为0.994 (P<0.001)。根据流式细胞仪结合凋亡指示抗体APO 2.7检测凋亡百分率(APO 2.7表达率)来判断白血病细胞对药物诱导凋亡的敏感性(表2),VCR与Dex组的凋亡敏感性也呈高度正相关,相关系数r为0.846 (P<0.001)。ALL组与HAL组之间对化疗药物VCR及Dex的凋亡诱导率差异无显著性,P值分别为0.345和0.569。
, 百拇医药
表2 24例患儿白血病细胞对VCR和
Dex诱导凋亡敏感性的对照(例数) VCR组
敏感性
Dex组敏感性
合计
不敏感
低度敏感
中度敏感
高度敏感
不敏感
2
2
, http://www.100md.com 低度敏感
3
3
2
8
中度敏感
4
1
5
高度敏感
1
8
9
合计
, 百拇医药
5
7
3
9
24
注:相关系数rs为0.846(P<0.001);高度敏感:凋亡百分率≥30%;中度敏感:凋亡百分率20%~29%;低度敏感:凋亡百分率10%~19%;不敏感:凋亡百分率<10% 结合细胞形态学观察及DNA电泳检测,发现治疗相关剂量的DNR对白血病细胞的作用机制与VCR、Dex、Ara-C的机制有所不同,11例中6例患儿表现为诱导凋亡为主,3例表现为引起坏死为主,2例无明显作用。三者的APO 2.7表达率差异有显著性,平均秩次分别为8.3、3.7和2.5(P=0.035)。三者的锥虫蓝拒染率差异也有显著性,平均秩次分别为6.8,2.3和9.0(P=0.043)。可见无明显作用的细胞最高,发生凋亡为主的细胞次之,发生坏死为主的细胞最低。
, 百拇医药
四、影响白血病细胞凋亡的因素
1.不同临床预后指标与化疗药物诱导凋亡及自发凋亡的关系(表3):CD34阳性组(CD34≥30%)的VCR、Dex诱导凋亡率及自发凋亡率明显低于阴性组(CD34<30%)。髓系抗原阴性ALL的VCR、Dex诱导凋亡率及自发凋亡率高于髓系抗原阳性ALL。肝脏肋缘下≥5 cm组的VCR、Dex诱导凋亡率及自发凋亡率高于无明显肝脏肿大组。T系白血病的自发凋亡率高于B系白血病。外周血幼稚细胞≥0.30组的自发凋亡率高于外周血幼稚细胞<0.30组。而其他不良预后指标如:年龄>10岁或≤2岁,病程≥3个月,淋巴结肿大(直径≥2.5 cm)及脾脏肿大(肋下≥5 cm),外周血高白细胞(WBC≥25×109/L),骨髓FAB分型为L3型等对药物诱导凋亡率及自发凋亡率均无显著意义。进一步对上述5项阳性指标进行多元逐步回归分析,发现仅有CD34这一个因素对药物诱导凋亡率及自发凋亡率有影响。
, 百拇医药
表3 ALL及HAL患儿白血病细胞的药物诱导凋亡率及
自发凋亡率与不同预后指标的关系(
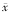 ±s,%) 影响因素
±s,%) 影响因素例数
自发凋亡率
均值显著性
检验P值
VCR诱导凋亡率
均值显著性
检验P值
Des诱导凋亡率
, 百拇医药 均值显著性
检验P值
CD34
阳性(≥30%)
11
10± 7
0.005*
18± 8
0.001*
18±12
0.026**
阴性(<30%)
, 百拇医药
12
25±15
42±20
41±23
免疫分型
B系
19
16±12
0.035**
29±21
0.505
25±24
0.087
, 百拇医药
T系
4
26± 5
37± 7
22±22
肝脏肋缘下
≥5cm
8
26±12
0.044**
43±22
0.017**
, 百拇医药
45±22
0.039**
<5cm
16
14±13
24±14
23±21
外周血幼稚细胞
≥0.30
10
25±16
0.022**
, 百拇医药
38±21
0.106
42±25
0.057
<0.30
14
13± 8
25±16
22±22
髓系抗原阴性ALL
11
26±15
, http://www.100md.com
43±22
42±24
髓系抗原阳性ALL

8
9± 3
20± 5
13± 7
急性混合性白血病
4
14±10
, http://www.100md.com 21±11
28±36
F值
0.022
0.012
0.035
P值
 与
与
0.114
0.082
0.507
 与
与
, 百拇医药
0.006*
0.010*
0.004*
 与
与
0.366
0.860
0.252
* 差异有极显著性, ** 差异有显著性 2.白血病细胞Bcl-2表达率与化疗药物诱导凋亡及自发凋亡的关系:初诊ALL及HAL患儿(n=24)白血病细胞的Bcl-2 表达率明显高于正常对照组儿童 (n=10) 骨髓的单个核细胞Bcl-2的表达率,平均秩次分别为22.5及5.5 (P<0.001)。但进一步分析发现白血病细胞的Bcl-2表达率与体外化疗药物VCR、Dex、DNR、Ara-C诱导凋亡率及自发凋亡率的相关系数分别为 -0.023(n=24),0.071(n=24), 0.275 (n=11), 0.037 (n=6), -0.033 (n=24),它们之间无明显负相关关系。
, http://www.100md.com
讨论
应用治疗相关剂量的VCR、Dex、Ara-C、DNR,均可诱导敏感的ALL或HAL细胞发生凋亡,说明诱导凋亡是化疗药物杀伤白血病细胞的重要机制。几种不同药物的凋亡诱导率呈高度正相关,提示某些化疗药物可能有相似的凋亡诱导途径。Muller等[6]发现以不同浓度的蒽环类药物阿霉素作用于急性淋巴细胞白血病细胞系Molt-4细胞,小剂量发生依赖于RNA合成的凋亡反应,大剂量则不能诱导凋亡,且明显抑制RNA合成。
原癌基因Bcl-2被认为是抑制细胞凋亡的重要基因。但是本试验发现ALL及HAL细胞的Bcl-2蛋白表达率与药物诱导凋亡率及体外自发凋亡率无明显负相关关系。Karawajew等[7]也发现,ALL中Bcl-2蛋白的表达与其体外培养自发凋亡率及CD95介导的凋亡无关。说明单靠Bcl-2蛋白并不能抑制所有细胞的凋亡。其活性也受其他一些蛋白,如p53、Raf-1等的调节。另外Bcl-2基因属于通过相互作用而调节细胞凋亡的Bcl-2基因家族,他们之间的比例决定细胞是否发生凋亡。
, 百拇医药
在各种预后指标中,CD34是一个影响白血病细胞凋亡率的独立指标。研究发现多种生长因子受体与CD34抗原共同表达,如蛋白酪氨酸激酶(PTK)家族成员c-kit和flt-3,在CD34阳性细胞的增殖及分化过程中起重要作用,且对化疗药物诱导CD34阳性白血病细胞凋亡有影响[8]。另外CD34蛋白可能参与跨膜信号传导,推测CD34分子可能通过影响细胞凋亡的信号传导途径而影响凋亡。
新鲜离体的白血病细胞的凋亡率很低,但是在体外培养后可产生不同程度的自发凋亡。骨髓基质细胞可以通过分泌某些抑制凋亡的细胞因子或直接接触作用来阻止白血病细胞的自发凋亡。此外,部分白血病细胞自分泌细胞因子的功能对他的高度增殖和凋亡抑制也有重要意义[9]。另外白血病细胞的体外自发凋亡率与化疗药物诱导凋亡率呈正相关,这对我们预测临床疗效,指导治疗起重要作用。
, http://www.100md.com
我们发现白血病细胞对凋亡诱导的敏感性与临床疗效有关。1例T-ALL患儿的白血病细胞对VCR,Dex诱导凋亡均为高度敏感,给予VP(长春新碱、泼尼松)方案预处理的第2天外周血白细胞立即由260×109/L(幼稚细胞100%)降至2×109/L。部分患儿的白血病细胞对Dex诱导凋亡不敏感,临床单用泼尼松治疗后骨髓白血病细胞比例无明显降低。大部分ALL及HAL患儿的白血病细胞对Ara-C诱导的细胞凋亡不敏感,但1例婴儿白血病患儿对Ara-C诱导的细胞凋亡表现高度敏感。Barnedo等[10]曾报道以Ara-C等抗代谢药为基础的化疗方案成功地使2例复发的白血病婴儿再次获得缓解且长期存活。不同患儿的白血病细胞对不同化疗药物的敏感性差异很大,我们在临床化疗前进行细胞凋亡等药物敏感性试验将有助于个体化治疗,可进一步提高白血病的治疗效果。
参考文献
1,Hirt A, Leibundgut K, Annette RL, et al. Cell birth and death in childhood acute lymphoblastic leukemia: how fast does the neoplastic cell clone expand? Br J Hematol,1997, 98: 999-1001.
, 百拇医药
2,Hickman JA. Apoptosis induced by anticancer drugs. Cancer Metast Rev, 1992,11: 121-139.
3,张鲁榕,孔宪涛,谢映华,等.白血病化疗药物体外敏感试验的临床应用.中华血液学杂志,1990,11:141-142.
4,卢圣栋,主编.现代分子生物学实验技术.北京:高等教育出版社,1993.209-211.
5,Zhang CH, Ao ZH, Seth A, et al. A mitochondrial membrane protein defined by a novel monoclonal antibody is preferentially detected in apoptotic cells. J Immunol, 1996, 157: 3980-3987.
, http://www.100md.com
6,Muller I, Jenner A, Bruchelt G, et al. Effect of concentration on the cytotoxic mechanism of doxorubicin-apoptosis and oxidative DNA damage. Biochem Biophys Res Commun, 1997, 230: 254-257.
7,Karawajew L, Wuchter C, Ruppert V, et al. Differential CD95 expression and function in T and B lineage acute lymphoblastic leukemia cells. Leukemia, 1997, 11: 1245-1252.
8,Hassan HT , Zander A. Stem cell factor as a survival and growth factor in human normal and malignant hematopoiesis. Acta Haematol, 1996 , 95: 257-262.
, http://www.100md.com
9,Pontvert-Delucq S, Hibner V,Vilmer E, et al. Heterogeneity of B lineage acute lymphoblastic leukemia (B-ALL) with regard to their in vitro spontaneous proliferation, growth factor response and Bcl-2 expression. Leuk Lymphoma, 1996, 21: 267-280.
10,Barnedo JC, Yusuf V, Abboud M, et al. Successful treatment of relapsed infant acute lymphoblastic leukemia with intensive antimetabolite-based chemotherapy. Med Pediatr Oncol, 1997, 29: 256-259.
(收稿日期:1999-05-21), 百拇医药