2型糖尿病与胰岛素信号传导缺陷关系的研究
http://www.100md.com
中国糖尿病杂志 2000年第5期第8卷 论 著
李新荣(东南大学医学院生化教研室 邮政编码 210009);章立(东南大学医学院生化教研室 邮政编码 210009);徐蘅(东南大学医学院生化教研室 邮政编码 210009);冯志民(东南大学医学院生化教研室 邮政编码 210009) 李新荣 章立 徐蘅 冯志民
关键词:2型糖尿病;信号传导;淋巴细胞
摘要:中国糖尿病杂志000503 摘要 目的 通过对胰岛素受体及受体后传导介质的测定,寻找2型糖尿病患者胰岛素抵抗信号传导通路中的一些共有的缺陷,为揭示其病因、寻找有效的治疗药物奠定基础。方法 用同位素示踪的方法,来测定患者外周血淋巴细胞TPK和MAPK的活性;用Fluo-3为荧光探针,来测定胞浆内Ca2+浓度;分光光度法测定一氧化氮(NO)浓度。结果 2型糖尿病病人TPK、MAPK水平下降,NO浓度降低,Ca2+浓度升高。结论 2型糖尿病患者胰岛素信号传导通路中有关信号分子存在缺陷。
, 百拇医药
Study on the relationship between type 2 diabetics and the defects of insulin signal transduction
Li Xinrong,Zhang Li,Xu Heng,et al
(Department of Biochemistry,Nanjing Railway Medical College,Nanjing 210009)
Abstract Objective Through the determination of the insulin receptor and its signal transducers,we tried to find the defects in the common pathway of insulin signal transduction in type 2 DM and to lay a foundation to discover the pathogenesis and effective drugs.Methods Using 32P-labeling method to determine the activity of TPK and MAPK.Using Fluo 3-AM as fluorescent probe to determine intracellular calcium of patients with type 2 DM.Using photometry to determine the concentration of NO.Results The activities of TPK,MAPK remarkably descended and the concentration of NO also greatly descended compared with healthy people.The concentration of intracellular calcium increased compared with healthy people.Conclusion The defects of the related signal molecule in insulin signal transduction of type 2 DM existed.
, 百拇医药
Key words Type 2 diabetes mellitus Signal transduction Lymrphocyte
2型糖尿病是一种多基因遗传因素、环境因素综合作用引起的内分泌代谢性疾病,其病理缺陷表现为胰岛素抵抗和胰岛素分泌相对不足,而胰岛素抵抗(IR)是其主要始发因素[1]。近来研究表明,胰岛素信号传导途径的异常是造成胰岛素抵抗的重要因素。胰岛素信号传导通路中的受体前、受体、受体后水平的任一环节出现障碍都会导致胰岛素抵抗。我们以人外周血淋巴细胞为标本,观察了2型糖尿病患者胰岛素受体及受体后几个重要的信号分子。通过这些研究力求寻找这些信号分子与2型糖尿病的关系,为揭示其发病机理、恢复正常信号传导途径奠定基础。
材料和方法
一、材料和试剂
1.标本来源:正常人新鲜全血取自南京市中心血站和东南大学医学院附院检验科,初诊2型糖尿病病人或未经胰岛素治疗患者的全血由八一医院内分泌科、南京铁道医学院附院内分泌科提供。正常人和患者的年龄均在35~60岁。
, http://www.100md.com
2.试剂:多肽底物Poly(Glu,Tyr)4∶1,表皮生长因子受体(EGFR)、Fluo 3-AM、Bay K8644亮肽素均购自Sigma公司,ATP由B M 公司进口分装,[γ-32P]ATP购自北京亚辉生物医学工程公司,PMSF购自华美生物工程公司(进口分装),DTT由上海化学试剂公司经销(进口分装)。其余试剂均为分析纯。
二、方法
1.TPK活性的测定方法:从全血中提取淋巴细胞,制备淋巴细胞膜。TPK活性测定反应体系参照Trevillyan等[2]方法:20mmol/L Tris-HCl(pH7.0),50mmol/L MgCl2,25μmol/L Na3VO4,0.1% Triton X-100,50μmol/L[γ-32P]ATP(1 500cpm/pmol),2mg/ml多肽底物Poly(Glu,Tyr)4∶1(空白管不加多肽底物),总反应体积50μl,加5μg左右膜蛋白起始反应,30℃水浴5分钟。终止反应参照Kong等[3]方法,反应完毕点样于新华一号滤纸片,迅速放入10% TCA-2%磷酸洗涤液中,用2%磷酸洗涤2次,每次15分钟,再用无水乙醇脱水,吹干,用液闪计数仪测定其放射性,以所测放射性计数率来反映TPK的活性。
, http://www.100md.com
2.MAPK的测定方法:淋巴细胞匀浆液制备及反应体系参照VanRenterghem等[4]的方法,酶反应缓冲液(含20mmol/L HEPES,pH7.0,3mmol/L巯基乙醇,10mmol/L MgCl2,0.1μg/ml牛血清白蛋白),100μmol/L[γ-32P]ATP(3~5cpm/fmol),200μmol/L EGFR,最后加入10μl酶反应液,总反应体系30μl。30℃水浴孵育15分钟,加入等体积的50%醋酸终止反应。点样30μl于滤纸上,用1%磷酸洗涤3次,每次2分钟,再用100%丙酮脱水2分钟,吹干。用液闪计数仪测定其放射性,以所测放射性计数率来反映MAPK的活性。
3.胞内Ca2+浓度的测定方法:淋巴细胞fluo-3的孵育及胞内Ca2+浓度的测定参照Yorek等[5]的方法,激发波长为490nm,发射波长为529nm,测定静息期荧光值,加入100μl溶液(含20% Triton X-100和20mmol/L CaCl2)测得Fmax。再加100μl 200mmol/L EGTA(pH7.0),得Fmin。Ca2+浓度可通过下式计算:[Ca2+]=Kd(F-Fmin)/(Fmax-F)。Fluo 3-AM的Kd值等于0.4μmol/L。
, 百拇医药
4.胞内一氧化氮(NO)的测定方法:NO化学性质活泼,在体内很快代谢为NO-2和NO-3,可利用硝酸还原酶特异性地将NO-3还原为NO-2,通过显色来测定其浓度。NO测定方法由南京建成生物工程研究所提供。
5.统计学分析:实验数据用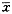 ±s表示,两组均数间的差异用完全随机资料的t检验,P<0.05为相差显著的界限。
±s表示,两组均数间的差异用完全随机资料的t检验,P<0.05为相差显著的界限。
结 果
一、2型糖尿病患者淋巴细胞膜TPK活性的测定
正常人及2型糖尿病患者淋巴细胞膜TPK活性测定的结果表明,2型糖尿病患者TPK活性下降。20例健康成年人外周血淋巴细胞膜TPK活性为786.31±198.46cpm,21例2型糖尿病患者淋巴细胞膜TPK活性测定为412.75±89.32cpm,P<0.01。
, http://www.100md.com
二、2型糖尿病患者淋巴细胞MAPK活性的测定
8例健康成年人外周血淋巴细胞MAPK活性为10 200.625±1 779.489cpm,8例2型糖尿病患者淋巴细胞MAPK活性为5 346.987±479.287cpm,P<0.01。
三、2型糖尿病患者淋巴细胞内NO含量的测定
18例健康成年人外周血淋巴细胞NO活性为63.13±22.12μmol*L-1/g*Pr,21例2型糖尿病患者淋巴细胞NO活性为17.03±5.94μmol*L-1/g*Pr,P<0.01。
四、2型糖尿病患者淋巴细胞胞浆内Ca2+浓度的测定
21例健康成年人外周血淋巴细胞胞浆内Ca2+浓度为0.142±0.049μmol/L,20例2型糖尿病患者淋巴细胞胞浆内Ca2+浓度为0.228±0.072μmol/L,P<0.05。
, http://www.100md.com
讨 论
2型糖尿病患者TPK活性与正常人相比有明显下降,说明2型糖尿病患者可能存在IR的缺陷。其活性下降的机制可能是:①遗传因素:即原发性IR缺陷。已发现的21种受体基因突变均发生在结构基因上,造成IR mRNA表达改变,阻碍受体生成α、β亚基,影响信号向细胞内传导,并加速受体降解,导致受体结合胰岛素能力异常[6]。②IR磷酸化对TPK活性的影响:TPK活性与酪氨酸磷酸化区域有关。胰岛素受体自身磷酸化涉及β亚基三个结构域的Tyr位点,即近膜侧区、TPK活性区和C-末端区。不同结构域的TPK磷酸化对IR信号传递作用和生物学意义是不同的,胰岛素受体Tyr1150磷酸化是受体激酶激活的关键步骤。另外2型糖尿病患者细胞内蛋白激酶C(PKC)活化,促使IR的β亚基Ser/Thr残基磷酸化,也会引起IR自身磷酸化下降和受体激酶活性下降,导致信号系统偶联异常[7]。③IR数量下降:年龄的增加也是导致IR数量下降的因素[6]。④受体与胰岛素亲和力低下同样会导致TPK活性下降。由于2型糖尿病患者TPK活性下降,造成IR受体TPK-Ras-MAPK通路的障碍。
, http://www.100md.com
MAPK是胰岛素信号传导通路下游的重要信号分子,是信号从细胞表面传导到细胞核内重要的传递者。MAPK的作用一方面通过细胞核转录调节因子的磷酸化,引起基因水平的改变;另一方面,也可通过激活其它底物磷酸化,调节细胞的有丝分裂,发挥胰岛素的促进细胞生长等作用。从实验结果来看,2型糖尿病病人MAPK活性与正常人相比有明显下降,从而表明了MAPK级联途径是胰岛素信号传导的重要环节,也说明TPK、MAPK活性密切相关。TPK活性的下降,可能会影响其后信号分子IRS-1、Ras、Raf的激活,同样可能会影响到MAPK的活性。而MAPK对上游信号通路也存在反馈调节。
近年来对糖尿病动物模型的研究表明,多数组织细胞胞浆内游离钙离子浓度升高,且这种改变与糖尿病慢性并发症的发生和发展有一定关系。本实验以Fluo-3为荧光探针,来测定胞内Ca2+的变化。实验表明,2型糖尿病患者胞内Ca2+浓度显著上升,这可能与Ca2+-ATP酶的失活和PKC的激活有关。
, 百拇医药
研究表明,临床上出现高血压、胰岛素抵抗、糖尿病时,机体多数组织细胞胞浆内游离Ca2+水平升高[8]。导致这一现象产生的机制可能是一方面高血糖直接抑制了Ca2+-ATP酶的活性,使细胞外的Ca2+进入细胞内。由于酶的糖基化抑制了Ca2+-ATP酶活性,同时高糖也抑制了Na+/Ca2+交换和Na+-K+-ATP酶的活性;另一方面,Demerdash等[9]研究发现PMNL的蛋白激酶C在高浓度葡萄糖中被激活,激活钙通道,使Ca2+从钙池(主要是内质网)中释放,也是血Ca2+浓度升高的机理之一。
我们在研究TPK、MAPK、Ca2+与2型糖尿病关系的同时,也观察了患者淋巴细胞内NO水平。从实验结果来看,2型糖尿病患者体内NO水平降低,可能与NO作为信号分子的NO/cGMP途径存在缺陷有关。NO激活可溶性鸟苷酸环化酶(sGC)、升高细胞内环鸟苷酸(cGMP)水平、通过第二信使cGMP的作用,是NO发挥多种生物效应的主要信号传导机制。有研究表明糖尿病大鼠NO浓度降低与高血糖有关[10]。因此,可以认为2型糖尿病的发生可能与NO/cGMP环节的缺陷也有关。
, http://www.100md.com
本实验对胰岛素信号传导通路中几个重要的信号分子TPK、MAPK、Ca2+、NO进行测定,来观察它们在病理状态下的变化。从结果来看,2型糖尿病患者的淋巴细胞内上述信号分子均出现异常。这些信号分子究竟是如何影响2型糖尿病的发生与发展,还有待进一步研究。
参考文献
1,Sacks DB.Amylin-a glucoregulatory hormone involved in the pathogenesis of diabetes mellitus?Clin Chem,1996,42:494.
2,Trevillyan JM,Nordstrom A,Linna TJ.High tyrosine-specific protein kinase activity in normal human peripheral blood lymphocytes.Biochim Biophys Acta,1985,845:1.
, http://www.100md.com
3,Kong SK,Wang JH.Purification and characterization of a protein tyrosine kinase from bovine spleen.J Biol Chem,1987,262:2597.
4,Van Renterghem B,Browning MD,Maller JL.Regulation of mitogen-activated protein kinase activation by protein kinases A and C in a cell-free system.J Biol Chem,1994,269:24666.
5,Yorek MA,Davidson EP,Dunlap JA,et al.Effect of bradykinin on cytosolic calcium in neuroblastoma cells using the fluorescent indicator fluo-3.Biochim Biophys Acta,1993,1177:215.
, http://www.100md.com
6,Moller DE,Flier JS.Insulin resistance-mechanisms,syndromes,and implications.N Engl J Med,1991,325:938.
7,Sibley DR,Benovic JL,Caron MG,et al.Regulation of transmembrane signaling by receptor phosphorylation.Cell,1987,48:913.
8,Barbagallo M,Gupta RK,Resnick LM.Cellularions in NIDDM:relation of calcium to hyperglycemia and cardiac mass.Diabetes Care,1996,19:1393.
9,Demerdash TM,Seyrek N,Smogorzewski M,et al.Pathways through which glucose induces a rise in [Ca2+] of polymorphonuclear leukocytes of rats.Kidney Int,1996,50:2032.
10,Kihara M,Low PA.Impaired vasoreactivity to nitric oxide in experimental diabetic neuropathy.Exp Neurol,1995,132:180.
(收稿:1999-07-13 修回:1999-12-13), 百拇医药
关键词:2型糖尿病;信号传导;淋巴细胞
摘要:中国糖尿病杂志000503 摘要 目的 通过对胰岛素受体及受体后传导介质的测定,寻找2型糖尿病患者胰岛素抵抗信号传导通路中的一些共有的缺陷,为揭示其病因、寻找有效的治疗药物奠定基础。方法 用同位素示踪的方法,来测定患者外周血淋巴细胞TPK和MAPK的活性;用Fluo-3为荧光探针,来测定胞浆内Ca2+浓度;分光光度法测定一氧化氮(NO)浓度。结果 2型糖尿病病人TPK、MAPK水平下降,NO浓度降低,Ca2+浓度升高。结论 2型糖尿病患者胰岛素信号传导通路中有关信号分子存在缺陷。
, 百拇医药
Study on the relationship between type 2 diabetics and the defects of insulin signal transduction
Li Xinrong,Zhang Li,Xu Heng,et al
(Department of Biochemistry,Nanjing Railway Medical College,Nanjing 210009)
Abstract Objective Through the determination of the insulin receptor and its signal transducers,we tried to find the defects in the common pathway of insulin signal transduction in type 2 DM and to lay a foundation to discover the pathogenesis and effective drugs.Methods Using 32P-labeling method to determine the activity of TPK and MAPK.Using Fluo 3-AM as fluorescent probe to determine intracellular calcium of patients with type 2 DM.Using photometry to determine the concentration of NO.Results The activities of TPK,MAPK remarkably descended and the concentration of NO also greatly descended compared with healthy people.The concentration of intracellular calcium increased compared with healthy people.Conclusion The defects of the related signal molecule in insulin signal transduction of type 2 DM existed.
, 百拇医药
Key words Type 2 diabetes mellitus Signal transduction Lymrphocyte
2型糖尿病是一种多基因遗传因素、环境因素综合作用引起的内分泌代谢性疾病,其病理缺陷表现为胰岛素抵抗和胰岛素分泌相对不足,而胰岛素抵抗(IR)是其主要始发因素[1]。近来研究表明,胰岛素信号传导途径的异常是造成胰岛素抵抗的重要因素。胰岛素信号传导通路中的受体前、受体、受体后水平的任一环节出现障碍都会导致胰岛素抵抗。我们以人外周血淋巴细胞为标本,观察了2型糖尿病患者胰岛素受体及受体后几个重要的信号分子。通过这些研究力求寻找这些信号分子与2型糖尿病的关系,为揭示其发病机理、恢复正常信号传导途径奠定基础。
材料和方法
一、材料和试剂
1.标本来源:正常人新鲜全血取自南京市中心血站和东南大学医学院附院检验科,初诊2型糖尿病病人或未经胰岛素治疗患者的全血由八一医院内分泌科、南京铁道医学院附院内分泌科提供。正常人和患者的年龄均在35~60岁。
, http://www.100md.com
2.试剂:多肽底物Poly(Glu,Tyr)4∶1,表皮生长因子受体(EGFR)、Fluo 3-AM、Bay K8644亮肽素均购自Sigma公司,ATP由B M 公司进口分装,[γ-32P]ATP购自北京亚辉生物医学工程公司,PMSF购自华美生物工程公司(进口分装),DTT由上海化学试剂公司经销(进口分装)。其余试剂均为分析纯。
二、方法
1.TPK活性的测定方法:从全血中提取淋巴细胞,制备淋巴细胞膜。TPK活性测定反应体系参照Trevillyan等[2]方法:20mmol/L Tris-HCl(pH7.0),50mmol/L MgCl2,25μmol/L Na3VO4,0.1% Triton X-100,50μmol/L[γ-32P]ATP(1 500cpm/pmol),2mg/ml多肽底物Poly(Glu,Tyr)4∶1(空白管不加多肽底物),总反应体积50μl,加5μg左右膜蛋白起始反应,30℃水浴5分钟。终止反应参照Kong等[3]方法,反应完毕点样于新华一号滤纸片,迅速放入10% TCA-2%磷酸洗涤液中,用2%磷酸洗涤2次,每次15分钟,再用无水乙醇脱水,吹干,用液闪计数仪测定其放射性,以所测放射性计数率来反映TPK的活性。
, http://www.100md.com
2.MAPK的测定方法:淋巴细胞匀浆液制备及反应体系参照VanRenterghem等[4]的方法,酶反应缓冲液(含20mmol/L HEPES,pH7.0,3mmol/L巯基乙醇,10mmol/L MgCl2,0.1μg/ml牛血清白蛋白),100μmol/L[γ-32P]ATP(3~5cpm/fmol),200μmol/L EGFR,最后加入10μl酶反应液,总反应体系30μl。30℃水浴孵育15分钟,加入等体积的50%醋酸终止反应。点样30μl于滤纸上,用1%磷酸洗涤3次,每次2分钟,再用100%丙酮脱水2分钟,吹干。用液闪计数仪测定其放射性,以所测放射性计数率来反映MAPK的活性。
3.胞内Ca2+浓度的测定方法:淋巴细胞fluo-3的孵育及胞内Ca2+浓度的测定参照Yorek等[5]的方法,激发波长为490nm,发射波长为529nm,测定静息期荧光值,加入100μl溶液(含20% Triton X-100和20mmol/L CaCl2)测得Fmax。再加100μl 200mmol/L EGTA(pH7.0),得Fmin。Ca2+浓度可通过下式计算:[Ca2+]=Kd(F-Fmin)/(Fmax-F)。Fluo 3-AM的Kd值等于0.4μmol/L。
, 百拇医药
4.胞内一氧化氮(NO)的测定方法:NO化学性质活泼,在体内很快代谢为NO-2和NO-3,可利用硝酸还原酶特异性地将NO-3还原为NO-2,通过显色来测定其浓度。NO测定方法由南京建成生物工程研究所提供。
5.统计学分析:实验数据用
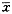 ±s表示,两组均数间的差异用完全随机资料的t检验,P<0.05为相差显著的界限。
±s表示,两组均数间的差异用完全随机资料的t检验,P<0.05为相差显著的界限。结 果
一、2型糖尿病患者淋巴细胞膜TPK活性的测定
正常人及2型糖尿病患者淋巴细胞膜TPK活性测定的结果表明,2型糖尿病患者TPK活性下降。20例健康成年人外周血淋巴细胞膜TPK活性为786.31±198.46cpm,21例2型糖尿病患者淋巴细胞膜TPK活性测定为412.75±89.32cpm,P<0.01。
, http://www.100md.com
二、2型糖尿病患者淋巴细胞MAPK活性的测定
8例健康成年人外周血淋巴细胞MAPK活性为10 200.625±1 779.489cpm,8例2型糖尿病患者淋巴细胞MAPK活性为5 346.987±479.287cpm,P<0.01。
三、2型糖尿病患者淋巴细胞内NO含量的测定
18例健康成年人外周血淋巴细胞NO活性为63.13±22.12μmol*L-1/g*Pr,21例2型糖尿病患者淋巴细胞NO活性为17.03±5.94μmol*L-1/g*Pr,P<0.01。
四、2型糖尿病患者淋巴细胞胞浆内Ca2+浓度的测定
21例健康成年人外周血淋巴细胞胞浆内Ca2+浓度为0.142±0.049μmol/L,20例2型糖尿病患者淋巴细胞胞浆内Ca2+浓度为0.228±0.072μmol/L,P<0.05。
, http://www.100md.com
讨 论
2型糖尿病患者TPK活性与正常人相比有明显下降,说明2型糖尿病患者可能存在IR的缺陷。其活性下降的机制可能是:①遗传因素:即原发性IR缺陷。已发现的21种受体基因突变均发生在结构基因上,造成IR mRNA表达改变,阻碍受体生成α、β亚基,影响信号向细胞内传导,并加速受体降解,导致受体结合胰岛素能力异常[6]。②IR磷酸化对TPK活性的影响:TPK活性与酪氨酸磷酸化区域有关。胰岛素受体自身磷酸化涉及β亚基三个结构域的Tyr位点,即近膜侧区、TPK活性区和C-末端区。不同结构域的TPK磷酸化对IR信号传递作用和生物学意义是不同的,胰岛素受体Tyr1150磷酸化是受体激酶激活的关键步骤。另外2型糖尿病患者细胞内蛋白激酶C(PKC)活化,促使IR的β亚基Ser/Thr残基磷酸化,也会引起IR自身磷酸化下降和受体激酶活性下降,导致信号系统偶联异常[7]。③IR数量下降:年龄的增加也是导致IR数量下降的因素[6]。④受体与胰岛素亲和力低下同样会导致TPK活性下降。由于2型糖尿病患者TPK活性下降,造成IR受体TPK-Ras-MAPK通路的障碍。
, http://www.100md.com
MAPK是胰岛素信号传导通路下游的重要信号分子,是信号从细胞表面传导到细胞核内重要的传递者。MAPK的作用一方面通过细胞核转录调节因子的磷酸化,引起基因水平的改变;另一方面,也可通过激活其它底物磷酸化,调节细胞的有丝分裂,发挥胰岛素的促进细胞生长等作用。从实验结果来看,2型糖尿病病人MAPK活性与正常人相比有明显下降,从而表明了MAPK级联途径是胰岛素信号传导的重要环节,也说明TPK、MAPK活性密切相关。TPK活性的下降,可能会影响其后信号分子IRS-1、Ras、Raf的激活,同样可能会影响到MAPK的活性。而MAPK对上游信号通路也存在反馈调节。
近年来对糖尿病动物模型的研究表明,多数组织细胞胞浆内游离钙离子浓度升高,且这种改变与糖尿病慢性并发症的发生和发展有一定关系。本实验以Fluo-3为荧光探针,来测定胞内Ca2+的变化。实验表明,2型糖尿病患者胞内Ca2+浓度显著上升,这可能与Ca2+-ATP酶的失活和PKC的激活有关。
, 百拇医药
研究表明,临床上出现高血压、胰岛素抵抗、糖尿病时,机体多数组织细胞胞浆内游离Ca2+水平升高[8]。导致这一现象产生的机制可能是一方面高血糖直接抑制了Ca2+-ATP酶的活性,使细胞外的Ca2+进入细胞内。由于酶的糖基化抑制了Ca2+-ATP酶活性,同时高糖也抑制了Na+/Ca2+交换和Na+-K+-ATP酶的活性;另一方面,Demerdash等[9]研究发现PMNL的蛋白激酶C在高浓度葡萄糖中被激活,激活钙通道,使Ca2+从钙池(主要是内质网)中释放,也是血Ca2+浓度升高的机理之一。
我们在研究TPK、MAPK、Ca2+与2型糖尿病关系的同时,也观察了患者淋巴细胞内NO水平。从实验结果来看,2型糖尿病患者体内NO水平降低,可能与NO作为信号分子的NO/cGMP途径存在缺陷有关。NO激活可溶性鸟苷酸环化酶(sGC)、升高细胞内环鸟苷酸(cGMP)水平、通过第二信使cGMP的作用,是NO发挥多种生物效应的主要信号传导机制。有研究表明糖尿病大鼠NO浓度降低与高血糖有关[10]。因此,可以认为2型糖尿病的发生可能与NO/cGMP环节的缺陷也有关。
, http://www.100md.com
本实验对胰岛素信号传导通路中几个重要的信号分子TPK、MAPK、Ca2+、NO进行测定,来观察它们在病理状态下的变化。从结果来看,2型糖尿病患者的淋巴细胞内上述信号分子均出现异常。这些信号分子究竟是如何影响2型糖尿病的发生与发展,还有待进一步研究。
参考文献
1,Sacks DB.Amylin-a glucoregulatory hormone involved in the pathogenesis of diabetes mellitus?Clin Chem,1996,42:494.
2,Trevillyan JM,Nordstrom A,Linna TJ.High tyrosine-specific protein kinase activity in normal human peripheral blood lymphocytes.Biochim Biophys Acta,1985,845:1.
, http://www.100md.com
3,Kong SK,Wang JH.Purification and characterization of a protein tyrosine kinase from bovine spleen.J Biol Chem,1987,262:2597.
4,Van Renterghem B,Browning MD,Maller JL.Regulation of mitogen-activated protein kinase activation by protein kinases A and C in a cell-free system.J Biol Chem,1994,269:24666.
5,Yorek MA,Davidson EP,Dunlap JA,et al.Effect of bradykinin on cytosolic calcium in neuroblastoma cells using the fluorescent indicator fluo-3.Biochim Biophys Acta,1993,1177:215.
, http://www.100md.com
6,Moller DE,Flier JS.Insulin resistance-mechanisms,syndromes,and implications.N Engl J Med,1991,325:938.
7,Sibley DR,Benovic JL,Caron MG,et al.Regulation of transmembrane signaling by receptor phosphorylation.Cell,1987,48:913.
8,Barbagallo M,Gupta RK,Resnick LM.Cellularions in NIDDM:relation of calcium to hyperglycemia and cardiac mass.Diabetes Care,1996,19:1393.
9,Demerdash TM,Seyrek N,Smogorzewski M,et al.Pathways through which glucose induces a rise in [Ca2+] of polymorphonuclear leukocytes of rats.Kidney Int,1996,50:2032.
10,Kihara M,Low PA.Impaired vasoreactivity to nitric oxide in experimental diabetic neuropathy.Exp Neurol,1995,132:180.
(收稿:1999-07-13 修回:1999-12-13), 百拇医药