实验性糖尿病大鼠早期肾脏病理学改变
http://www.100md.com
中国糖尿病杂志 2000年第5期第8卷 短篇报告
孔晓红(天津医科大学总医院内分泌科 邮政编码300052);马秀萍(北京邮电医院内分泌科);高慧(西安医科大学第一附属医院内分泌科) 孔晓红 马秀萍 高慧
关键词:
摘要:中国糖尿病杂志000523 我们通过链脲佐菌素(STZ)诱导糖尿病大鼠,在光镜和电镜下观察糖尿病刚成模组及1、2、3、4周不同病程糖尿病大鼠肾脏病理学改变。应用图象分析的方法,半定量分析基底膜厚度、肾小球面积、肾小球细胞总数和平均细胞面积等,探讨糖尿病肾病早期肾脏病理学的变化规律及其机制,为糖尿病肾病早期诊断提供实验依据。
材料与方法
1.实验对象:选择健康成年雄性Wistar大鼠40只(西安医科大学动物中心提供),体重约250g,随机分为两组,实验组30只,对照组10只。实验组禁食10小时后,按65mg/kg体重于左下腹腔内注射STZ(溶于pH4.5、0.1mmol/L枸橼酸盐缓冲液中),对照组注射等体积枸橼酸盐缓冲液。3天后检测血糖、尿糖,将尿糖持续阳性,血糖≥16.65mmol/L作为糖尿病大鼠成模标准。实验组大鼠分为5组,每组6只:①糖尿病刚成模组;②成模后1周组;③成模后2周组;④成模后3周组;⑤成模后4周组。
, http://www.100md.com
2.实验方法:肾脏组织光镜和电镜标本的制备与分析:用多功能真彩色病理图象分析系统CMIAS-008(北京航空航天大学、空军总医院联合开发)进行图象分析,测定肾小球基底膜厚度(thickness of glomerular basement membrane,TGBM)、肾小球面积(glomerular area,GA)、平均细胞面积(mean glomerular cell area ,MGCA)和肾小球细胞总数(total number of glomerular cells,TNGC)。为使肾小球标化,选择有血管极和尿极的肾小球进行测定。
3.各参数值用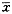 ±s表示,组间均数比较用成组t检验,并用SAS软件包进行多因素相关回归分析。
±s表示,组间均数比较用成组t检验,并用SAS软件包进行多因素相关回归分析。
结 果
肾脏组织的定量图象分析结果显示,糖尿病刚成模组与正常对照组比较无显著性差异(P>0.05),而随后糖尿病大鼠肾小球基底膜厚度随病程的延长而增厚,糖尿病大鼠1、2、3、4周与刚成模组大鼠的各项参数存在显著性差异(P<0.05),GA、MGCA、TNGC均随病程的延长而增大,但各组间的TNGC无显著性差异(P>0.05);糖尿病各组间GA和MGCA有显著性差异(P<0.05)。相关分析表明,MGCA与GA呈正相关(r=0.88,P<0.05),TGBM与UAER呈正相关(r=0.80,P<0.05)(附表)。
, http://www.100md.com
附表 糖尿病大鼠肾组织的定量图象分析结果(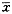 ±s) 组别
±s) 组别
例数
UAER
(μg/min)
GA(μm2)
(×100)
MGCA(μm2)
(×100)
TNGC(个/肾小球)
(×100)
, http://www.100md.com
TGBM(mm)
(×600)
对照组
10
3.00±0.18
413.05±53.26
2.36±0.26
87.20±11.63
0.56±0.03
DM组
6
3.39±0.44
, 百拇医药
437.50±28.61
3.17±0.09
107.60±5.32
0.72±0.08
1周
6
9.84±0.51**△
473.56±28.36△
3.29±0.08△
110.4±5.50
1.11±0.10△
, 百拇医药
2周
6
91.62±8.76**△△
494.35±40.55**△
3.45±0.11**△
127.40±7.33
1.41±0.13**△△
3周
6
74.28±9.42**△△
, 百拇医药 578.34±17.93**△△
3.79±0.01**△△
131.60±3.78
1.76±0.13**△△
4周
6
12.20±1.23**△△
643.25±32.26**△△
4.05±0.11**△△
137.80±8.93
, 百拇医药
2.63±0.36**△△
与对照组比较*P<0.05,**P<0.01;与DM组比较△P<0.05,△△P<0.01
讨 论
糖尿病大鼠刚成模组至病程为4周的糖尿病大鼠,肾小球面积逐渐增加,与Nyengaard等[1]结果相近。作者认为,肾小球毛细血管数目增加和毛细血管袢扩张是肾脏肥大和肾血流增加的一个重要因素。肾小球毛细血管袢是由基底膜和内皮细胞等多种细胞组成,其中球管反馈(tube globe feedback,TGF)对调节肾血流起着重要作用。球管反馈是指肾小管的小球滤过液刺激致密斑,反射性地改变肾小球滤过。当激活TGF时,肾小球入球小动脉收缩;反之,入球小动脉舒张,肾血流量增加[2]。
糖尿病早期肾损害首先表现为肾小球基底膜电荷屏障受损,随后出现基底膜增厚。本实验也证实了这一病理结果。肾小球基底膜厚度与尿白蛋白排泄率呈正相关。不同病程糖尿病大鼠随病程延长,肾脏受损程度加深,TGBM也逐渐增加。糖尿病大鼠1周组TGBM的增加即有统计学意义,4周组的TGBM为1周组的2.5倍,与Seon的结果一致[3]。糖尿病引起基底膜改变的机制十分复杂,可能有多种因素参与了发病:①糖尿病高血糖状态所致的蛋白非酶糖化是重要环节。国外Tarsio等研究证实基底膜结构蛋白非酶糖化可以改变硫酸肝素糖蛋白与胶原的亲和力,使基底膜电荷屏障受损,而且可以通过AGE重排,形成高度交连的网状结构而改变基底膜构型。②动脉的玻璃样变和膜样物质渗出到毛细血管内皮下。③系膜基质扩展到周围的基底膜。④脂类物质渗出到肾小球毛细血管腔。有关机制有待进一步研究。
, 百拇医药
参考文献
1,Nyengaard JR, Rasch R. The impact of experimental diabetes mellitus in rats on glomerular capillary number and sizes. Diabetologia, 1993,36:189.
2,Osawa G, Sasaki T, Sato T, et al. Kinetic study of glomerular cells of diabetic rats in relation to the development of irreversible glomerular sclerosis. J Diabet Comp,1991,5:115.
3,Seon YD, Lee TH, Lee MC, et al. Changes of glomerular basement membrane components in vacor-induced diabetic nephropathy. Korean J Intern Med, 1999, 14:77.
(收稿:1999-06-10 修回:2000-05-15), 百拇医药
关键词:
摘要:中国糖尿病杂志000523 我们通过链脲佐菌素(STZ)诱导糖尿病大鼠,在光镜和电镜下观察糖尿病刚成模组及1、2、3、4周不同病程糖尿病大鼠肾脏病理学改变。应用图象分析的方法,半定量分析基底膜厚度、肾小球面积、肾小球细胞总数和平均细胞面积等,探讨糖尿病肾病早期肾脏病理学的变化规律及其机制,为糖尿病肾病早期诊断提供实验依据。
材料与方法
1.实验对象:选择健康成年雄性Wistar大鼠40只(西安医科大学动物中心提供),体重约250g,随机分为两组,实验组30只,对照组10只。实验组禁食10小时后,按65mg/kg体重于左下腹腔内注射STZ(溶于pH4.5、0.1mmol/L枸橼酸盐缓冲液中),对照组注射等体积枸橼酸盐缓冲液。3天后检测血糖、尿糖,将尿糖持续阳性,血糖≥16.65mmol/L作为糖尿病大鼠成模标准。实验组大鼠分为5组,每组6只:①糖尿病刚成模组;②成模后1周组;③成模后2周组;④成模后3周组;⑤成模后4周组。
, http://www.100md.com
2.实验方法:肾脏组织光镜和电镜标本的制备与分析:用多功能真彩色病理图象分析系统CMIAS-008(北京航空航天大学、空军总医院联合开发)进行图象分析,测定肾小球基底膜厚度(thickness of glomerular basement membrane,TGBM)、肾小球面积(glomerular area,GA)、平均细胞面积(mean glomerular cell area ,MGCA)和肾小球细胞总数(total number of glomerular cells,TNGC)。为使肾小球标化,选择有血管极和尿极的肾小球进行测定。
3.各参数值用
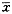 ±s表示,组间均数比较用成组t检验,并用SAS软件包进行多因素相关回归分析。
±s表示,组间均数比较用成组t检验,并用SAS软件包进行多因素相关回归分析。结 果
肾脏组织的定量图象分析结果显示,糖尿病刚成模组与正常对照组比较无显著性差异(P>0.05),而随后糖尿病大鼠肾小球基底膜厚度随病程的延长而增厚,糖尿病大鼠1、2、3、4周与刚成模组大鼠的各项参数存在显著性差异(P<0.05),GA、MGCA、TNGC均随病程的延长而增大,但各组间的TNGC无显著性差异(P>0.05);糖尿病各组间GA和MGCA有显著性差异(P<0.05)。相关分析表明,MGCA与GA呈正相关(r=0.88,P<0.05),TGBM与UAER呈正相关(r=0.80,P<0.05)(附表)。
, http://www.100md.com
附表 糖尿病大鼠肾组织的定量图象分析结果(
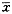 ±s) 组别
±s) 组别例数
UAER
(μg/min)
GA(μm2)
(×100)
MGCA(μm2)
(×100)
TNGC(个/肾小球)
(×100)
, http://www.100md.com
TGBM(mm)
(×600)
对照组
10
3.00±0.18
413.05±53.26
2.36±0.26
87.20±11.63
0.56±0.03
DM组
6
3.39±0.44
, 百拇医药
437.50±28.61
3.17±0.09
107.60±5.32
0.72±0.08
1周
6
9.84±0.51**△
473.56±28.36△
3.29±0.08△
110.4±5.50
1.11±0.10△
, 百拇医药
2周
6
91.62±8.76**△△
494.35±40.55**△
3.45±0.11**△
127.40±7.33
1.41±0.13**△△
3周
6
74.28±9.42**△△
, 百拇医药 578.34±17.93**△△
3.79±0.01**△△
131.60±3.78
1.76±0.13**△△
4周
6
12.20±1.23**△△
643.25±32.26**△△
4.05±0.11**△△
137.80±8.93
, 百拇医药
2.63±0.36**△△
与对照组比较*P<0.05,**P<0.01;与DM组比较△P<0.05,△△P<0.01
讨 论
糖尿病大鼠刚成模组至病程为4周的糖尿病大鼠,肾小球面积逐渐增加,与Nyengaard等[1]结果相近。作者认为,肾小球毛细血管数目增加和毛细血管袢扩张是肾脏肥大和肾血流增加的一个重要因素。肾小球毛细血管袢是由基底膜和内皮细胞等多种细胞组成,其中球管反馈(tube globe feedback,TGF)对调节肾血流起着重要作用。球管反馈是指肾小管的小球滤过液刺激致密斑,反射性地改变肾小球滤过。当激活TGF时,肾小球入球小动脉收缩;反之,入球小动脉舒张,肾血流量增加[2]。
糖尿病早期肾损害首先表现为肾小球基底膜电荷屏障受损,随后出现基底膜增厚。本实验也证实了这一病理结果。肾小球基底膜厚度与尿白蛋白排泄率呈正相关。不同病程糖尿病大鼠随病程延长,肾脏受损程度加深,TGBM也逐渐增加。糖尿病大鼠1周组TGBM的增加即有统计学意义,4周组的TGBM为1周组的2.5倍,与Seon的结果一致[3]。糖尿病引起基底膜改变的机制十分复杂,可能有多种因素参与了发病:①糖尿病高血糖状态所致的蛋白非酶糖化是重要环节。国外Tarsio等研究证实基底膜结构蛋白非酶糖化可以改变硫酸肝素糖蛋白与胶原的亲和力,使基底膜电荷屏障受损,而且可以通过AGE重排,形成高度交连的网状结构而改变基底膜构型。②动脉的玻璃样变和膜样物质渗出到毛细血管内皮下。③系膜基质扩展到周围的基底膜。④脂类物质渗出到肾小球毛细血管腔。有关机制有待进一步研究。
, 百拇医药
参考文献
1,Nyengaard JR, Rasch R. The impact of experimental diabetes mellitus in rats on glomerular capillary number and sizes. Diabetologia, 1993,36:189.
2,Osawa G, Sasaki T, Sato T, et al. Kinetic study of glomerular cells of diabetic rats in relation to the development of irreversible glomerular sclerosis. J Diabet Comp,1991,5:115.
3,Seon YD, Lee TH, Lee MC, et al. Changes of glomerular basement membrane components in vacor-induced diabetic nephropathy. Korean J Intern Med, 1999, 14:77.
(收稿:1999-06-10 修回:2000-05-15), 百拇医药