人骨形态发生蛋白-2完整成熟肽基因的克隆
作者:熊绍虎 刘大庸 余磊 蒋立新 王朝阳
单位:熊绍虎(510515 广州市 第一军医大学解剖学教研室);刘大庸(510515 广州市 第一军医大学解剖学教研室);余磊(510515 广州市 第一军医大学解剖学教研室);蒋立新(510515 广州市 第一军医大学解剖学教研室);王朝阳(510515 广州市 第一军医大学解剖学教研室)
关键词:骨形态发生蛋白-2;基因;克隆
中国临床解剖学杂志000325 【摘 要】 目的:克隆人骨形态发生蛋白-2(hBMP-2)完整成熟肽基因。方法:依据Genbank中hBMP-2的序列化学合成两条引物,从人胎儿骨组织中提取得到的总RNA中,通过反转录聚合酶链式反应(RT-PCR)得到hBMP-2完整成熟肽基因。将所得的基因片段插入克隆载体pUC-19并转化大肠杆菌JM109,提取重组质粒,酶切鉴定并测序。结果:DNA琼脂糖凝胶电泳显示:PCR产物为一长约400 bp的带,阳性克隆质粒经双酶切可切出约400bp的片段。全自动DNA测序表明与Genbank中的序列完全相符。结论:通过反转录聚合酶链式反应从人胎儿骨组织中成功地克隆了人BMP-2完整成熟肽基因,基因序列完全正确。
, http://www.100md.com
【关键词】
The cloning of integral human BMP-2 mature peptide gene.
Xiong Shaohu, Liu Dayong, Yu lei, et al.
Department of Anatomy, The First Military Medical University, Guangzhou 510515
Objective: To clone integral human bone morphogenetic protein-2(BMP-2) mature peptide gene. Methods: Two primers were chemosynthesized according to the hBMP-2 sequence reported in Genbank. The hBMP-2 gene was gained by RT-PCR from the cDNA which was extracted from human fetus bone tissue, and was cloned into vector pUC-19. The seqence of recombinanted plasmid pUC-19-hBMP-2 was analyzed by sequence analysis. Results: DNA agarose gel electrophoresis showed that the product of RT-PCR was about 400bp, and double enzyme digestion of the recombinanted plasmid corresponded with it. The result of sequence assay was in agreement with the reported hBMP-2 sequence in Genbank. Conclusion: The integral human BMP-2 mature peptide gene was cloned successfully, and totally identified with the sequence of human BMP-2 in Genbank.
, 百拇医药
Keywords Bone morphogenetic protein-2 Gene Clone
骨形态发生蛋白(Bone morphogenetic protein, BMP)是一种具有诱导成骨活性的酸性糖蛋白,其中以BMP-2的活性最强[1]。BMP-2在组织中含量较微,每千克皮质骨仅含1~2μg[2],因而利用基因工程重组BMP-2成为必需,并已取得较好成果。国外较多采用真核细胞表达,如CHO,COS及杆状病毒系统,亦有其完整成熟肽在大肠杆菌中表达的报道[3,4]。国内多采用原核细胞表达,但多为人骨形态发生蛋白-2成熟肽的不同长短的片段[5,6]。本文以人胎儿骨组织为材料提取cDNA,通过反转录聚合酶链式反应(RT-PCR),成功克隆hBMP-2完整成熟肽基因,为其进一步在大肠杆菌中表达打下基础。
1 材料与方法
, 百拇医药
1.1 材料
①引产人胎儿骨组织;②质粒与菌株:克隆载体pUC-19由王朝阳硕士惠赠,JM109菌株由吴振龙硕士惠赠;③主要试剂: Trizol、反转录酶AMV、EX-Taq酶、限制性核酸内切酶KpnI、PstI及T4 DNA连接酶分别为Gibco、日本TaKaRa和NEB产品,其他为国产分析纯。
1. 2 方法
1.2.1 引物设计 从Genbank检索hBMP-2成熟肽基因,由徐兵博士设计两段引物。5′端加上Met+Ala序列、KpnI酶切序列及保护序列,构成上游引物;3′端加上PstI酶切序列及保护序列,构成下游引物。引物经GOLDKEY软件检验,无发夹结构。序列如下:
上游引物:5′-CGGGGTACCATGAAT-CAAGCCAAACACAAACAGCGG,划线为KpnI 酶切序列;
, 百拇医药
下游引物:5′-AAACTGCAGTTA-CTAGCGACACCCACAACCCTC,划线为PstI酶切序列。
引物由宝生物工程(大连)有限公司(TaKaRa Biotech)合成。
1.2.2 反转录聚合酶链式反应(RT-PCR) ①提取总RNA 液氮保存引产人胎儿骨组织经研钵研碎、组织匀浆器制成匀浆后按Trizol Reagent说明书进行;②反转录:反应体系20 μl,其中RNA液5 μl,3端引物100 pMol,AMV酶1 μl(5U)。室温10 min后42℃保温1 h,冰浴2 min;③聚合酶链式反应:反应体系为 50 μl,其中cDNA 5μl,引物100 pMol。反应如下:预变性94℃,10 min,加入Taq酶5U(即采用热启动技术[8])。变性94 ℃,60 s;退火Tm 65℃,40 s;延伸72℃,60 s。30循环。
1.2.3 克隆载体的构建 ①DNA回收、酶切:挖块-冻融法回收DNA,用KpnI、PstI双酶切;②连接:经KpnI、PstI双酶切后的pUC-19及目的基因片段,用T4 DNA连接酶,于16℃连接15 h。
, 百拇医药
1.2.4 阳性克隆的筛选 ①感受态细胞制备及转化参照《分子克隆》[9];②筛选克隆 取上述菌液涂IPTG-X-gal LB平板(Amp100μg/ml),37℃电热培养箱倒置培养。随机挑取白色菌落10个于5 ml LB(Amp100μg/ml)培养基,37℃摇床,过夜。碱裂解法提取质粒,KpnI、PstI双酶切,1.5%琼脂糖电泳鉴定。
1.2.5 序列测定 由宝生物工程(大连)有限公司完成。
2 结果
2.1 RT-PCR结果
RT-PCR样品做DNA琼脂糖(1.5%)电泳,长波紫外光下与100bp ladder Marker相比较,在400 bp稍下方见一条带,与所要之DNA片段372 bp相符(见附图)。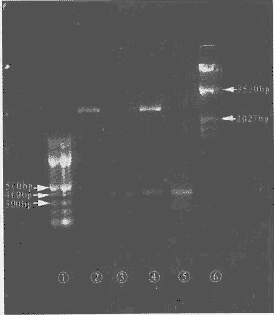
, 百拇医药
①100bp ladder marker ②pUC-19/KpnI+PstI
③target gene /KpnI+PstI ④pUC19-hBMP-2/KpnI+PstI
⑤RT-PCR product ⑥λDNA/EcoR I+Hind Ⅲ
附图 RT-PCR产物及重组pUC19-hBMP-2的酶切鉴定
2. 2 克隆筛选结果
阳性克隆提取质粒经KpnI、PstI双酶切后在DNA琼脂糖电泳凝胶上显示两条带,分别与对照相吻合(见附图)。
2. 3 测序结果
测序结果显示所得目的基因的序列与从Genbank所检索到的序列完全吻合。
, http://www.100md.com
3 讨论
3.1 人BMP-2的基因克隆及基因表达
1988年,Wozney等[10]首先从人U-20s细胞等cDNA文库中成功克隆了人BMP-2。BMP-2 cDNA全长为1587 bp,ORF(Open reading frames)1188bp,编码为396个氨基酸的多肽,包括N端的信号肽,中间的前肽及C端的成熟肽。翻译后的前体蛋白经进一步加工修饰,包括切掉信号肽及前肽后,得到成熟的人BMP-2成熟肽。BMP-2在组织中含量很少,故而关于其在原核及真核细胞中表达的研究遂成热点。由于BMP-2在真核细胞中的表达量较低且耗时耗资。人们开始研究其在原核细胞中的表达。1994年,赵明等[5]用限制性内切酶AFL-Ⅱ切取编码hBMP-2成熟肽的0.36kb基因片段并克隆于E.Coli表达载体pMX-1中,温度诱导表达,重组产物具有较强诱骨活性。E.Coli中表达的rhBMP-2(recombinanted human BMP-2)因成骨活性较理想,其表达以包涵体形式存在, 易于纯化, 相对产量较高, 花费低廉而受到青睐。此后,有报道将编码hBMP-2羧基端不同长短的氨基酸肽段的hBMP-2 cDNA放入E.Coli中表达,具有不同程度的成骨活性,且愈接近成熟肽长度活性愈高[6]。因此,克隆其全长成为必需。本文成功地克隆了完整人BMP-2成熟肽基因,为其在大肠杆菌中地进一步表达打下基础。
, 百拇医药
3.2 RT-PCR条件的选择
PCR技术自80年代发展至今日趋完善。在常规的PCR体系中,能有效扩增小片段,通常扩增小于1kb的片段,都能得到满意的结果。RT-PCR较传统PCR,仅需增加一步反转录,操作简便,不需特殊设备。本文采用的方法则更简便,只须提取总RNA即可,无须再提取mRNA,更不需要建cDNA文库,仅须RT-PCR一步即可从特定组织中成功克隆目的基因。该方法简便而可靠,为基因的克隆提供了一种快捷的方法。
有研究表明,在胚胎期和成年期的某些组织器官中都有BMP-2 mRNA的表达,其中以骨组织中的mRNA丰度最高,而其他组织细胞如心、肝、脑、肺和肾脏,虽有BMP-2 mRNA转录物的产生,但其水平均不高[5]。故而在我们的实验中选择了以人胎儿骨组织为材料提取总RNA。在PCR反应的条件中,引物的特异性是特异性扩增的基础。我们通过检索Genbank,确定了hBMP-2成熟肽的基因序列,以指导设计特异性的引物。一般而言,如果把PCR 混合物在显著低于Tm 值的温度下哪怕是作简短的保温,也可能产生引物二聚体和非特异配对。在本实验中,PCR 的两段引物存在引物二聚体,但因其为基因本身所固有,故而未予改动,而是采用热启动技术[8]即预变性后加入Taq酶,很好地解决了这个问题。测序结果也证明了这一点。再者,引物浓度过高,也可引起非特异性扩增。我们在实验中选择较低浓度的引物浓度(100pmol)[11]以消除非特异性片段的扩增。
, http://www.100md.com
(研究用的标本材料得到秦立君和王燕两位医师帮助,表示衷心的感谢!)
参考文献
1,Tabas JA, Zasloff M, Wasmuth JJ, et al. Human bone morphogenetic protein-2:chromosomal localization of human gene for BMP-1,BMP-2A and BMP-3.Genomics,1991,9:283
2,Riley EH, Lane JM, Urist MR,et al. Bone morphogenetic protein-2:Biology and application .Clin Orthop Rel Res,1996,324:39
3,Ruppert R,Hoffmann E,Sebald W. Human bone morphogenetic protein -2 contains a heparin binding site. Which modifies its biological activity. Eur J Biochem,1996,237:295
, 百拇医药
4,Kubler NR , Reuther JF ,Faller G, et al. Inductive of recombinant human BMP-2 produced in a bacterial expression system. Int J Oral Maxillofac Surg,1998,27:305
5,赵 明,王会信,周廷冲.重组人骨形态发生蛋白-2成熟肽在大肠杆菌中的表达及其诱导成骨活性.生物化学杂志,1994,10(2):318
6,林 松,徐印钦,李伯良.人骨形成蛋白-2A活性片段的E.Coli中高效表达.生物化学与生物物理学报,1996,28(1):8
7,蒲 勤,陈苏民,陈南春. 重组人骨形成蛋白-2成熟肽在大肠杆菌中的高效表达.第四军医大学学报,1998,19(1):8
8,Diefferbach CW, Dveksler GS. PCR Primer(A Laboratory Manual) .New York: Cold Spring Harbor Laboratory Press,1995.39
9,J.萨姆布鲁克,E.F.弗里奇. 分子克隆实验指南. 第2版. 北京:科学出版社,1992.55
10,Wozney JM, Rosen V, Celeste AJ, et al. Novel regulators of bone formation: Molecular clones and activities.Science,1988,242:1528
11,卢圣栋,主编. 现代分子生物学实验技术.第2版.北京:中国协和医科大学出版社,1999.460
(收稿:1999-08-02), http://www.100md.com
单位:熊绍虎(510515 广州市 第一军医大学解剖学教研室);刘大庸(510515 广州市 第一军医大学解剖学教研室);余磊(510515 广州市 第一军医大学解剖学教研室);蒋立新(510515 广州市 第一军医大学解剖学教研室);王朝阳(510515 广州市 第一军医大学解剖学教研室)
关键词:骨形态发生蛋白-2;基因;克隆
中国临床解剖学杂志000325 【摘 要】 目的:克隆人骨形态发生蛋白-2(hBMP-2)完整成熟肽基因。方法:依据Genbank中hBMP-2的序列化学合成两条引物,从人胎儿骨组织中提取得到的总RNA中,通过反转录聚合酶链式反应(RT-PCR)得到hBMP-2完整成熟肽基因。将所得的基因片段插入克隆载体pUC-19并转化大肠杆菌JM109,提取重组质粒,酶切鉴定并测序。结果:DNA琼脂糖凝胶电泳显示:PCR产物为一长约400 bp的带,阳性克隆质粒经双酶切可切出约400bp的片段。全自动DNA测序表明与Genbank中的序列完全相符。结论:通过反转录聚合酶链式反应从人胎儿骨组织中成功地克隆了人BMP-2完整成熟肽基因,基因序列完全正确。
, http://www.100md.com
【关键词】
The cloning of integral human BMP-2 mature peptide gene.
Xiong Shaohu, Liu Dayong, Yu lei, et al.
Department of Anatomy, The First Military Medical University, Guangzhou 510515
Objective: To clone integral human bone morphogenetic protein-2(BMP-2) mature peptide gene. Methods: Two primers were chemosynthesized according to the hBMP-2 sequence reported in Genbank. The hBMP-2 gene was gained by RT-PCR from the cDNA which was extracted from human fetus bone tissue, and was cloned into vector pUC-19. The seqence of recombinanted plasmid pUC-19-hBMP-2 was analyzed by sequence analysis. Results: DNA agarose gel electrophoresis showed that the product of RT-PCR was about 400bp, and double enzyme digestion of the recombinanted plasmid corresponded with it. The result of sequence assay was in agreement with the reported hBMP-2 sequence in Genbank. Conclusion: The integral human BMP-2 mature peptide gene was cloned successfully, and totally identified with the sequence of human BMP-2 in Genbank.
, 百拇医药
Keywords Bone morphogenetic protein-2 Gene Clone
骨形态发生蛋白(Bone morphogenetic protein, BMP)是一种具有诱导成骨活性的酸性糖蛋白,其中以BMP-2的活性最强[1]。BMP-2在组织中含量较微,每千克皮质骨仅含1~2μg[2],因而利用基因工程重组BMP-2成为必需,并已取得较好成果。国外较多采用真核细胞表达,如CHO,COS及杆状病毒系统,亦有其完整成熟肽在大肠杆菌中表达的报道[3,4]。国内多采用原核细胞表达,但多为人骨形态发生蛋白-2成熟肽的不同长短的片段[5,6]。本文以人胎儿骨组织为材料提取cDNA,通过反转录聚合酶链式反应(RT-PCR),成功克隆hBMP-2完整成熟肽基因,为其进一步在大肠杆菌中表达打下基础。
1 材料与方法
, 百拇医药
1.1 材料
①引产人胎儿骨组织;②质粒与菌株:克隆载体pUC-19由王朝阳硕士惠赠,JM109菌株由吴振龙硕士惠赠;③主要试剂: Trizol、反转录酶AMV、EX-Taq酶、限制性核酸内切酶KpnI、PstI及T4 DNA连接酶分别为Gibco、日本TaKaRa和NEB产品,其他为国产分析纯。
1. 2 方法
1.2.1 引物设计 从Genbank检索hBMP-2成熟肽基因,由徐兵博士设计两段引物。5′端加上Met+Ala序列、KpnI酶切序列及保护序列,构成上游引物;3′端加上PstI酶切序列及保护序列,构成下游引物。引物经GOLDKEY软件检验,无发夹结构。序列如下:
上游引物:5′-CGGGGTACCATGAAT-CAAGCCAAACACAAACAGCGG,划线为KpnI 酶切序列;
, 百拇医药
下游引物:5′-AAACTGCAGTTA-CTAGCGACACCCACAACCCTC,划线为PstI酶切序列。
引物由宝生物工程(大连)有限公司(TaKaRa Biotech)合成。
1.2.2 反转录聚合酶链式反应(RT-PCR) ①提取总RNA 液氮保存引产人胎儿骨组织经研钵研碎、组织匀浆器制成匀浆后按Trizol Reagent说明书进行;②反转录:反应体系20 μl,其中RNA液5 μl,3端引物100 pMol,AMV酶1 μl(5U)。室温10 min后42℃保温1 h,冰浴2 min;③聚合酶链式反应:反应体系为 50 μl,其中cDNA 5μl,引物100 pMol。反应如下:预变性94℃,10 min,加入Taq酶5U(即采用热启动技术[8])。变性94 ℃,60 s;退火Tm 65℃,40 s;延伸72℃,60 s。30循环。
1.2.3 克隆载体的构建 ①DNA回收、酶切:挖块-冻融法回收DNA,用KpnI、PstI双酶切;②连接:经KpnI、PstI双酶切后的pUC-19及目的基因片段,用T4 DNA连接酶,于16℃连接15 h。
, 百拇医药
1.2.4 阳性克隆的筛选 ①感受态细胞制备及转化参照《分子克隆》[9];②筛选克隆 取上述菌液涂IPTG-X-gal LB平板(Amp100μg/ml),37℃电热培养箱倒置培养。随机挑取白色菌落10个于5 ml LB(Amp100μg/ml)培养基,37℃摇床,过夜。碱裂解法提取质粒,KpnI、PstI双酶切,1.5%琼脂糖电泳鉴定。
1.2.5 序列测定 由宝生物工程(大连)有限公司完成。
2 结果
2.1 RT-PCR结果
RT-PCR样品做DNA琼脂糖(1.5%)电泳,长波紫外光下与100bp ladder Marker相比较,在400 bp稍下方见一条带,与所要之DNA片段372 bp相符(见附图)。

, 百拇医药
①100bp ladder marker ②pUC-19/KpnI+PstI
③target gene /KpnI+PstI ④pUC19-hBMP-2/KpnI+PstI
⑤RT-PCR product ⑥λDNA/EcoR I+Hind Ⅲ
附图 RT-PCR产物及重组pUC19-hBMP-2的酶切鉴定
2. 2 克隆筛选结果
阳性克隆提取质粒经KpnI、PstI双酶切后在DNA琼脂糖电泳凝胶上显示两条带,分别与对照相吻合(见附图)。
2. 3 测序结果
测序结果显示所得目的基因的序列与从Genbank所检索到的序列完全吻合。
, http://www.100md.com
3 讨论
3.1 人BMP-2的基因克隆及基因表达
1988年,Wozney等[10]首先从人U-20s细胞等cDNA文库中成功克隆了人BMP-2。BMP-2 cDNA全长为1587 bp,ORF(Open reading frames)1188bp,编码为396个氨基酸的多肽,包括N端的信号肽,中间的前肽及C端的成熟肽。翻译后的前体蛋白经进一步加工修饰,包括切掉信号肽及前肽后,得到成熟的人BMP-2成熟肽。BMP-2在组织中含量很少,故而关于其在原核及真核细胞中表达的研究遂成热点。由于BMP-2在真核细胞中的表达量较低且耗时耗资。人们开始研究其在原核细胞中的表达。1994年,赵明等[5]用限制性内切酶AFL-Ⅱ切取编码hBMP-2成熟肽的0.36kb基因片段并克隆于E.Coli表达载体pMX-1中,温度诱导表达,重组产物具有较强诱骨活性。E.Coli中表达的rhBMP-2(recombinanted human BMP-2)因成骨活性较理想,其表达以包涵体形式存在, 易于纯化, 相对产量较高, 花费低廉而受到青睐。此后,有报道将编码hBMP-2羧基端不同长短的氨基酸肽段的hBMP-2 cDNA放入E.Coli中表达,具有不同程度的成骨活性,且愈接近成熟肽长度活性愈高[6]。因此,克隆其全长成为必需。本文成功地克隆了完整人BMP-2成熟肽基因,为其在大肠杆菌中地进一步表达打下基础。
, 百拇医药
3.2 RT-PCR条件的选择
PCR技术自80年代发展至今日趋完善。在常规的PCR体系中,能有效扩增小片段,通常扩增小于1kb的片段,都能得到满意的结果。RT-PCR较传统PCR,仅需增加一步反转录,操作简便,不需特殊设备。本文采用的方法则更简便,只须提取总RNA即可,无须再提取mRNA,更不需要建cDNA文库,仅须RT-PCR一步即可从特定组织中成功克隆目的基因。该方法简便而可靠,为基因的克隆提供了一种快捷的方法。
有研究表明,在胚胎期和成年期的某些组织器官中都有BMP-2 mRNA的表达,其中以骨组织中的mRNA丰度最高,而其他组织细胞如心、肝、脑、肺和肾脏,虽有BMP-2 mRNA转录物的产生,但其水平均不高[5]。故而在我们的实验中选择了以人胎儿骨组织为材料提取总RNA。在PCR反应的条件中,引物的特异性是特异性扩增的基础。我们通过检索Genbank,确定了hBMP-2成熟肽的基因序列,以指导设计特异性的引物。一般而言,如果把PCR 混合物在显著低于Tm 值的温度下哪怕是作简短的保温,也可能产生引物二聚体和非特异配对。在本实验中,PCR 的两段引物存在引物二聚体,但因其为基因本身所固有,故而未予改动,而是采用热启动技术[8]即预变性后加入Taq酶,很好地解决了这个问题。测序结果也证明了这一点。再者,引物浓度过高,也可引起非特异性扩增。我们在实验中选择较低浓度的引物浓度(100pmol)[11]以消除非特异性片段的扩增。
, http://www.100md.com
(研究用的标本材料得到秦立君和王燕两位医师帮助,表示衷心的感谢!)
参考文献
1,Tabas JA, Zasloff M, Wasmuth JJ, et al. Human bone morphogenetic protein-2:chromosomal localization of human gene for BMP-1,BMP-2A and BMP-3.Genomics,1991,9:283
2,Riley EH, Lane JM, Urist MR,et al. Bone morphogenetic protein-2:Biology and application .Clin Orthop Rel Res,1996,324:39
3,Ruppert R,Hoffmann E,Sebald W. Human bone morphogenetic protein -2 contains a heparin binding site. Which modifies its biological activity. Eur J Biochem,1996,237:295
, 百拇医药
4,Kubler NR , Reuther JF ,Faller G, et al. Inductive of recombinant human BMP-2 produced in a bacterial expression system. Int J Oral Maxillofac Surg,1998,27:305
5,赵 明,王会信,周廷冲.重组人骨形态发生蛋白-2成熟肽在大肠杆菌中的表达及其诱导成骨活性.生物化学杂志,1994,10(2):318
6,林 松,徐印钦,李伯良.人骨形成蛋白-2A活性片段的E.Coli中高效表达.生物化学与生物物理学报,1996,28(1):8
7,蒲 勤,陈苏民,陈南春. 重组人骨形成蛋白-2成熟肽在大肠杆菌中的高效表达.第四军医大学学报,1998,19(1):8
8,Diefferbach CW, Dveksler GS. PCR Primer(A Laboratory Manual) .New York: Cold Spring Harbor Laboratory Press,1995.39
9,J.萨姆布鲁克,E.F.弗里奇. 分子克隆实验指南. 第2版. 北京:科学出版社,1992.55
10,Wozney JM, Rosen V, Celeste AJ, et al. Novel regulators of bone formation: Molecular clones and activities.Science,1988,242:1528
11,卢圣栋,主编. 现代分子生物学实验技术.第2版.北京:中国协和医科大学出版社,1999.460
(收稿:1999-08-02), http://www.100md.com