内皮素对成年鼠离体心室肌细胞内游离钙浓度的影响及机制
作者:姚平 潘敬运 詹澄扬
单位:
姚平 暨南大学医学院生理学教研室(广州 510632);潘敬运 詹澄扬 中山医科大学生理学教研室
关键词:心肌;内皮缩血管肽类;钙;钙通道;蛋白质类
中国病理生理杂志990413 摘 要 目的和方法:采用分离的Sprague-Dawley 大鼠心室肌细胞,以Fura-2/AM荧光指示剂负载,检测心肌细胞内游离钙浓度([Ca2+]i)变化,探讨内皮素-1(ET-1)对[Ca2+]i的作用及其机制。结果:ET-1(1×10-7mol/L)引起[Ca2+]i升高分两个时相:快速相和持续相,可被ETA的特异性受体阻断剂BQ123(2×10-6mol/L)所阻断。移去细胞外液钙以及用百日咳毒素(200ng/mL)处理10 h后,ET-1仍引起快速相,但持续相消失。Ryanodine(4 μmol/L)和异搏定(2×10-5mol/L)对ET-1诱导[Ca2+]i升高的作用无显著影响。结论:ET-1升高[Ca2+]i是通过ETA受体介导;快速相[Ca2+]i升高主要由胞内Ryanodine不敏感的钙池释放造成,与百日咳毒素敏感的G蛋白无关;持续相[Ca2+]i升高主要由胞外Ca2+内流引起,不是通过电压依赖性L-型钙通道介导,与百日咳毒素敏感的G蛋白有关。
, http://www.100md.com
The effect of ET-1 on [Ca2+]i and its mechanism in isolated adult rat ventricular myocytes
YAO Ping*, PAN Jing-Yun, ZHAN Cheng-Yang
* Department of Physiology, Medical College, Jinan University, Guangzhou(510632)
Department of Physiology, Sun Yat-Sen University of Medical Sciences, Guangzhou
Abstract AIM and METHOD: The mechanism of endothelin-1(ET-1)-induced increase of intracellular concentration of free calcium ([Ca2+]i) in isolated adult rat ventricular myocytes was investigated by using Fura-2/AM as a calcium indicator. RESULTS: ET-1(1×10-7 mol/L) induced the biphasic [Ca2+]i responses including the rapid initial transient phase and the sustained phase. BQ123(2×10-6mol/L) completely blocked ET-1-induced increase of [Ca2+]i. Pertussis toxin (PTX) (200 ng/mL) and removal of extracellular Ca2+ didn't inhibit the rapid initial transient phase of ET-1-induced rise in [Ca2+]i, but abolished the sustained phase of [Ca2+]i response to ET-1. The biphasic [Ca2+]i responses to ET-1 were not significantly affected by the additions of Ryanodine (4μmol/L) and verapamil (2×10-5mol/L) respectively. CONCLUSIONS:ET-1-induced biphasic [Ca2+]i responses were mediated by ETA receptor. The rapid initial transient phase was the result of mobilization of [Ca2+]i from a Ryanodine-insensitive intracellular pool via PTX-insensitive G-protein, the sustained phase resulted from the transmembrane Ca2+ influx via a pathway that was not voltage-dependent L-type Ca2+ channels, but involved in PTX-sensitive G-protein.
, 百拇医药
MeSH Myocardium; Endothelins; Calcium; Calcium channels; Proteins
内皮素(endothelin, ET)是由21个氨基酸残基构成的多肽,有ET-1、ET-2和ET-3 3种异构肽。现已证实心肌细胞含有ET-1及其受体[1,2],ET-1对心脏组织有直接作用[3],包括正性变力、变时作用和延长动作电位持续时间。在较高浓度时,ET-1引起细胞内Ca2+动员,并促进Ca2+跨膜内流。但ET-1引起成年鼠离体心室肌细胞[Ca2+]i升高的机制尚未完全清楚。本实验采用Fura-2/AM荧光技术,测定成年鼠离体心室肌细胞内游离Ca2+浓度,探讨ET-1诱导[Ca2+]i升高的机制。
材料和方法
, http://www.100md.com
一、 材料:
(一)动物:Sprague-Dawley大鼠,雌雄不拘,体重150~180g,由中山医科大学实验动物中心提供。
(二)主要试剂和仪器:1型胶原酶(collagenase type 1)、Joklik培养液、Fura-2/AM 、内皮素-1 (endothelin-1)、EGTA [ethylene glycol-bis(β-aminoethyl ether)-N, N'-tetra-acetic acid]、Ryanodine和百日咳毒素(pertussis toxin)均为美国Sigma公司产品;BQ123为美国Belmont Inc产品;异搏定(Verapamil)为德国Knell产品;Triton X-100为日本Macalai Tesque INC Kyoto产品;850-荧光分光光度计为日本Hitachi制造。
二、 方法:
, 百拇医药
(一)心室肌细胞的分离:用戊巴比妥钠(50 mg/kg ip)对SD大鼠进行麻醉,开胸取出心脏,立即用改良的Langendorff灌流装置,通过主动脉插管逆行循环灌流心脏。体积分数为95%O2+5% CO2混合气体饱和含钙K-H液,其成分(mmol/L):118 NaCl, 25NaHCO3, 4.7 KCl, 1.2KH2PO4, 1.25CaCl2, 1.2 MgSO4, 10葡萄糖。用上述灌流液灌流5 min后,改用无钙K-H液灌流。5min后在灌流液中加入1型胶原酶(125U/mL)和牛血清白蛋白(1mg/mL),用此消化液继续灌流20min。此后,每隔5 min以递增方式加入CaCl2,使灌流液中CaCl2浓度在20min内增加至1.25mmol/L。灌流温度为37℃,pH约7.4。总灌流时间为45~50min。灌流后,迅速剪下心室肌,在含钙的消化液中把心肌剪成碎片,用吸管反复吹散,分离心肌细胞。离心沉淀,弃去上清液。用新配制的Joklik培养液稀释细胞,使其细胞浓度为5×104/mL。在显微镜下可见80%以上心肌细胞呈典型杆状,横纹清晰。
, http://www.100md.com
(二)细胞内游离钙浓度([Ca2+]i)的测定:将心肌细胞混悬液置于细胞培养瓶内,加入Fura-2/AM(终浓度为1μmol/L),在37℃恒温水浴振荡器中负载45min,使Fura-2/AM进入细胞并充分反应。然后离心沉淀细胞,弃去含Fura-2/AM上清液,用含钙K-H液反复冲洗,离心2~3次。最后将心肌细胞置于含钙K-H液中待用。
实验时,取心肌细胞悬液1mL置于石英杯内,用磁力搅拌器搅拌,维持心肌细胞的悬浮状态。荧光分光光度计的测试参数如下:激发波长340nm,裂隙宽度3nm,发射波长500nm,裂隙宽度10 nm。[Ca2+]i浓度按下列公式[4]计算:
[Ca2+]i =KD[(F-Fmin)/(Fmax-F)](nmol/L)
, 百拇医药
KD为解离平衡常数(224nmol/L),F为测得的荧光强度,Fmax为加入1%Triton X-100后,测得的最大荧光强度,Fmin为加入EGTA(10mmol/L)后,测得的最小荧光强度。
实验数据以均数±标准差(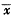 ±s)表示,并用t检验判断均数差异的显著性。
±s)表示,并用t检验判断均数差异的显著性。
结果
一、 ET-1对心肌细胞[Ca2+]i的影响:
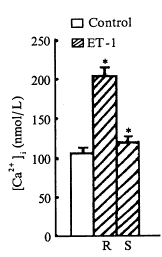
每次取心室肌细胞混悬液标本1mL(以下各实验均相同),加入1×10-7mol/L ET-1, 引起[Ca2+]i升高呈双相反应,即快速相(R)和持续相(S)。快速相由加入ET-1前对照值的(107.9±8.3)nmol/L升高到(206.5±10.2)nmol/L(P<0.01);紧接快速相之后的持续相为(121.2±5.8) nmol/L(P<0.01)(图1)。
, http://www.100md.com
二、 BQ123对ET-1诱导[Ca2+]i升高的影响:
BQ123是ETA受体特异性拮抗剂。对照值[Ca2+]i为(108.1±9.6)nmol/L,加入2×10-6mol/L BQ123后,[Ca2+]i为(107.5±8.3)nmol/L (P>0.05); 5min后再加入1 ×10-7mol/L ET-1,[Ca2+]i为(108.9±7.8)nmol/L,无显著变化(P>0.05 )(图2)。
, http://www.100md.com
Fig 1 Effect of ET-1(1×10-7mol/L) on [Ca2+]i in ventricular myocytes, (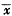 ±s,n=9),*P<0.01, vs control
±s,n=9),*P<0.01, vs control
R=rapid initial transient phase; S=sustained phase
图1 ET-1(1×10-7 mol/L)对心室肌细胞[Ca2+]i的影响
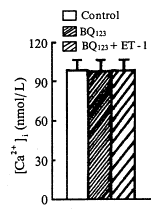
, 百拇医药 Fig 2 BQ123 blocks ET-1-induced increase of [Ca2+]i in ventricular myocytes (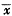 ±s, n=9) 图2 BQ123阻断ET-1升高[Ca2+]i的作用
±s, n=9) 图2 BQ123阻断ET-1升高[Ca2+]i的作用
三、 除去细胞外钙时,ET-1对[Ca2+]i的影响:
先将心室肌细胞标本用除去钙K-H液冲洗,离心,弃上清液,反复3次。再在心肌细胞混悬液中加入0.1mmol/L EGTA,络合细胞外液中残余Ca2+,测得[Ca2+]i为(106.5±7.8)nmol/L。加入1×10-7mol/L ET-1,[Ca2+]i快速相升高到(203.9±11.5)nmol/L(P<0.01),但无持续相(图3)。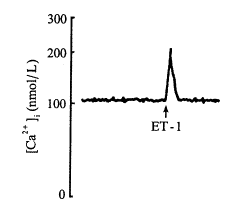
, http://www.100md.com
Fig 3 Effect of ET-1 on [Ca2+]i in ventricular myocytes after removal
of external calcium from K-H solution (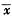 ±s, n=9) * P<0.01, vs control图 3 除去细胞外钙时,ET-1对[Ca2+]i的影响
±s, n=9) * P<0.01, vs control图 3 除去细胞外钙时,ET-1对[Ca2+]i的影响
四、异搏定对ET-1诱导[Ca2+]i升高的影响:
异搏定是L-型钙通道阻断剂。加入2×10-5mol/L异搏定后,[Ca2+]i为(105.9±8.2)nmol/L,与对照值[Ca2+]i (107.2±6.9) nmol/L无显著差异(P>0.05)。10min后加入1×10-7mol/L ET-1,仍出现快速相 [Ca2+]i为(201.8±9.5)nmol/L(P<0.01)和持续相[Ca2+]i为(119.3±6.1)nmol/L(P<0.01)(图4A)。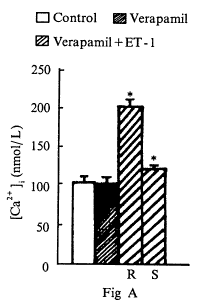
, 百拇医药
Fig 4 Effects of verapamil (Fig A), Ryanodine (Fig B) and pertussis toxin (PTX) (Fig C) on ET-1-induced increase of [Ca2+]i in ventricular myocytes ( ±s , n=9) * P<0.01, vs control图4 异搏定(图A)、Ryanodine(图B)和百日咳毒素(图C)对ET-1诱导[Ca2+]i增加的影响
±s , n=9) * P<0.01, vs control图4 异搏定(图A)、Ryanodine(图B)和百日咳毒素(图C)对ET-1诱导[Ca2+]i增加的影响
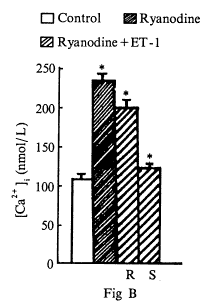
五、 Ryanodine对ET-1诱导[Ca2+]i升高的影响:
加入4μmol/L Ryanodine后,[Ca2+]i从(108.3±9.2) nmol/L升高到(238.5±12.6)nmol/L(P<0.01),然后[Ca2+]i逐渐下降,当[Ca2+]i基本恢复到对照水平时,加入1×10-7mol/L ET-1,仍有快速相[Ca2+]i为(202.6±10.3) nmol/L(P<0.01)和持续相[Ca2+]i为(123.5±7.1)nmol/L(P<0.01)(图4B)。
, 百拇医药
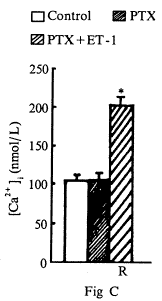
六、百日咳毒素对ET-1诱导[Ca2+]i升高的影响:
百日咳毒素是G旦白抑制剂。心肌细胞经百日咳毒素(200 ng/mL)处理10h后,[Ca2+]i为(107.2±9.8)nmol/L,与对照值[Ca2+]i (106.8±8.5)nmol/L 无显著差异(P>0.05)。加入1×10-7mol/L ET-1后,仍出现快速相[Ca2+]i为(203.8±10.1nmol/L(P<0.01),但无持续相(图4C)。
讨论
本实验结果显示,ET-1升高[Ca2+]i有两个时相:起始的短暂快速相和随后的持续相,可被ETA的特异性受体阻断剂BQ123所阻断,表明ET-1诱导[Ca2+]i升高的效应是由ETA受体介导的。将大鼠心肌细胞外液的钙去除后,ET-1仍引起快速相,但持续相消失,表明ET-1诱导的快速相可能主要与胞内Ca2+释放有关,持续相可能主要与胞外Ca2+内流有关。
, 百拇医药
为了进一步探讨胞内Ca2+释放及胞外Ca2+内流的机制,我们用百日咳毒素(PTX)预处理心肌细胞后,ET-1诱导[Ca2+]i升高的快速相不受影响,而持续相消失,表明ET-1诱导的[Ca2+]i升高的快速相不是与百日咳毒素敏感的G旦白耦联的,而持续相可能通过百日咳毒素敏感的G旦白耦联。细胞内游离Ca2+主要贮存于内质网(ER)和肌浆网(SR)中,有1,4,5—三磷酸肌醇(IP3)敏感和IP3不敏感两类钙池,分别由IP3受体系统和Ryanodine受体系统调控[5]。Ryanodine是一种从Ryania speciosa vahl 提取的生物碱,可兴奋Ryanodine 受体,使细胞内钙释放和耗竭。本实验观察到,Ryanodine 对ET-1引起[Ca2+]i升高的快速相无显著影响,表明ET-1诱导[Ca2+]i升高的快速相可能是由Ryanodine 不敏感的胞内钙池释放。ET-1引起胞内钙释放的机制仍未充分了解,最近一些报导显示,心肌的SR也发现有IP3受体,ET-1作用于ETA受体后,通过磷脂酶C-IP3系统开放SR钙释放通道[6],从而引起[Ca2+]i增加。
, 百拇医药
至于ET-1引起[Ca2+]i升高的持续相的胞外Ca2+内流是通过细胞膜上哪一种钙通道则仍有争论。Lauer等[7]在兔的心肌细胞中发现,ET-1通过G蛋白间接激活电压依赖性的L-型钙通道;Furukawa等[8]在培养新生大鼠心室肌细胞中用膜片钳方法分析了Ca2+内流的通道,他们证实ET-1是激活T-型钙通道而引起Ca2+内流。我们用L-型电压依赖性钙通道拮抗剂异搏定,不影响ET-1引起的[Ca2+]i升高,提示ET-1引起的胞外Ca2+内流不是通过L-型电压依赖性钙通道。Vigne等[9]在鼠的心房肌细胞中亦证明ET-1不是心肌L-型Ca2+通道的一种激动剂。ET-1引起的胞外Ca2+内流可能是由于一种非选择性阳离子通道开放而诱导的膜去极化的结果,而不是ET-1对钙通道的一种直接激活效应[10]。
, 百拇医药
参考文献
1 Suzuki T, Kumazaki T, Mitsui Y. Endothelin-1 is produced and secreted by neonatal rat cardiac myocytes in vitro. Biochem Biophys Res Commun, 1993, 191:823.
2 韩雅玲,陈思聪. 内皮素调节心血管功能的分子和细胞机制.心血管病学进展,1994,15:362.
3 Ebihara Y, Haist JV, Karmazyn M. Modulation of endothelin-1 effects on rat hearts and cardiomyocytes by nitric oxide and 8-bromo cyclic GMP. J Mol Cell Cardiol, 1996,28:265.
, http://www.100md.com
4 潘敬运,黄晓笛,詹澄扬. 用荧光染料Fura-2法测定心室肌细胞内游离钙离子浓度.中山医科大学学报,1990,11:14.
5 Colin WT, Lan CBM. Calcium and inositol 1,4,5-trisphosphate receptors: a complex relationship. TIBS, 1992, 17:403.
6 Simonson MS, Dunn MJ. The molecular mechanisms of cardiovascular and renal regulation by endothelin peptides. J Lab Clin Med, 1992, 119:622.
7 Lauer MR, Gunn MD, Clusin WT. Endothelin-1 activates a voltage-dependent Ca2+ current by a G protein-dependent mechanism in rabbit cardiac myocytes. J Physiol, 1992, 448:729.
, http://www.100md.com
8 Furukawa T, Ito H, Nitta J. Endothelin-1 enhances calcium entry through T-type calcium channels in cultured neonatal rat ventricular myocytes. Circ Res, 1992, 71:1242.
9 Vigne P, Breittmayer JP, Marsault R, et al. Endothelin mobilizes Ca2+ from a caffeine- and ryanodine-insensitive intracellular pool in rat atrial cells. J Biol Chem, 1990,265:6782.
10 Wallnofer A, Weir S, Ruegg U, et al. The mechanism of action of endothelin-1 as compared with other agonists in vascular smooth muscle. J Cardiovasc Pharmacol, 1989, 13(Suppl 5):S23.
1999年2月2日收稿,1999年3月17日修回, 百拇医药
单位:
姚平 暨南大学医学院生理学教研室(广州 510632);潘敬运 詹澄扬 中山医科大学生理学教研室
关键词:心肌;内皮缩血管肽类;钙;钙通道;蛋白质类
中国病理生理杂志990413 摘 要 目的和方法:采用分离的Sprague-Dawley 大鼠心室肌细胞,以Fura-2/AM荧光指示剂负载,检测心肌细胞内游离钙浓度([Ca2+]i)变化,探讨内皮素-1(ET-1)对[Ca2+]i的作用及其机制。结果:ET-1(1×10-7mol/L)引起[Ca2+]i升高分两个时相:快速相和持续相,可被ETA的特异性受体阻断剂BQ123(2×10-6mol/L)所阻断。移去细胞外液钙以及用百日咳毒素(200ng/mL)处理10 h后,ET-1仍引起快速相,但持续相消失。Ryanodine(4 μmol/L)和异搏定(2×10-5mol/L)对ET-1诱导[Ca2+]i升高的作用无显著影响。结论:ET-1升高[Ca2+]i是通过ETA受体介导;快速相[Ca2+]i升高主要由胞内Ryanodine不敏感的钙池释放造成,与百日咳毒素敏感的G蛋白无关;持续相[Ca2+]i升高主要由胞外Ca2+内流引起,不是通过电压依赖性L-型钙通道介导,与百日咳毒素敏感的G蛋白有关。
, http://www.100md.com
The effect of ET-1 on [Ca2+]i and its mechanism in isolated adult rat ventricular myocytes
YAO Ping*, PAN Jing-Yun, ZHAN Cheng-Yang
* Department of Physiology, Medical College, Jinan University, Guangzhou(510632)
Department of Physiology, Sun Yat-Sen University of Medical Sciences, Guangzhou
Abstract AIM and METHOD: The mechanism of endothelin-1(ET-1)-induced increase of intracellular concentration of free calcium ([Ca2+]i) in isolated adult rat ventricular myocytes was investigated by using Fura-2/AM as a calcium indicator. RESULTS: ET-1(1×10-7 mol/L) induced the biphasic [Ca2+]i responses including the rapid initial transient phase and the sustained phase. BQ123(2×10-6mol/L) completely blocked ET-1-induced increase of [Ca2+]i. Pertussis toxin (PTX) (200 ng/mL) and removal of extracellular Ca2+ didn't inhibit the rapid initial transient phase of ET-1-induced rise in [Ca2+]i, but abolished the sustained phase of [Ca2+]i response to ET-1. The biphasic [Ca2+]i responses to ET-1 were not significantly affected by the additions of Ryanodine (4μmol/L) and verapamil (2×10-5mol/L) respectively. CONCLUSIONS:ET-1-induced biphasic [Ca2+]i responses were mediated by ETA receptor. The rapid initial transient phase was the result of mobilization of [Ca2+]i from a Ryanodine-insensitive intracellular pool via PTX-insensitive G-protein, the sustained phase resulted from the transmembrane Ca2+ influx via a pathway that was not voltage-dependent L-type Ca2+ channels, but involved in PTX-sensitive G-protein.
, 百拇医药
MeSH Myocardium; Endothelins; Calcium; Calcium channels; Proteins
内皮素(endothelin, ET)是由21个氨基酸残基构成的多肽,有ET-1、ET-2和ET-3 3种异构肽。现已证实心肌细胞含有ET-1及其受体[1,2],ET-1对心脏组织有直接作用[3],包括正性变力、变时作用和延长动作电位持续时间。在较高浓度时,ET-1引起细胞内Ca2+动员,并促进Ca2+跨膜内流。但ET-1引起成年鼠离体心室肌细胞[Ca2+]i升高的机制尚未完全清楚。本实验采用Fura-2/AM荧光技术,测定成年鼠离体心室肌细胞内游离Ca2+浓度,探讨ET-1诱导[Ca2+]i升高的机制。
材料和方法
, http://www.100md.com
一、 材料:
(一)动物:Sprague-Dawley大鼠,雌雄不拘,体重150~180g,由中山医科大学实验动物中心提供。
(二)主要试剂和仪器:1型胶原酶(collagenase type 1)、Joklik培养液、Fura-2/AM 、内皮素-1 (endothelin-1)、EGTA [ethylene glycol-bis(β-aminoethyl ether)-N, N'-tetra-acetic acid]、Ryanodine和百日咳毒素(pertussis toxin)均为美国Sigma公司产品;BQ123为美国Belmont Inc产品;异搏定(Verapamil)为德国Knell产品;Triton X-100为日本Macalai Tesque INC Kyoto产品;850-荧光分光光度计为日本Hitachi制造。
二、 方法:
, 百拇医药
(一)心室肌细胞的分离:用戊巴比妥钠(50 mg/kg ip)对SD大鼠进行麻醉,开胸取出心脏,立即用改良的Langendorff灌流装置,通过主动脉插管逆行循环灌流心脏。体积分数为95%O2+5% CO2混合气体饱和含钙K-H液,其成分(mmol/L):118 NaCl, 25NaHCO3, 4.7 KCl, 1.2KH2PO4, 1.25CaCl2, 1.2 MgSO4, 10葡萄糖。用上述灌流液灌流5 min后,改用无钙K-H液灌流。5min后在灌流液中加入1型胶原酶(125U/mL)和牛血清白蛋白(1mg/mL),用此消化液继续灌流20min。此后,每隔5 min以递增方式加入CaCl2,使灌流液中CaCl2浓度在20min内增加至1.25mmol/L。灌流温度为37℃,pH约7.4。总灌流时间为45~50min。灌流后,迅速剪下心室肌,在含钙的消化液中把心肌剪成碎片,用吸管反复吹散,分离心肌细胞。离心沉淀,弃去上清液。用新配制的Joklik培养液稀释细胞,使其细胞浓度为5×104/mL。在显微镜下可见80%以上心肌细胞呈典型杆状,横纹清晰。
, http://www.100md.com
(二)细胞内游离钙浓度([Ca2+]i)的测定:将心肌细胞混悬液置于细胞培养瓶内,加入Fura-2/AM(终浓度为1μmol/L),在37℃恒温水浴振荡器中负载45min,使Fura-2/AM进入细胞并充分反应。然后离心沉淀细胞,弃去含Fura-2/AM上清液,用含钙K-H液反复冲洗,离心2~3次。最后将心肌细胞置于含钙K-H液中待用。
实验时,取心肌细胞悬液1mL置于石英杯内,用磁力搅拌器搅拌,维持心肌细胞的悬浮状态。荧光分光光度计的测试参数如下:激发波长340nm,裂隙宽度3nm,发射波长500nm,裂隙宽度10 nm。[Ca2+]i浓度按下列公式[4]计算:
[Ca2+]i =KD[(F-Fmin)/(Fmax-F)](nmol/L)
, 百拇医药
KD为解离平衡常数(224nmol/L),F为测得的荧光强度,Fmax为加入1%Triton X-100后,测得的最大荧光强度,Fmin为加入EGTA(10mmol/L)后,测得的最小荧光强度。
实验数据以均数±标准差(
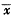 ±s)表示,并用t检验判断均数差异的显著性。
±s)表示,并用t检验判断均数差异的显著性。结果
一、 ET-1对心肌细胞[Ca2+]i的影响:
每次取心室肌细胞混悬液标本1mL(以下各实验均相同),加入1×10-7mol/L ET-1, 引起[Ca2+]i升高呈双相反应,即快速相(R)和持续相(S)。快速相由加入ET-1前对照值的(107.9±8.3)nmol/L升高到(206.5±10.2)nmol/L(P<0.01);紧接快速相之后的持续相为(121.2±5.8) nmol/L(P<0.01)(图1)。
, http://www.100md.com
二、 BQ123对ET-1诱导[Ca2+]i升高的影响:
BQ123是ETA受体特异性拮抗剂。对照值[Ca2+]i为(108.1±9.6)nmol/L,加入2×10-6mol/L BQ123后,[Ca2+]i为(107.5±8.3)nmol/L (P>0.05); 5min后再加入1 ×10-7mol/L ET-1,[Ca2+]i为(108.9±7.8)nmol/L,无显著变化(P>0.05 )(图2)。


, http://www.100md.com
Fig 1 Effect of ET-1(1×10-7mol/L) on [Ca2+]i in ventricular myocytes, (
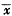 ±s,n=9),*P<0.01, vs control
±s,n=9),*P<0.01, vs controlR=rapid initial transient phase; S=sustained phase
图1 ET-1(1×10-7 mol/L)对心室肌细胞[Ca2+]i的影响


, 百拇医药 Fig 2 BQ123 blocks ET-1-induced increase of [Ca2+]i in ventricular myocytes (
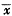 ±s, n=9) 图2 BQ123阻断ET-1升高[Ca2+]i的作用
±s, n=9) 图2 BQ123阻断ET-1升高[Ca2+]i的作用三、 除去细胞外钙时,ET-1对[Ca2+]i的影响:
先将心室肌细胞标本用除去钙K-H液冲洗,离心,弃上清液,反复3次。再在心肌细胞混悬液中加入0.1mmol/L EGTA,络合细胞外液中残余Ca2+,测得[Ca2+]i为(106.5±7.8)nmol/L。加入1×10-7mol/L ET-1,[Ca2+]i快速相升高到(203.9±11.5)nmol/L(P<0.01),但无持续相(图3)。


, http://www.100md.com
Fig 3 Effect of ET-1 on [Ca2+]i in ventricular myocytes after removal
of external calcium from K-H solution (
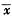 ±s, n=9) * P<0.01, vs control图 3 除去细胞外钙时,ET-1对[Ca2+]i的影响
±s, n=9) * P<0.01, vs control图 3 除去细胞外钙时,ET-1对[Ca2+]i的影响四、异搏定对ET-1诱导[Ca2+]i升高的影响:
异搏定是L-型钙通道阻断剂。加入2×10-5mol/L异搏定后,[Ca2+]i为(105.9±8.2)nmol/L,与对照值[Ca2+]i (107.2±6.9) nmol/L无显著差异(P>0.05)。10min后加入1×10-7mol/L ET-1,仍出现快速相 [Ca2+]i为(201.8±9.5)nmol/L(P<0.01)和持续相[Ca2+]i为(119.3±6.1)nmol/L(P<0.01)(图4A)。



, 百拇医药
Fig 4 Effects of verapamil (Fig A), Ryanodine (Fig B) and pertussis toxin (PTX) (Fig C) on ET-1-induced increase of [Ca2+]i in ventricular myocytes (
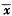 ±s , n=9) * P<0.01, vs control图4 异搏定(图A)、Ryanodine(图B)和百日咳毒素(图C)对ET-1诱导[Ca2+]i增加的影响
±s , n=9) * P<0.01, vs control图4 异搏定(图A)、Ryanodine(图B)和百日咳毒素(图C)对ET-1诱导[Ca2+]i增加的影响五、 Ryanodine对ET-1诱导[Ca2+]i升高的影响:
加入4μmol/L Ryanodine后,[Ca2+]i从(108.3±9.2) nmol/L升高到(238.5±12.6)nmol/L(P<0.01),然后[Ca2+]i逐渐下降,当[Ca2+]i基本恢复到对照水平时,加入1×10-7mol/L ET-1,仍有快速相[Ca2+]i为(202.6±10.3) nmol/L(P<0.01)和持续相[Ca2+]i为(123.5±7.1)nmol/L(P<0.01)(图4B)。
, 百拇医药
六、百日咳毒素对ET-1诱导[Ca2+]i升高的影响:
百日咳毒素是G旦白抑制剂。心肌细胞经百日咳毒素(200 ng/mL)处理10h后,[Ca2+]i为(107.2±9.8)nmol/L,与对照值[Ca2+]i (106.8±8.5)nmol/L 无显著差异(P>0.05)。加入1×10-7mol/L ET-1后,仍出现快速相[Ca2+]i为(203.8±10.1nmol/L(P<0.01),但无持续相(图4C)。
讨论
本实验结果显示,ET-1升高[Ca2+]i有两个时相:起始的短暂快速相和随后的持续相,可被ETA的特异性受体阻断剂BQ123所阻断,表明ET-1诱导[Ca2+]i升高的效应是由ETA受体介导的。将大鼠心肌细胞外液的钙去除后,ET-1仍引起快速相,但持续相消失,表明ET-1诱导的快速相可能主要与胞内Ca2+释放有关,持续相可能主要与胞外Ca2+内流有关。
, 百拇医药
为了进一步探讨胞内Ca2+释放及胞外Ca2+内流的机制,我们用百日咳毒素(PTX)预处理心肌细胞后,ET-1诱导[Ca2+]i升高的快速相不受影响,而持续相消失,表明ET-1诱导的[Ca2+]i升高的快速相不是与百日咳毒素敏感的G旦白耦联的,而持续相可能通过百日咳毒素敏感的G旦白耦联。细胞内游离Ca2+主要贮存于内质网(ER)和肌浆网(SR)中,有1,4,5—三磷酸肌醇(IP3)敏感和IP3不敏感两类钙池,分别由IP3受体系统和Ryanodine受体系统调控[5]。Ryanodine是一种从Ryania speciosa vahl 提取的生物碱,可兴奋Ryanodine 受体,使细胞内钙释放和耗竭。本实验观察到,Ryanodine 对ET-1引起[Ca2+]i升高的快速相无显著影响,表明ET-1诱导[Ca2+]i升高的快速相可能是由Ryanodine 不敏感的胞内钙池释放。ET-1引起胞内钙释放的机制仍未充分了解,最近一些报导显示,心肌的SR也发现有IP3受体,ET-1作用于ETA受体后,通过磷脂酶C-IP3系统开放SR钙释放通道[6],从而引起[Ca2+]i增加。
, 百拇医药
至于ET-1引起[Ca2+]i升高的持续相的胞外Ca2+内流是通过细胞膜上哪一种钙通道则仍有争论。Lauer等[7]在兔的心肌细胞中发现,ET-1通过G蛋白间接激活电压依赖性的L-型钙通道;Furukawa等[8]在培养新生大鼠心室肌细胞中用膜片钳方法分析了Ca2+内流的通道,他们证实ET-1是激活T-型钙通道而引起Ca2+内流。我们用L-型电压依赖性钙通道拮抗剂异搏定,不影响ET-1引起的[Ca2+]i升高,提示ET-1引起的胞外Ca2+内流不是通过L-型电压依赖性钙通道。Vigne等[9]在鼠的心房肌细胞中亦证明ET-1不是心肌L-型Ca2+通道的一种激动剂。ET-1引起的胞外Ca2+内流可能是由于一种非选择性阳离子通道开放而诱导的膜去极化的结果,而不是ET-1对钙通道的一种直接激活效应[10]。
, 百拇医药
参考文献
1 Suzuki T, Kumazaki T, Mitsui Y. Endothelin-1 is produced and secreted by neonatal rat cardiac myocytes in vitro. Biochem Biophys Res Commun, 1993, 191:823.
2 韩雅玲,陈思聪. 内皮素调节心血管功能的分子和细胞机制.心血管病学进展,1994,15:362.
3 Ebihara Y, Haist JV, Karmazyn M. Modulation of endothelin-1 effects on rat hearts and cardiomyocytes by nitric oxide and 8-bromo cyclic GMP. J Mol Cell Cardiol, 1996,28:265.
, http://www.100md.com
4 潘敬运,黄晓笛,詹澄扬. 用荧光染料Fura-2法测定心室肌细胞内游离钙离子浓度.中山医科大学学报,1990,11:14.
5 Colin WT, Lan CBM. Calcium and inositol 1,4,5-trisphosphate receptors: a complex relationship. TIBS, 1992, 17:403.
6 Simonson MS, Dunn MJ. The molecular mechanisms of cardiovascular and renal regulation by endothelin peptides. J Lab Clin Med, 1992, 119:622.
7 Lauer MR, Gunn MD, Clusin WT. Endothelin-1 activates a voltage-dependent Ca2+ current by a G protein-dependent mechanism in rabbit cardiac myocytes. J Physiol, 1992, 448:729.
, http://www.100md.com
8 Furukawa T, Ito H, Nitta J. Endothelin-1 enhances calcium entry through T-type calcium channels in cultured neonatal rat ventricular myocytes. Circ Res, 1992, 71:1242.
9 Vigne P, Breittmayer JP, Marsault R, et al. Endothelin mobilizes Ca2+ from a caffeine- and ryanodine-insensitive intracellular pool in rat atrial cells. J Biol Chem, 1990,265:6782.
10 Wallnofer A, Weir S, Ruegg U, et al. The mechanism of action of endothelin-1 as compared with other agonists in vascular smooth muscle. J Cardiovasc Pharmacol, 1989, 13(Suppl 5):S23.
1999年2月2日收稿,1999年3月17日修回, 百拇医药