重症烧伤大鼠早期外周血单个核细胞凋亡的实验研究
作者:张璐 赵克森 张琳 谭小华
单位:第一军医大学全军休克微循环重点实验室(广州 510515)
关键词:;烧伤;单核细胞;基因表达
重症烧伤大鼠早期外周血单个核细胞凋亡的实验研究
摘要 目的:探讨烧伤后早期外周血单个核细胞(PBMC)凋亡的发生、变化规律及bcl-2蛋白表达的变化。方法:应用流式细胞仪、DNA凝胶电泳等手段观察烧伤大鼠PBMC凋亡发生的动力学变化、bcl-2蛋白的表达及烧伤血清对细胞凋亡的影响。结果:烧伤后6 h起,PBMC凋亡率明显增加,随时间的推延呈增高趋势,此时bcl-2蛋白表达下调;烧伤血清可以诱导单核细胞株Raw 264.7凋亡。结论:PBMC凋亡在严重烧伤的免疫功能紊乱方面起重要作用,而bcl-2基因下调可能是重症烧伤早期PBMC细胞凋亡的分子机制之一;烧伤血清含有(或缺乏)某种物质,可以介导细胞凋亡。
, 百拇医药
Apoptosis of peripheral blood mononuclear cells in the early stage of severe burns in rats
ZHANG Lu,ZHAO Ke-Sen,ZHANG Lin,TAN Xiao-Hua
Key Lab for Shock and Microcirculation Research of PLA,The First Military Medical University, Guangzhou (510515)
Abstract AIM:To investigate the apoptosis and its alteration rule, molecular mechanism of peripheral blood mononuclear cells(PBMC) from severe burn rats. METHODS:The apoptosis of circulating PBMC ,monocytic cell Raw264.7 cultured in 10% burn serum and bcl-2 gene expression was detected by flow cytometric cell cycle analysis and DNA electrophoresis. RESULTS: Six hours after burn PBMC displayed characteristic apoptosis .Furthermore,the expression of bcl-2 gene was decreased effectively. Serum from burned rats can induce apoptosis in Raw264.7. CONCLUSIONS: Apoptosis may play a major role in thermal injury-related immunodeficiency.The decrease of bcl-2 protein might be one of the molecular mechanisms of apoptosis,and some humoral factor(s) in burn serum may play a role in the induction of apoptosis in Raw264.7 cell.
, 百拇医药
MeSH Burns; Monocytes; Gene expression
近年来,白细胞在重症烧伤发生发展中的细胞机理受到越来越多的重视。细胞凋亡是细胞接受某些信号或受到某些因素刺激后一种主动的由基因调控的细胞消亡过程,是机体维持内环境所必需的。有关细胞凋亡在胚胎发育、肿瘤、免疫缺陷等发生发展中的作用已有诸多报道[1,2],但细胞凋亡是否参与严重烧伤的发生发展,及在其中的作用如何尚不清楚。为进一步探讨烧伤发生发展的细胞机理,本研究复制大鼠重症烧伤模型,观察外周血单个核细胞(peripheral blood mononuclear cells,PBMC)的凋亡发生状况,并初步探讨了其发生机制。
材料与方法
(一) 动物模型:Wistar大鼠24只,雄性,体重190~230 g,随机分为正常组及烧伤组(n=12),用13.3%乌拉坦+1%氯醛糖麻醉动物(0.6 mL/100 g iP)。一侧颈动脉管插入PE50聚乙烯导管,用以放血。用我室常规方法[3],复制重症烧伤模型。正常对照组除不烧伤外,其余处理与烧伤相同。各组动物于伤后不同时间点(3 h,6 h,9 h,12 h,24 h)取血,回输等量生理盐水,使动物存活。
, 百拇医药
(二) 外周血单个核细胞悬液的制备:按文献方法[4]制备外周血单个核细胞(PBMC)。
(三) 体外细胞培养实验:将1×106的细胞接种在含5%小牛血清的DMEM培养液中培养(37℃,5% CO2)。采取烧伤后12 h大鼠的颈动脉血液,无菌分离血清,按20%比例与DMEM培养液混合,-20℃保存,另取正常大鼠颈动脉血液作对照。分别用含10%烧伤血清及正常大鼠血清的培养液孵育单核细胞株Raw 264.7细胞,于不同时点(3 h,6 h,12 h,18 h,24 h)收集细胞。单核细胞株R264.7细胞由美国Sripps研究所惠赠。
(四) 流式细胞仪检测细胞凋亡:按文献[5]方法进行。
(五) 流式细胞仪检测bcl-2蛋白表达:将正常PBMC及烧伤后6 h与12 h收集的细胞于4℃,1%多聚甲醛固定15 min,PBS清洗,加入羊血清封闭10 min,加入鼠抗人bcl-2单抗,37℃孵育30 min,PBS清洗,加入羊抗鼠IgG-FITC,黑暗中37℃孵育30 min。Elite流式细胞仪检测。
, http://www.100md.com
(六) DNA凝胶电泳:用快速法[4]抽提细胞DNA片段,进行1.5%琼脂糖凝胶电泳。
(七)统计学分析:实验数据以均数±标准差(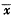 ±s)表示,两组动物间结果比较用Students t检验;同组动物不同时点的比较用配对t检验,判断差异显著性。
±s)表示,两组动物间结果比较用Students t检验;同组动物不同时点的比较用配对t检验,判断差异显著性。
结果
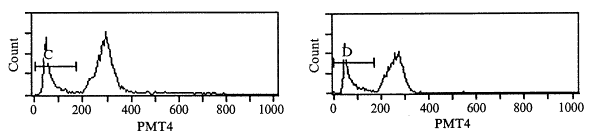
(一) 细胞凋亡检测结果:应用流式细胞仪分析细胞DNA含量,结果显示典型的凋亡细胞群特征:DNA含量低于G1期细胞,出现亚二倍体峰(见图1)。重症烧伤组在烧伤后6 h PBMC凋亡率明显增高(P<0.01),约为对照组4倍,并且随时间推移凋亡率逐渐增加,伤后12 h约为对照组的6倍,此后维持于平台阶段,24 h后仍是对照组的6倍左右。(见表1)。进一步,用琼脂糖凝胶电泳检测显示,烫伤后12h,大鼠单个核细胞的DNA电泳出现明显的阶梯状条带,而对照DNA电泳未发现阶梯状条带(见图2)。
, 百拇医药
表1 烧伤后PBMC凋亡发生率的变化
Tab 1 Changes in incidence of apoptosis on PBMC after sever burn(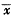 ±s,%)
±s,%)
Group
n
Hours after burn
0
3
6
12
, 百拇医药
24
Control
12
4.8±0.8
Burn
12
6.9±1.2
19.6±3.2**
25.8±3.5**
27.2±2.8**
** P<0.01,vs control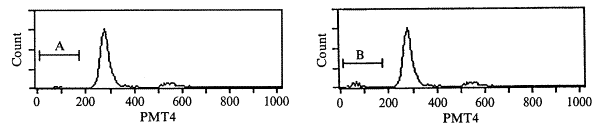
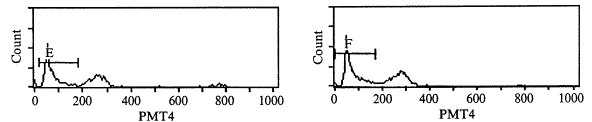
, 百拇医药
Fig 1 Flow cytometry analysis of PBMC from control group(A) and severe burn rats after 3(B),6(C),9(D),12(E),24(F)hours .The vertical axis indicates cell number and the horizontal axis reprents red fluorescense intensity.The percentage of nonviable(PI+)cells is indicated 图1 流式细胞仪检测烧伤大鼠PBMC凋亡
表2 烧伤血清对Raw264.7细胞凋亡的影响
Tab 2 Effect of burn serum on the apoptosis of Raw264.7 ( ±s,%)
±s,%)
, 百拇医药
Serum
n
Hours of culture
0
6
12
18
24
Normal
3
3.5±0.8
3.8±0.5
4.5±1.2
, 百拇医药
5.2±0.5
6.5±0.8
Burn
3
5.8±1.2
18.0±1.9**
23.2±3.2**
32.3±2.8**
** P<0.01,vs control
Fig 2 Agarose gel electrophoresis of PBMC DNA from rat after severe burns. Lane 1:PBMC DNA 12 hours after burn; Lane 2:PBMC DNA 24 hours after burn; Lane 3:control PBMC DNA; Lane 4:λDNA/HindIII+EcoRI
, 百拇医药
图2 烧伤大鼠PBMC DNA凝胶电泳图谱
(二) Bcl-2蛋白表达:流式细胞仪检测显示正常大鼠PBMC细胞稳定表达bcl-2,其bcl-2阳性表达细胞荧光强度百分率为62.5%±2.8%(FITC的荧光值表示bcl-2蛋白含量的多少);烧伤后bcl-2表达进行性下调,6 h为51.2%±2.6%(P<0.05),12 h后为41.5%±2.2% (P<0.01)。
(三) 烧伤血清对Raw264.7细胞凋亡的影响:用10%的烧伤血清刺激Raw264.7细胞,流式细胞仪检测显示12 h后其凋亡百分率明显增高,约为正常血清组的6倍(P<0.01),此后随时间的推移逐渐增高(表2)。
讨论
细胞凋亡是机体为维持内环境稳定,由基因控制的细胞自主的有序的死亡。业已知道,重症烧伤后机体易出现细胞、免疫功能紊乱[6]。已查明烧伤和创伤以后出现了白细胞功能不全(dysfunction),表现为它的趋化性、吞噬力、产生超氧阴离子和过氧化氢能力、及杀减细菌能力均减弱,导致机体免疫力下降和容易发生感染[7,8]。迄今为止,关于细胞凋亡在烧伤发生发展中的作用已有诸多研究。外周血单个核细胞包括淋巴细胞、单核细胞及NK细胞,可产生IL-2、IL-6、TNF等多种细胞因子,是机体重要的免疫细胞。目前,关于PBMC凋亡在烧伤发生发展中作用的研究鲜有报道。本研究采用流式细胞仪,DNA凝胶电泳技术观察到烧伤早期(6 h)PBMC即出现明显的细胞凋亡,由烧伤前的4.8%±1.2%增加为19.6%±3.2%(P<0.01),增加4倍左右,随烧伤时相的推延,PBMC凋亡率逐渐增加,伤后12小时约为对照组的6倍,此后维持于平台阶段。这提示细胞凋亡在严重烧伤的免疫功能紊乱方面起重要作用。
, http://www.100md.com
细胞凋亡是一种主动的受基因调控的细胞自杀过程。多种基因如bcl-2、 P53、c-myc、bax、bad等参与凋亡的调控。其中 bcl-2尤为重要,它被认为是细胞凋亡调控的最后通路之一。Bcl-2的抗凋亡机制尚未完全阐明,但新近的资料提示bcl-2能与几种bcl-2相关蛋白形成异二聚体[9],介导细胞凋亡。本实验发现正常PBMC细胞稳定表达bcl-2,烧伤后6 h起bcl-2表达进行性下调(P<0.01),bcl-2基因表达下调可能是重症烧伤早期大鼠PBMC细胞凋亡显著增加的分子机制之一。
业已证明,烧伤后血液中肿瘤坏死因子、白介素等多种细胞因子和神经内分泌介质增多。已知某些体液因子参与细胞凋亡的发生,如IL-6对野生型P53介导的细胞凋亡有抑制作用;糖皮质激素对淋巴细胞凋亡有诱导作用;而IL-4对氢化可的松介导的淋巴细胞性白血病细胞凋亡有抑制作用。烧伤血清含有烧伤后多种体液因子,本研究应用烧伤血清刺激单核细胞株Raw264.7,观察到12 后Raw264.7细胞凋亡率明显增高(P<0.01),这提示烧伤血清中含有(或缺乏)某种物质,可以介导PBMC凋亡,但这些物质的生物学本质和它们通过哪些基因带来PBMC凋亡,尚需进一步研究。
, http://www.100md.com
参考文献
1 Cummings MC,Winterford CM,Walker NI.Apoptosis.The Am J Surg Pathol,1997,21:88.
2 Hale AJ,Smith CA,Sutherland LC,et al.Apoptosis:molecular regulation of cell death.Eur J Biochem,1996,236:1.
3 赵克森,朱佐江,吴坤莹.虎杖4号增强烧伤休克早期心功能的效应.中华整形烧伤外科杂志,1989,5:275.
4 Chitnis D,Dickerson C,Munster AM,et al.Inhibition of apoptosis in polymorphonuclear neutrophils from burn patients.J Leukocyte Biol,1996,59:835.
, 百拇医药
5 张亚历,姜 泊,周殿元.程序化细胞死亡常用研究方法.见:姜泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京:人民军医出版社,1996.176.
6 Maldonado MD,Venturoli A,Franco A,et al.Specific changes in peripheral blood lymphocyte phenotype from burn patients probable origin of the thermal injury-related lymphocytopenia.Burns,1991,17:188.
7 Mozingo DW,Pruitt Jr BA.Infectious complications after burn injury. Current Opinion in Surgical Infections,1994,2:69.
8 Cioffi WG,Burleson DG,Pruitt Jr BA.Leukocyte responses to injury.Arch Surg,1993,128:1260.
9 Reed JC.Bcl-2 and the regulation of programmed cell death.J Cell Biol,1993,75:241.
1998年8月5日收稿,1998年12月15日修回, 百拇医药
单位:第一军医大学全军休克微循环重点实验室(广州 510515)
关键词:;烧伤;单核细胞;基因表达
重症烧伤大鼠早期外周血单个核细胞凋亡的实验研究
摘要 目的:探讨烧伤后早期外周血单个核细胞(PBMC)凋亡的发生、变化规律及bcl-2蛋白表达的变化。方法:应用流式细胞仪、DNA凝胶电泳等手段观察烧伤大鼠PBMC凋亡发生的动力学变化、bcl-2蛋白的表达及烧伤血清对细胞凋亡的影响。结果:烧伤后6 h起,PBMC凋亡率明显增加,随时间的推延呈增高趋势,此时bcl-2蛋白表达下调;烧伤血清可以诱导单核细胞株Raw 264.7凋亡。结论:PBMC凋亡在严重烧伤的免疫功能紊乱方面起重要作用,而bcl-2基因下调可能是重症烧伤早期PBMC细胞凋亡的分子机制之一;烧伤血清含有(或缺乏)某种物质,可以介导细胞凋亡。
, 百拇医药
Apoptosis of peripheral blood mononuclear cells in the early stage of severe burns in rats
ZHANG Lu,ZHAO Ke-Sen,ZHANG Lin,TAN Xiao-Hua
Key Lab for Shock and Microcirculation Research of PLA,The First Military Medical University, Guangzhou (510515)
Abstract AIM:To investigate the apoptosis and its alteration rule, molecular mechanism of peripheral blood mononuclear cells(PBMC) from severe burn rats. METHODS:The apoptosis of circulating PBMC ,monocytic cell Raw264.7 cultured in 10% burn serum and bcl-2 gene expression was detected by flow cytometric cell cycle analysis and DNA electrophoresis. RESULTS: Six hours after burn PBMC displayed characteristic apoptosis .Furthermore,the expression of bcl-2 gene was decreased effectively. Serum from burned rats can induce apoptosis in Raw264.7. CONCLUSIONS: Apoptosis may play a major role in thermal injury-related immunodeficiency.The decrease of bcl-2 protein might be one of the molecular mechanisms of apoptosis,and some humoral factor(s) in burn serum may play a role in the induction of apoptosis in Raw264.7 cell.
, 百拇医药
MeSH Burns; Monocytes; Gene expression
近年来,白细胞在重症烧伤发生发展中的细胞机理受到越来越多的重视。细胞凋亡是细胞接受某些信号或受到某些因素刺激后一种主动的由基因调控的细胞消亡过程,是机体维持内环境所必需的。有关细胞凋亡在胚胎发育、肿瘤、免疫缺陷等发生发展中的作用已有诸多报道[1,2],但细胞凋亡是否参与严重烧伤的发生发展,及在其中的作用如何尚不清楚。为进一步探讨烧伤发生发展的细胞机理,本研究复制大鼠重症烧伤模型,观察外周血单个核细胞(peripheral blood mononuclear cells,PBMC)的凋亡发生状况,并初步探讨了其发生机制。
材料与方法
(一) 动物模型:Wistar大鼠24只,雄性,体重190~230 g,随机分为正常组及烧伤组(n=12),用13.3%乌拉坦+1%氯醛糖麻醉动物(0.6 mL/100 g iP)。一侧颈动脉管插入PE50聚乙烯导管,用以放血。用我室常规方法[3],复制重症烧伤模型。正常对照组除不烧伤外,其余处理与烧伤相同。各组动物于伤后不同时间点(3 h,6 h,9 h,12 h,24 h)取血,回输等量生理盐水,使动物存活。
, 百拇医药
(二) 外周血单个核细胞悬液的制备:按文献方法[4]制备外周血单个核细胞(PBMC)。
(三) 体外细胞培养实验:将1×106的细胞接种在含5%小牛血清的DMEM培养液中培养(37℃,5% CO2)。采取烧伤后12 h大鼠的颈动脉血液,无菌分离血清,按20%比例与DMEM培养液混合,-20℃保存,另取正常大鼠颈动脉血液作对照。分别用含10%烧伤血清及正常大鼠血清的培养液孵育单核细胞株Raw 264.7细胞,于不同时点(3 h,6 h,12 h,18 h,24 h)收集细胞。单核细胞株R264.7细胞由美国Sripps研究所惠赠。
(四) 流式细胞仪检测细胞凋亡:按文献[5]方法进行。
(五) 流式细胞仪检测bcl-2蛋白表达:将正常PBMC及烧伤后6 h与12 h收集的细胞于4℃,1%多聚甲醛固定15 min,PBS清洗,加入羊血清封闭10 min,加入鼠抗人bcl-2单抗,37℃孵育30 min,PBS清洗,加入羊抗鼠IgG-FITC,黑暗中37℃孵育30 min。Elite流式细胞仪检测。
, http://www.100md.com
(六) DNA凝胶电泳:用快速法[4]抽提细胞DNA片段,进行1.5%琼脂糖凝胶电泳。
(七)统计学分析:实验数据以均数±标准差(
结果
(一) 细胞凋亡检测结果:应用流式细胞仪分析细胞DNA含量,结果显示典型的凋亡细胞群特征:DNA含量低于G1期细胞,出现亚二倍体峰(见图1)。重症烧伤组在烧伤后6 h PBMC凋亡率明显增高(P<0.01),约为对照组4倍,并且随时间推移凋亡率逐渐增加,伤后12 h约为对照组的6倍,此后维持于平台阶段,24 h后仍是对照组的6倍左右。(见表1)。进一步,用琼脂糖凝胶电泳检测显示,烫伤后12h,大鼠单个核细胞的DNA电泳出现明显的阶梯状条带,而对照DNA电泳未发现阶梯状条带(见图2)。
, 百拇医药
表1 烧伤后PBMC凋亡发生率的变化
Tab 1 Changes in incidence of apoptosis on PBMC after sever burn(
Group
n
Hours after burn
0
3
6
12
, 百拇医药
24
Control
12
4.8±0.8
Burn
12
6.9±1.2
19.6±3.2**
25.8±3.5**
27.2±2.8**
** P<0.01,vs control



, 百拇医药
Fig 1 Flow cytometry analysis of PBMC from control group(A) and severe burn rats after 3(B),6(C),9(D),12(E),24(F)hours .The vertical axis indicates cell number and the horizontal axis reprents red fluorescense intensity.The percentage of nonviable(PI+)cells is indicated 图1 流式细胞仪检测烧伤大鼠PBMC凋亡
表2 烧伤血清对Raw264.7细胞凋亡的影响
Tab 2 Effect of burn serum on the apoptosis of Raw264.7 (
, 百拇医药
Serum
n
Hours of culture
0
6
12
18
24
Normal
3
3.5±0.8
3.8±0.5
4.5±1.2
, 百拇医药
5.2±0.5
6.5±0.8
Burn
3
5.8±1.2
18.0±1.9**
23.2±3.2**
32.3±2.8**
** P<0.01,vs control
Fig 2 Agarose gel electrophoresis of PBMC DNA from rat after severe burns. Lane 1:PBMC DNA 12 hours after burn; Lane 2:PBMC DNA 24 hours after burn; Lane 3:control PBMC DNA; Lane 4:λDNA/HindIII+EcoRI
, 百拇医药
图2 烧伤大鼠PBMC DNA凝胶电泳图谱
(二) Bcl-2蛋白表达:流式细胞仪检测显示正常大鼠PBMC细胞稳定表达bcl-2,其bcl-2阳性表达细胞荧光强度百分率为62.5%±2.8%(FITC的荧光值表示bcl-2蛋白含量的多少);烧伤后bcl-2表达进行性下调,6 h为51.2%±2.6%(P<0.05),12 h后为41.5%±2.2% (P<0.01)。
(三) 烧伤血清对Raw264.7细胞凋亡的影响:用10%的烧伤血清刺激Raw264.7细胞,流式细胞仪检测显示12 h后其凋亡百分率明显增高,约为正常血清组的6倍(P<0.01),此后随时间的推移逐渐增高(表2)。
讨论
细胞凋亡是机体为维持内环境稳定,由基因控制的细胞自主的有序的死亡。业已知道,重症烧伤后机体易出现细胞、免疫功能紊乱[6]。已查明烧伤和创伤以后出现了白细胞功能不全(dysfunction),表现为它的趋化性、吞噬力、产生超氧阴离子和过氧化氢能力、及杀减细菌能力均减弱,导致机体免疫力下降和容易发生感染[7,8]。迄今为止,关于细胞凋亡在烧伤发生发展中的作用已有诸多研究。外周血单个核细胞包括淋巴细胞、单核细胞及NK细胞,可产生IL-2、IL-6、TNF等多种细胞因子,是机体重要的免疫细胞。目前,关于PBMC凋亡在烧伤发生发展中作用的研究鲜有报道。本研究采用流式细胞仪,DNA凝胶电泳技术观察到烧伤早期(6 h)PBMC即出现明显的细胞凋亡,由烧伤前的4.8%±1.2%增加为19.6%±3.2%(P<0.01),增加4倍左右,随烧伤时相的推延,PBMC凋亡率逐渐增加,伤后12小时约为对照组的6倍,此后维持于平台阶段。这提示细胞凋亡在严重烧伤的免疫功能紊乱方面起重要作用。
, http://www.100md.com
细胞凋亡是一种主动的受基因调控的细胞自杀过程。多种基因如bcl-2、 P53、c-myc、bax、bad等参与凋亡的调控。其中 bcl-2尤为重要,它被认为是细胞凋亡调控的最后通路之一。Bcl-2的抗凋亡机制尚未完全阐明,但新近的资料提示bcl-2能与几种bcl-2相关蛋白形成异二聚体[9],介导细胞凋亡。本实验发现正常PBMC细胞稳定表达bcl-2,烧伤后6 h起bcl-2表达进行性下调(P<0.01),bcl-2基因表达下调可能是重症烧伤早期大鼠PBMC细胞凋亡显著增加的分子机制之一。
业已证明,烧伤后血液中肿瘤坏死因子、白介素等多种细胞因子和神经内分泌介质增多。已知某些体液因子参与细胞凋亡的发生,如IL-6对野生型P53介导的细胞凋亡有抑制作用;糖皮质激素对淋巴细胞凋亡有诱导作用;而IL-4对氢化可的松介导的淋巴细胞性白血病细胞凋亡有抑制作用。烧伤血清含有烧伤后多种体液因子,本研究应用烧伤血清刺激单核细胞株Raw264.7,观察到12 后Raw264.7细胞凋亡率明显增高(P<0.01),这提示烧伤血清中含有(或缺乏)某种物质,可以介导PBMC凋亡,但这些物质的生物学本质和它们通过哪些基因带来PBMC凋亡,尚需进一步研究。
, http://www.100md.com
参考文献
1 Cummings MC,Winterford CM,Walker NI.Apoptosis.The Am J Surg Pathol,1997,21:88.
2 Hale AJ,Smith CA,Sutherland LC,et al.Apoptosis:molecular regulation of cell death.Eur J Biochem,1996,236:1.
3 赵克森,朱佐江,吴坤莹.虎杖4号增强烧伤休克早期心功能的效应.中华整形烧伤外科杂志,1989,5:275.
4 Chitnis D,Dickerson C,Munster AM,et al.Inhibition of apoptosis in polymorphonuclear neutrophils from burn patients.J Leukocyte Biol,1996,59:835.
, 百拇医药
5 张亚历,姜 泊,周殿元.程序化细胞死亡常用研究方法.见:姜泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京:人民军医出版社,1996.176.
6 Maldonado MD,Venturoli A,Franco A,et al.Specific changes in peripheral blood lymphocyte phenotype from burn patients probable origin of the thermal injury-related lymphocytopenia.Burns,1991,17:188.
7 Mozingo DW,Pruitt Jr BA.Infectious complications after burn injury. Current Opinion in Surgical Infections,1994,2:69.
8 Cioffi WG,Burleson DG,Pruitt Jr BA.Leukocyte responses to injury.Arch Surg,1993,128:1260.
9 Reed JC.Bcl-2 and the regulation of programmed cell death.J Cell Biol,1993,75:241.
1998年8月5日收稿,1998年12月15日修回, 百拇医药