高原低氧对大鼠下丘脑生长抑素和γ-氨基丁酸含量的影响
作者:阮怀珍 范晓棠 张金海 袁碧波 吴喜贵
单位:(第三军医大学神经生物学教研室,重庆 400038)
关键词:高海拔;低氧; 生长抑素;RNA,信使;氨基丁酸类
中国病理生理杂志000104
[摘 要] 目的: 观察高原低氧大鼠下丘脑前生长抑素原(PPS)mRNA和γ-氨基丁酸(GABA)含量变化。方法: 应用大鼠高原低氧模型及原位杂交技术和氨基酸测定法, 检测下丘脑前PPS-mRNA神经元数量和GABA的含量。结果: 高原低氧组大鼠下丘脑GABA的含量明显增多,室周核、室旁核、弓状核PPS-mRNA阳性神经元数目增加; 而GABA受体拮抗剂荷包牡丹碱使高原低氧大鼠下丘脑PPS-mRNA阳性神经元数目增多更为显著, 但对GABA含量的增加影响不大。结论:高原低氧可导致下丘脑神经递质代谢紊乱。
, 百拇医药
[中图分类号] Q 459 [文献标识码] A
[文章编号]1000-4718(2000)01-0017-03
Effect of altitude hypoxia on somatostatin and γ-aminobutyric acid content of rat hypothalamus
RUAN Huai-zhen, FAN Xiao-tang, ZHANG Jin-hai, YUAN Bi-bo, WU Xi-gui
(Department of Neurobiology, Third Military Medical University, Chongqing 400038,China)
[Abstract] AIM:To observe the effect of altitude hypoxia on γ-aminobutyric (GABA) content and prepro-somatostatin mRNA (PPS-mRNA) in the rat hypothalamus. METHODS: Using altitude hypoxia model,in situ hybridization and amino acid analyzer, the number of PPS-mRNA and GABA content in rat hypothalamus was determined. RESULTS:After altitude hypoxia, the contents of GABA in hypothalamus and the number of PPS-mRNA neurons in periventricular nucleus (PeVN), paraventricular nucleus (PaVN) and arcuate nucleus (ArcN) increased significiantly. Bicuculline, a GABA receptor antagonits, could enhance PPS-mRNA expression evoked by altitude hypoxia, but had no effect on GABA content. CONCLUSION: Altitude hypoxia can induce neurotransmitter imbalance of hypothalamus.
, 百拇医药
[MeSH] Altitude; Anoxia; Somatostatin; RNA, messenger; Aminobutyric acids
生长抑素(somatostatin, SOM)不仅是下丘脑分泌的一种调节性多肽,而且是一种作用广泛、功效很强的神经递质或神经调节物,&127;它参与了机体多种生理功能的活动和调节。下丘脑SOM神经元还接受γ-氨基丁酸 (γ-aminobutyric acid, GABA )末梢的支配[1],它们之间的关系一般是相互抑制其释放或相互抑制其功能[2]。 但是在高原低氧环境中, 下丘脑GABA与SOM的变化及关系,尚不清楚。本文应用原位杂交技术和氨基酸测定法研究高原低氧大鼠下丘脑内PPS-mRNA的表达和GABA含量的变化。
材 料 和 方 法
(一)动物模型及分组: 实验用SD大鼠77只,体重为150~200 g, 雌雄不拘。随机分为正常对照组(室温常氧)、低氧1, 3, 7 d组及荷苞牡丹碱(bicuculline, Bic)+ 低氧1,3,7 d组(每组11只,5只进行原位杂交染色,6只进行GABA含量测定),将大鼠置于模拟海拔6000 m的低压舱内(舱内温度为4℃), 每天6h。
, 百拇医药
(二) GABA的提取及含量测定:大鼠断头,迅速取出下丘脑,精确称重。置样品于冰镇玻管中,加入10%磺基水杨酸(1 mL),冰浴下以玻璃匀浆器手动匀浆并离心(4 ℃,15 000 r/min, 30 min),取上清液50 μL,用美国Beckman-6300黄金系列高效氨基酸分析仪检测GABA的含量。分析条件如下:柱高10 cm,柱温77 ℃,锂缓冲液(Li-F),茚三酮的流速为10 mL/h,比色波长为570 nm。
(三) 前生长抑素原mRNA原位杂交法: 实验毕, 按常规进行大鼠脑组织灌流, 固定,取出下丘脑,行冠状连续切片(35 μm), 然后以地高辛标记的反义cRNA探针(400 bp)按文献[3]叙述步骤进行原位杂交前、杂交和杂交后处理(杂交过程中的温度是恒度的,不需要调节)。抗地高辛抗体工作浓度为1∶1000, 以NBT/BCIP (400 μg.mL-1/200 μg.mL-1)反应液显色。对照实验包括用2 μg/mg RNA酶A预处理切片30 min和用不含探针杂交缓冲液杂交,结果均检测不到明显的杂交信号。在每一动物下丘脑不同核团随机抽样4片,经图像分析仪,作阳性细胞计数(整个核团), 取均数作为该动物的PPS-mRNA数。
, 百拇医药
(四)数据处理:数据以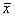 ±s表示,用电子计算机经双样本t检验程序(PDA-2)进行处理。
±s表示,用电子计算机经双样本t检验程序(PDA-2)进行处理。
结 果
(一) 高原低氧对大鼠下丘脑GABA含量的影响: 由表1可见,下丘脑GABA的含量在高原低氧第1 d即开始增加, 3 d和7 d组均明显多于对照组(P<0.01)。每天进舱前腹腔注射GABA受体拮抗剂荷包牡丹碱( Bic, 1.5 mg/kg),观察到与同一时间单纯低氧组比较,大鼠下丘脑GABA含量变化不大。
(二) 高原低氧对大鼠下丘脑PPS-mRNA的影响 :大鼠下丘脑室周核(periventricular nucleus, PeVN), 室旁核(paraventricular nucleus, PaVN), 弓状核(arcuate nucleus,ArcN) PPS-mRNA阳性神经元数目在低氧的第1 d即开始增加, 3 d和7 d组仍很明显(表2; 图1a,b)。每天进舱前腹腔注射GABA受体拮抗剂荷包牡丹碱(Bic, 1.5 mg/kg),观察到与同一时间单纯低氧组比较, 大鼠下丘脑PPS-mRNA阳性神经元数目显著增加(P<0.01, 表2; 图1c)。
, http://www.100md.com
表1 高原低氧对大鼠下丘脑GABA含量的影响
Tab 1 Effects of altitude hypoxia on GABA content
in rat hypothalamus (μmol/g,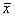 ±s,n=6) Group
±s,n=6) Group
GABA contents
Control
4.16±0.26
1 d
4.97±0.36*
, http://www.100md.com 3 d
5.22±0.33**
7 d
5.92±0.47**
Bic+1 d
5.13±0.21**
Bic+3 d
5.43±0.35**
Bic+7 d
6.05±0.51**
P<0.05, ** P<0.01, vs control group
, 百拇医药
Bic=bicuculline表2 高原低氧对大鼠下丘脑PPS-mRNA神经元数目的影响
Tab 2 Effects of altitude hypoxia on number of PPS-mRNA
neurons in rat hypothalamus (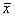 ±s,n=5) Group
±s,n=5) Group
PeVN
PaVN
ArcN
Control
22.3±1.5
, http://www.100md.com 15.0±2.7
12.1±0.9
1 d
56.5±3.1**
40.0±2.5**
21.5±2.2**
3 d
58.0±2.9**
41.2±3.1**
19.7±2.8**
, 百拇医药 7 d
59.2±1.5**
39.9±2.7**
24.0±1.5**
Bic+1 d
72.2±3.2△△
63.5±2.4△△
33.5±4.4△△
Bic+3 d
74.3±4.5##
, http://www.100md.com
62.0±4.5##
32.0±3.9##
Bic+7 d
77.5±5.0▲▲
59.8±5.2▲▲
37.5±3.2▲▲
**P<0.01,vs control group; △△P<0.01,vs 1 d group;
##P<0.01, vs 3 d group; ▲▲ P<0.01, vs 7 d group讨 论
下丘脑作为神经内分泌和自主神经调节的中枢,调控着多种生理功能和生命过程,研究发现,低氧可影响下丘脑TRHmRNA, CRFmRNA和AVPmRNA的表达[4]。SOM也是下丘脑分泌的一种调节性多肽,它参与了机体多种生理功能的活动和调节,是一种作用广泛的神经递质或神经调节物。大鼠下丘脑正中隆起的SOM可受各种刺激而发生快速反应性释放增加[5]。本文应用高原低氧模型,观察到下丘脑室周核,室旁核,弓状核PPS-mRNA阳性神经元数目在高原低氧的第1 d即开始增加,3 d和7 d组仍明显, 证实了高原低氧可增加下丘脑神经递质的含量。
, 百拇医药
a.PPS-mRNA neurons in periventricular nucleus were very sparse in control group (×100)
b.After altitude hypoxia, PPS-mRNA neurous in periventricular nucleus were densely labeled (7 d,×100)
c.ip bicuculine, PPS-mRNA neurous in periventricular nucleus were increased after altitude hypoxia (7 d,×100)
, http://www.100md.com Fig 1(a,b,c) Photomicrograph of PPS-mRNA neurons in the rat hypothalamus
图1(a,b,c) 大鼠下丘脑PPS-mRNA阳性神经元显微照相
低氧及缺氧缺血可致中枢神经系统神经递质代谢紊乱, 使脑内兴奋性和抑制性氨基酸增多[6,7], 两者相互作用共同调节SOM的释放。我们的研究得到了类似的结果,观察到下丘脑GABA含量在间断低氧1 d, 3 d, 7 d均显著提高。据报道, 谷氨酸可通过NMDA受体来调节SOM 的释放, 在下丘脑神经元的培养中发现, 孵育介质中Glu的大量释放可导致SOM的大量释放, 而培养液中GABA浓度升高,谷氨酸引起的SOM释放呈剂量依赖性减少[8]。我们的研究发现高原低氧使下丘脑PPS-mRNA阳性神经元数目增多,说明兴奋性和抑制性氨基酸的比例失调。GABA是中枢神经系统的主要抑制性神经递质, 形态学研究发现, 下丘脑的室周区可见GABA能神经末梢支配SOM分泌神经元[1,9],这些解剖的联系支持GABA与SOM必然存在功能上的联系。通过离体和在体实验证实, GABA对下丘脑SOM的释放有内源性抑制作用,GABA的内源性抑制作用可被荷包牡丹碱和印防己毒素(picrotoxin)两种GABAA受体拮抗剂所逆转,说明GABA对SOM释放的抑制作用是通过GABA受体介导的[10]。我们在实验中发现,荷包牡丹碱虽然不影响高原低氧引起的大鼠下丘脑GABA含量增多, 但由于阻断了GABA受体, 使GABA 对SOM的抑制作用减弱, 故下丘脑PPS-mRNA阳性神经元数目增多更显著, 证明GABA是通过其受体来抑制SOM的转录,合成和释放。目前, 尽管对低氧时脑内 SOM含量增多的机制还不甚清楚, 但正是由于兴奋性和抑制性氨基酸的比例失调,使SOM合成,释放增加。
, 百拇医药
[基金项目] 国家自然科学基金资助(No. 39670283)
[参 考 文 献]
[1] 陈宜张. 记第31届国际生理科学大会有关神经内分泌领域的报道[J]. 生理科学进展,1989,20:374~376.
[2] Vasko MR, Harris V. Gamma-aminobutyric acid inhibits the potassium-stimulated release of somatostatin from rat spinal cord slices [J]. Brain Res, 1990,507:129~137.
[3] 阮怀珍, 李希成, 蔡文琴. P物质及福尔马林增强前生长抑素原mRNA在大鼠脊髓的表达 [J]. 中国神经科学杂志, 1998,14(2):105~108.
, 百拇医药
[4] 杜继增. 低氧影响下丘脑神经肽mRNA表达 [J]. 中国科学院低氧生理开放研究实验室年报(1991-1993), 1994. 330.
[5] Aguila MC, Pickle RL, Yu WH, et al. Roles of somatostatin and growth hormone-releasing factor in ether stress inhibition of growth hormone release [J]. Neuroendocrinology, 1991,54(5):515~502.
[6] Krajnc D, Neff NH, Hadjiconstantinou M. Glutamate,glutamine and glutamine synthetase in the neonatal rat brain following hypoxia [J]. Brain Res,1996, 707: 134~137.
, http://www.100md.com
[7] Fukushima R, Yoshida Y, Chiba S. Long-term effects of postnatal hypoxia on monoamine and amino acid levels in the rat brain [J]. Yakubutsu Seishin Kodo, 1990,10:335~342.
[8] Rage F, Benyassi A, Arancibia S, et al. Gamma-aminobutyric acid-glutamate interaction in the control of somatostatin release from hypothalamic neurons in primary culture: in vivo corroboration [J]. Endocrinology, 1992,130:1056~1062.
[9] Kakucska I, Tappaz ML, Gaal G, et al. GABA ergic innervation of somatostatin-containng neurosecretory cells of the anterior periventricular hypothalamic area: a light and electron microscopy double immunolabeling study [J]. Neuroscience, 1988, 25:585~593.
[10] Arancibia S,Briozzo P. Peripheral administration of picrotoxin and bicuculline stimulates in vivo somatostatin release from rat median eminence [J]. Neurosci Lett, 1990,111:211~216.
[收稿日期]1998-10-20 [修回日期]1999-03-10
, 百拇医药
单位:(第三军医大学神经生物学教研室,重庆 400038)
关键词:高海拔;低氧; 生长抑素;RNA,信使;氨基丁酸类
中国病理生理杂志000104
[摘 要] 目的: 观察高原低氧大鼠下丘脑前生长抑素原(PPS)mRNA和γ-氨基丁酸(GABA)含量变化。方法: 应用大鼠高原低氧模型及原位杂交技术和氨基酸测定法, 检测下丘脑前PPS-mRNA神经元数量和GABA的含量。结果: 高原低氧组大鼠下丘脑GABA的含量明显增多,室周核、室旁核、弓状核PPS-mRNA阳性神经元数目增加; 而GABA受体拮抗剂荷包牡丹碱使高原低氧大鼠下丘脑PPS-mRNA阳性神经元数目增多更为显著, 但对GABA含量的增加影响不大。结论:高原低氧可导致下丘脑神经递质代谢紊乱。
, 百拇医药
[中图分类号] Q 459 [文献标识码] A
[文章编号]1000-4718(2000)01-0017-03
Effect of altitude hypoxia on somatostatin and γ-aminobutyric acid content of rat hypothalamus
RUAN Huai-zhen, FAN Xiao-tang, ZHANG Jin-hai, YUAN Bi-bo, WU Xi-gui
(Department of Neurobiology, Third Military Medical University, Chongqing 400038,China)
[Abstract] AIM:To observe the effect of altitude hypoxia on γ-aminobutyric (GABA) content and prepro-somatostatin mRNA (PPS-mRNA) in the rat hypothalamus. METHODS: Using altitude hypoxia model,in situ hybridization and amino acid analyzer, the number of PPS-mRNA and GABA content in rat hypothalamus was determined. RESULTS:After altitude hypoxia, the contents of GABA in hypothalamus and the number of PPS-mRNA neurons in periventricular nucleus (PeVN), paraventricular nucleus (PaVN) and arcuate nucleus (ArcN) increased significiantly. Bicuculline, a GABA receptor antagonits, could enhance PPS-mRNA expression evoked by altitude hypoxia, but had no effect on GABA content. CONCLUSION: Altitude hypoxia can induce neurotransmitter imbalance of hypothalamus.
, 百拇医药
[MeSH] Altitude; Anoxia; Somatostatin; RNA, messenger; Aminobutyric acids
生长抑素(somatostatin, SOM)不仅是下丘脑分泌的一种调节性多肽,而且是一种作用广泛、功效很强的神经递质或神经调节物,&127;它参与了机体多种生理功能的活动和调节。下丘脑SOM神经元还接受γ-氨基丁酸 (γ-aminobutyric acid, GABA )末梢的支配[1],它们之间的关系一般是相互抑制其释放或相互抑制其功能[2]。 但是在高原低氧环境中, 下丘脑GABA与SOM的变化及关系,尚不清楚。本文应用原位杂交技术和氨基酸测定法研究高原低氧大鼠下丘脑内PPS-mRNA的表达和GABA含量的变化。
材 料 和 方 法
(一)动物模型及分组: 实验用SD大鼠77只,体重为150~200 g, 雌雄不拘。随机分为正常对照组(室温常氧)、低氧1, 3, 7 d组及荷苞牡丹碱(bicuculline, Bic)+ 低氧1,3,7 d组(每组11只,5只进行原位杂交染色,6只进行GABA含量测定),将大鼠置于模拟海拔6000 m的低压舱内(舱内温度为4℃), 每天6h。
, 百拇医药
(二) GABA的提取及含量测定:大鼠断头,迅速取出下丘脑,精确称重。置样品于冰镇玻管中,加入10%磺基水杨酸(1 mL),冰浴下以玻璃匀浆器手动匀浆并离心(4 ℃,15 000 r/min, 30 min),取上清液50 μL,用美国Beckman-6300黄金系列高效氨基酸分析仪检测GABA的含量。分析条件如下:柱高10 cm,柱温77 ℃,锂缓冲液(Li-F),茚三酮的流速为10 mL/h,比色波长为570 nm。
(三) 前生长抑素原mRNA原位杂交法: 实验毕, 按常规进行大鼠脑组织灌流, 固定,取出下丘脑,行冠状连续切片(35 μm), 然后以地高辛标记的反义cRNA探针(400 bp)按文献[3]叙述步骤进行原位杂交前、杂交和杂交后处理(杂交过程中的温度是恒度的,不需要调节)。抗地高辛抗体工作浓度为1∶1000, 以NBT/BCIP (400 μg.mL-1/200 μg.mL-1)反应液显色。对照实验包括用2 μg/mg RNA酶A预处理切片30 min和用不含探针杂交缓冲液杂交,结果均检测不到明显的杂交信号。在每一动物下丘脑不同核团随机抽样4片,经图像分析仪,作阳性细胞计数(整个核团), 取均数作为该动物的PPS-mRNA数。
, 百拇医药
(四)数据处理:数据以
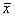 ±s表示,用电子计算机经双样本t检验程序(PDA-2)进行处理。
±s表示,用电子计算机经双样本t检验程序(PDA-2)进行处理。结 果
(一) 高原低氧对大鼠下丘脑GABA含量的影响: 由表1可见,下丘脑GABA的含量在高原低氧第1 d即开始增加, 3 d和7 d组均明显多于对照组(P<0.01)。每天进舱前腹腔注射GABA受体拮抗剂荷包牡丹碱( Bic, 1.5 mg/kg),观察到与同一时间单纯低氧组比较,大鼠下丘脑GABA含量变化不大。
(二) 高原低氧对大鼠下丘脑PPS-mRNA的影响 :大鼠下丘脑室周核(periventricular nucleus, PeVN), 室旁核(paraventricular nucleus, PaVN), 弓状核(arcuate nucleus,ArcN) PPS-mRNA阳性神经元数目在低氧的第1 d即开始增加, 3 d和7 d组仍很明显(表2; 图1a,b)。每天进舱前腹腔注射GABA受体拮抗剂荷包牡丹碱(Bic, 1.5 mg/kg),观察到与同一时间单纯低氧组比较, 大鼠下丘脑PPS-mRNA阳性神经元数目显著增加(P<0.01, 表2; 图1c)。
, http://www.100md.com
表1 高原低氧对大鼠下丘脑GABA含量的影响
Tab 1 Effects of altitude hypoxia on GABA content
in rat hypothalamus (μmol/g,
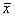 ±s,n=6) Group
±s,n=6) GroupGABA contents
Control
4.16±0.26
1 d
4.97±0.36*
, http://www.100md.com 3 d
5.22±0.33**
7 d
5.92±0.47**
Bic+1 d
5.13±0.21**
Bic+3 d
5.43±0.35**
Bic+7 d
6.05±0.51**
P<0.05, ** P<0.01, vs control group
, 百拇医药
Bic=bicuculline表2 高原低氧对大鼠下丘脑PPS-mRNA神经元数目的影响
Tab 2 Effects of altitude hypoxia on number of PPS-mRNA
neurons in rat hypothalamus (
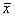 ±s,n=5) Group
±s,n=5) GroupPeVN
PaVN
ArcN
Control
22.3±1.5
, http://www.100md.com 15.0±2.7
12.1±0.9
1 d
56.5±3.1**
40.0±2.5**
21.5±2.2**
3 d
58.0±2.9**
41.2±3.1**
19.7±2.8**
, 百拇医药 7 d
59.2±1.5**
39.9±2.7**
24.0±1.5**
Bic+1 d
72.2±3.2△△
63.5±2.4△△
33.5±4.4△△
Bic+3 d
74.3±4.5##
, http://www.100md.com
62.0±4.5##
32.0±3.9##
Bic+7 d
77.5±5.0▲▲
59.8±5.2▲▲
37.5±3.2▲▲
**P<0.01,vs control group; △△P<0.01,vs 1 d group;
##P<0.01, vs 3 d group; ▲▲ P<0.01, vs 7 d group讨 论
下丘脑作为神经内分泌和自主神经调节的中枢,调控着多种生理功能和生命过程,研究发现,低氧可影响下丘脑TRHmRNA, CRFmRNA和AVPmRNA的表达[4]。SOM也是下丘脑分泌的一种调节性多肽,它参与了机体多种生理功能的活动和调节,是一种作用广泛的神经递质或神经调节物。大鼠下丘脑正中隆起的SOM可受各种刺激而发生快速反应性释放增加[5]。本文应用高原低氧模型,观察到下丘脑室周核,室旁核,弓状核PPS-mRNA阳性神经元数目在高原低氧的第1 d即开始增加,3 d和7 d组仍明显, 证实了高原低氧可增加下丘脑神经递质的含量。

, 百拇医药
a.PPS-mRNA neurons in periventricular nucleus were very sparse in control group (×100)

b.After altitude hypoxia, PPS-mRNA neurous in periventricular nucleus were densely labeled (7 d,×100)

c.ip bicuculine, PPS-mRNA neurous in periventricular nucleus were increased after altitude hypoxia (7 d,×100)
, http://www.100md.com Fig 1(a,b,c) Photomicrograph of PPS-mRNA neurons in the rat hypothalamus
图1(a,b,c) 大鼠下丘脑PPS-mRNA阳性神经元显微照相
低氧及缺氧缺血可致中枢神经系统神经递质代谢紊乱, 使脑内兴奋性和抑制性氨基酸增多[6,7], 两者相互作用共同调节SOM的释放。我们的研究得到了类似的结果,观察到下丘脑GABA含量在间断低氧1 d, 3 d, 7 d均显著提高。据报道, 谷氨酸可通过NMDA受体来调节SOM 的释放, 在下丘脑神经元的培养中发现, 孵育介质中Glu的大量释放可导致SOM的大量释放, 而培养液中GABA浓度升高,谷氨酸引起的SOM释放呈剂量依赖性减少[8]。我们的研究发现高原低氧使下丘脑PPS-mRNA阳性神经元数目增多,说明兴奋性和抑制性氨基酸的比例失调。GABA是中枢神经系统的主要抑制性神经递质, 形态学研究发现, 下丘脑的室周区可见GABA能神经末梢支配SOM分泌神经元[1,9],这些解剖的联系支持GABA与SOM必然存在功能上的联系。通过离体和在体实验证实, GABA对下丘脑SOM的释放有内源性抑制作用,GABA的内源性抑制作用可被荷包牡丹碱和印防己毒素(picrotoxin)两种GABAA受体拮抗剂所逆转,说明GABA对SOM释放的抑制作用是通过GABA受体介导的[10]。我们在实验中发现,荷包牡丹碱虽然不影响高原低氧引起的大鼠下丘脑GABA含量增多, 但由于阻断了GABA受体, 使GABA 对SOM的抑制作用减弱, 故下丘脑PPS-mRNA阳性神经元数目增多更显著, 证明GABA是通过其受体来抑制SOM的转录,合成和释放。目前, 尽管对低氧时脑内 SOM含量增多的机制还不甚清楚, 但正是由于兴奋性和抑制性氨基酸的比例失调,使SOM合成,释放增加。
, 百拇医药
[基金项目] 国家自然科学基金资助(No. 39670283)
[参 考 文 献]
[1] 陈宜张. 记第31届国际生理科学大会有关神经内分泌领域的报道[J]. 生理科学进展,1989,20:374~376.
[2] Vasko MR, Harris V. Gamma-aminobutyric acid inhibits the potassium-stimulated release of somatostatin from rat spinal cord slices [J]. Brain Res, 1990,507:129~137.
[3] 阮怀珍, 李希成, 蔡文琴. P物质及福尔马林增强前生长抑素原mRNA在大鼠脊髓的表达 [J]. 中国神经科学杂志, 1998,14(2):105~108.
, 百拇医药
[4] 杜继增. 低氧影响下丘脑神经肽mRNA表达 [J]. 中国科学院低氧生理开放研究实验室年报(1991-1993), 1994. 330.
[5] Aguila MC, Pickle RL, Yu WH, et al. Roles of somatostatin and growth hormone-releasing factor in ether stress inhibition of growth hormone release [J]. Neuroendocrinology, 1991,54(5):515~502.
[6] Krajnc D, Neff NH, Hadjiconstantinou M. Glutamate,glutamine and glutamine synthetase in the neonatal rat brain following hypoxia [J]. Brain Res,1996, 707: 134~137.
, http://www.100md.com
[7] Fukushima R, Yoshida Y, Chiba S. Long-term effects of postnatal hypoxia on monoamine and amino acid levels in the rat brain [J]. Yakubutsu Seishin Kodo, 1990,10:335~342.
[8] Rage F, Benyassi A, Arancibia S, et al. Gamma-aminobutyric acid-glutamate interaction in the control of somatostatin release from hypothalamic neurons in primary culture: in vivo corroboration [J]. Endocrinology, 1992,130:1056~1062.
[9] Kakucska I, Tappaz ML, Gaal G, et al. GABA ergic innervation of somatostatin-containng neurosecretory cells of the anterior periventricular hypothalamic area: a light and electron microscopy double immunolabeling study [J]. Neuroscience, 1988, 25:585~593.
[10] Arancibia S,Briozzo P. Peripheral administration of picrotoxin and bicuculline stimulates in vivo somatostatin release from rat median eminence [J]. Neurosci Lett, 1990,111:211~216.
[收稿日期]1998-10-20 [修回日期]1999-03-10
, 百拇医药