脂多糖、白细胞介素-6、肿瘤坏死因子α对乳鼠星形胶质细胞表达组织因子的影响
作者:朱发明 文志斌 熊石龙 李俊成 贺石林
单位:朱发明(浙江省血液中心,浙江 杭州 310020);文志斌 熊石龙 李俊成 贺石林(湖南医科大学生理教研室, 湖南 长沙 410078)
关键词:星形细胞;凝血致活酶;白细胞介素-6;脂多糖类;肿瘤坏死因子
中国病理生理杂志000219
[摘 要] 目的:观察脂多糖、白介素-6和肿瘤坏死因子α对大鼠星形胶质细胞组织因子活性表达的影响。方法:培养Wistar乳鼠星形胶质细胞,细胞用抗神经胶质纤维酸性蛋白单克隆抗体确认。细胞冻融液组织因子活性检测采用一期血浆复钙时间法。结果:脂多糖、白介素-6和肿瘤坏死因子α组星形胶质细胞表达组织因子活性明显高于对照组(P<0.05)。脂多糖、白介素-6和肿瘤坏死因子α与三氟吡啦嗪(TFP)或1-(5-异喹啉磺胺)-3-甲基哌嗪(H7)联合运用,则它们的刺激作用受到明显抑制。结论:脂多糖、白介素-6、肿瘤坏死因子能刺激星形胶质细胞表达组织因子活性,其机制可能与钙/钙调素和蛋白激酶C途径有关。
, http://www.100md.com
[中图分类号] Q189 [文献标识码] A
[文章编号] 1000-4718(2000)02-0163-04
Effects of lipopolysaccharide,IL-6 and TNFα on the tissue factor expression of astrocytes
WEN Zhi-bin, HE Xiao-fan, LI Jun-cheng, HE Shi-lin
(Department of Physiology, Hunan Medical University, Changsha 410078)
ZHU Fa-ming
(Blood Centre of Zhejiang Province, Hangzhou 310020, China)
, 百拇医药
[Abstract] AIM:To study the effects of lipopolysaccharide(LPS), interleukin-6(IL-6)and tumor necrosis factor α (TNFα) on tissue factor(TF) expression of astrocytes. METHODS:Astrocytes were identified with anti-glial fibrillary acidic protein antibody. The TF activity of cell lysate was measured with one stage clotting assay. RESULTS:TF activity of astrocytes of LPS,IL-6,TNFα groups were obviously higher than that of the control group(P<0.05); While LPS,IL-6 and TNFα were combined with trifluoperazine or H7, their inductive effects were inhibited. CONCLUSION:LPS,IL-6 and TNFα promoted the TF expression of astrocytes and its mechanisms may connected with Calcium/Camodulin and protein kinase C pathway.
, http://www.100md.com
[MeSH] Astrocytes; Thromboplastin; Interleukin-6; Lipopolysaccharides; Tumor necrosis factor
组织因子(tissue factor,TF)作为外源性凝血途径的启动因子在凝血过程起重要的作用[1]。TF为跨膜的单链蛋白质,在功能上既是因子Ⅶ和因子Ⅶa的受体,又是因子Ⅶa的辅因子。早已知脑组织中富含组织因子,但新近研究才证实脑内的星形胶质细胞(astrocyte, AS)能表达TF[2,3],本实验室的研究曾表明凝血酶能刺激星形胶质细胞表达组织因子,但有关炎性介质对星形胶质细胞表达TF的影响及其机制目前尚未见报道[1,3]。本文拟报道脂多糖(lipopolysaccharide, LPS)、肿瘤坏死因子α(tumor necrosis factor α, TNFα)、白介素-6(interleukin-6,IL-6)对星形胶质细胞表达TF的影响。
, 百拇医药
材 料 和 方 法
一、试剂和药品
DMEM培养基干粉、LPS、IL-6、TNFα、钙调素阻断剂三氟吡啦嗪(trifluoperazine, TFP)、蛋白激酶C抑制剂1-(5-异喹啉磺胺)-3-甲基哌嗪[1-(5-isoquinolinyl sulfonyl)-3-methyl-piperazine](H7)、兔抗鼠神经胶质纤维样酸性蛋白单抗、异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的羊抗兔IgG抗体均为美国Sigma产品;dansyl-Glu-Gly-Arg-chloromethyl ketone Ⅶa(DEGR-Ⅶa)由Taylor惠赠;抗组织因子单克隆抗体由Morrissey
惠赠。DMEM完全培养液、IL-6、TNFα、H7、TFP等试剂经鲎试验检测全部为阴性。
, http://www.100md.com
二、细胞培养
按Hertz等报道的方法[4]培养Wistar乳鼠(出生后24 h内)星形胶质细胞。由于星形胶质细胞能特异性分泌神经胶质纤维样酸性蛋白(glial fibrillary acidic protein,GFAP),故采用GFAP抗原间接免疫荧光法进行鉴定[3]。
三、实验方案
将同源传代的单层星形胶质细胞,接种于24孔板上,每孔接种细胞数为5×104,37℃、5%CO2饱和湿度下培养。待24孔板细胞完全融合成片后去培养液,用D-Hanks液洗涤3遍。然后分别加入含不同刺激物的完全DMEM 1mL,对照只加完全DMEM 1mL。37℃、5%CO2饱和湿度下培养相应的时间后,制备细胞悬液,贮存于-40℃待测[3]。
, http://www.100md.com
四、TF检测方法
(一)AS冻融液促凝活性的测定 采用一期凝固法[3,5]。
(二)TF活性确认方法 为确认星形胶质细胞冻融液的促凝活性来自TF,实验从生物活性与抗原特异性两方面加以证实[6~7]。1.生物活性特异性 DEGR-Ⅶa是经化学修饰的因子Ⅶa,它和因子Ⅶa竞争性地与TF结合,但形成的DEGR-Ⅶa/TF复合物不能激活因子Ⅹ。当血中DEGR-Ⅶa的含量远远大于因子Ⅶa时,血中就不能形成足量的因子Ⅶa/TF复合物,也就不能有效地激活因子Ⅹ,从而TF的促凝活性被阻断。2.抗原特异性 抗TF单抗与TF形成抗原抗体复合物,可特异性抑制TF的促凝活性。
五、统计处理
数据为均数±标准差(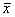 ±s),采用INSTAT统计软件分析,组间比较采用F检验。若F>F0.05,则两两比较用q检验。
±s),采用INSTAT统计软件分析,组间比较采用F检验。若F>F0.05,则两两比较用q检验。
, 百拇医药
结 果
一、星形胶质细胞鉴定
使用抗GFAP单抗组荧光显微镜下可见99%以上的细胞呈现黄色荧光,而无单抗组荧光显微镜下未见荧光,表明培养的细胞绝大多数属于星形胶质细胞。用各刺激物后镜下观察细胞形态无明显的变化。
二、TF活性确认
(一)DEGR-Ⅶa对兔脑凝血活酶和AS冻融液促凝作用的影响 从表1可见,加入足量的DEGR-Ⅶa(终浓度为46μg/mL)阻断TF作用后,各种稀释度的兔脑凝血活酶与AS冻融液的促凝活性均完全丧失,其凝固时间与加入生理盐水的血浆相对照无明显差异(P>0.05)。这提示AS冻融液与兔脑凝血活酶一样,它们的促凝活性都来自TF。
表1 DEGR-Ⅶa对兔脑凝血活酶和星形胶质细胞促凝活性的影响
, http://www.100md.com
Tab 1 Effect of DEGR-Ⅶa on the procoagulant activity of rabbit thromboplastin and astrocytes lysate (clotting time, s)
Pooled human plasma
Dilution
1∶1
1∶2
1∶4
1∶8
1∶16
Saline
Rabbit thromboplastin
, 百拇医药
Without DEGR-Ⅶa
49.0
55.0
64.0
77.0
105.0
232.0
With DEGR-Ⅶa
231.0
227.5
230.0
232.5
, http://www.100md.com
233.0
233.0
Astrocyte lysate
Without DEGR-Ⅶa
58.7
69.5
88.5
107.0
123.0
232.0
With DEGR-Ⅶa
229.0
, 百拇医药
228.5
231.5
228.0
231.0
233.0
(二)抗TF单抗对兔脑凝血活酶和AS冻融液生物活性的影响 加入兔脑凝血活酶或鼠AS冻融液的血浆,凝固时间在加入抗TF单抗(终浓度0.25 μg/mL)后均明显延长,并且随促凝物稀释度加大,凝固时间延长,二者间存在明显的相关性(r=0.989,P<0.05,见表2)。这提示AS冻融液中促凝活性与兔脑凝血活酶一样,均来自TF。表2 抗TF单抗对兔脑凝血活酶和星形胶质细胞冻融液促凝活性的影响
Tab 2 Effect of TF monoclonal antibody on the procoagulant activity of the rabbit thromboplastin and astrocytes lysate (clotting time,s)
, 百拇医药
Pooled human plasma
Dilution
1∶1
1∶2
1∶4
1∶8
1∶16
Saline
Rabbit thromboplastin
Without TF McAb
49.0
55.0
, 百拇医药
64.0
77.0
105.0
232.0
With TF McAb
58.3
76.0
87.0
112.0
142.0
230.0
Astrocyte lysate
, 百拇医药
Without TF McAb
58.7
69.5
88.5
107.0
123.0
232.0
With TF McAb
82.5
94.6
120.5
154.5
, 百拇医药 181.5
230.0
三、脂多糖、白介素-6、肿瘤坏死因子α对星形胶质细胞表达TF的影响
实验中加入LPS终浓度1μg/mL,IL-6为40 ng/mL,TNFα/为100 ng/mL。加入刺激物后培养时间为24 h。结果显示(见表3):IL-6、LPS、TNFα、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6、TNFα+IL-6各组星形胶质细胞表达TF均明显高于对照组(P<0.05)。LPS、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6组星形胶质细胞表达TF明显高于IL-6组(P<0.05),但TNFα、TNFα+IL-6、LPS+TNFα组与IL-6组比较无明显的差异(P>0.05)。LPS、IL-6+TNFα、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6组星形胶质细胞表达TF明显高于TNFα组(P<0.05)。LPS+TNFα、LPS+TNFα,+IL-6组星形胶质细胞表达TF与LPS组比较无明显的差异(P>0.05)。
, http://www.100md.com
四、H7和TFP对LPS、TNFα、IL-6刺激AS表达TF活性的影响
实验中加入LPS终浓度1 μg/mL,IL-6为40 ng/mL,TNFα为100 ng/mL,HS7为200 μmol/L,TFP为50 nmol/L。加入刺激物后培养时间为6 h。从表4可见,LPS、TNFα和IL-6组AS表达TF明显高于对照组(P<0.05)。各组分别加入H7或TFP时,均可明显抑制LPS、TNFα和IL-6对AS表达TF活性的刺激作用(P<0.05)。表3 脂多糖、白介素-6、肿瘤坏死因子α
对星形胶质细胞表达TF的影响
Tab 3 Effects of LPS,IL-6 and TNFα on the tissue factor
expression of astrocytes (n=9,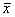 ±s) Group
±s) Group
, 百拇医药
TF(mU×102/mL)
Control
31.9±2.1
IL-6
42.3±2.4*
TNFα
40.0±2.3*
LPS
46.4±2.8*
IL-6+TNFα
44.0±2.7*
, 百拇医药
LPS+IL-6
46.6±3.1*
LPS+TNFα
45.3±1.8*
LPS+IL-6+TNFα
48.0±2.0*
*P<0.05,vs control group表4 H7和TFP对LPS、TNFα、IL-6
刺激AS表达TF活性的影响
Tab 4 Effect of H7 Kand TFP on the expression
, http://www.100md.com
TF of astrocytes induced by LPS,TNFα,IL-6
(n=6,mU×102/mL,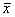 ±s)
±s)
Control
Stimuli
LPS
TNFα
IL-6
Control
7.0±1.2
20.1±2.0*
, 百拇医药
14.9±1.8*
17.0±2.0*
H7
4.0±1.6*
12.6±0.6#
9.9±1.4★
11.1±0.4△
TFP
4.2±1.3*
6.8±2.0#
, 百拇医药
7.4±0.8★
7.4±1.3△
*P<0.05,vs control;#P<0.05,vs LPS control;
★P<0.05,vs TNFα control;△P<0.05,vs IL-6 control讨 论
近几年的研究表明,由组织因子(TF)启动的外源性凝血途径在病理过程中的血栓形成具有重要的作用[1]。本室曾观察到内毒素休克时,血浆TF含量明显升高,组织因子途径抑制物(tissuefactor pathway inhibitor,TFPI)/TF比值则明显降低[1]。临床资料也显示DIC病人TF抗原水平明显升高,用抗TF单抗或重组的组织因子途径抑制物(TFPI)可明显减少内毒素休克的死亡率[1,6],提示TF与DIC的发生发展有一定的相关性。内毒素休克时,细菌内毒素可刺激血管内皮细胞或单核细胞分泌细胞因子(TNFα与IL-6等),这些细胞因子可以刺激血管内皮细胞和单个核细胞大量表达TF,同时也可通过血脑屏障而起作用。本实验结果提示LPS、IL-6和TNFα均能刺激星形胶质细胞表达TF,其中以LPS的作用最强。由于细胞因子可通过血脑屏障,而且脑内星形胶质细胞自身也能分泌TNFα和IL-6[10],因此内毒性休克病人,在炎性介质的刺激下星形胶质细胞表达TF可能明显增加。LPS、TNFα和IL-6促进星形胶质细胞TF活性表达的作用能被H7与TFP所阻断,这提示LPS、TNFα+和IL-6促进星形胶质细胞组织因子活性表达可能与蛋白激酶C(PKC)和钙/钙调素(Ca2+/CaM)途径有关。
, 百拇医药
本实验室的研究表明脑出血病人血浆TF明显增高[8],这提示脑出血病人体内外源性凝血途径可能被激活。当脑内病变或外伤,在炎性介质的刺激下星形胶质细胞表达TF可能增多,局部可形成高浓度TF,有可能启动外源性凝血途径。此外由于炎症时血脑屏障通透性的改变,血液中凝血因子可渗透进入脑组织中,TF与血中因子Ⅶa结合可启动外源性凝血途径,在脑内局部可能形成过量的凝血酶,过量的凝血酶不仅使神经轴突回缩,突触传递障碍[10];而且使星形胶质细胞变形,神经营养与屏障功能受损。某些脑出血患者预后不良可能与此有关。此外,TF也可通过血脑屏障进入脑内微血管,促进脑血管微血栓形成,这可能在促进内毒素休克的发展中起一定作用。由于TNFα和IL-6分泌增强通常出现在炎症条件下,因此脑部感染与创伤时炎症反应引起的脑部病理变化,可能与星形胶质细胞功能改变有关。
[基金项目] 国家自然科学基金资助(39770710)
[参 考 文 献]
, 百拇医药
[1] 朱发明,贺石林,李俊成. 组织因子途径生理与临床意义[J]. 国外医学输血与血液学分册,1997,20(1):52.
[2] Flossel C, Luther T, Muller M, et al. Immunohistochemical detection of tissue factor (TF) on paraffin sections of routinely fixed human tissue [J]. Histochemistry, 1994, 101(6): 449.
[3] Eddleston M, De la Torre JC, Oldstone MBA, et al. Astrocytes are the primary source of tissue factor in the murine central nervous system [J]. J Clin Invest, 1993,92(1):349.
, 百拇医药
[4] Hertz L, Juurlink BHJ, Hertz E, et al. Preparation of primary cultures of mouse (Rat) astrocytes [M]. Adissection and tissue culture manual of the nervous system. Alan R. Liss, Inc.1989.105~108.
[5] McGee MP, Foster S, Wang XY. Simultaneous expression of tissue factor and tissue factor pathway inhibitor by human monocytes. A potential mechanism for localized control of blood coagulation [J]. J Exp Med,1994,179(6):1847.
[6] Li AG, Chang ACK, Peer GT, et al. Comparison of the capacity of rhTNFα and Escherichia coli to induce procoagulant activity by baboon mononuclear cells in vivo and in vitro [J].Shock,1996,5(4):274.
, 百拇医药
[7] Ruf W, Edgington TS. An anti-tissue factor monoclonal antibody which inhibits TF-Ⅶa complex is a potent anticoagulant in plasma [J].Thromb Haemost,1991,66(5):529.
[8] 文志斌, 肖苏红, 何晓凡,等. 脑出血患者血浆组织因子和组织因子途径抑制物含量变化及其意义. 中国危重病急救医学,1996,89(3):664.
[9] Chung IY, Benveniste EN. Tumor necrosis factor-α production by astrocytes induction by lipopolysaccharide、 IFN-γ and IFN-β [J]. J Immunol,1990,144(8):2999.
[10] Suidan H, Stone S, Hemmings B,et al. Thrombin causes neurite retraction in neuronal cells through activation of cell surface receptors [J]. Neuron,1992,8(2):363.
[收稿日期]1998-12-01 [修回日期]1999-09-03
, 百拇医药
单位:朱发明(浙江省血液中心,浙江 杭州 310020);文志斌 熊石龙 李俊成 贺石林(湖南医科大学生理教研室, 湖南 长沙 410078)
关键词:星形细胞;凝血致活酶;白细胞介素-6;脂多糖类;肿瘤坏死因子
中国病理生理杂志000219
[摘 要] 目的:观察脂多糖、白介素-6和肿瘤坏死因子α对大鼠星形胶质细胞组织因子活性表达的影响。方法:培养Wistar乳鼠星形胶质细胞,细胞用抗神经胶质纤维酸性蛋白单克隆抗体确认。细胞冻融液组织因子活性检测采用一期血浆复钙时间法。结果:脂多糖、白介素-6和肿瘤坏死因子α组星形胶质细胞表达组织因子活性明显高于对照组(P<0.05)。脂多糖、白介素-6和肿瘤坏死因子α与三氟吡啦嗪(TFP)或1-(5-异喹啉磺胺)-3-甲基哌嗪(H7)联合运用,则它们的刺激作用受到明显抑制。结论:脂多糖、白介素-6、肿瘤坏死因子能刺激星形胶质细胞表达组织因子活性,其机制可能与钙/钙调素和蛋白激酶C途径有关。
, http://www.100md.com
[中图分类号] Q189 [文献标识码] A
[文章编号] 1000-4718(2000)02-0163-04
Effects of lipopolysaccharide,IL-6 and TNFα on the tissue factor expression of astrocytes
WEN Zhi-bin, HE Xiao-fan, LI Jun-cheng, HE Shi-lin
(Department of Physiology, Hunan Medical University, Changsha 410078)
ZHU Fa-ming
(Blood Centre of Zhejiang Province, Hangzhou 310020, China)
, 百拇医药
[Abstract] AIM:To study the effects of lipopolysaccharide(LPS), interleukin-6(IL-6)and tumor necrosis factor α (TNFα) on tissue factor(TF) expression of astrocytes. METHODS:Astrocytes were identified with anti-glial fibrillary acidic protein antibody. The TF activity of cell lysate was measured with one stage clotting assay. RESULTS:TF activity of astrocytes of LPS,IL-6,TNFα groups were obviously higher than that of the control group(P<0.05); While LPS,IL-6 and TNFα were combined with trifluoperazine or H7, their inductive effects were inhibited. CONCLUSION:LPS,IL-6 and TNFα promoted the TF expression of astrocytes and its mechanisms may connected with Calcium/Camodulin and protein kinase C pathway.
, http://www.100md.com
[MeSH] Astrocytes; Thromboplastin; Interleukin-6; Lipopolysaccharides; Tumor necrosis factor
组织因子(tissue factor,TF)作为外源性凝血途径的启动因子在凝血过程起重要的作用[1]。TF为跨膜的单链蛋白质,在功能上既是因子Ⅶ和因子Ⅶa的受体,又是因子Ⅶa的辅因子。早已知脑组织中富含组织因子,但新近研究才证实脑内的星形胶质细胞(astrocyte, AS)能表达TF[2,3],本实验室的研究曾表明凝血酶能刺激星形胶质细胞表达组织因子,但有关炎性介质对星形胶质细胞表达TF的影响及其机制目前尚未见报道[1,3]。本文拟报道脂多糖(lipopolysaccharide, LPS)、肿瘤坏死因子α(tumor necrosis factor α, TNFα)、白介素-6(interleukin-6,IL-6)对星形胶质细胞表达TF的影响。
, 百拇医药
材 料 和 方 法
一、试剂和药品
DMEM培养基干粉、LPS、IL-6、TNFα、钙调素阻断剂三氟吡啦嗪(trifluoperazine, TFP)、蛋白激酶C抑制剂1-(5-异喹啉磺胺)-3-甲基哌嗪[1-(5-isoquinolinyl sulfonyl)-3-methyl-piperazine](H7)、兔抗鼠神经胶质纤维样酸性蛋白单抗、异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的羊抗兔IgG抗体均为美国Sigma产品;dansyl-Glu-Gly-Arg-chloromethyl ketone Ⅶa(DEGR-Ⅶa)由Taylor惠赠;抗组织因子单克隆抗体由Morrissey
惠赠。DMEM完全培养液、IL-6、TNFα、H7、TFP等试剂经鲎试验检测全部为阴性。
, http://www.100md.com
二、细胞培养
按Hertz等报道的方法[4]培养Wistar乳鼠(出生后24 h内)星形胶质细胞。由于星形胶质细胞能特异性分泌神经胶质纤维样酸性蛋白(glial fibrillary acidic protein,GFAP),故采用GFAP抗原间接免疫荧光法进行鉴定[3]。
三、实验方案
将同源传代的单层星形胶质细胞,接种于24孔板上,每孔接种细胞数为5×104,37℃、5%CO2饱和湿度下培养。待24孔板细胞完全融合成片后去培养液,用D-Hanks液洗涤3遍。然后分别加入含不同刺激物的完全DMEM 1mL,对照只加完全DMEM 1mL。37℃、5%CO2饱和湿度下培养相应的时间后,制备细胞悬液,贮存于-40℃待测[3]。
, http://www.100md.com
四、TF检测方法
(一)AS冻融液促凝活性的测定 采用一期凝固法[3,5]。
(二)TF活性确认方法 为确认星形胶质细胞冻融液的促凝活性来自TF,实验从生物活性与抗原特异性两方面加以证实[6~7]。1.生物活性特异性 DEGR-Ⅶa是经化学修饰的因子Ⅶa,它和因子Ⅶa竞争性地与TF结合,但形成的DEGR-Ⅶa/TF复合物不能激活因子Ⅹ。当血中DEGR-Ⅶa的含量远远大于因子Ⅶa时,血中就不能形成足量的因子Ⅶa/TF复合物,也就不能有效地激活因子Ⅹ,从而TF的促凝活性被阻断。2.抗原特异性 抗TF单抗与TF形成抗原抗体复合物,可特异性抑制TF的促凝活性。
五、统计处理
数据为均数±标准差(
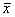 ±s),采用INSTAT统计软件分析,组间比较采用F检验。若F>F0.05,则两两比较用q检验。
±s),采用INSTAT统计软件分析,组间比较采用F检验。若F>F0.05,则两两比较用q检验。, 百拇医药
结 果
一、星形胶质细胞鉴定
使用抗GFAP单抗组荧光显微镜下可见99%以上的细胞呈现黄色荧光,而无单抗组荧光显微镜下未见荧光,表明培养的细胞绝大多数属于星形胶质细胞。用各刺激物后镜下观察细胞形态无明显的变化。
二、TF活性确认
(一)DEGR-Ⅶa对兔脑凝血活酶和AS冻融液促凝作用的影响 从表1可见,加入足量的DEGR-Ⅶa(终浓度为46μg/mL)阻断TF作用后,各种稀释度的兔脑凝血活酶与AS冻融液的促凝活性均完全丧失,其凝固时间与加入生理盐水的血浆相对照无明显差异(P>0.05)。这提示AS冻融液与兔脑凝血活酶一样,它们的促凝活性都来自TF。
表1 DEGR-Ⅶa对兔脑凝血活酶和星形胶质细胞促凝活性的影响
, http://www.100md.com
Tab 1 Effect of DEGR-Ⅶa on the procoagulant activity of rabbit thromboplastin and astrocytes lysate (clotting time, s)
Pooled human plasma
Dilution
1∶1
1∶2
1∶4
1∶8
1∶16
Saline
Rabbit thromboplastin
, 百拇医药
Without DEGR-Ⅶa
49.0
55.0
64.0
77.0
105.0
232.0
With DEGR-Ⅶa
231.0
227.5
230.0
232.5
, http://www.100md.com
233.0
233.0
Astrocyte lysate
Without DEGR-Ⅶa
58.7
69.5
88.5
107.0
123.0
232.0
With DEGR-Ⅶa
229.0
, 百拇医药
228.5
231.5
228.0
231.0
233.0
(二)抗TF单抗对兔脑凝血活酶和AS冻融液生物活性的影响 加入兔脑凝血活酶或鼠AS冻融液的血浆,凝固时间在加入抗TF单抗(终浓度0.25 μg/mL)后均明显延长,并且随促凝物稀释度加大,凝固时间延长,二者间存在明显的相关性(r=0.989,P<0.05,见表2)。这提示AS冻融液中促凝活性与兔脑凝血活酶一样,均来自TF。表2 抗TF单抗对兔脑凝血活酶和星形胶质细胞冻融液促凝活性的影响
Tab 2 Effect of TF monoclonal antibody on the procoagulant activity of the rabbit thromboplastin and astrocytes lysate (clotting time,s)
, 百拇医药
Pooled human plasma
Dilution
1∶1
1∶2
1∶4
1∶8
1∶16
Saline
Rabbit thromboplastin
Without TF McAb
49.0
55.0
, 百拇医药
64.0
77.0
105.0
232.0
With TF McAb
58.3
76.0
87.0
112.0
142.0
230.0
Astrocyte lysate
, 百拇医药
Without TF McAb
58.7
69.5
88.5
107.0
123.0
232.0
With TF McAb
82.5
94.6
120.5
154.5
, 百拇医药 181.5
230.0
三、脂多糖、白介素-6、肿瘤坏死因子α对星形胶质细胞表达TF的影响
实验中加入LPS终浓度1μg/mL,IL-6为40 ng/mL,TNFα/为100 ng/mL。加入刺激物后培养时间为24 h。结果显示(见表3):IL-6、LPS、TNFα、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6、TNFα+IL-6各组星形胶质细胞表达TF均明显高于对照组(P<0.05)。LPS、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6组星形胶质细胞表达TF明显高于IL-6组(P<0.05),但TNFα、TNFα+IL-6、LPS+TNFα组与IL-6组比较无明显的差异(P>0.05)。LPS、IL-6+TNFα、LPS+IL-6、LPS+TNFα、LPS+TNFα+IL-6组星形胶质细胞表达TF明显高于TNFα组(P<0.05)。LPS+TNFα、LPS+TNFα,+IL-6组星形胶质细胞表达TF与LPS组比较无明显的差异(P>0.05)。
, http://www.100md.com
四、H7和TFP对LPS、TNFα、IL-6刺激AS表达TF活性的影响
实验中加入LPS终浓度1 μg/mL,IL-6为40 ng/mL,TNFα为100 ng/mL,HS7为200 μmol/L,TFP为50 nmol/L。加入刺激物后培养时间为6 h。从表4可见,LPS、TNFα和IL-6组AS表达TF明显高于对照组(P<0.05)。各组分别加入H7或TFP时,均可明显抑制LPS、TNFα和IL-6对AS表达TF活性的刺激作用(P<0.05)。表3 脂多糖、白介素-6、肿瘤坏死因子α
对星形胶质细胞表达TF的影响
Tab 3 Effects of LPS,IL-6 and TNFα on the tissue factor
expression of astrocytes (n=9,
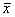 ±s) Group
±s) Group, 百拇医药
TF(mU×102/mL)
Control
31.9±2.1
IL-6
42.3±2.4*
TNFα
40.0±2.3*
LPS
46.4±2.8*
IL-6+TNFα
44.0±2.7*
, 百拇医药
LPS+IL-6
46.6±3.1*
LPS+TNFα
45.3±1.8*
LPS+IL-6+TNFα
48.0±2.0*
*P<0.05,vs control group表4 H7和TFP对LPS、TNFα、IL-6
刺激AS表达TF活性的影响
Tab 4 Effect of H7 Kand TFP on the expression
, http://www.100md.com
TF of astrocytes induced by LPS,TNFα,IL-6
(n=6,mU×102/mL,
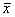 ±s)
±s)Control
Stimuli
LPS
TNFα
IL-6
Control
7.0±1.2
20.1±2.0*
, 百拇医药
14.9±1.8*
17.0±2.0*
H7
4.0±1.6*
12.6±0.6#
9.9±1.4★
11.1±0.4△
TFP
4.2±1.3*
6.8±2.0#
, 百拇医药
7.4±0.8★
7.4±1.3△
*P<0.05,vs control;#P<0.05,vs LPS control;
★P<0.05,vs TNFα control;△P<0.05,vs IL-6 control讨 论
近几年的研究表明,由组织因子(TF)启动的外源性凝血途径在病理过程中的血栓形成具有重要的作用[1]。本室曾观察到内毒素休克时,血浆TF含量明显升高,组织因子途径抑制物(tissuefactor pathway inhibitor,TFPI)/TF比值则明显降低[1]。临床资料也显示DIC病人TF抗原水平明显升高,用抗TF单抗或重组的组织因子途径抑制物(TFPI)可明显减少内毒素休克的死亡率[1,6],提示TF与DIC的发生发展有一定的相关性。内毒素休克时,细菌内毒素可刺激血管内皮细胞或单核细胞分泌细胞因子(TNFα与IL-6等),这些细胞因子可以刺激血管内皮细胞和单个核细胞大量表达TF,同时也可通过血脑屏障而起作用。本实验结果提示LPS、IL-6和TNFα均能刺激星形胶质细胞表达TF,其中以LPS的作用最强。由于细胞因子可通过血脑屏障,而且脑内星形胶质细胞自身也能分泌TNFα和IL-6[10],因此内毒性休克病人,在炎性介质的刺激下星形胶质细胞表达TF可能明显增加。LPS、TNFα和IL-6促进星形胶质细胞TF活性表达的作用能被H7与TFP所阻断,这提示LPS、TNFα+和IL-6促进星形胶质细胞组织因子活性表达可能与蛋白激酶C(PKC)和钙/钙调素(Ca2+/CaM)途径有关。
, 百拇医药
本实验室的研究表明脑出血病人血浆TF明显增高[8],这提示脑出血病人体内外源性凝血途径可能被激活。当脑内病变或外伤,在炎性介质的刺激下星形胶质细胞表达TF可能增多,局部可形成高浓度TF,有可能启动外源性凝血途径。此外由于炎症时血脑屏障通透性的改变,血液中凝血因子可渗透进入脑组织中,TF与血中因子Ⅶa结合可启动外源性凝血途径,在脑内局部可能形成过量的凝血酶,过量的凝血酶不仅使神经轴突回缩,突触传递障碍[10];而且使星形胶质细胞变形,神经营养与屏障功能受损。某些脑出血患者预后不良可能与此有关。此外,TF也可通过血脑屏障进入脑内微血管,促进脑血管微血栓形成,这可能在促进内毒素休克的发展中起一定作用。由于TNFα和IL-6分泌增强通常出现在炎症条件下,因此脑部感染与创伤时炎症反应引起的脑部病理变化,可能与星形胶质细胞功能改变有关。
[基金项目] 国家自然科学基金资助(39770710)
[参 考 文 献]
, 百拇医药
[1] 朱发明,贺石林,李俊成. 组织因子途径生理与临床意义[J]. 国外医学输血与血液学分册,1997,20(1):52.
[2] Flossel C, Luther T, Muller M, et al. Immunohistochemical detection of tissue factor (TF) on paraffin sections of routinely fixed human tissue [J]. Histochemistry, 1994, 101(6): 449.
[3] Eddleston M, De la Torre JC, Oldstone MBA, et al. Astrocytes are the primary source of tissue factor in the murine central nervous system [J]. J Clin Invest, 1993,92(1):349.
, 百拇医药
[4] Hertz L, Juurlink BHJ, Hertz E, et al. Preparation of primary cultures of mouse (Rat) astrocytes [M]. Adissection and tissue culture manual of the nervous system. Alan R. Liss, Inc.1989.105~108.
[5] McGee MP, Foster S, Wang XY. Simultaneous expression of tissue factor and tissue factor pathway inhibitor by human monocytes. A potential mechanism for localized control of blood coagulation [J]. J Exp Med,1994,179(6):1847.
[6] Li AG, Chang ACK, Peer GT, et al. Comparison of the capacity of rhTNFα and Escherichia coli to induce procoagulant activity by baboon mononuclear cells in vivo and in vitro [J].Shock,1996,5(4):274.
, 百拇医药
[7] Ruf W, Edgington TS. An anti-tissue factor monoclonal antibody which inhibits TF-Ⅶa complex is a potent anticoagulant in plasma [J].Thromb Haemost,1991,66(5):529.
[8] 文志斌, 肖苏红, 何晓凡,等. 脑出血患者血浆组织因子和组织因子途径抑制物含量变化及其意义. 中国危重病急救医学,1996,89(3):664.
[9] Chung IY, Benveniste EN. Tumor necrosis factor-α production by astrocytes induction by lipopolysaccharide、 IFN-γ and IFN-β [J]. J Immunol,1990,144(8):2999.
[10] Suidan H, Stone S, Hemmings B,et al. Thrombin causes neurite retraction in neuronal cells through activation of cell surface receptors [J]. Neuron,1992,8(2):363.
[收稿日期]1998-12-01 [修回日期]1999-09-03
, 百拇医药