海马区星形胶质细胞的活化状态与缺血耐受性关系的研究
作者:张敬军 陈青 孙思琴
单位:张敬军(泰山医学院附属医院微循环研究所,山东 泰安 271000);陈青(泰安卫生学校);孙思琴(泰山医学院附属医院微循环研究所,山东 泰安 271000)
关键词:脑缺血;星形细胞;海马
中国病理生理杂志0000218
[摘 要] 目的:观察海马区星形胶质细胞的活化状态与缺血耐受性的关系。方法:钳夹沙土鼠的双侧颈总动脉制造脑缺血模型,应用尼氏染色及免疫荧光法染色,观察海马锥体细胞迟发性神经元坏死及抗胶质纤维酸性蛋白(GFAP)染色的改变。结果: 脑缺血组,CA1区锥体细胞几乎全部丧失,只见很少量的细胞残存,零星散在分布;预缺血组,CA1区锥体细胞少部分丧失,大部分幸存。对照组有少量微弱的GFAP染色阳性细胞;脑缺血组有些GFAP染色阳性细胞,多为弱阳性;预缺血组GFAP染色反应明显增多、增粗,且染色深染。结论:星形胶质细胞形态、机能的改变在缺血性脑损伤中起重要作用,该细胞对缺血的耐受性可能与其活化状态有关。
, 百拇医药
[中图分类号] R363 [文献标识码] A
[文章编号]1000-4718(2000)02-0160-03
Relation between astroglial activation state and ischemic tolerance in the gerbil hippocampus
ZHANG Jing-jun, CHEN Qing, SUN Si-qin
(Institute of Microcirculation, Taishan Medical College Affiliated Hospital, Taian 271000,China)
[Abstract] AIM:To observe the relation between astroglial activation state and ischemic tolerance in the gerbil hippocampus. METHOD: Bilateral occlusion of common carotid arteries and immunofluorescent methods in the gerbil hippocampal tissue. Slices were used. The morphological changes of the neurons were observed by light microscopy.RESULTS:Pretreatment with 2 minute bilateral carotid artery occlusion produced protective effects of CA1 neurons. Glial fibrillary acidic protein (GFAP) staining showed weak positive cells in control group. Most of GFAP positive cells showed weak and middle positive cells after recirculation 1d and 2d following ischemic 3.5 min and preconditioning of the brain with sublethal ischemia respectively.CONCLUSION:Astroglial played an important role in cerebral ischemia. It is possible that state of astroglial activation related to neuronal survival in ischemic tolerance.
, 百拇医药
[MeSH] Cerebral ischemia; Astrocytes; Hippocampus
短暂性前脑缺血再灌流后,海马本部CA1区锥体细胞最早且最易发生细胞凋亡或迟发性神经元坏死(delayed neuron death, DND)[1],这一现象是人们研究的热点之一,提出了许多假说,然而这些假说均不能完全解释这一现象。近年国外文献报道这种选择性易损可被亚致死的预缺血所抑制[2],尽管机理不清,但有一点是可以肯定的,星形胶质细胞在缺血性脑损伤中起重要作用。星形胶质细胞的活化状态与缺血性神经元耐受关系的研究未见报道,本文探讨星形胶质细胞的活化状态与缺血性神经元耐受的关系。
材 料 和 方 法
一、实验动物
雄性沙土鼠70~80 g(约12周龄)64只,随机分为8组,预缺血3组,脑缺血3组,假手术对照2组,每组8只。
, http://www.100md.com
二、试剂与仪器
抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(Sigma公司),用荧光素标记抗鼠的IgG(chemicon international INC公司),TME300温差电偶仪(日本unique公司)。
三、脑缺血的复制
1.5%卤烷吸入麻醉沙土鼠,选择一侧脑区,在前囱前及前囱一侧各2 mm的交叉点,用温差电偶探针垂直进针2 mm,监测脑温并维持在(37±0.2)℃。暴露两侧颈总动脉,停止麻醉至动物清醒,用无损伤的血管夹立即夹闭双侧颈总动脉,2 min后松夹恢复血流3 d,然后再夹闭双侧颈总动脉3.5 min,松夹恢复血流分别为1 d、2 d及7 d为预缺血组。用上述方法夹闭双侧颈总动脉3.5 min,分别再灌流1 d、2 d、及7 d为脑缺血组。假手术对照2组除不夹闭双侧颈总动脉外,其它步骤同实验组。模型成功的标准是:阻断双侧颈总动脉血流后,动物立即出现呼吸加快,肢体痉挛,在10 s~1 min内昏迷。血流复通后,动物分别在5~10 min苏醒,不合上述标准者弃去不用。
, 百拇医药
四、尼氏染色
在戊巴比妥钠麻醉下,经心依次灌注下列溶液:(一)PBS 50 mL;(二)40 g.L-1多聚甲醛300 mL。取出大脑用40 g.L-1多聚甲醛固定2 h,常规石蜡包埋。每只动物取前囱后1.0 mm~1.3 mm间的连续6张冠状背侧海马切片,片厚5 μm,裱片,脱蜡,焦油紫尼氏染色,脱水,胶封。在10×40倍光镜下计数CA1区锥体细胞层1 mm长的范围内细胞核完整的细胞数。
五、海马脑片的制备及染色
在戊巴比妥钠麻醉下,经心依次灌注下列溶液:(一)PBS 50 mL;(二)40 g.L-1多聚甲醛300 mL。取出大脑,用40 g.L-1的多聚甲醛固定24 h(4℃),常规石蜡包埋。每只动物取前囱后1.0 mm~1.3 mm间的连续6张冠状背侧海马切片,片厚5 μm。脱蜡,10%的羊血清孵化30 min(37℃),抗GFAP抗体(1∶200)孵化90 min(37℃),TBS冲洗,用TRITC标记抗鼠的IgG(1∶200)孵化1 h(37℃),冲洗、封片、荧光显微镜观片。TBS代替一抗做空白对照。
, 百拇医药
结 果
一、3.5 min前脑缺血再灌流7 d,海马CA1区锥体细胞几乎全部丧失,只见很少量的细胞残存,零星散在分布。2 min前脑缺血,间隔3 d,再行3.5 min前脑缺血再灌流7 d,海马CA1区锥体细胞少部分丧失,大部分幸存。各组中CA2区、CA3区锥体细胞未见明显细胞丢失。假手术对照组CA1区锥体细胞未见丢失。每例动物取连续6张切片,在10×40倍光镜下计数CA1区锥体细胞层1 mm长细胞核完整的细胞数。见表1。
表1 海马CA1区锥体层细胞密度
Tab 1 Numbers of pyramidal cells to the hippocampal CA1 subfield (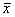 ±s,n=8) Group
±s,n=8) Group
, http://www.100md.com
Numbers of pyramidal cells
Sham-operated
238.0±11.1*
3.5 min-7d
45.0±5.2
2 min-3d+3.5 min-7d
231.0±14.6*
* P<0.01, vs 3.5 min-7d group
二、根据GFAP的染色强度可分为强阳性、中等、弱阳性3种类型,强阳性GFAP着色很深,弱阳性GFAP着色很弱,中等强度介于两者之间。假手术对照组:海马切片上有少量微弱的GFAP染色阳性细胞。脑缺血组:海马切片上有些GFAP染色阳性细胞,多为弱阳性。预缺血组:海马切片上GFAP染色阳性细胞,较对照组及脑缺血组明显多、粗、深染,主要分布于海马本部的放射层及腔隙分子层,形态以圆形或椭圆形的中、小型细胞为主,细胞突起明显,阳性细胞多呈中等强度。不同的缺血条件,海马本部GFAP阳性细胞密度不一,每只动物取出连续6张冠状背侧海马切片,在荧光显微镜下计数单侧CA1区1 mm长度范围的GFAP阳性细胞数,其定量分析结果见表2。每组鼠结果一致。空白对照实验结果为阴性。
, 百拇医药
表2 海马CA1区1 mm长度范围的GFAP阳性细胞数
Tab 2 Numbers of GFAP positive cells to the hippocampal
CA1 subfield in 1 mm length (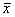 ±s,n=8) Group(ischemic/reperfusion)
±s,n=8) Group(ischemic/reperfusion)
Numbers of positive cells
Sham-operated
16
3.5 min-1d
, 百拇医药
18
3.5 min-2d
23
2 min-3d+3.5 min-1d
73*
2 min-3d+3.5 min-2d
78*
* P<0.01, vs other 3 groups讨 论
预缺血组,CA1区锥体细胞大部分幸存,说明2 min预缺血强度及此间隔时窗具有保护作用。此机理不清,可能与下列因素有关:基因的表达及调控,bcl-2基因是主要的抗细胞凋亡基因,短暂性前脑缺血再灌流24 h,CA1区锥体细胞bcl-2蛋白表达增加[3],当再次缺血时,这些锥体细胞可能对缺血耐受。其次神经元生存环境中的靶细胞、神经营养因子、细胞因子、细胞外间质等因素对神经元生存起重要作用。
, http://www.100md.com
实验结果表明,预缺血组,GFAP阳性细胞较对照组及脑缺血组明显多、粗及深染,GFAP染色反应可代表着星形胶质细胞的活化状态,说明星形胶质细胞的活化状态明显高于对照组及脑缺血组。星形胶质细胞的活化状态与CA1区锥体细胞的保护作用一致,因此我们推测星形胶质细胞的活化状态可能与缺血性神经元的耐受性有关,其机理可能是:生理条件下,星形胶质细胞的功能是维持局部微小环境的稳定[4]。脑缺血时兴奋性递质谷氨酸从突触前膜大量释放,作用于突触后膜上的谷氨酸受体,从而触发了细胞凋亡或DND的反应链[5]。脑缺血也导致水电平衡紊乱、血脑屏障破坏,星形胶质细胞的活化状态提高了星形胶质细胞的功能,从而提高了摄取兴奋毒谷氨酸的能力[6]。提高了维持水电酸碱平衡及修补血脑屏障的能力。因此星形胶质细胞的活化状态可能有利于微小环境的改善,从而有利于神经元对缺血耐受。
其次,星形胶质细胞的活化状态上调分泌许多神经营养因子,可能有利于神经元的修复。体内外研究证实星形胶质细胞分泌的神经生长因子和成纤维细胞生长因子对神经组织起营养支持保护作用。缺少星形胶质细胞的作用,神经元对扩散性抑制波呈高度易损伤性[8]。因此推测预缺血导致星形胶质细胞活化产生的营养物质可能减轻了第二次脑缺血对神经元的损害,这些可能是神经细胞对预缺血耐受性的作用机制之一。星形胶质细胞与神经元的联系及相互影响极其复杂,有保护神经元的一面,也有损害的一面,因此进一步地研究星形胶质细胞的功能,探讨新的治疗方案,既发挥星形胶质细胞的保护作用,又抑制星形胶质细胞的神经毒性,对脑缺血的治疗有重要意义。
, 百拇医药
[基金项目] 山东省自然科学基金资助(Y98C19048)
[参 考 文 献]
[1] 张敬军,陈 青. 脑缺血再灌流后海马区细胞凋亡的研究[J]. 中国临床神经科学,1999,7:38~40.
[2] Liu Y, Kato H, Nakata N, Kogure K. Temporal profile of heat shock protein 70 synthesis in ischemic tolerance induced by precondilioning ischemia in rat hippocampus [J]. Neuroscience,1993,56:921~927.
[3] Shimazaki, Ishida A, Kawai N. Increase in bcl-2 oncogen and the tolerance to ischemia-induced neuronal death in the gerbil hippocampus [J]. Neurosci Res,1994,20:95~99.
, http://www.100md.com
[4] Abbott NJ, Revest PA, Romero IA. Astrocyte-endothelial interaction: physiology and pathology [J]. Neuropathol Appl Neurobiol,1992,18:424~433.
[5] Takei, Endo Y. Ca2+ ionophore-induced apoptosis on cultured embryonic rat cortical neurons [J]. Brain Res,1994,652:65~70.
[6] Petito CK, Chung MC, Verkhovsky LM, et al. Brain glutamine synthetase increase following cerebral ischemia in the rat [J]. Brain Res,1992,569:275~280.
, 百拇医药
[7] Giulian D, Vaca K, Corpuz M. Brain glia release factors with opposing actions upon neuronal survival [J]. J Neurosci,1993,13:27~37.
[8] Largo C, Cuevas P, Herreras O. Is glia dysfunction the initial cause of neuronal death in ischemic penumbra [J]? Neurol Res,1996,18:445~448.
[收稿日期]1999-07-11 [修回日期]1999-12-09
, http://www.100md.com
单位:张敬军(泰山医学院附属医院微循环研究所,山东 泰安 271000);陈青(泰安卫生学校);孙思琴(泰山医学院附属医院微循环研究所,山东 泰安 271000)
关键词:脑缺血;星形细胞;海马
中国病理生理杂志0000218
[摘 要] 目的:观察海马区星形胶质细胞的活化状态与缺血耐受性的关系。方法:钳夹沙土鼠的双侧颈总动脉制造脑缺血模型,应用尼氏染色及免疫荧光法染色,观察海马锥体细胞迟发性神经元坏死及抗胶质纤维酸性蛋白(GFAP)染色的改变。结果: 脑缺血组,CA1区锥体细胞几乎全部丧失,只见很少量的细胞残存,零星散在分布;预缺血组,CA1区锥体细胞少部分丧失,大部分幸存。对照组有少量微弱的GFAP染色阳性细胞;脑缺血组有些GFAP染色阳性细胞,多为弱阳性;预缺血组GFAP染色反应明显增多、增粗,且染色深染。结论:星形胶质细胞形态、机能的改变在缺血性脑损伤中起重要作用,该细胞对缺血的耐受性可能与其活化状态有关。
, 百拇医药
[中图分类号] R363 [文献标识码] A
[文章编号]1000-4718(2000)02-0160-03
Relation between astroglial activation state and ischemic tolerance in the gerbil hippocampus
ZHANG Jing-jun, CHEN Qing, SUN Si-qin
(Institute of Microcirculation, Taishan Medical College Affiliated Hospital, Taian 271000,China)
[Abstract] AIM:To observe the relation between astroglial activation state and ischemic tolerance in the gerbil hippocampus. METHOD: Bilateral occlusion of common carotid arteries and immunofluorescent methods in the gerbil hippocampal tissue. Slices were used. The morphological changes of the neurons were observed by light microscopy.RESULTS:Pretreatment with 2 minute bilateral carotid artery occlusion produced protective effects of CA1 neurons. Glial fibrillary acidic protein (GFAP) staining showed weak positive cells in control group. Most of GFAP positive cells showed weak and middle positive cells after recirculation 1d and 2d following ischemic 3.5 min and preconditioning of the brain with sublethal ischemia respectively.CONCLUSION:Astroglial played an important role in cerebral ischemia. It is possible that state of astroglial activation related to neuronal survival in ischemic tolerance.
, 百拇医药
[MeSH] Cerebral ischemia; Astrocytes; Hippocampus
短暂性前脑缺血再灌流后,海马本部CA1区锥体细胞最早且最易发生细胞凋亡或迟发性神经元坏死(delayed neuron death, DND)[1],这一现象是人们研究的热点之一,提出了许多假说,然而这些假说均不能完全解释这一现象。近年国外文献报道这种选择性易损可被亚致死的预缺血所抑制[2],尽管机理不清,但有一点是可以肯定的,星形胶质细胞在缺血性脑损伤中起重要作用。星形胶质细胞的活化状态与缺血性神经元耐受关系的研究未见报道,本文探讨星形胶质细胞的活化状态与缺血性神经元耐受的关系。
材 料 和 方 法
一、实验动物
雄性沙土鼠70~80 g(约12周龄)64只,随机分为8组,预缺血3组,脑缺血3组,假手术对照2组,每组8只。
, http://www.100md.com
二、试剂与仪器
抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(Sigma公司),用荧光素标记抗鼠的IgG(chemicon international INC公司),TME300温差电偶仪(日本unique公司)。
三、脑缺血的复制
1.5%卤烷吸入麻醉沙土鼠,选择一侧脑区,在前囱前及前囱一侧各2 mm的交叉点,用温差电偶探针垂直进针2 mm,监测脑温并维持在(37±0.2)℃。暴露两侧颈总动脉,停止麻醉至动物清醒,用无损伤的血管夹立即夹闭双侧颈总动脉,2 min后松夹恢复血流3 d,然后再夹闭双侧颈总动脉3.5 min,松夹恢复血流分别为1 d、2 d及7 d为预缺血组。用上述方法夹闭双侧颈总动脉3.5 min,分别再灌流1 d、2 d、及7 d为脑缺血组。假手术对照2组除不夹闭双侧颈总动脉外,其它步骤同实验组。模型成功的标准是:阻断双侧颈总动脉血流后,动物立即出现呼吸加快,肢体痉挛,在10 s~1 min内昏迷。血流复通后,动物分别在5~10 min苏醒,不合上述标准者弃去不用。
, 百拇医药
四、尼氏染色
在戊巴比妥钠麻醉下,经心依次灌注下列溶液:(一)PBS 50 mL;(二)40 g.L-1多聚甲醛300 mL。取出大脑用40 g.L-1多聚甲醛固定2 h,常规石蜡包埋。每只动物取前囱后1.0 mm~1.3 mm间的连续6张冠状背侧海马切片,片厚5 μm,裱片,脱蜡,焦油紫尼氏染色,脱水,胶封。在10×40倍光镜下计数CA1区锥体细胞层1 mm长的范围内细胞核完整的细胞数。
五、海马脑片的制备及染色
在戊巴比妥钠麻醉下,经心依次灌注下列溶液:(一)PBS 50 mL;(二)40 g.L-1多聚甲醛300 mL。取出大脑,用40 g.L-1的多聚甲醛固定24 h(4℃),常规石蜡包埋。每只动物取前囱后1.0 mm~1.3 mm间的连续6张冠状背侧海马切片,片厚5 μm。脱蜡,10%的羊血清孵化30 min(37℃),抗GFAP抗体(1∶200)孵化90 min(37℃),TBS冲洗,用TRITC标记抗鼠的IgG(1∶200)孵化1 h(37℃),冲洗、封片、荧光显微镜观片。TBS代替一抗做空白对照。
, 百拇医药
结 果
一、3.5 min前脑缺血再灌流7 d,海马CA1区锥体细胞几乎全部丧失,只见很少量的细胞残存,零星散在分布。2 min前脑缺血,间隔3 d,再行3.5 min前脑缺血再灌流7 d,海马CA1区锥体细胞少部分丧失,大部分幸存。各组中CA2区、CA3区锥体细胞未见明显细胞丢失。假手术对照组CA1区锥体细胞未见丢失。每例动物取连续6张切片,在10×40倍光镜下计数CA1区锥体细胞层1 mm长细胞核完整的细胞数。见表1。
表1 海马CA1区锥体层细胞密度
Tab 1 Numbers of pyramidal cells to the hippocampal CA1 subfield (
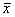 ±s,n=8) Group
±s,n=8) Group, http://www.100md.com
Numbers of pyramidal cells
Sham-operated
238.0±11.1*
3.5 min-7d
45.0±5.2
2 min-3d+3.5 min-7d
231.0±14.6*
* P<0.01, vs 3.5 min-7d group
二、根据GFAP的染色强度可分为强阳性、中等、弱阳性3种类型,强阳性GFAP着色很深,弱阳性GFAP着色很弱,中等强度介于两者之间。假手术对照组:海马切片上有少量微弱的GFAP染色阳性细胞。脑缺血组:海马切片上有些GFAP染色阳性细胞,多为弱阳性。预缺血组:海马切片上GFAP染色阳性细胞,较对照组及脑缺血组明显多、粗、深染,主要分布于海马本部的放射层及腔隙分子层,形态以圆形或椭圆形的中、小型细胞为主,细胞突起明显,阳性细胞多呈中等强度。不同的缺血条件,海马本部GFAP阳性细胞密度不一,每只动物取出连续6张冠状背侧海马切片,在荧光显微镜下计数单侧CA1区1 mm长度范围的GFAP阳性细胞数,其定量分析结果见表2。每组鼠结果一致。空白对照实验结果为阴性。
, 百拇医药
表2 海马CA1区1 mm长度范围的GFAP阳性细胞数
Tab 2 Numbers of GFAP positive cells to the hippocampal
CA1 subfield in 1 mm length (
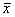 ±s,n=8) Group(ischemic/reperfusion)
±s,n=8) Group(ischemic/reperfusion)Numbers of positive cells
Sham-operated
16
3.5 min-1d
, 百拇医药
18
3.5 min-2d
23
2 min-3d+3.5 min-1d
73*
2 min-3d+3.5 min-2d
78*
* P<0.01, vs other 3 groups讨 论
预缺血组,CA1区锥体细胞大部分幸存,说明2 min预缺血强度及此间隔时窗具有保护作用。此机理不清,可能与下列因素有关:基因的表达及调控,bcl-2基因是主要的抗细胞凋亡基因,短暂性前脑缺血再灌流24 h,CA1区锥体细胞bcl-2蛋白表达增加[3],当再次缺血时,这些锥体细胞可能对缺血耐受。其次神经元生存环境中的靶细胞、神经营养因子、细胞因子、细胞外间质等因素对神经元生存起重要作用。
, http://www.100md.com
实验结果表明,预缺血组,GFAP阳性细胞较对照组及脑缺血组明显多、粗及深染,GFAP染色反应可代表着星形胶质细胞的活化状态,说明星形胶质细胞的活化状态明显高于对照组及脑缺血组。星形胶质细胞的活化状态与CA1区锥体细胞的保护作用一致,因此我们推测星形胶质细胞的活化状态可能与缺血性神经元的耐受性有关,其机理可能是:生理条件下,星形胶质细胞的功能是维持局部微小环境的稳定[4]。脑缺血时兴奋性递质谷氨酸从突触前膜大量释放,作用于突触后膜上的谷氨酸受体,从而触发了细胞凋亡或DND的反应链[5]。脑缺血也导致水电平衡紊乱、血脑屏障破坏,星形胶质细胞的活化状态提高了星形胶质细胞的功能,从而提高了摄取兴奋毒谷氨酸的能力[6]。提高了维持水电酸碱平衡及修补血脑屏障的能力。因此星形胶质细胞的活化状态可能有利于微小环境的改善,从而有利于神经元对缺血耐受。
其次,星形胶质细胞的活化状态上调分泌许多神经营养因子,可能有利于神经元的修复。体内外研究证实星形胶质细胞分泌的神经生长因子和成纤维细胞生长因子对神经组织起营养支持保护作用。缺少星形胶质细胞的作用,神经元对扩散性抑制波呈高度易损伤性[8]。因此推测预缺血导致星形胶质细胞活化产生的营养物质可能减轻了第二次脑缺血对神经元的损害,这些可能是神经细胞对预缺血耐受性的作用机制之一。星形胶质细胞与神经元的联系及相互影响极其复杂,有保护神经元的一面,也有损害的一面,因此进一步地研究星形胶质细胞的功能,探讨新的治疗方案,既发挥星形胶质细胞的保护作用,又抑制星形胶质细胞的神经毒性,对脑缺血的治疗有重要意义。
, 百拇医药
[基金项目] 山东省自然科学基金资助(Y98C19048)
[参 考 文 献]
[1] 张敬军,陈 青. 脑缺血再灌流后海马区细胞凋亡的研究[J]. 中国临床神经科学,1999,7:38~40.
[2] Liu Y, Kato H, Nakata N, Kogure K. Temporal profile of heat shock protein 70 synthesis in ischemic tolerance induced by precondilioning ischemia in rat hippocampus [J]. Neuroscience,1993,56:921~927.
[3] Shimazaki, Ishida A, Kawai N. Increase in bcl-2 oncogen and the tolerance to ischemia-induced neuronal death in the gerbil hippocampus [J]. Neurosci Res,1994,20:95~99.
, http://www.100md.com
[4] Abbott NJ, Revest PA, Romero IA. Astrocyte-endothelial interaction: physiology and pathology [J]. Neuropathol Appl Neurobiol,1992,18:424~433.
[5] Takei, Endo Y. Ca2+ ionophore-induced apoptosis on cultured embryonic rat cortical neurons [J]. Brain Res,1994,652:65~70.
[6] Petito CK, Chung MC, Verkhovsky LM, et al. Brain glutamine synthetase increase following cerebral ischemia in the rat [J]. Brain Res,1992,569:275~280.
, 百拇医药
[7] Giulian D, Vaca K, Corpuz M. Brain glia release factors with opposing actions upon neuronal survival [J]. J Neurosci,1993,13:27~37.
[8] Largo C, Cuevas P, Herreras O. Is glia dysfunction the initial cause of neuronal death in ischemic penumbra [J]? Neurol Res,1996,18:445~448.
[收稿日期]1999-07-11 [修回日期]1999-12-09
, http://www.100md.com