bFGF促进内皮细胞β1整合素表达及其意义探讨
作者:周序珑 邓漪平
单位:周序珑(暨南大学医学院病理教研室, 广东 广州 510632);邓漪平(中山医科大学组胚教研室, 广东 广州 510089)
关键词:成纤维细胞生长因子,碱性;结合素类;新生血管化
中国病理生理杂志000611
[摘 要] 目的:观察碱性成纤维细胞生长因子对血管内皮细胞β1整合素表达的影响。方法:采用Western Blot法结合图像处理分析,检测bFGF作用前后培养血管内皮细胞β1整合素的表达。结果:bFGF处理组和对照组平均灰度值分别为166.11±9.86和175.32±5.12,两组免疫酶显色有显著差异。结论:bFGF能够诱导内皮细胞膜表面β1整合素合成增加。推测bFGF通过上调内皮细胞β1整合素表达,可能在促进血管生成方面有重要作用。
, http://www.100md.com
[中图分类号] Q786 [文献标识码] A
[文章编号] 1000-4718(2000)06-0519-03
Effect of bFGF on expression of endothelial cell integrin β1 subunits
ZHOU Xu-long
( Dept. of Pathology, Medical College of Jinan University, Guangzhou 510632, China)
DENG Yi-ping
(Dept. of Histology and Embryology, Sun Yat-Sen University of Medical Science, Guangzhou 510089, China)
, 百拇医药
[Abstract] AIM: To study the effect of basic fibroblast growth factor(bFGF) to the expression of integrin β1 subunit of endothelial cells. METHOD: The expression of integrin β1 subunit of endothelial cells was determined before and after bFGF treatment with Western Blot and immage analysis method.RESULTS: The mean gray value of immunostain by immage analysis method is 166.11±9.86 in the experimental group and 175.32±5.12 in the control group, suggested that bFGF may upregulate expression of integrin β1 subunits of endothelial cell. CONCLUSION: bFGF may play an important role in angiogenesis by way of inducing the overexpression of endothelial cell integrin β1 subunits.
, http://www.100md.com
[MeSH] Fibroblast growth factor,basic; Integrins;Neovascularization
血管生成是胚胎发育中的必然过程,也是组织损伤修复、炎症、类风湿、糖尿病视网膜病、肿瘤的生长和转移等病变过程中的重要一环。血管生成受许多因素的影响,其中碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)起重要的促进作用。实验证明bFGF在促进血管生成方面具有多方面效应,但这种多效作用的机制目前尚不完全清楚。本文采用Western Blot法结合图像处理分析,观察bFGF对血管内皮细胞β1整合素表达的影响,试图阐明bFGF促进血管生成的作用机制。
材 料 和 方 法
一、主要试剂
bFGF(珠海东大生物制剂公司),抗β1整合素抗体、辛基-β-D-吡喃糖苷(octyl-β-D-glucopyranoside)、苯*****(phenylmethylsulfonyl fluoride,PMSF)、抑肽酶、标准分子量蛋白等均购自Sigma公司。
, 百拇医药
二、主要器材
SCR-6型稳流稳压电泳仪(江苏江阴无线电一厂),DYY-Ⅲ28型垂直电泳槽、DYY-Ⅲ40B型电泳槽(均为北京六一仪器厂),GL-20A型低温高速离心机(湖南医疗仪器厂),图像处理分析系统(德国,Kontron IBAS 2.0)。
三、血管内皮细胞的培养与鉴定
长白与大白杂交良种小猪(华南农大荔山种猪场提供),按本室常规方法取主动脉内皮细胞,含15%胎牛血清的M199培养液原代培养并传代,倒置显微镜下形态学鉴定以及内皮细胞Ⅷ:Ag的免疫组化染色鉴定。
四、bFGF对内皮细胞β1整合素表达的影响
(一)内皮细胞膜蛋白的提取 参考Glyman的方法[1]。传代培养第4~5代融合状态内皮细胞,实验组每瓶加含100 ng/mL bFGF的无血清M199培养基2 mL,对照组用无血清M199培养液2 mL, 5% CO2、37℃培养18 h。625 mg.L-1胰酶-100 mg.L-1 EDTA混合液消化细胞1~2 min,加D-Hanks液2 mL,4℃低温条件下用细胞刮刮下细胞后,将细胞悬液并入离心管。离心1 500 r/min, 5 min,弃上清。加预冷的细胞裂解液(含辛基-β-D-吡喃糖苷50 mmol/L、PMSF 1 mmol/L、抑肽酶2 mg/L、硫酸锰1 mmol/L、Triton X-100 1%、叠氮钠0.2 g/L, 用50 mmol/L pH 7.4 Tris-HCl缓冲液配制),4℃裂解细胞1 h。低温离心2次,分别为2 500 r/min,15 min和14 000 r/min,30 min,弃沉渣。上清蛋白质溶液经4℃、0.05 mol/L pH7.6-HCL缓冲液透析48 h,再用聚乙二醇将其浓缩,考马斯亮蓝G250法测定实验组和对照组蛋白质溶液浓度。
, 百拇医药
(二)SDS-PAGE电泳 配制8%分离胶。上样,每孔槽内确保所加样品的蛋白质的总量相等。然后进行电泳,浓缩胶用恒流10 mA,分离胶用恒流18 mA。结束电泳后,将凝胶切成两半,一半做银染,另一半做蛋白质印迹和免疫酶显色。
(三)蛋白质印迹和免疫酶显色 参考《分子克隆实验指南》[2]中方法进行。将滤纸、硝酸纤维素滤膜、凝胶叠放好后,4℃冰箱中恒流60 mA电转移14 h,卸下电泳装置后,将硝酸纤维素滤膜放入培养皿中晾干30~60 min后,加入封闭液,置摇床上室温平缓摇动温育1~2 h,再加含抗β1整合素第一抗体的封闭液(抗体按1∶200配),放摇床4℃平缓摇动过夜,用PBS洗膜3次,每次10 min,加含第二抗体的封闭液(抗体按1∶500配),置摇床上室温平缓摇动1 h,PBS洗膜3次后加DAB显色液,放摇床上平缓摇动,待蛋白条带显色后,用PBS洗膜终止显色,再将滤膜与另一半做银染凝胶比较,确定显色条带的分子量位置,并拍照做永久保存。
, http://www.100md.com
(四)图像处理分析 将硝酸纤维素膜在IBAS图像处理系统中测实验组和对照组显色条带的面积和平均灰度值。实验重复2次,比较bFGF处理组和对照组的显色差别。
结 果
内皮细胞原代培养72~96 h,细胞呈扁平、多边形,细胞境界不清楚,相互呈典型鹅卵石样镶嵌排列,见图1。内皮细胞Ⅷ:Ag的免疫组化染色呈阳性反应,胞浆内含棕黄色阳性反应物质。SDS-PAGE电泳结果见图2。蛋白质转印和免疫酶反应可见在分子量94 kD和116 kD之间有1条阳性反应显色条带,符合整合素β1亚单位的分子量范围。实验重复3次,结果相似,见图3。用IBAS图像处理系统对两条显色条带进行灰度值测定,bFGF处理组和对照组的平均灰度值分别为166.11±9.86和175.32±5.12,两组间有显著差别(P<0.05)。
, http://www.100md.com
Fig 1 Primary cultured endothelial cells in confluence (×100)
图1 原代培养已生长融合的内皮细胞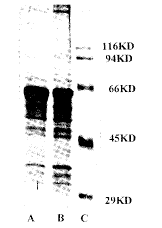
Fig 2 SDS-PAGE electrophoresis for the extraction of endothelial cells
Lane A: bFGF group; Lane B: control group; Lane C: molecular mark
图2 内皮细胞蛋白提取物的SDS-PAGE凝胶电泳
, http://www.100md.com
Fig 3 Immunostain for the Western Blot nitrocellulose filter
Lane A: bFGF group;Lane B: control group
图3 蛋白质印迹的免疫酶显色
讨 论
bFGF是迄今发现的促内皮细胞增殖作用最强的生长因子,很多中胚层来源细胞以及内皮细胞本身都可分泌bFGF[3]。bFGF属单链糖蛋白,分子量16~18 kD。局部组织细胞产生的bFGF以自分泌和旁分泌的形式维持内皮细胞的生长,并能够和基膜细胞外基质(extracellularmatrix,ECM)中的硫酸乙酰肝素结合,以结合型的形式储存在组织中。当组织损伤时,基膜ECM受破坏,原结合的bFGF游离出来,可刺激内皮细胞增殖分化,起促进组织修复的作用[4]。bFGF引起的内皮细胞效应是多方面的。据检测,牛主动脉内皮细胞上有亲合率很高的bFGF受体,约3 000个/每个细胞,且bFGF与细胞膜受体的亲合率很高[5,6]。因此局部组织中微量浓度的bFGF即可引起内皮细胞明显的反应。bFGF引起内皮细胞效应表现出多效性的特点:bFGF有显著的致内皮细胞分裂效应;能促使内皮细胞在ECM上的粘附和迁移;能促进内皮细胞合成ECM成分;bFGF还具有趋化作用,当组织损伤时,内皮细胞的迁移方向与bFGF的浓度梯度呈正相关。目前有关bFGF引起内皮细胞各种效应的研究已有较多报道,但对其引起多效性的机理仍不完全清楚。本文采用Western Blot结合图像处理分析方法,观察bFGF对血管内皮细胞β1整合素表达的影响。结果显示bFGF处理组和对照组平均灰度值分别为166.11±9.86和175.32±5.12,bFGF处理组的显色较对照组深,统计学有显著性差异,表明bFGF能够诱导内皮细胞膜表面β1整合素合成增加。
, http://www.100md.com
整合素属细胞粘附分子中的一大类,其主要作用是介导细胞间相互识别粘附以及细胞与细胞外基质的相互结合。已证实血管内皮细胞表面有多种类型的整合素表达,它们参与内皮细胞间的连接,维持血管的完整性并介导血管内皮通透性调节[7]。整合素β亚单位的胞内段还具有酪氨酸蛋白激酶活性,介导了细胞间以及细胞与ECM间的信号转导。由整合素α和β亚单位胞外段共同构成的结构域能特异识别ECM中多种配体分子上的RGD三肽序列,并通过与这些RGD位点结合,直接介导内皮细胞相互连接和形状的维持,并参与内皮细胞在基质中的粘附和迁移,几乎在血管生成的每一步骤中都起着十分关键的作用[8]。本文证实bFGF可促进内皮细胞β1整合素的表达增加。并据此推测bFGF在促血管生成过程中所具有的多效性特点是通过上调内皮细胞β1整合素表达,从而增强内皮细胞的粘附、识别和迁移等功能,促进血管生成过程。
[参 考 文 献]
, http://www.100md.com [1] Clyman RI, Turner DC, Kramer RH. An α1/β1 integrin receptor on rat aortic smooth muscle cells mediates adhesion to laminin and collagen type I and IV[J]. Arteriosclerosis, 1990, 10(3):402~409.
[2] Sambrook J,Fritsch EF,Maniatis T著. 克隆化基因所表达蛋白质的检测与分析[M].金冬雁, 黎孟枫, 译. 分子克隆实验指南.第2版.北京:科学出版社, 1992. 888~897.
[3] Ishibashi H,Nakagawa K,Nakashima Y,et al. Condition media of carcinoma cells cultured in by hypoxic microenviroment stimulate angiogenesis in vitro; relationship to basic fibroblast growth factor[J]. Virchow Archiev, 1995,425(6):561~565.
, 百拇医药
[4] Mcneil PL,Muthukrishnan L,Warder E,et al. Growth factors are released by mechanically wounded endothelial cells[J]. J Cell Biol, 1989, 109(2):811~822.
[5] Wilting J, Brend SB, Kuaz H, et al. Development of the embryonic vascular system[J]. Cell Mol Biol Res, 1995, 41(4): 219~232.
[6] Neufeld G,Gospodarowicz D. The identification and pastial characterization of the fibroblast growth factor receptor of boby hamster kidney[J]. J Biol Chem, 1985,260(25):13860~13868.
, 百拇医药
[7] Enenstein J. Basic FGF and TGF-beta differentially modulate integrin expression of human microvascular endothelial cells[J]. Exp Cell Res, 1992, 203(2): 499~503.
[8] Lampugnani MG,Resnati M,Dejana E,et al. The role of integrins maitenance of endothelial monolayer integrity[J]. J Cell Biol, 1991, 112(3):479~890.
[收稿日期] 1999-04-15 [修回日期] 1999-06-28
, http://www.100md.com
单位:周序珑(暨南大学医学院病理教研室, 广东 广州 510632);邓漪平(中山医科大学组胚教研室, 广东 广州 510089)
关键词:成纤维细胞生长因子,碱性;结合素类;新生血管化
中国病理生理杂志000611
[摘 要] 目的:观察碱性成纤维细胞生长因子对血管内皮细胞β1整合素表达的影响。方法:采用Western Blot法结合图像处理分析,检测bFGF作用前后培养血管内皮细胞β1整合素的表达。结果:bFGF处理组和对照组平均灰度值分别为166.11±9.86和175.32±5.12,两组免疫酶显色有显著差异。结论:bFGF能够诱导内皮细胞膜表面β1整合素合成增加。推测bFGF通过上调内皮细胞β1整合素表达,可能在促进血管生成方面有重要作用。
, http://www.100md.com
[中图分类号] Q786 [文献标识码] A
[文章编号] 1000-4718(2000)06-0519-03
Effect of bFGF on expression of endothelial cell integrin β1 subunits
ZHOU Xu-long
( Dept. of Pathology, Medical College of Jinan University, Guangzhou 510632, China)
DENG Yi-ping
(Dept. of Histology and Embryology, Sun Yat-Sen University of Medical Science, Guangzhou 510089, China)
, 百拇医药
[Abstract] AIM: To study the effect of basic fibroblast growth factor(bFGF) to the expression of integrin β1 subunit of endothelial cells. METHOD: The expression of integrin β1 subunit of endothelial cells was determined before and after bFGF treatment with Western Blot and immage analysis method.RESULTS: The mean gray value of immunostain by immage analysis method is 166.11±9.86 in the experimental group and 175.32±5.12 in the control group, suggested that bFGF may upregulate expression of integrin β1 subunits of endothelial cell. CONCLUSION: bFGF may play an important role in angiogenesis by way of inducing the overexpression of endothelial cell integrin β1 subunits.
, http://www.100md.com
[MeSH] Fibroblast growth factor,basic; Integrins;Neovascularization
血管生成是胚胎发育中的必然过程,也是组织损伤修复、炎症、类风湿、糖尿病视网膜病、肿瘤的生长和转移等病变过程中的重要一环。血管生成受许多因素的影响,其中碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)起重要的促进作用。实验证明bFGF在促进血管生成方面具有多方面效应,但这种多效作用的机制目前尚不完全清楚。本文采用Western Blot法结合图像处理分析,观察bFGF对血管内皮细胞β1整合素表达的影响,试图阐明bFGF促进血管生成的作用机制。
材 料 和 方 法
一、主要试剂
bFGF(珠海东大生物制剂公司),抗β1整合素抗体、辛基-β-D-吡喃糖苷(octyl-β-D-glucopyranoside)、苯*****(phenylmethylsulfonyl fluoride,PMSF)、抑肽酶、标准分子量蛋白等均购自Sigma公司。
, 百拇医药
二、主要器材
SCR-6型稳流稳压电泳仪(江苏江阴无线电一厂),DYY-Ⅲ28型垂直电泳槽、DYY-Ⅲ40B型电泳槽(均为北京六一仪器厂),GL-20A型低温高速离心机(湖南医疗仪器厂),图像处理分析系统(德国,Kontron IBAS 2.0)。
三、血管内皮细胞的培养与鉴定
长白与大白杂交良种小猪(华南农大荔山种猪场提供),按本室常规方法取主动脉内皮细胞,含15%胎牛血清的M199培养液原代培养并传代,倒置显微镜下形态学鉴定以及内皮细胞Ⅷ:Ag的免疫组化染色鉴定。
四、bFGF对内皮细胞β1整合素表达的影响
(一)内皮细胞膜蛋白的提取 参考Glyman的方法[1]。传代培养第4~5代融合状态内皮细胞,实验组每瓶加含100 ng/mL bFGF的无血清M199培养基2 mL,对照组用无血清M199培养液2 mL, 5% CO2、37℃培养18 h。625 mg.L-1胰酶-100 mg.L-1 EDTA混合液消化细胞1~2 min,加D-Hanks液2 mL,4℃低温条件下用细胞刮刮下细胞后,将细胞悬液并入离心管。离心1 500 r/min, 5 min,弃上清。加预冷的细胞裂解液(含辛基-β-D-吡喃糖苷50 mmol/L、PMSF 1 mmol/L、抑肽酶2 mg/L、硫酸锰1 mmol/L、Triton X-100 1%、叠氮钠0.2 g/L, 用50 mmol/L pH 7.4 Tris-HCl缓冲液配制),4℃裂解细胞1 h。低温离心2次,分别为2 500 r/min,15 min和14 000 r/min,30 min,弃沉渣。上清蛋白质溶液经4℃、0.05 mol/L pH7.6-HCL缓冲液透析48 h,再用聚乙二醇将其浓缩,考马斯亮蓝G250法测定实验组和对照组蛋白质溶液浓度。
, 百拇医药
(二)SDS-PAGE电泳 配制8%分离胶。上样,每孔槽内确保所加样品的蛋白质的总量相等。然后进行电泳,浓缩胶用恒流10 mA,分离胶用恒流18 mA。结束电泳后,将凝胶切成两半,一半做银染,另一半做蛋白质印迹和免疫酶显色。
(三)蛋白质印迹和免疫酶显色 参考《分子克隆实验指南》[2]中方法进行。将滤纸、硝酸纤维素滤膜、凝胶叠放好后,4℃冰箱中恒流60 mA电转移14 h,卸下电泳装置后,将硝酸纤维素滤膜放入培养皿中晾干30~60 min后,加入封闭液,置摇床上室温平缓摇动温育1~2 h,再加含抗β1整合素第一抗体的封闭液(抗体按1∶200配),放摇床4℃平缓摇动过夜,用PBS洗膜3次,每次10 min,加含第二抗体的封闭液(抗体按1∶500配),置摇床上室温平缓摇动1 h,PBS洗膜3次后加DAB显色液,放摇床上平缓摇动,待蛋白条带显色后,用PBS洗膜终止显色,再将滤膜与另一半做银染凝胶比较,确定显色条带的分子量位置,并拍照做永久保存。
, http://www.100md.com
(四)图像处理分析 将硝酸纤维素膜在IBAS图像处理系统中测实验组和对照组显色条带的面积和平均灰度值。实验重复2次,比较bFGF处理组和对照组的显色差别。
结 果
内皮细胞原代培养72~96 h,细胞呈扁平、多边形,细胞境界不清楚,相互呈典型鹅卵石样镶嵌排列,见图1。内皮细胞Ⅷ:Ag的免疫组化染色呈阳性反应,胞浆内含棕黄色阳性反应物质。SDS-PAGE电泳结果见图2。蛋白质转印和免疫酶反应可见在分子量94 kD和116 kD之间有1条阳性反应显色条带,符合整合素β1亚单位的分子量范围。实验重复3次,结果相似,见图3。用IBAS图像处理系统对两条显色条带进行灰度值测定,bFGF处理组和对照组的平均灰度值分别为166.11±9.86和175.32±5.12,两组间有显著差别(P<0.05)。

, http://www.100md.com
Fig 1 Primary cultured endothelial cells in confluence (×100)
图1 原代培养已生长融合的内皮细胞

Fig 2 SDS-PAGE electrophoresis for the extraction of endothelial cells
Lane A: bFGF group; Lane B: control group; Lane C: molecular mark
图2 内皮细胞蛋白提取物的SDS-PAGE凝胶电泳

, http://www.100md.com
Fig 3 Immunostain for the Western Blot nitrocellulose filter
Lane A: bFGF group;Lane B: control group
图3 蛋白质印迹的免疫酶显色
讨 论
bFGF是迄今发现的促内皮细胞增殖作用最强的生长因子,很多中胚层来源细胞以及内皮细胞本身都可分泌bFGF[3]。bFGF属单链糖蛋白,分子量16~18 kD。局部组织细胞产生的bFGF以自分泌和旁分泌的形式维持内皮细胞的生长,并能够和基膜细胞外基质(extracellularmatrix,ECM)中的硫酸乙酰肝素结合,以结合型的形式储存在组织中。当组织损伤时,基膜ECM受破坏,原结合的bFGF游离出来,可刺激内皮细胞增殖分化,起促进组织修复的作用[4]。bFGF引起的内皮细胞效应是多方面的。据检测,牛主动脉内皮细胞上有亲合率很高的bFGF受体,约3 000个/每个细胞,且bFGF与细胞膜受体的亲合率很高[5,6]。因此局部组织中微量浓度的bFGF即可引起内皮细胞明显的反应。bFGF引起内皮细胞效应表现出多效性的特点:bFGF有显著的致内皮细胞分裂效应;能促使内皮细胞在ECM上的粘附和迁移;能促进内皮细胞合成ECM成分;bFGF还具有趋化作用,当组织损伤时,内皮细胞的迁移方向与bFGF的浓度梯度呈正相关。目前有关bFGF引起内皮细胞各种效应的研究已有较多报道,但对其引起多效性的机理仍不完全清楚。本文采用Western Blot结合图像处理分析方法,观察bFGF对血管内皮细胞β1整合素表达的影响。结果显示bFGF处理组和对照组平均灰度值分别为166.11±9.86和175.32±5.12,bFGF处理组的显色较对照组深,统计学有显著性差异,表明bFGF能够诱导内皮细胞膜表面β1整合素合成增加。
, http://www.100md.com
整合素属细胞粘附分子中的一大类,其主要作用是介导细胞间相互识别粘附以及细胞与细胞外基质的相互结合。已证实血管内皮细胞表面有多种类型的整合素表达,它们参与内皮细胞间的连接,维持血管的完整性并介导血管内皮通透性调节[7]。整合素β亚单位的胞内段还具有酪氨酸蛋白激酶活性,介导了细胞间以及细胞与ECM间的信号转导。由整合素α和β亚单位胞外段共同构成的结构域能特异识别ECM中多种配体分子上的RGD三肽序列,并通过与这些RGD位点结合,直接介导内皮细胞相互连接和形状的维持,并参与内皮细胞在基质中的粘附和迁移,几乎在血管生成的每一步骤中都起着十分关键的作用[8]。本文证实bFGF可促进内皮细胞β1整合素的表达增加。并据此推测bFGF在促血管生成过程中所具有的多效性特点是通过上调内皮细胞β1整合素表达,从而增强内皮细胞的粘附、识别和迁移等功能,促进血管生成过程。
[参 考 文 献]
, http://www.100md.com [1] Clyman RI, Turner DC, Kramer RH. An α1/β1 integrin receptor on rat aortic smooth muscle cells mediates adhesion to laminin and collagen type I and IV[J]. Arteriosclerosis, 1990, 10(3):402~409.
[2] Sambrook J,Fritsch EF,Maniatis T著. 克隆化基因所表达蛋白质的检测与分析[M].金冬雁, 黎孟枫, 译. 分子克隆实验指南.第2版.北京:科学出版社, 1992. 888~897.
[3] Ishibashi H,Nakagawa K,Nakashima Y,et al. Condition media of carcinoma cells cultured in by hypoxic microenviroment stimulate angiogenesis in vitro; relationship to basic fibroblast growth factor[J]. Virchow Archiev, 1995,425(6):561~565.
, 百拇医药
[4] Mcneil PL,Muthukrishnan L,Warder E,et al. Growth factors are released by mechanically wounded endothelial cells[J]. J Cell Biol, 1989, 109(2):811~822.
[5] Wilting J, Brend SB, Kuaz H, et al. Development of the embryonic vascular system[J]. Cell Mol Biol Res, 1995, 41(4): 219~232.
[6] Neufeld G,Gospodarowicz D. The identification and pastial characterization of the fibroblast growth factor receptor of boby hamster kidney[J]. J Biol Chem, 1985,260(25):13860~13868.
, 百拇医药
[7] Enenstein J. Basic FGF and TGF-beta differentially modulate integrin expression of human microvascular endothelial cells[J]. Exp Cell Res, 1992, 203(2): 499~503.
[8] Lampugnani MG,Resnati M,Dejana E,et al. The role of integrins maitenance of endothelial monolayer integrity[J]. J Cell Biol, 1991, 112(3):479~890.
[收稿日期] 1999-04-15 [修回日期] 1999-06-28
, http://www.100md.com