脑室注射组胺对下丘脑室旁核促皮质素释放激素神经元的作用
作者:张静 高国全 王竹立 李朝阳 卢光启
单位:张静 王竹立 卢光启(中山医科大学生理教研室 广东 广州 510089);高国全 李朝阳(生化教研室)
关键词:组胺;下丘脑室旁核;促肾上腺皮质素释放激素
中国病理生理杂志000609
[摘 要] 目的:观察第三脑室注射组胺对下丘脑室旁核促皮质素释放激素(CRH)神经元活动的影响。方法:Fos 癌蛋白免疫组化LSAB 法结合双抗原标记法;半定量逆转录聚合酶链反应(RT-PCR)方法。结果:第三脑室注射组胺后,(1)下丘脑室旁核Fos阳性神经元数目明显增加(P<0.05);(2)室旁核内的Fos阳性神经元中约有31.78% 同时呈CRH 阳性反应;(3)室旁核CRH mRNA 含量明显升高,且有量效关系。 结论:中枢组胺可以激活下丘脑室旁核的CRH神经元,并使CRH 基因表达增加。
, 百拇医药
[中图分类号] R338.2+7 [文献标识码] A
[文章编号] 1000-4718(2000)06-0512-04
Effect of intraventricular injection of histamine on corticotropin releasing hormone neurons in paraventricular nucleus of hypothalamus
ZHANG Jing, WANG Zhu-li, LU Guang-qi
(1.Department of Physiology)
GAO Guo-quan, LI Chao-yang
, 百拇医药
(Biochemistry, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China)
[Abstract] AIM:To study the effect of intraventricular injection(icv) of histamine(HA) on corticotropin releasing hormone (CRH) neurons activity in paraventricular nucleus (PVN) of hypothalamus. METHOD: Fos ontogenic protein immunohistochemistry and double antigen immunohistochemistry method; semiquantitative reverse transcription-polymerase chain reaction(RT-PCR) method were used. RESULTS: After intraventricular injection of HA, (1) number of Fos immunnoreactive positive neurons in PVN increased significantly; (2) double labeling experiments showed that there were 31.78%±1.59% of Fos immunoreactive cells in PVN expressed CRH simultaneously; (3) the CRHmRNA level in PVN was increased in a dose-dependent manner. CONCLUSION: Central histamine activated CRH neurons in PVN of hypothalamus and increase the expression of CRH gene.
, http://www.100md.com
[MeSH] Histamine; Paraventricular hypothalamic nucleus; Corticotropin-releasing hormone
组胺(histamine, HA)作为脑内的一种神经递质,参与对内脏活动和激素分泌等功能的调节。本实验室以前的研究提示,HA对五肽促胃液素诱导的胃酸分泌有兴奋和抑制双重效应,且双重效应均可能与脑内促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH)有关[1,2]。另外,有文献报道,中枢注射HA刺激垂体释放促肾上腺皮质激素(adrenocorticotrophic hormone, ACTH )及肾上腺分泌糖皮质激素的作用可能是通过刺激下丘脑CRH的分泌和释放实现的[3]。 但HA是否对下丘脑CRH 神经元有直接刺激作用,尚缺乏确切的证据。 本实验采用免疫组织化学结合双抗原标记法及半定量逆转录聚合酶链反应法,从分子水平和细胞水平两个层次探讨HA对下丘脑室旁核CRH 神经元的刺激作用。
, http://www.100md.com
材 料 和 方 法
一、 实验动物
成年SD雄性健康大鼠,250~300 g,本校实验动物中心提供。
二、 第三脑室埋管及注药法
用1.5%戊巴比妥钠(45~50 mg/kg i p) 麻醉大鼠,按本室常规使用的方法行第三脑室埋管术[1],单笼饲养7~10 d 后,在清醒状态下用自动推注机经埋藏管注射HA。
三、 组织准备
第三脑室注射HA 90 min 后,麻醉大鼠。经心脏灌注生理盐水100 mL冲洗积血,继之灌注4 ℃ 40 g/L 多聚甲醛500 mL 固定,维持约1.5 h。断头取脑,后固定4 h,在含300 g/L 蔗糖的0.1 mol/L PBS 液中浸泡至脑块下沉。自前连合平面至乳头体平面行冠状冰冻切片,片厚40 μm。收集切片于含0.3% H2O2 0.01 mol/L 的PBS中。
, 百拇医药
四、 组织取材及RNA提取
第三脑室注射HA 4 h 后,麻醉大鼠,依靠立体定位仪取出双侧室旁核,按异硫氰酸胍-酚-氯仿一步法提取组织总RNA,用紫外分光光度计精确测定RNA浓度。
五、 免疫组织化学LSAB(labelled streptavidin biotin)法及双抗原标记法
全过程缓冲液为0.01 mol/L 的PBS,pH 7.4~7.6。具体步骤如下:(1)PBS洗切片5 min×3,进入含0.3% Triton X-100 的正常羊血清中室温浸泡30 min;(2)兔抗 c-fos多克隆抗体(1∶1000)4 ℃,48 h;(3)即用型生物素标记的羊抗兔IgG 抗体,4 ℃,8~12 h;(4)即用型辣根过氧化酶标记的链霉卵白素,4 ℃,8~12 h;(5)硫酸镍胺-葡萄糖氧化酶-DAB 加强染色法(GDN 法)显色后,裱片,常规脱水、透明、封片后,光镜下观察结果。以上各步骤间均用PBS 洗切片5 min×3。对照组采用替代实验,用正常血清代替一抗,其余步骤同上,结果均为阴性。
, 百拇医药
经过GDN法显色的切片,用0.01 mol/L 的PBS彻底清洗后,孵育30 min,进入1∶500的兔抗CRH多抗,4 ℃,48 h,随后的过程同单标法,DAB显色。
六、 RT-PCR
PCR引物根据发表的大鼠CRH 的cDNA全序列[4]设计,以cDNA为模板,按94 ℃,60 s, 55 ℃ 60 s,72 ℃ 90 s ,35 个循环的条件进行PCR 扩增,扩增产物用2.0% 琼脂糖凝胶电泳分离,EB染色后,紫外灯下拍照。
七、 图像分析和数据处理
用图像分析系统计数每只动物室旁核的Fos 免疫反应阳性细胞数,并计算双标细胞占Fos 表达细胞的百分比;测量PCR照相底片上电泳条带的积分光密度(IOD)。数据输入计算机用Student-Newman-Keuls(SNK) 方法进行统计学分析。全部数据用均数±标准差(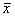 ±s)表示,不同组别间行t检验。
±s)表示,不同组别间行t检验。
, http://www.100md.com
结 果
一、 第三脑室注射HA诱导下丘脑室旁核c-fos基因的表达
6只鼠第三脑室注射HA 10.0 μg/2.0 μL ,90 min后,在下丘脑室旁核内可见密集的Fos蛋白阳性反应细胞,与仅注射生理盐水组相比,差异有显著(P<0.05)。(图1-a,b;表1)。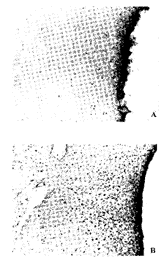
Fig 1 The effect of icv HA on the expression of c-fos gene in paraventricular nucleus (PVN) of hypothalamus(×100)
a: icv NS; b: icv HA
图1 第三脑室注射HA对下丘脑室旁核c-fos基因表达的影响
, 百拇医药
表1 脑室注射HA后,下丘脑室旁核的Fos阳性细胞数(个/核)
Tab 1 Fos immunoreactive neurons in PVN of hypothalamus
after icv HA(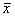 ±s) Group
±s) Group
1
2
3
4
5
6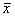 ±s
±s
, 百拇医药
icv NS
57
46
39
41
50
53
47.6±7.0
icv HA
592
612
525
639
, http://www.100md.com
562
541
578.5±43.6*
*P<0.05, vs NS group
二、 双标实验结果
用GDN法将Fos阳性细胞染成蓝黑色,DAB法将CRH细胞染成棕色,结果显示,第三脑室注射HA的大鼠,室旁核内Fos阳性神经元中有(31.78±1.59)% (n=6)同时呈CRH免疫阳性反应(图2)。说明HA激活的室旁核神经元中有部分是CRH神经元。
Fig 2 The result of immunohistochemistry double labeling in PVN after icv 10.0 μg HA (×400)
, 百拇医药
Thin arrow: neurons showing only c-fos immunoreactive nuclei; Thick arrow: neurons contain both c-fos immunoreactive nuclei and CRH-like immunoreactive material
图2 第三脑室注射HA 后室旁核双标结果
三、第三脑室注射HA刺激下丘脑室旁核CRH基因表达
icv NS 组,577 bp处未见电泳条带;icv 10.0 μg、20.0 μg和50.0 μg HA,577bp 处电泳条带的积分光密度分别为34.62±5.67 (n=6)、48.61±6.73 (n=6)和67.26±5.85 (n=6);3组之间的差异有显著(P<0.05)(图3);说明第三脑室注射HA可以增加PVN CRHmRNA含量,且有量效关系。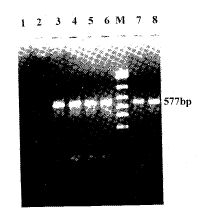
, 百拇医药
Fig 3 The effect of icv HA on the CRHmRNA level in PVN
1,2: icv NS; 3,4: icv 50.0 μg HA; 5,6: icv 20.0 μg HA; 7,8: icv 10.0 μg HA; M: PCR marker (237, 377, 515, 695, 994, 1 543)
图3 第三脑室注射HA对室旁核CRHmRNA水平的影响
讨 论
c-fos是一种存在于正常神经元胞核内的原癌基因,可被多种刺激诱导而快速表达。目前c-fos基因表达法作为显示神经元活动的一种手段已被广泛应用于神经科学,尤其是功能与形态相结合的研究中。由于c-fos基因对外界刺激反应非常敏感,因此实验中严格控制实验条件,尽可能减少非特异性表达是非常重要的。我们在实验中采用慢性埋管术清醒无痛注药方法,避免了创伤、疼痛及麻醉剂的影响。
, 百拇医药
本研究结果表明,HA经第三脑室注射后能诱导室旁核内大量神经元出现Fos阳性反应,说明HA 可以激活室旁核内的神经元;结合双抗原标记结果,在室旁核Fos阳性神经元中有31.78 ±1.59% 同时呈CRH 免疫阳性反应,而且双标细胞主要分布在室旁核内侧,认为HA可以直接激活CRH神经元。但根据上述结果并不能判断CRH神经元的Fos表达是否伴有CRH的合成增加,这也是形态学研究的局限所在。因此,本研究选用了目前测定mRNA较灵敏的RT-PCR方法,测定HA注射前后,室旁核CRHmRNA 水平的变化。发现第三脑室注射HA确实可以升高CRHmRNA 水平,且有量效关系。但CRHmRNA 水平的变化晚于c-fos表达的改变,考虑c-fos基因参与CRH基因表达的调控。Imaki等[5]发现,制动刺激后15 min 在PVN出现c-fos mRNA的快速表达,30 min达到高峰,然后逐渐减弱,90 min后消失;而CRHmRNA的水平到90 min时才开始改变,180 min后升高。本研究在实验过程中也曾观察到,第三脑室注射HA,30 min后c-fos即开始表达,90 min达高峰, 而CRHmRNA的水平在注射HA后2 h 和3 h时明显低于4 h。已知在人的CRH基因的启动子上有几个真核转录因子(AP-1)序列,大鼠和人的CRH基因的5’端区域有高度同源性,所以认为c-fos基因的表达产物与c-jun的表达产物结合而成的Fos-Jun复合物可以和AP-1结合,进一步诱导CRH基因的表达[6]。
, 百拇医药
本实验室以前的功能学研究表明,第三脑室注射HA或H1受体激动剂PEA对五肽促胃液素诱导的胃酸分泌有兴奋和抑制双重效应[1],在双侧肾上腺摘除的大鼠,PEA第三脑室注射抑制胃酸分泌的作用可被预先注射CRH抗血清阻断[7],而在迷走神经切断的大鼠,PEA兴奋胃酸分泌的作用也可因注射CRH抗血清取消[8],说明中枢CRH参与HA及其H1受体激动剂对胃酸分泌的调节作用。Kiar等报道,侧脑室注射HA 270 nmol引起的血浆ACTH水平的升高,可被预先注射CRH抗血清阻断[3],因此推测,中枢HA对胃酸分泌及垂体-肾上腺轴的作用可能都是通过激活CRH神经元,引起CRH合成增加实现的。本研究为这一机制提供了直接依据。另外,有资料表明,CRH本身脑室注射可以抑制狗或大鼠的胃酸分泌[9],室旁核注射也可抑制胃酸分泌[10];而在迷走神经切断的大鼠,CRH表现为对胃酸分泌的增强作用[2],进一步证实了CRH是中枢HA调节胃酸分泌的递质之一。但由于第三脑室注射HA激活的室旁核神经元中只有约1/3是CRH神经元,HA是否还通过其它递质和途径对内脏和内分泌功能起调节作用,尚需进一步探讨。
, 百拇医药
[参 考 文 献]
[1] 王竹立,卢光启. 第三脑室注射组胺及其受体激动剂对五肽促胃液素诱导的大鼠胃酸分泌的影响[J]. 生理学报,1992,44(3):261~268.
[2] 张静,王竹立,卢光启. 第三脑室注射组胺增强五肽促胃液素诱导的胃酸分泌的作用机制[J]. 生理学报,1997,49(4):439~444.
[3] Kiar A, Knigge U, Bach FW, et al. Histamine-and stress-induced secretion of ACTH and β-endorphin: involvement of corticotropin-releasing hormone and vasopressin[J]. Neuroendocrinology,1992, 56:419~428.
, http://www.100md.com
[4] Thompson RC, Seasholtz AF, Herbert E. Rat corticotropin-releasing hormone gene: Sequence and tissue-specific expression[J]. Mol Endocrinol, 1987(1): 363~370.
[5] Imaki T, Shibasaki T, Hotta M, et al. Early induction of c-fos precedes increased expression of corticotropin-releasing factor messenger ribonucleic acid in the paraventricular nucleus after immobilization stress[J]. Endocrinology,1992, 131: 240~246.
[6] Sheng M, Greenberg ME. The regulation and function of c-fos and other immediate early genes in the nervous system[J]. Neuron, 1990, 4: 477~485.
, http://www.100md.com
[7] 李民友,王竹立,卢光启. 组胺H1受体激动剂PEA抑制胃酸分泌效应的中枢机制[J]. 生理学报,1995,47(3):259~262.
[8] 孙成钢,王竹立,王天忠,等. 脑室注射组胺H1受体激动剂对大鼠胃酸分泌的作用机制[J]. 生理学报,1993,45(6):581~586.
[9] Tache Y, Goto Y, Gunion M, et al. Inhibition of gastric acid secretion in rats and in dogs by corticotropin-releasing factor[J]. Gastroenterology, 1984, 86:281~286.
[10] Gunion MW, Tache Y. Intrahypothalamic microinfusion of corticotropin-releasing factor inhibits gastric acid secretion but increases secretion volume in rats[J]. Brain Res, 1987, 411(1): 156~161.
[收稿日期] 1999-03-25 [修回日期] 1999-06-29
, http://www.100md.com
单位:张静 王竹立 卢光启(中山医科大学生理教研室 广东 广州 510089);高国全 李朝阳(生化教研室)
关键词:组胺;下丘脑室旁核;促肾上腺皮质素释放激素
中国病理生理杂志000609
[摘 要] 目的:观察第三脑室注射组胺对下丘脑室旁核促皮质素释放激素(CRH)神经元活动的影响。方法:Fos 癌蛋白免疫组化LSAB 法结合双抗原标记法;半定量逆转录聚合酶链反应(RT-PCR)方法。结果:第三脑室注射组胺后,(1)下丘脑室旁核Fos阳性神经元数目明显增加(P<0.05);(2)室旁核内的Fos阳性神经元中约有31.78% 同时呈CRH 阳性反应;(3)室旁核CRH mRNA 含量明显升高,且有量效关系。 结论:中枢组胺可以激活下丘脑室旁核的CRH神经元,并使CRH 基因表达增加。
, 百拇医药
[中图分类号] R338.2+7 [文献标识码] A
[文章编号] 1000-4718(2000)06-0512-04
Effect of intraventricular injection of histamine on corticotropin releasing hormone neurons in paraventricular nucleus of hypothalamus
ZHANG Jing, WANG Zhu-li, LU Guang-qi
(1.Department of Physiology)
GAO Guo-quan, LI Chao-yang
, 百拇医药
(Biochemistry, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China)
[Abstract] AIM:To study the effect of intraventricular injection(icv) of histamine(HA) on corticotropin releasing hormone (CRH) neurons activity in paraventricular nucleus (PVN) of hypothalamus. METHOD: Fos ontogenic protein immunohistochemistry and double antigen immunohistochemistry method; semiquantitative reverse transcription-polymerase chain reaction(RT-PCR) method were used. RESULTS: After intraventricular injection of HA, (1) number of Fos immunnoreactive positive neurons in PVN increased significantly; (2) double labeling experiments showed that there were 31.78%±1.59% of Fos immunoreactive cells in PVN expressed CRH simultaneously; (3) the CRHmRNA level in PVN was increased in a dose-dependent manner. CONCLUSION: Central histamine activated CRH neurons in PVN of hypothalamus and increase the expression of CRH gene.
, http://www.100md.com
[MeSH] Histamine; Paraventricular hypothalamic nucleus; Corticotropin-releasing hormone
组胺(histamine, HA)作为脑内的一种神经递质,参与对内脏活动和激素分泌等功能的调节。本实验室以前的研究提示,HA对五肽促胃液素诱导的胃酸分泌有兴奋和抑制双重效应,且双重效应均可能与脑内促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH)有关[1,2]。另外,有文献报道,中枢注射HA刺激垂体释放促肾上腺皮质激素(adrenocorticotrophic hormone, ACTH )及肾上腺分泌糖皮质激素的作用可能是通过刺激下丘脑CRH的分泌和释放实现的[3]。 但HA是否对下丘脑CRH 神经元有直接刺激作用,尚缺乏确切的证据。 本实验采用免疫组织化学结合双抗原标记法及半定量逆转录聚合酶链反应法,从分子水平和细胞水平两个层次探讨HA对下丘脑室旁核CRH 神经元的刺激作用。
, http://www.100md.com
材 料 和 方 法
一、 实验动物
成年SD雄性健康大鼠,250~300 g,本校实验动物中心提供。
二、 第三脑室埋管及注药法
用1.5%戊巴比妥钠(45~50 mg/kg i p) 麻醉大鼠,按本室常规使用的方法行第三脑室埋管术[1],单笼饲养7~10 d 后,在清醒状态下用自动推注机经埋藏管注射HA。
三、 组织准备
第三脑室注射HA 90 min 后,麻醉大鼠。经心脏灌注生理盐水100 mL冲洗积血,继之灌注4 ℃ 40 g/L 多聚甲醛500 mL 固定,维持约1.5 h。断头取脑,后固定4 h,在含300 g/L 蔗糖的0.1 mol/L PBS 液中浸泡至脑块下沉。自前连合平面至乳头体平面行冠状冰冻切片,片厚40 μm。收集切片于含0.3% H2O2 0.01 mol/L 的PBS中。
, 百拇医药
四、 组织取材及RNA提取
第三脑室注射HA 4 h 后,麻醉大鼠,依靠立体定位仪取出双侧室旁核,按异硫氰酸胍-酚-氯仿一步法提取组织总RNA,用紫外分光光度计精确测定RNA浓度。
五、 免疫组织化学LSAB(labelled streptavidin biotin)法及双抗原标记法
全过程缓冲液为0.01 mol/L 的PBS,pH 7.4~7.6。具体步骤如下:(1)PBS洗切片5 min×3,进入含0.3% Triton X-100 的正常羊血清中室温浸泡30 min;(2)兔抗 c-fos多克隆抗体(1∶1000)4 ℃,48 h;(3)即用型生物素标记的羊抗兔IgG 抗体,4 ℃,8~12 h;(4)即用型辣根过氧化酶标记的链霉卵白素,4 ℃,8~12 h;(5)硫酸镍胺-葡萄糖氧化酶-DAB 加强染色法(GDN 法)显色后,裱片,常规脱水、透明、封片后,光镜下观察结果。以上各步骤间均用PBS 洗切片5 min×3。对照组采用替代实验,用正常血清代替一抗,其余步骤同上,结果均为阴性。
, 百拇医药
经过GDN法显色的切片,用0.01 mol/L 的PBS彻底清洗后,孵育30 min,进入1∶500的兔抗CRH多抗,4 ℃,48 h,随后的过程同单标法,DAB显色。
六、 RT-PCR
PCR引物根据发表的大鼠CRH 的cDNA全序列[4]设计,以cDNA为模板,按94 ℃,60 s, 55 ℃ 60 s,72 ℃ 90 s ,35 个循环的条件进行PCR 扩增,扩增产物用2.0% 琼脂糖凝胶电泳分离,EB染色后,紫外灯下拍照。
七、 图像分析和数据处理
用图像分析系统计数每只动物室旁核的Fos 免疫反应阳性细胞数,并计算双标细胞占Fos 表达细胞的百分比;测量PCR照相底片上电泳条带的积分光密度(IOD)。数据输入计算机用Student-Newman-Keuls(SNK) 方法进行统计学分析。全部数据用均数±标准差(
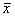 ±s)表示,不同组别间行t检验。
±s)表示,不同组别间行t检验。, http://www.100md.com
结 果
一、 第三脑室注射HA诱导下丘脑室旁核c-fos基因的表达
6只鼠第三脑室注射HA 10.0 μg/2.0 μL ,90 min后,在下丘脑室旁核内可见密集的Fos蛋白阳性反应细胞,与仅注射生理盐水组相比,差异有显著(P<0.05)。(图1-a,b;表1)。

Fig 1 The effect of icv HA on the expression of c-fos gene in paraventricular nucleus (PVN) of hypothalamus(×100)
a: icv NS; b: icv HA
图1 第三脑室注射HA对下丘脑室旁核c-fos基因表达的影响
, 百拇医药
表1 脑室注射HA后,下丘脑室旁核的Fos阳性细胞数(个/核)
Tab 1 Fos immunoreactive neurons in PVN of hypothalamus
after icv HA(
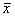 ±s) Group
±s) Group1
2
3
4
5
6
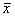 ±s
±s, 百拇医药
icv NS
57
46
39
41
50
53
47.6±7.0
icv HA
592
612
525
639
, http://www.100md.com
562
541
578.5±43.6*
*P<0.05, vs NS group
二、 双标实验结果
用GDN法将Fos阳性细胞染成蓝黑色,DAB法将CRH细胞染成棕色,结果显示,第三脑室注射HA的大鼠,室旁核内Fos阳性神经元中有(31.78±1.59)% (n=6)同时呈CRH免疫阳性反应(图2)。说明HA激活的室旁核神经元中有部分是CRH神经元。

Fig 2 The result of immunohistochemistry double labeling in PVN after icv 10.0 μg HA (×400)
, 百拇医药
Thin arrow: neurons showing only c-fos immunoreactive nuclei; Thick arrow: neurons contain both c-fos immunoreactive nuclei and CRH-like immunoreactive material
图2 第三脑室注射HA 后室旁核双标结果
三、第三脑室注射HA刺激下丘脑室旁核CRH基因表达
icv NS 组,577 bp处未见电泳条带;icv 10.0 μg、20.0 μg和50.0 μg HA,577bp 处电泳条带的积分光密度分别为34.62±5.67 (n=6)、48.61±6.73 (n=6)和67.26±5.85 (n=6);3组之间的差异有显著(P<0.05)(图3);说明第三脑室注射HA可以增加PVN CRHmRNA含量,且有量效关系。

, 百拇医药
Fig 3 The effect of icv HA on the CRHmRNA level in PVN
1,2: icv NS; 3,4: icv 50.0 μg HA; 5,6: icv 20.0 μg HA; 7,8: icv 10.0 μg HA; M: PCR marker (237, 377, 515, 695, 994, 1 543)
图3 第三脑室注射HA对室旁核CRHmRNA水平的影响
讨 论
c-fos是一种存在于正常神经元胞核内的原癌基因,可被多种刺激诱导而快速表达。目前c-fos基因表达法作为显示神经元活动的一种手段已被广泛应用于神经科学,尤其是功能与形态相结合的研究中。由于c-fos基因对外界刺激反应非常敏感,因此实验中严格控制实验条件,尽可能减少非特异性表达是非常重要的。我们在实验中采用慢性埋管术清醒无痛注药方法,避免了创伤、疼痛及麻醉剂的影响。
, 百拇医药
本研究结果表明,HA经第三脑室注射后能诱导室旁核内大量神经元出现Fos阳性反应,说明HA 可以激活室旁核内的神经元;结合双抗原标记结果,在室旁核Fos阳性神经元中有31.78 ±1.59% 同时呈CRH 免疫阳性反应,而且双标细胞主要分布在室旁核内侧,认为HA可以直接激活CRH神经元。但根据上述结果并不能判断CRH神经元的Fos表达是否伴有CRH的合成增加,这也是形态学研究的局限所在。因此,本研究选用了目前测定mRNA较灵敏的RT-PCR方法,测定HA注射前后,室旁核CRHmRNA 水平的变化。发现第三脑室注射HA确实可以升高CRHmRNA 水平,且有量效关系。但CRHmRNA 水平的变化晚于c-fos表达的改变,考虑c-fos基因参与CRH基因表达的调控。Imaki等[5]发现,制动刺激后15 min 在PVN出现c-fos mRNA的快速表达,30 min达到高峰,然后逐渐减弱,90 min后消失;而CRHmRNA的水平到90 min时才开始改变,180 min后升高。本研究在实验过程中也曾观察到,第三脑室注射HA,30 min后c-fos即开始表达,90 min达高峰, 而CRHmRNA的水平在注射HA后2 h 和3 h时明显低于4 h。已知在人的CRH基因的启动子上有几个真核转录因子(AP-1)序列,大鼠和人的CRH基因的5’端区域有高度同源性,所以认为c-fos基因的表达产物与c-jun的表达产物结合而成的Fos-Jun复合物可以和AP-1结合,进一步诱导CRH基因的表达[6]。
, 百拇医药
本实验室以前的功能学研究表明,第三脑室注射HA或H1受体激动剂PEA对五肽促胃液素诱导的胃酸分泌有兴奋和抑制双重效应[1],在双侧肾上腺摘除的大鼠,PEA第三脑室注射抑制胃酸分泌的作用可被预先注射CRH抗血清阻断[7],而在迷走神经切断的大鼠,PEA兴奋胃酸分泌的作用也可因注射CRH抗血清取消[8],说明中枢CRH参与HA及其H1受体激动剂对胃酸分泌的调节作用。Kiar等报道,侧脑室注射HA 270 nmol引起的血浆ACTH水平的升高,可被预先注射CRH抗血清阻断[3],因此推测,中枢HA对胃酸分泌及垂体-肾上腺轴的作用可能都是通过激活CRH神经元,引起CRH合成增加实现的。本研究为这一机制提供了直接依据。另外,有资料表明,CRH本身脑室注射可以抑制狗或大鼠的胃酸分泌[9],室旁核注射也可抑制胃酸分泌[10];而在迷走神经切断的大鼠,CRH表现为对胃酸分泌的增强作用[2],进一步证实了CRH是中枢HA调节胃酸分泌的递质之一。但由于第三脑室注射HA激活的室旁核神经元中只有约1/3是CRH神经元,HA是否还通过其它递质和途径对内脏和内分泌功能起调节作用,尚需进一步探讨。
, 百拇医药
[参 考 文 献]
[1] 王竹立,卢光启. 第三脑室注射组胺及其受体激动剂对五肽促胃液素诱导的大鼠胃酸分泌的影响[J]. 生理学报,1992,44(3):261~268.
[2] 张静,王竹立,卢光启. 第三脑室注射组胺增强五肽促胃液素诱导的胃酸分泌的作用机制[J]. 生理学报,1997,49(4):439~444.
[3] Kiar A, Knigge U, Bach FW, et al. Histamine-and stress-induced secretion of ACTH and β-endorphin: involvement of corticotropin-releasing hormone and vasopressin[J]. Neuroendocrinology,1992, 56:419~428.
, http://www.100md.com
[4] Thompson RC, Seasholtz AF, Herbert E. Rat corticotropin-releasing hormone gene: Sequence and tissue-specific expression[J]. Mol Endocrinol, 1987(1): 363~370.
[5] Imaki T, Shibasaki T, Hotta M, et al. Early induction of c-fos precedes increased expression of corticotropin-releasing factor messenger ribonucleic acid in the paraventricular nucleus after immobilization stress[J]. Endocrinology,1992, 131: 240~246.
[6] Sheng M, Greenberg ME. The regulation and function of c-fos and other immediate early genes in the nervous system[J]. Neuron, 1990, 4: 477~485.
, http://www.100md.com
[7] 李民友,王竹立,卢光启. 组胺H1受体激动剂PEA抑制胃酸分泌效应的中枢机制[J]. 生理学报,1995,47(3):259~262.
[8] 孙成钢,王竹立,王天忠,等. 脑室注射组胺H1受体激动剂对大鼠胃酸分泌的作用机制[J]. 生理学报,1993,45(6):581~586.
[9] Tache Y, Goto Y, Gunion M, et al. Inhibition of gastric acid secretion in rats and in dogs by corticotropin-releasing factor[J]. Gastroenterology, 1984, 86:281~286.
[10] Gunion MW, Tache Y. Intrahypothalamic microinfusion of corticotropin-releasing factor inhibits gastric acid secretion but increases secretion volume in rats[J]. Brain Res, 1987, 411(1): 156~161.
[收稿日期] 1999-03-25 [修回日期] 1999-06-29
, http://www.100md.com