力竭性游泳对大鼠心肌线粒体基质游离Ca2+及Na+/Ca2+交换的影响
作者:连克杰 丁树哲 许豪文
单位:河北师范大学体育系(石家庄050016)连克杰 丁树哲;华东师范大学体育系 许豪文
关键词:
中国运动医学杂志980306提要 应用荧光Ca2+指示剂Fura-2 AM测定大鼠心肌线粒体基质游离Ca2+浓度变化,观察到力竭性游泳后心肌线粒体内游离Ca2+浓度下降(P<0.05),在介质中加0.5μmol/L Ca2+时,表现出摄钙能力(P<0.001),但能力下降(P<0.05),对线粒体外Ca2+浓度变化的应答敏感性下降。在线粒体负载Ca2+条件下,Na+依赖性Ca2+释放(Na+/Ca2+交换)能力下降(P<0.05),因此线粒体不能及时反映心肌需能的变化,表现出氧化磷酸化的失调。文中探讨了线粒体Ca2+转动变化的机制和生理意义。
, 百拇医药
Effect of Exhaustive Swimming on Myocardial Mitochondrial Matrix
Free Ca2+ and Na+/Ca2+ Exchange in Rats
Lian Kejie, et al
Dept. of Physical Education, Hebei Normal University, Shijiazhuang, 050016
Using fluoresence technique with Fura-2AM as Ca2+ indicator for investigating the change in myocardial mitochondrial matrix free Ca2+ concentration in rats, the present study showed that the mitochondrial free Ca2+ level decreased after exhaustive swimming (P>0.05). As the incubation contains 0.5 μmol/L CaCl2, the mitochondria demonstrated the decreased ability of Ca2+-uptake after exhaustive swimming(P<0.05). It also showed that the mitochondrial response to changes of the incubation's Ca2+ concentration was desensitized. The ability of Na+-dependent Ca2+ release from Ca2+-loaded mitochondria after exhaustive swimming decreased(P<0.05).Therefore, the mitochondrial oxidative metabolism was not able to keep pace with the myocardial energy requirement, showing the disorder of oxidative phosphorylation. In the paper, the mechanisms of the change in mitochondrial Ca2+ transport and its physiological signification were discussed.
, 百拇医药
Key words: exhaustive swimming, myocardial mitochondial, mitochondrial matrix free Ca2+,Na+-dependent Ca2+ release, fura-2
长时间力竭性游泳后心脏肌组织细胞内氧化磷酸化调控发生了变化,造成这种变化的因素是多方面的。近来人们对Ca2+对细胞功能的调控作用有了较多的认识,但关于力竭运动后,Ca2+对心肌功能的调节作用则报道甚少,特别是由线粒体Ca2+转运机能的改变而造成的线粒体基质游离Ca2+水平的变化情况,尚未见报道。本工作采用荧光Ca2+指示剂Fura-2AM测定线粒体基质游离Ca2+浓度变化的方法,着重研究了力竭性游泳后大鼠心肌线粒体在不同外Ca2+浓度时基质游离Ca2+浓度的应答性(Ca2+摄取)变化情况和特异性Ca2+释放通道——Na+依赖性Ca2+释放(Na+/Ca2+交换)过程,探讨了心肌在运动负荷后线粒体Ca2+转动变化的机制和氧化磷酸化调控变化的作用机理。
, 百拇医药
1 材料和方法
1.1 材料
Fura-2AM、MOPS、EGTA、Glutamate、Malate、DOC、钌红(RR)系Sigma公司产品;CaCl2、KCl、NaCl为国产基准试剂;其他为国产分析纯。
1.2 方法
1.2.1 动物分组和运动模型
取250-300g雄性SD大鼠(中外合资西普尔—毕凯实验动物有限公司提供),随机分为对照组和力竭性游泳组,实验前12h均禁食,自由饮水。对照组大鼠在实验前置于水深约2cm,水温31℃的水槽中10min;力竭性游泳组大鼠在长100cm、宽50cm、水深45cm、水温31±1℃的玻璃槽中游泳至力竭,以在水面下10S不能上浮为力竭判断标准,然后断头取材。
, http://www.100md.com
1.2.2 心肌线粒体分离及线粒体负载Fura-2的方法
心肌线粒体分离按Vaghy方法[1]。分离出的线粒体用180mmol/L KCl溶液洗两次并悬浮于其中。蛋白质定量采用Bradford方法[2]。心肌线粒体负载Fura-2的方法是将线粒体5mg/L在测试介质液中与10μmol/L Fura-2AM 30℃温育10min,0-4℃离心并用预冷的180mmol/L KCl溶液洗涤两次除去多余的Fura-2AM,并将负载Fura-2的线粒体悬浮于180mmol/L KCl溶液中,待用。测试介质液成份:120mmol/L KCl, 10mmol/L MOPS,5mmol/L glatamate, 5mmol/L malate, PH7.0,全过程避光操作。
1.2.3 心肌线粒体基质游离Ca2+浓度测定方法
心肌线粒体内游离Ca2+浓度测定按Gunter[3]方法,但稍加改进。在测试介质中加入0.5mg Fura-2负载后的线粒体36.8-37℃温育5min,反应体系为2ml,其它条件见图,表所示。在RF—540型岛津荧光分光光度计上,分别测定正常时,线粒体破膜后饱和钙及无钙(EGTA络合)3种情况下荧光强度,激发波长340nm和380nm,发射波长505nm,狭缝10nm。
, 百拇医药
实验数据以均数±标准差表示,两样本以均数t检验进行分析。
2 实验结果
对照组和力竭性游泳组心肌线粒体在不同条件下基质游离Ca2+浓度列于表中。A组为线粒体外无外加Ca2+时的情况,可以看出,力竭性游泳组线粒体基质游离Ca2+浓度低于对照组(P<0.05),提示线粒体Ca2+转动过程已发生变化。
B组为线粒体在外加0.5μmol/L Ca2+时的情况(所用线粒体为重新加样,非A组的),结果表明,两组心肌线粒体均有大量Ca2+摄取(P<0.001),但对游离Ca2+水平比较,力竭性游泳组明显低于对照组(P<0.05),表明维持线粒体膜内外Ca2+浓度梯度能力下降。
, 百拇医药
对线粒体内Ca2+浓度净增加量(B组线粒体内游离Ca2+浓度减去A组线粒体内游离Ca2+浓度所得的差数,B-A组)比较发现,力竭性游泳组明显低于对照组(P<0.05),表明力竭性游泳后心肌线粒体Ca2+摄取能力下降。
表1 力竭性游泳时Fura-2负载的大鼠心肌线粒体Ca2+摄取和Na+依赖性Ca2+翻译的影响
Table 1 Effect of exhaustive swimming on Ca2+ uptake by and Na+-dependent Ca2+
release from fura-2-loaded cardiac mitochondria in rats Group
, 百拇医药
Addition to mitochondrial
incubation
Mitochondrial matrix free [Ca2+] (nM)
Control
n
Swimming
n
Ca2+ uptake
A
B
B-A
, 百拇医药
Na+-dependent
Ca2+ release
C
B-C
None
0.5μΜ CaCl2
1μΜ RR plus
10mM NaCl
in B
419.59±187.04
1726.05±257.26
, 百拇医药
1306.46±217.62
411.06±87.53
1315.00±90.16
8
8
6
230.16±100.19*
1124.52±180.59*
894.39±190.37*
389.77±148.23**
, 百拇医药 811.77±139.52*
8
7
6
t=test *P<0.05 **P>0.05
表中C组是在线粒体负荷Ca2+后用钌红(RR)阻断摄钙过程,加Na+并达平衡后的基质游离Ca2+水平。结果表明,Na+依赖性Ca2+释放后两组线粒体基质游离Ca2+浓度无显著差异(P>0.05),与B组比较均有Ca2+释放发生(P<0.001,表中未标)。但对两组净释放量(B-C组)进行比较发现,力竭性游泳组明显低于对照组(P<0.05),表明力竭性游泳后心肌线粒体Na+依赖性Ca2+释放能力降低。
, http://www.100md.com
图1是对照组和力竭性游泳组心肌线粒体在相同条件下,在不同外Ca2+浓度时基质游离Ca2+浓度应答性变化的情况。结果表明两组线粒体均随外Ca2+的增加而增加,均表现为主动摄钙能力。但力竭性游泳组心肌线粒体内游离Ca2+的增加低于对照组,提示力竭性游泳后心肌线粒体对胞浆Ca2+浓度变化的敏感性下降。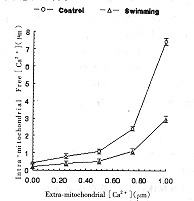
Extra-mitochondrial [Ca2+](μm)
图1 对照组和力竭性游泳组Fura-2负载的大鼠心
肌线粒体外Ca2+浓度与内Ca2+浓度间的关系
, http://www.100md.com
Fig 1 Relationship between extra- and intra-mito-
chondrial [Ca2+] in control and exhaustive
swimming fura-2-loaded rat heart mitochondria.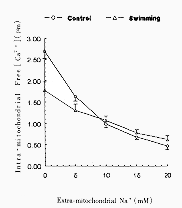
Extra-mitochondrial Na+ (mM)
图2 对照组和力竭性游泳组Fura-2负载的心肌线
粒体外Na+浓度的增加对内[Ca2+]的影响
, 百拇医药
Fig 2 Effects of increases in extra-mitochondrial Na+ on
intra-mitochondrial [Ca2+] in control and exhaustive
swimming fura-2-loaded rat heart mitochondria.
图2是对照组和力竭性游泳组心肌线粒体Ca2+负荷后在线粒体外Na+逐渐增加时,基质游离Ca2+水平的下降情况。结果表明,两组基质游离Ca2+浓度均随线粒体外Na+浓度的增加而下降,均具有Na+诱导Ca2+释放能力,但力竭性游泳组的Ca2+释放低于对照组。
, 百拇医药
3 讨论
心脏每次跳动时ATP的消耗主要用于肌纤维的收缩和肌细胞膜对Ca2+、Na+等离子的转运。目前认为,线粒体ATP生成较直接的调控因素是肌细胞内Ca2+水平[4]。心肌细胞内Ca2+浓度的增加可通过线粒体Ca2+摄取而使心肌线粒体内游离Ca2+水平上升,刺激其中的Ca2+敏感酶:丙酮酸脱氢酶系、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶的活性,导致NADH增加。此外,Ca2+还可作用于H+-ATPase上F1的Ca2+-依赖抑制蛋白(CaBI),解除其抑制作用,增加ATP生成[5]。线粒体Ca2+释放过程则可降低这一刺激作用,对心脏功能同样具有重要意义。
, 百拇医药 力竭性游泳是一运动性疲劳的动物模型。在实验中发现,力竭性游泳后,心肌线粒体Ca2+转运发生了改变。线粒体基质游离Ca2+浓度下降(表A组),表明Ca2+刺激线粒体ATP生成作用降低,同文献报道一致[6]。在外界Ca2+浓度为0.5μmol/L时,力竭性游泳组心肌线粒体基质游离Ca2+浓度低于对照组。线粒体Ca2+摄取是由其膜内外H+电化学梯度供能而完成的,在达到平衡后,由Ca2+形成的跨膜电位差符合下列Nernst方程:Δψ=(2.303RT/2F)*log([Ca2+]in/[Ca2+]out),如果按温度为37℃,线粒体外[Ca2+]为500nmol/L计算,可得对照组Δψ=108.9mV,力竭性游泳组Δψ=69.2mV。这一结果表明,在同等条件下,力竭性游泳后心肌线粒体质子跨膜电位下降,同用荧光法测定线粒体膜表面电位下降的结果相符[6],因此这一机能变化与线粒体呼吸链机能下降有密切关系。图1则反映了线粒体外Ca2+浓度的改变对其基质游离Ca2+水平变化的情况。可以看出,力竭性游泳组线粒体基质游离Ca2+浓度随介质中Ca2+浓度增加的幅度明显低于对照组,对线粒体外Ca2+浓度增加的应答敏感性降低。
, 百拇医药
心肌、骨骼肌、脑等组织的线粒体Ca2+释放主要是特异性快速的Na+依赖性Ca2+释放,为酶学乒乓机制(Ping Pong Machanism)[7],此过程为逆电化学梯度的耗能过程,能量最终来源为线粒体跨膜质子梯度。力竭性游泳后,心肌线粒体仍具有Na+/Ca2+交换能力(表中C组),但这一能力明显下降(表中B-C组,图2进一步表明了这一下降趋势。关于Na+/Ca2+交换能力下降的原因现仍不十分清楚,由于其能量来源为线粒体氧化代谢,故线粒体膜电位的下降是其重要原因之一。此外,Na+依赖性线粒体Ca2+释放的下降,加之心肌细胞内高钙[8]进一步对其抑制,势必导致Ca2+在线粒体中一定时间内(未疲劳前)大量积聚,由此而激活磷酯酶A2并抑制焦磷酸酶的活性。磷酯酶A2活性增加等因素可导致线粒体非特异孔道打开[9],释放Ca2+;焦磷酸酶活性下降使PPi含量上升,从而进一步引起磷酸钙沉淀生成增加[10],结果导致心肌线粒体游离Ca2+浓度下降,氧化磷酸化能力也随之下降,这又使得心肌细胞膜对Ca2+、Na+向膜外的正常转运受到影响,由此而导致疲劳的发生。
, 百拇医药
心肌线粒体Ca2+摄取及释放速率慢于每次心脏跳动时肌细胞内Ca2+浓度变化速率,线粒体基质游离Ca2+浓度只是反映心肌细胞内时间平均游离Ca2+浓度(the time - average cytoplasmic free Ca2+ concentration)。心脏在受到激素等外界刺激后,心跳加快,肌细胞内游离Ca2+时间平均浓度升高,线粒体基质游离Ca2+浓度应答性增高,刺激了氧化磷酸化,从而使心肌的收缩与线粒体的供能一致。心肌线粒体Ca2+释放的生理意义主要在于消除线粒体旧的供能信息,以便接受新的变化刺激[9]。力竭性游泳后,心肌线粒体对胞浆Ca2+浓度变化的应答敏感性下降,Na+依赖性线粒体Ca2+释放能力下降,使基质中游离Ca2+水平较长时间保持原有信息水平,因此不能及时反映心肌需能的变化,表现出心肌细胞内氧化磷酸化的失调,限制了进一步的运动活动。另一方面,在心脏停止外界刺激后,线粒体Na+依赖性Ca2+释放下降使得刺激线粒体氧化磷酸化的钙离子浓度信息不能同时解除,有利于恢复,并可能为运动后“氧债”的原因之一。
, http://www.100md.com
*国家自然科学基金资助项目
4 参考文献
1.Vaghy PL., et al. Selective inhibition of Na+ induced Ca2+ -release from heart mitochondria by diltiazem and certain other antagonist drugs. J. Biol. Chem. 1982,257:6000-6002.
2.Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein. J.Biol. Chem., 1976.72:248-254.
3.Gunter T E., Restrepo D, and Gunter K K. Conversion of esterified fura-1 to Ca2+-sentive forms by mitochondria. Am. J. Physiol. 1988,255,C304-C310.
, http://www.100md.com
4.Balavan R S. Regulation of oxidativ phosphorylation in the mammalian cell. Am. J. physiol. 1990,258:C377-C389.
5.Harris D A, and DAS A M. Control of mitochondrial ATP synthesis in the heart. Biochem. J. 1991,280:C561-573.
6.王文信,丁树哲,许豪文.耗竭性游泳对大鼠心肌线粒体膜功能的影响。生物化学与生物物理学报,1994,26(2):246-248.
7.Havat L J and M Crompton. Evidence for the exitence of regulatory sites for Ca2+ on the Na+/Ca2+ carrier of cardiac mitochondria. Biochem. J. 1982,202:509-518.
, 百拇医药
8.丁树哲,许豪文,程伯基.疲劳运动后大鼠心肌线粒体的研究。中国运动医学杂志,1992,11(1):22-26.
9.Gunter T E and Pfeiffer D r. Mechanisms which mitochondria transport calcium. Am. J. Physiol. 1990,258:C755-786.
10.Mccorack J G. Role of calcium ions in regulations of mammalian intramitochondrial metabolism. Physiol. Rev., 1990,70:391-416.
(1997.09.08收稿), http://www.100md.com
单位:河北师范大学体育系(石家庄050016)连克杰 丁树哲;华东师范大学体育系 许豪文
关键词:
中国运动医学杂志980306提要 应用荧光Ca2+指示剂Fura-2 AM测定大鼠心肌线粒体基质游离Ca2+浓度变化,观察到力竭性游泳后心肌线粒体内游离Ca2+浓度下降(P<0.05),在介质中加0.5μmol/L Ca2+时,表现出摄钙能力(P<0.001),但能力下降(P<0.05),对线粒体外Ca2+浓度变化的应答敏感性下降。在线粒体负载Ca2+条件下,Na+依赖性Ca2+释放(Na+/Ca2+交换)能力下降(P<0.05),因此线粒体不能及时反映心肌需能的变化,表现出氧化磷酸化的失调。文中探讨了线粒体Ca2+转动变化的机制和生理意义。
, 百拇医药
Effect of Exhaustive Swimming on Myocardial Mitochondrial Matrix
Free Ca2+ and Na+/Ca2+ Exchange in Rats
Lian Kejie, et al
Dept. of Physical Education, Hebei Normal University, Shijiazhuang, 050016
Using fluoresence technique with Fura-2AM as Ca2+ indicator for investigating the change in myocardial mitochondrial matrix free Ca2+ concentration in rats, the present study showed that the mitochondrial free Ca2+ level decreased after exhaustive swimming (P>0.05). As the incubation contains 0.5 μmol/L CaCl2, the mitochondria demonstrated the decreased ability of Ca2+-uptake after exhaustive swimming(P<0.05). It also showed that the mitochondrial response to changes of the incubation's Ca2+ concentration was desensitized. The ability of Na+-dependent Ca2+ release from Ca2+-loaded mitochondria after exhaustive swimming decreased(P<0.05).Therefore, the mitochondrial oxidative metabolism was not able to keep pace with the myocardial energy requirement, showing the disorder of oxidative phosphorylation. In the paper, the mechanisms of the change in mitochondrial Ca2+ transport and its physiological signification were discussed.
, 百拇医药
Key words: exhaustive swimming, myocardial mitochondial, mitochondrial matrix free Ca2+,Na+-dependent Ca2+ release, fura-2
长时间力竭性游泳后心脏肌组织细胞内氧化磷酸化调控发生了变化,造成这种变化的因素是多方面的。近来人们对Ca2+对细胞功能的调控作用有了较多的认识,但关于力竭运动后,Ca2+对心肌功能的调节作用则报道甚少,特别是由线粒体Ca2+转运机能的改变而造成的线粒体基质游离Ca2+水平的变化情况,尚未见报道。本工作采用荧光Ca2+指示剂Fura-2AM测定线粒体基质游离Ca2+浓度变化的方法,着重研究了力竭性游泳后大鼠心肌线粒体在不同外Ca2+浓度时基质游离Ca2+浓度的应答性(Ca2+摄取)变化情况和特异性Ca2+释放通道——Na+依赖性Ca2+释放(Na+/Ca2+交换)过程,探讨了心肌在运动负荷后线粒体Ca2+转动变化的机制和氧化磷酸化调控变化的作用机理。
, 百拇医药
1 材料和方法
1.1 材料
Fura-2AM、MOPS、EGTA、Glutamate、Malate、DOC、钌红(RR)系Sigma公司产品;CaCl2、KCl、NaCl为国产基准试剂;其他为国产分析纯。
1.2 方法
1.2.1 动物分组和运动模型
取250-300g雄性SD大鼠(中外合资西普尔—毕凯实验动物有限公司提供),随机分为对照组和力竭性游泳组,实验前12h均禁食,自由饮水。对照组大鼠在实验前置于水深约2cm,水温31℃的水槽中10min;力竭性游泳组大鼠在长100cm、宽50cm、水深45cm、水温31±1℃的玻璃槽中游泳至力竭,以在水面下10S不能上浮为力竭判断标准,然后断头取材。
, http://www.100md.com
1.2.2 心肌线粒体分离及线粒体负载Fura-2的方法
心肌线粒体分离按Vaghy方法[1]。分离出的线粒体用180mmol/L KCl溶液洗两次并悬浮于其中。蛋白质定量采用Bradford方法[2]。心肌线粒体负载Fura-2的方法是将线粒体5mg/L在测试介质液中与10μmol/L Fura-2AM 30℃温育10min,0-4℃离心并用预冷的180mmol/L KCl溶液洗涤两次除去多余的Fura-2AM,并将负载Fura-2的线粒体悬浮于180mmol/L KCl溶液中,待用。测试介质液成份:120mmol/L KCl, 10mmol/L MOPS,5mmol/L glatamate, 5mmol/L malate, PH7.0,全过程避光操作。
1.2.3 心肌线粒体基质游离Ca2+浓度测定方法
心肌线粒体内游离Ca2+浓度测定按Gunter[3]方法,但稍加改进。在测试介质中加入0.5mg Fura-2负载后的线粒体36.8-37℃温育5min,反应体系为2ml,其它条件见图,表所示。在RF—540型岛津荧光分光光度计上,分别测定正常时,线粒体破膜后饱和钙及无钙(EGTA络合)3种情况下荧光强度,激发波长340nm和380nm,发射波长505nm,狭缝10nm。
, 百拇医药
实验数据以均数±标准差表示,两样本以均数t检验进行分析。
2 实验结果
对照组和力竭性游泳组心肌线粒体在不同条件下基质游离Ca2+浓度列于表中。A组为线粒体外无外加Ca2+时的情况,可以看出,力竭性游泳组线粒体基质游离Ca2+浓度低于对照组(P<0.05),提示线粒体Ca2+转动过程已发生变化。
B组为线粒体在外加0.5μmol/L Ca2+时的情况(所用线粒体为重新加样,非A组的),结果表明,两组心肌线粒体均有大量Ca2+摄取(P<0.001),但对游离Ca2+水平比较,力竭性游泳组明显低于对照组(P<0.05),表明维持线粒体膜内外Ca2+浓度梯度能力下降。
, 百拇医药
对线粒体内Ca2+浓度净增加量(B组线粒体内游离Ca2+浓度减去A组线粒体内游离Ca2+浓度所得的差数,B-A组)比较发现,力竭性游泳组明显低于对照组(P<0.05),表明力竭性游泳后心肌线粒体Ca2+摄取能力下降。
表1 力竭性游泳时Fura-2负载的大鼠心肌线粒体Ca2+摄取和Na+依赖性Ca2+翻译的影响
Table 1 Effect of exhaustive swimming on Ca2+ uptake by and Na+-dependent Ca2+
release from fura-2-loaded cardiac mitochondria in rats Group
, 百拇医药
Addition to mitochondrial
incubation
Mitochondrial matrix free [Ca2+] (nM)
Control
n
Swimming
n
Ca2+ uptake
A
B
B-A
, 百拇医药
Na+-dependent
Ca2+ release
C
B-C
None
0.5μΜ CaCl2
1μΜ RR plus
10mM NaCl
in B
419.59±187.04
1726.05±257.26
, 百拇医药
1306.46±217.62
411.06±87.53
1315.00±90.16
8
8
6
230.16±100.19*
1124.52±180.59*
894.39±190.37*
389.77±148.23**
, 百拇医药 811.77±139.52*
8
7
6
t=test *P<0.05 **P>0.05
表中C组是在线粒体负荷Ca2+后用钌红(RR)阻断摄钙过程,加Na+并达平衡后的基质游离Ca2+水平。结果表明,Na+依赖性Ca2+释放后两组线粒体基质游离Ca2+浓度无显著差异(P>0.05),与B组比较均有Ca2+释放发生(P<0.001,表中未标)。但对两组净释放量(B-C组)进行比较发现,力竭性游泳组明显低于对照组(P<0.05),表明力竭性游泳后心肌线粒体Na+依赖性Ca2+释放能力降低。
, http://www.100md.com
图1是对照组和力竭性游泳组心肌线粒体在相同条件下,在不同外Ca2+浓度时基质游离Ca2+浓度应答性变化的情况。结果表明两组线粒体均随外Ca2+的增加而增加,均表现为主动摄钙能力。但力竭性游泳组心肌线粒体内游离Ca2+的增加低于对照组,提示力竭性游泳后心肌线粒体对胞浆Ca2+浓度变化的敏感性下降。

Extra-mitochondrial [Ca2+](μm)
图1 对照组和力竭性游泳组Fura-2负载的大鼠心
肌线粒体外Ca2+浓度与内Ca2+浓度间的关系
, http://www.100md.com
Fig 1 Relationship between extra- and intra-mito-
chondrial [Ca2+] in control and exhaustive
swimming fura-2-loaded rat heart mitochondria.

Extra-mitochondrial Na+ (mM)
图2 对照组和力竭性游泳组Fura-2负载的心肌线
粒体外Na+浓度的增加对内[Ca2+]的影响
, 百拇医药
Fig 2 Effects of increases in extra-mitochondrial Na+ on
intra-mitochondrial [Ca2+] in control and exhaustive
swimming fura-2-loaded rat heart mitochondria.
图2是对照组和力竭性游泳组心肌线粒体Ca2+负荷后在线粒体外Na+逐渐增加时,基质游离Ca2+水平的下降情况。结果表明,两组基质游离Ca2+浓度均随线粒体外Na+浓度的增加而下降,均具有Na+诱导Ca2+释放能力,但力竭性游泳组的Ca2+释放低于对照组。
, 百拇医药
3 讨论
心脏每次跳动时ATP的消耗主要用于肌纤维的收缩和肌细胞膜对Ca2+、Na+等离子的转运。目前认为,线粒体ATP生成较直接的调控因素是肌细胞内Ca2+水平[4]。心肌细胞内Ca2+浓度的增加可通过线粒体Ca2+摄取而使心肌线粒体内游离Ca2+水平上升,刺激其中的Ca2+敏感酶:丙酮酸脱氢酶系、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶的活性,导致NADH增加。此外,Ca2+还可作用于H+-ATPase上F1的Ca2+-依赖抑制蛋白(CaBI),解除其抑制作用,增加ATP生成[5]。线粒体Ca2+释放过程则可降低这一刺激作用,对心脏功能同样具有重要意义。
, 百拇医药 力竭性游泳是一运动性疲劳的动物模型。在实验中发现,力竭性游泳后,心肌线粒体Ca2+转运发生了改变。线粒体基质游离Ca2+浓度下降(表A组),表明Ca2+刺激线粒体ATP生成作用降低,同文献报道一致[6]。在外界Ca2+浓度为0.5μmol/L时,力竭性游泳组心肌线粒体基质游离Ca2+浓度低于对照组。线粒体Ca2+摄取是由其膜内外H+电化学梯度供能而完成的,在达到平衡后,由Ca2+形成的跨膜电位差符合下列Nernst方程:Δψ=(2.303RT/2F)*log([Ca2+]in/[Ca2+]out),如果按温度为37℃,线粒体外[Ca2+]为500nmol/L计算,可得对照组Δψ=108.9mV,力竭性游泳组Δψ=69.2mV。这一结果表明,在同等条件下,力竭性游泳后心肌线粒体质子跨膜电位下降,同用荧光法测定线粒体膜表面电位下降的结果相符[6],因此这一机能变化与线粒体呼吸链机能下降有密切关系。图1则反映了线粒体外Ca2+浓度的改变对其基质游离Ca2+水平变化的情况。可以看出,力竭性游泳组线粒体基质游离Ca2+浓度随介质中Ca2+浓度增加的幅度明显低于对照组,对线粒体外Ca2+浓度增加的应答敏感性降低。
, 百拇医药
心肌、骨骼肌、脑等组织的线粒体Ca2+释放主要是特异性快速的Na+依赖性Ca2+释放,为酶学乒乓机制(Ping Pong Machanism)[7],此过程为逆电化学梯度的耗能过程,能量最终来源为线粒体跨膜质子梯度。力竭性游泳后,心肌线粒体仍具有Na+/Ca2+交换能力(表中C组),但这一能力明显下降(表中B-C组,图2进一步表明了这一下降趋势。关于Na+/Ca2+交换能力下降的原因现仍不十分清楚,由于其能量来源为线粒体氧化代谢,故线粒体膜电位的下降是其重要原因之一。此外,Na+依赖性线粒体Ca2+释放的下降,加之心肌细胞内高钙[8]进一步对其抑制,势必导致Ca2+在线粒体中一定时间内(未疲劳前)大量积聚,由此而激活磷酯酶A2并抑制焦磷酸酶的活性。磷酯酶A2活性增加等因素可导致线粒体非特异孔道打开[9],释放Ca2+;焦磷酸酶活性下降使PPi含量上升,从而进一步引起磷酸钙沉淀生成增加[10],结果导致心肌线粒体游离Ca2+浓度下降,氧化磷酸化能力也随之下降,这又使得心肌细胞膜对Ca2+、Na+向膜外的正常转运受到影响,由此而导致疲劳的发生。
, 百拇医药
心肌线粒体Ca2+摄取及释放速率慢于每次心脏跳动时肌细胞内Ca2+浓度变化速率,线粒体基质游离Ca2+浓度只是反映心肌细胞内时间平均游离Ca2+浓度(the time - average cytoplasmic free Ca2+ concentration)。心脏在受到激素等外界刺激后,心跳加快,肌细胞内游离Ca2+时间平均浓度升高,线粒体基质游离Ca2+浓度应答性增高,刺激了氧化磷酸化,从而使心肌的收缩与线粒体的供能一致。心肌线粒体Ca2+释放的生理意义主要在于消除线粒体旧的供能信息,以便接受新的变化刺激[9]。力竭性游泳后,心肌线粒体对胞浆Ca2+浓度变化的应答敏感性下降,Na+依赖性线粒体Ca2+释放能力下降,使基质中游离Ca2+水平较长时间保持原有信息水平,因此不能及时反映心肌需能的变化,表现出心肌细胞内氧化磷酸化的失调,限制了进一步的运动活动。另一方面,在心脏停止外界刺激后,线粒体Na+依赖性Ca2+释放下降使得刺激线粒体氧化磷酸化的钙离子浓度信息不能同时解除,有利于恢复,并可能为运动后“氧债”的原因之一。
, http://www.100md.com
*国家自然科学基金资助项目
4 参考文献
1.Vaghy PL., et al. Selective inhibition of Na+ induced Ca2+ -release from heart mitochondria by diltiazem and certain other antagonist drugs. J. Biol. Chem. 1982,257:6000-6002.
2.Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein. J.Biol. Chem., 1976.72:248-254.
3.Gunter T E., Restrepo D, and Gunter K K. Conversion of esterified fura-1 to Ca2+-sentive forms by mitochondria. Am. J. Physiol. 1988,255,C304-C310.
, http://www.100md.com
4.Balavan R S. Regulation of oxidativ phosphorylation in the mammalian cell. Am. J. physiol. 1990,258:C377-C389.
5.Harris D A, and DAS A M. Control of mitochondrial ATP synthesis in the heart. Biochem. J. 1991,280:C561-573.
6.王文信,丁树哲,许豪文.耗竭性游泳对大鼠心肌线粒体膜功能的影响。生物化学与生物物理学报,1994,26(2):246-248.
7.Havat L J and M Crompton. Evidence for the exitence of regulatory sites for Ca2+ on the Na+/Ca2+ carrier of cardiac mitochondria. Biochem. J. 1982,202:509-518.
, 百拇医药
8.丁树哲,许豪文,程伯基.疲劳运动后大鼠心肌线粒体的研究。中国运动医学杂志,1992,11(1):22-26.
9.Gunter T E and Pfeiffer D r. Mechanisms which mitochondria transport calcium. Am. J. Physiol. 1990,258:C755-786.
10.Mccorack J G. Role of calcium ions in regulations of mammalian intramitochondrial metabolism. Physiol. Rev., 1990,70:391-416.
(1997.09.08收稿), http://www.100md.com